抗坏血酸对等离子体质谱法测定汞的增敏作用研究
段建坤,方慧文,赵杨阳
(武汉产品质量监督检验所,湖北 武汉 430048)
抗坏血酸对等离子体质谱法测定汞的增敏作用研究
段建坤,方慧文*,赵杨阳
(武汉产品质量监督检验所,湖北 武汉 430048)
研究了将抗坏血酸加入到样品中作为增敏剂,以电感耦合等离子体质谱测定汞的增敏效应。考察了硝酸浓度、抗坏血酸浓度、水浴温度和时间等实验条件对增敏作用的影响。结果表明,在5%硝酸,500 mg·L-1的抗坏血酸,水浴温度50 ℃,时间为20 min的条件下,汞的灵敏度最高,此时,汞的灵敏度增强近30倍,其检出限低至1 ng·L-1。在汞浓度为0.005~10.0 μg·L-1范围内线性关系良好,相关系数为0.999,相对标准偏差为5.6%(0.1 μg·L-1,n=7)。该文还进一步探讨了抗坏血酸产生增敏作用的机理。
汞;抗坏血酸;增敏;等离子体质谱
汞是一种毒性较大、易挥发的重金属,进入人体后,会对人体造成极大危害,因此,其检测技术受到很多分析化学工作者的重视。目前常见的汞测定技术有原子荧光光谱法[1]、原子吸收光谱法[2-3]、电感耦合等离子体质谱法(ICP-MS)[4]以及电化学法[5]等。其中,ICP-MS法作为一种高灵敏的多元素同时检测技术而备受青睐。然而,对于部分电离能较高的元素(如Hg,As,Se),由于其在ICP中的电离效率较低,采用ICP-MS对其测定普遍存在灵敏度较低的问题。为了提高检测的灵敏度,需要采取一些额外的手段,如分离富集技术(固相萃取、液液萃取、共沉淀等)[6]、蒸气发生及吹扫捕集[7-9]以及加入增敏剂[10-12]等。加入增敏剂因无需增加额外的操作步骤或设备,而得到较多应用。ICP-MS中最常见的增敏剂为含碳化合物[10-14],一般直接添加到样品溶液或载气中。这些增敏剂能提高电离效率,增大气溶胶传输效率,增加样品提升量或雾化效率。有报道将乙醇加至水溶液中能提高ICP-MS的检测灵敏度,对Se,As和Hg尤其有效[15]。此外,挥发性的有机化合物也被添加到氩气中并被引入雾化室[11,16-18]。对于含碳化物增敏作用的机理解释,最常见的一种观点是含碳化合物的加入改变了样品溶液的表面性质并使气溶胶粒径更小,从而提高了雾化效率[10]。此外,也有研究认为,增敏作用是因为碳的增强效应,即待测粒子与含碳的多原子粒子之间存在电荷转移,从而提高了待测元素的电离效率[12,19]。许多分析工作者对含碳化合物能增强ICP-MS的灵敏度这一现象进行了研究探讨[10,15,19-20]。
虽然含碳化合物的加入能提升灵敏度,但也会带来一些问题,如导致等离子体不稳定、多原子离子干扰增多以及采样锥的碳沉积更为严重等[21]。因此有必要采取一些控制手段,如降低进样流速、提高射频功率以及向等离子中引入少量氧气等[14,22-24]。本文采用低浓度的抗坏血酸作为增敏剂,大幅提高检测的灵敏度,同时由于加入的试剂浓度很低,使其对等离子体的影响降至最低。通过实验,本研究认为抗坏血酸的增敏作用主要不在于碳,而在于抗坏血酸将汞离子还原成水溶性气态汞从而极大提高了样品引入效率,进而提高了灵敏度。
1 实验部分
1.1 仪器与试剂
Elan DRC-e型ICP-MS(美国Perkin Elmer公司):功率1 100 W,雾化气流量0.95 L·min-1,十字交叉雾化器,Scott雾室,监测的汞同位素为202Hg。超纯水机(美国Millipore公司),超声波清洗器(上海科导超声仪器有限公司)。实验所用器皿均用10%硝酸浸泡24 h以上,用去离子水淋洗干净,晾干备用。
汞标准溶液(GBW 08617)购于中国计量科学研究院。取一定量溶液以超纯水稀释为标准使用液(1.00 mg·L-1),并逐级稀释为工作溶液(0.01~10 μg·L-1)。硝酸为优级纯,其余试剂为分析纯及以上纯度。实验用水为超纯水(电阻率18.2 MΩ·cm)。
1.2 实验方法
将抗坏血酸加至一定酸度的样品溶液中,并于50 ℃水浴中加热一段时间后自然冷却。在4 h内以ICP-MS测定。

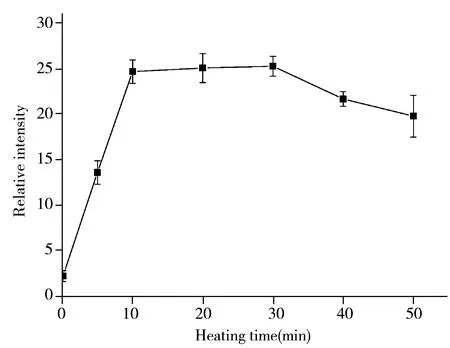
图1 水浴温度(A)与加热时间(B)的影响Fig.1 Effect of water bath temperature(A) and heating time(B)
2 结果与讨论
2.1 实验条件的优化
考察了抗坏血酸浓度对灵敏度的影响。发现抗坏血酸浓度从50 mg·L-1增至2 000 mg·L-1时,其灵敏度增强因子(同等浓度的Hg在试验条件下的信号强度与5%硝酸基体中信号强度的比值)先增强至最大,而后当浓度增至1 000 mg·L-1时略有下降。据此选择抗坏血酸的最佳浓度为500 mg·L-1,远低于文献中含碳增敏剂的加入量[10-11]。此条件下,抗坏血酸在采样锥上沉积量很小,信号的相对标准偏差(RSD=2.4%)与标准溶液相近(RSD=2.0%),远低于2%乙醇的碳沉积效应及其对等离子稳定性(RSD=5.5%)的影响。因此,可以认为抗坏血酸对于等离子体的不利影响大大降低甚至忽略。
在实验中需要对样品溶液进行水浴加热处理。分别考察了水浴温度以及加热时间的影响。结果表明(见图1),随着水浴温度从20 ℃升至40 ℃,Hg的灵敏度逐渐增加,然后维持不变。温度升高至70 ℃时灵敏度有所下降,可能是温度过高导致汞挥发所致。加热时间在10~30 min时灵敏度最大,其后逐渐下降。实验最终选择50 ℃水浴20 min。
介质对于灵敏度也有一定的影响。试验了硝酸和盐酸作为介质的影响,结果发现硝酸作为介质最合适,当硝酸浓度为1%~10%时,对灵敏度几乎无影响。因此后续实验选择5%硝酸为介质。
2.2 增敏机理的探讨
在ICP-MS检测中,信号强度主要取决于两个因素:①待分析对象的传输效率;②元素在等离子体中的电离度。提高检测灵敏度的常用方法有:①向样品溶液中加入少量有机试剂以改变溶液的物理性质,进而提高气溶胶的去溶效率/传输率;②向等离子体中引入含碳物质,从而在等离子体中产生大量的C+或含碳多原子离子,并通过待测原子C+或含碳多原子离子之间的电荷转移效应使一些难电离的元素电离度大幅提高。为了研究抗坏血酸的增敏机理,本实验以乙醇作为比较对象,向样品溶液中加入500 mg·L-1乙醇,并与抗坏血酸的结果进行比较,结果见图2。

图2 不同基质条件下汞的信号强度Fig.2 Signal intensity of Hg in different matrices A:5% nitric acid;B:5% nitric acid+500 mg·L-1 ethanol;C:5% nitric acid+500 mg·L-1 ascorbic acid;D:5% nitric acid+500 mg·L-1 ascorbic acid+10 mg·L-1 thiourea;E:5% nitric acid+500 mg·L-1 ascorbic acid+100 μg·L-1 Au+
从图2可以看出,乙醇虽有增敏作用,但其增敏能力远低于抗坏血酸。因此,抗坏血酸的增敏作用不在于其中的碳元素,而在于其对传质效率的极大提升。考虑到抗坏血酸的还原作用以及操作中需要水浴,推测在此过程中发生了氧化还原反应。为了进一步确证,采用硫脲或金离子作为Hg2+稳定剂加至样品中,实验结果表明,加入稳定剂后增敏作用消失(见图2)。此外,将处理后的样品通入氮气进行曝气吹脱后再测定,结果表明该样品溶液中的汞信号强度大幅降低至正常值以下。
因此,本研究认为抗坏血酸的增敏作用机理在于样品中的Hg2+被还原成了挥发性的汞形态(如水溶性气态汞[25]),在雾化过程中大部分从气溶胶中逸出并随载气进入等离子体,比一般气动雾化的进样效率(3%~5%)大幅提高,从而显著提高了检测灵敏度。
2.3 分析性能
为了评价抗坏血酸的增敏作用,按照IUPAC的定义计算了加入抗坏血酸前后时Hg的检出限,以空白样品信号标准偏差的3倍计算检出限。在优化条件下,加入抗坏血酸时,汞的检出限为1 ng·L-1,与不加入抗坏血酸时汞的检出限(0.03 μg·L-1)相比,其灵敏度提高了近30倍。在汞浓度为0.005~10.0 μg·L-1范围内,其线性相关系数为0.999,相对标准偏差(RSD)为5.6%(0.1 μg·L-1,n=7)。
3 结 论
本研究表明,抗坏血酸的加入使样品溶液中的Hg2+转化成为水溶性气态汞,从而极大地提高了气动雾化时的进样效率,因此ICP-MS测定Hg的灵敏度得到了显著的增强,检出限低至1 ng·L-1,有利于实现极低汞含量的样品(如饮用水、环境水样)的检测。
[1] Silva M J,Paim A P S,Pimentel M F,Cervera M L,Guardia M.Anal.Chim.Acta,2010,667(1/2):43-48.
[2] Souza S O,François L L,Borges A R,Vale M G R,Araujo R G O.Spectrochim.Acta:B,2015,114:58-64.
[3] Panichev N A,Panicheva S E.FoodChem.,2015,166:432-441.
[4] Kenduzler E,Ates M,Arslan Z,McHenry M,Tchounwou P B.Talanta,2012,93:404-410.
[5] Liang S C,Wei X P,Huang W G,Li J P.J.Instrum.Anal.(梁顺超,魏小平,黄文刚,李建平.分析测试学报),2016,35(5):618-626.
[6] Zhou Q X,Xing A,Zhao K F.J.Chromatogr.A,2014,1360:76-81.
[7] Duan H L,Lin J J,Zhang S,Gong Z B.J.Instrum.Anal.(段华玲,林继军,张硕,弓振斌.分析测试学报),2011,30(9):964-968.
[8] Ribeiro A S,Vieira M A,Curtius A J.Spectrochim.Acta:B,2004,59(2):243-253.
[9] Pietilä H,Perämäki P,Piispanen J,Majuri L,Starr M,Nieminen T,Kantola M.Ukonmaanaho L.Microchem.J.,2014,112:113-118.
[10] Cao S Q,Chen H T,Zeng X J.J.Anal.At.Spectrom.,1999,14(8):1183-1186.
[11] Kovaevi M,Goessler W.Spectrochim.Acta:B,2005,60(9/10):1357-1362.
[12] Allain P,Jaunault L,Mauras Y,Mermet J M,Delaporte T.Anal.Chem.,1991,63(14):1497-1498.
[13] Grindlay G,Gras L,Mora J,Loos-Vollebregt M T C.Spectrochim.Acta:B,2008,63(2):234-243.
[14] Hu Z,Hu S,Gao S,Liu Y,Lin S.Spectrochim.Acta:B,2004,59(9):1463-1470.
[15] Dressler V L,Pozebon D,Curtius A J.Anal.Chim.Acta,1999,379(1):175-183.
[16] Warburton E,Infante H G.J.Anal.At.Spectrom.,2007,22(4):370-376.
[17] Floor G H,Millot R,Iglesias M,Negrel P.J.MassSpectrom.,2011,46(2):182-188.
[18] Rodushkin I,Nordlund P,Engström E,Baxter D C.J.Anal.At.Spectrom.,2005,20(11):1250-1255.
[19] Pettine M,Casentini B,Mastroianni D,Capri S.Anal.Chim.Acta,2007,599(2):191-198.
[20] Grindlay G,Mora J,Loos-Vollebregt M,Vanhaecke F.Spectrochim.Acta:B,2013,86:42-49.
[21] Agatemor C,Beauchemin D.Anal.Chim.Acta,2011,706(1):66-83.
[22] Hu Z,Gao S,Hu S,Yuan H,Liu X,Liu Y.J.Anal.At.Spectrom.,2005,20(11):1263-1269.
[23] Pécheyran C,Quetel C R,Lecuyer F M M,Donard O F X.Anal.Chem.,1998,70(13):2639-2645.
[24] Tormen L,Gil R A,Frescura V L A,Martinez L D,Curtius A J.Spectrochim.Acta:B,2010,65(11):959-966.
[25] Lindberg S E,Vette A F,Miles C,Schaedlich F.Biogeochemistry,2000,48(2):237-259.
Study on Ascorbic Acid Signal Enhancement for Hg Determined by Inductively Coupled Plasma Mass Spectrometry
DUAN Jian-kun,FANG Hui-wen*,ZHAO Yang-yang
(Wuhan Product Quality Supervision and Inspection Institute,Wuhan 430048,China)
In this study,ascorbic acid was added into the sample solution to improve the signal intensity of Hg determined by inductively coupled plasma mass spectrometry(ICP-MS).Factors effecting the signal enhancement,such as concentrations of nitric acid and ascorbic acid,temperature and time of water bath,were optimized.According to the results,5% of HNO3,500 mg·L-1of ascorbic acid and a 50 ℃ water bath for 20 min resulted in the highest sensitivity for Hg.A nearly 30 times signal enhancement factor could be achieved,and the detection limit of Hg was 1 ng·L-1.The calibration curve had a good linearity in the concentration range of 0.005-10.0 μg·L-1with correlation coefficients above 0.999.The repeatability of the proposed method was obtained at 0.1 μg·L-1of Hg2+with the relative standard deviations(RSDs) of 5.6% by seven replicates.Besides,the mechanism for signal enhancement was investigated and discussed.
mercury;ascorbic acid;signal enhancement;inductively coupled plasma mass spectrometry(ICP-MS)
2016-07-21;
2016-10-12
国家质检总局科技计划项目(2012QK150)
10.3969/j.issn.1004-4957.2017.02.024
O657.63;O614.243
A
1004-4957(2017)02-0284-04
*通讯作者:方慧文,硕士,工程师,研究方向:分析化学,Tel:027-68853716,E-mail:kang14@163.com

