UPLC—MS/MS测定复方丹参方中丹参酮ⅡA、丹参酚酸B、人参皂苷Rg1及其在大鼠血浆和脑组织的药代动力学研究
张杰+刘胜兰+王慧+阳国平+李劲平+刘世坤+唐智+裴奇+黄攀豪


[摘要]建立大鼠血漿和脑组织中丹参酮Ⅱa(TSⅡa)、丹酚酸B(SAB)、人参皂苷Rg1(GRg1)的UPLC-MS/MS分析方法,并开展药物动力学研究。选用SD大鼠,单剂量灌胃(ig)复方丹参方,采集血液与脑组织样品,采用UPLC-MS/MS测定血浆和脑组织中TSⅡa、SAB和GRg1的浓度,以Phoenix WinNolin 6.1药动学程序软件对数据进行非房室模型拟合,采用统计矩法计算药动学参数。经方法学考证,3种成分的峰面积与其在血样及脑组织中的浓度线性关系良好(r>0.992 2);回收率为58.86%~112.1%,日内、日间RSD≤9.7%,准确度及稳定性均符合体内药物分析的要求。大鼠ig给复方丹参方后的血浆药动参数如下:丹参酮Ⅱatmax(1.58±0.081) h,Cmax(725.4±88.20) μg·L-1,AUC0-t(2 101.3±124.85) μg·h·L-1, MRT0-t(3.66±0.05) h;丹酚酸B tmax(1.29±0.21) h,Cmax(307.9±46.75) μg·L-1,AUC0-t(537.4±88.24) μg·h·L-1, MRTlast (2.08±0.11) h;人参皂苷Rg1tmax(1.42±0.20) h,Cmax(460.38±154.60) μg·L-1,AUC0-t(383.4±88.16) μg·h·L-1, MRTlast (1.87±0.046) h。脑组织药动参数如下:丹参酮ⅡA tmax(0.75±0.22) h,Cmax(1.41±0.420) ng·g-1,AUC0-t(4.34±2.48) ng·h·g-1, MRT0-t (4.00±1.90) h;丹酚酸B tmax(1.08±0.20) h,Cmax(21.09±4.850) ng·g-1,AUC0-t(14.83±3.160) ng·h·g-1, MRT0-t(0.99±0.08) h;人参皂苷Rg1tmax(0.50±0.16) h,Cmax(130.96±54.220) ng·g-1,AUC0-t(136.24±34.350) ng·h·g-1, MRT0-t(2.87±0.33) h。该研究所建立的UPLC-MS/MS方法可用于大鼠血浆及脑组织中丹参酮Ⅱa、丹酚酸B、人参皂苷Rg1中的药动学研究。
[关键词]UPLC-MS/MS; 丹参酮Ⅱa; 丹酚酸B; 人参皂苷Rg1; 药动学
[Abstract]A sensitive and specific ultra-performance liquid chromatography-mass spectrometry (UPLC-MS/MS) method was developed for analysis of tanshinone Ⅱa(TSⅡa), salvianolic acid B(SAB) and ginsenoside Rg1(GRg1) in rat plasma and brain tissues. Male healthy Sprague-Dawley(SD) rats were orally given single dose of Fufang Danshen preparation (TS Ⅱa 60 mg·kg-1, SAB 300 mg·kg-1, GRg1 150 mg·kg-1, borneol 300 mg·kg-1), and their blood samples and brain tissues were collected at different time points. The drug plasma and brain tissue concentrations of the three analytes were determined by UPLC-MS/MS method. Subsequently, the main pharmacokinetics parameters of plasma and brain tissues were calculated by using Phoenix WinNolin 6.1 software. The methodological test showed that all of analytes in both plasma and brain homogenate exhibited a good linearity within the concentration range(r>0.992 2). Their mean recoveries were between 58.86% and 112.1%. Intra-day and inter-day precisions of the investigated components exhibited RSD≤9.7%, and the accuracy(RE) ranged from -9.68% to 8.20% at all quality control levels. The results of accuracy and stability meet the requirements for biopharmaceutical analysis. For TSⅡa, the pharmacokinetics parameters tmax, Cmax, AUC0-t, MRTlast in the plasma were (1.58±0.081) h, (725.4±88.20) μg·L-1, (2 101.3±124.85) μg·h·L-1 and (3.66±0.05) h, respectively. For SAB, the pharmacokinetics parameters tmax, Cmax, AUC0-t, MRTlast in the plasma were (1.29±0.21) h, (307.9±46.75) μg·L-1, (537.4±88.24) μg·h·L-1 and (2.08±0.11) h, respectively. For GRg1, the pharmacokinetics parameters tmax, Cmax, AUC0-t, MRTlast in the plasma were (1.42±0.20) h, (460.38±154.60) μg·L-1, (383.4±88.16) μg·h·L-1 and (1.87±0.046) h, respectively. For TSⅡa, the pharmacokinetics parameters tmax, Cmax, AUC0-t, MRTlast in the brain tissue were (0.75±0.22) h, (1.41±0.42) ng·g-1, (4.34±2.48) ng·h·g-1 and (4.00±1.90) h, respectively. For SAB, the pharmacokinetics parameters tmax, Cmax, AUC0-t, MRTlast in the plasma were (1.08±0.20) h, (21.09±4.850) ng·g-1, (14.83±3.160) ng·h·g-1 and (0.99±0.08) h, respectively. For GRg1, the pharmacokinetics parameters tmax, Cmax, AUC0-t, MRTlast in the plasma were (0.50±0.16) h, (130.96±54.220) ng·g-1, (136.24±34.350) ng·h·g-1 and (2.87±0.33) h, respectively. The developed method was successfully applied in pharmacokinetic studies on content of TS Ⅱa, SAB and GRg1 in rat plasma and brain tissues.
[Key words]UPLC-MS/MS; tanshinone Ⅱa; salvianolic acid B; ginsenoside Rg1; pharmacokinetic
复方丹参方由丹参、三七和冰片3味中药组成,活血化瘀,理气止痛,被广泛用于冠心病、心复绞痛、脑缺血再灌注损伤、脑缺血、阿尔兹海默病等[1-3],疗效确切,《中国药典》1977年版至2015年版均有收载,且已列入国家基本药品目录。研究表明,丹参主要有效成分为丹参酮Ⅱa、隐丹参酮等脂溶性丹参酮类和丹参酚酸B、丹参素等水溶性丹参酚酸类,对心肌缺血、脑缺血以及脑缺血再灌注损伤具有明显的保护作用[4]。三七皂苷R1、人参皂苷Rg1和Rb1等三七皂苷类是三七的主要有效成分,具有改善微循环、抗血栓形成和扩张血管等作用[5]。冰片为佐使药,芳香走窜,“引药上行”。
近年来,有关复方丹参方药理药效、药代动力学、剂型、质量控制等研究报道较多。在药代动力学领域,大多局限于丹参、三七单独或联合给药后大鼠血浆药动学行为研究,或注射单体后于某一时间点在大鼠脑组织中的分布情况研究[6-9]。本研究采用UPLC-MS/MS技术,建立了复方丹参方中主要有效成分丹参酮Ⅱa、丹参酚酸B、人参皂苷Rg1在大鼠血浆和脑组织中定量分析方法,并应用此分析方法对大鼠血浆及脑组织中的药动学特征进行了研究,为进一步开展复方丹参方配伍规律、临床应用研究奠定基础。
1 材料
Waters Xevo TQ-S型三重四极杆液质联用仪,包括Waters Acquity I 型 UPLC液相色谱仪带自动进样器和柱温箱,带电喷雾离子化源(ESI)和MassLynx V4.1软件数据处理系统(Waters,美国);METTLER TOLEDO MS105DU型1/10万天平(METTLER,美国);VORTEX-6旋涡混合器(江苏海门其林贝尔仪器制造有限公司);VIBRAX VXR 振荡器(德国IKA公司);Eppendorf Centrifuge 5415型冷冻高速离心机(德国);吉尔森移液器;ND100-1 氮气吹扫仪(杭州瑞诚仪器有限公司)。
丹参酮Ⅱa(TSⅡa,纯度99.08%,批号Must-15081916)、丹酚酸B(SAB,纯度99.08%,批号Must-15092512)、人参皂苷Rg1(GRg1,纯度98.10%,批号Must-15042215)对照品购自成都曼斯特生物科技有限公司;多潘立酮对照品(批号100304-201103)和雙氯酚酸钠对照品(批号100334-200302)购自中国食品药品检定研究院;三七总皂苷(批号Must-15060601,人参皂苷Rg1的质量分数为44.8%);冰片(湖南科瑞鸿泰股份有限公司)和丹参(湖南崇善堂中药饮片有限公司)经中南大学药学院李劲平副教授鉴定均符合药典规定;丹参煎液的制备:取丹参饮片300 g,按2015年版《中国药典》中复方丹参片中丹参的提取工艺进行提取,并浓缩至200 mL。用HPLC测定丹参煎液中TSⅡa 6 g·L-1,SAB 30 g·L-1。甲醇、乙腈(色谱纯,Merck);甲酸(色谱纯,ACS);水(娃哈哈纯净水);其他为分析纯试剂。
SPF级SD雄性大鼠66只,体重(220±20) g,由中南大学湘雅三医院动物实验中心提供,合格证号SCXK(湘)2014-0016。
2 方法
2.1 给药与样品采集
大鼠适应性喂养1周后,实验前12 h 禁食不禁水,并随机分为11组,每组6只,各组大鼠均按丹参15 g·kg-1(TSⅡa 60 mg·kg-1,SAB 300 mg·kg-1),三七5 g·kg-1(GRg1 150 mg·kg-1),冰片300 mg·kg-1ig给药。于给药前和给药后15,30,45 min 和1,1.5,2,4,6,8,10 h 摘除眼球采血,肝素抗凝。并立即在冰台上快速取大鼠脑组织,剥离软脑膜,生理盐水洗净,滤纸吸干表面水分,称重,以生理盐水为匀浆液,按1 mL生理盐水含0.45 g脑组织进行匀浆,将血浆以及脑组织匀浆样品均放置于-20 ℃冰箱保存。
2.2 样品处理
2.2.1 血浆中TSⅡa,GRg1测定样品处理 精密吸取100 μL血浆,精密加入15 μL 多潘立酮(20 μg·L-1)混匀,加入300 μL乙腈,于震荡器上震荡10 min(1 500 r·min-1),13 200 r·min-1离心8 min,吸取上清液100 μL置于新EP管中,加入200 μL水,涡旋混匀,取10 μL进样检测。
2.2.2 脑组织TSⅡa,GRg1测定样品处理 精密吸取100 μL脑组织匀浆,精密加入5 μL 多潘立酮溶液(20 μg·L-1)混匀,加入150 μL乙腈,于震荡器上震荡10 min(1 500 r·min-1),13 200 r·min-1离心8 min,吸取上清液100 μL置于新EP管中,加入150 μL水,涡旋混匀,取10 μL进样检测。
2.2.3 血浆及脑组织中SAB测定样品处理 精密吸取200 μL血浆或脑组织匀浆,精密加入10 μL双氯芬酸钠溶液(1 mg·L-1)混匀,加入80 μL HCl溶液(1 mol·mL-1)混匀,再以2 mL乙酸乙酯震荡(1 500 r·min-1)提取10 min,吸取上清,于40 ℃下N2吹干,150 μL 50%乙腈溶液复溶,13 200 r·min-1离心8 min,取上清10 μL进样检测。
2.3 测定条件
2.3.1 色谱条件 分别建立测定血浆与脑组织样品中TSⅡa,GRg1,SAB浓度的色谱条件。色谱柱ACQUITY UPLCTM BEH 苯基柱(2.1 mm× 50 mm,1.7 μm),流动相A为乙腈(含0.1%甲酸),B为0.25%甲酸水,柱温为35 ℃,进样体积10 μL。TSⅡa,GRg1和内标多潘立酮的梯度洗脱程序为0~3 min,24% A,3~4 min,24%~85% A,4~6 min,85%A,6~7 min,24% A,流速0.2 mL·min-1。SAB和内标双氯芬酸钠梯度洗脱程序为0~1.8 min,35%A,1.8~4 min,35%~60%A,4~5 min,60%~35%A,流速为0.25 mL·min-1。
2.3.2 质谱条件 电喷雾离子源(ESI),分别以正、负离子模式检测。正离子模式检测TSⅡa,GRg1和多潘立酮,负离子模式检测SAB和双氯芬酸钠。工作参数设置为:离子源温度500 ℃,喷雾电压3.0 kV,雾化氣N2的流速为1 000 L·h-1,碰撞气氩气的流速为0.12 mL·min-1。扫描方式为多反应检测(MRM),检测以下离子反应m/z 295/249.3(TSⅡa),碰撞能量为20 V;m/z 823.09/643.17(GRg1),碰撞能量为35 V;m/z 426.20/147.0(多潘立酮),碰撞能量为35 V;m/z 716.81/518.83(SAB),碰撞能量为14 V;m/z 293.95/249.85(双氯芬酸钠),碰撞能量为10 V。
3 结果
3.1 专属性考察
取大鼠空白血浆或脑匀浆、大鼠空白血浆或脑匀浆加对照品和内标、给药后的大鼠血浆或脑匀浆(加内标),按2.2项下操作,色谱图见图1,结果表明,血浆和脑组织中内源性杂质不干扰待测物和内标的测定,方法专属性良好。
3.2 线性范围及定量下限考察
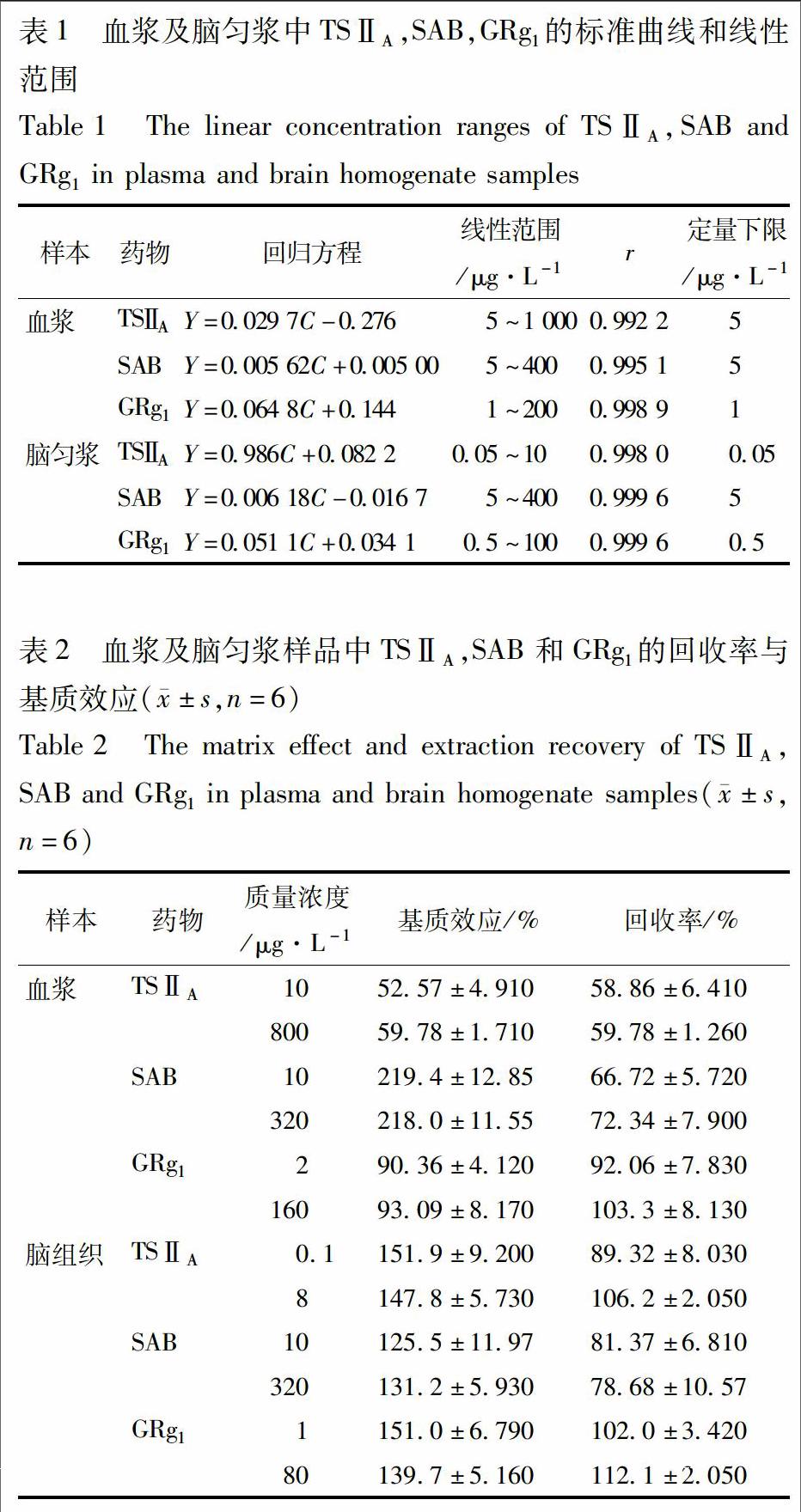
取对照品储备液、大鼠空白血浆以及空白脑匀浆,通过倍比稀释得到标准血样和脑组织匀浆样品,按2.2项下样品前处理后进行分析,以被测化合物的峰面积(Y)对其在血浆或脑匀浆中的浓度(C)用加权(1/C2) 最小二乘法进行回归运算,所得TSⅡa,SAB,GRg1在大鼠血浆及脑匀浆中的标准曲线方程、线性范围、相关系数以及定量下限见表1。试验以S/N≥10作为定量标准。
3.3 精密度及准确度试验
取空白血浆和空白脑匀浆90 μL或180 μL,分别加入不同浓度的TSⅡa,SAB,GRg1对照品溶液10 μL或20 μL制备低、中、高质量浓度(TSⅡa血浆质量浓度为10,80,800 μg·L-1;SAB血浆质量浓度为10,32,320 μg·L-1;GRg1血浆质量浓度为2,16,160 μg·L-1;TSⅡa脑匀浆质量浓度为0.1,0.8,8 μg·L-1;SAB脑匀浆质量浓度为10,32,320 μg·L-1;GRg1脑匀浆质量浓度为2,16,160 μg·L-1)的QC样品,按2.2项下方法处理,每个浓度点5个样品,依法与标准曲线同批测定,连续测定3批(分别于3 d内完成),用随行标准曲线计算QC样品的浓度。据此求算方法的准确度和精密度。结果表明,血浆中TSⅡa日内、日间准确度分别为91.60%~93.14%(RSD≤4.1%,N=5),89.74%~91.48%(RSD≤5.8%,N=15);脑匀浆中TSⅡa日内、日间准确度分别为95.20%~104.2%(RSD≤3.8%,N=5),102.7%~106.2%(RSD≤6.6%,N=15);血浆中SAB日内、日间准确度分别为99.17%~110.5%(RSD≤6.3%,N=5),102.5%~106.2%(RSD≤7.3%,N=15);脑匀浆中SAB日内、日间准确度分别为105.8%~106.5%(RSD≤3.4%,N=5),101.2%~105.2%(RSD≤8.0%,N=15);血浆中GRg1日内、日间准确度分别为101.9%~111.2%(RSD≤4.0%,N=5),96.37%~105.6%(RSD≤8.8%,N=15);脑匀浆中GRg1日内、日间准确度分别为87.42%~96.86%(RSD≤3.7%,N=5),90.31%~96.44%(RSD≤5.0%,N=15)。结果均符合生物样品分析方法指导原则的要求。
3.4 回收率考察
准确配制血浆或脑匀浆的低、高浓度质控(QC)样品,按2.2项下方法操作,记录待测物和内标的峰面积;同时用空白基质配制相应浓度的待测物和内标溶液进样得到的峰面积作为对照,每个浓度平行操作6份,回收率=血浆或脑匀浆样品的平均峰面积/空白基质样品平均峰面积×100%,结果用±s表示,见表2。采用同样的方法考察内标多潘立酮和双氯芬酸钠在血浆和脑匀浆中的回收率,结果多潘立酮在血浆及脑匀浆中的回收率分别为(98.1±2.97)%,(100.0±1.31)%;双氯芬酸钠在血浆及脑匀浆中的回收率分别为(69.8±1.85)%,(77.5±3.85)%。
3.5 基质效应
取空白血浆或空白脑组织匀浆和相对应体积的纯水,按2.2项下方法处理后,加入相应浓度的标准溶液,使得各待测组分的浓度与低、高质控样品浓度相当,每个浓度重复6次,记录空白生物基质峰面积A1和水作为基质的峰面积A2,基质效应=A1/A2×100%,结果用±s表示,见表2。内标多潘立酮在血浆及脑匀浆中的基质效应分别为(102.2±1.59)%,(83.4±0.520)%;内标双氯芬酸钠在血浆及脑匀浆中的基质效应分别为(176.4±2.760)%,(100.3±1.930)%。
3.6 稳定性试验
取空白血浆和空白脑匀浆80 μL或180 μL,分别加入不同浓度的TSⅡa,SAB,GRg1对照品溶液制备低、高浓度的QC样品,并置于以下4种条件下考察其稳定性: ①QC 样品于室温放置6 h后处理进样,结果显示在血浆及脑匀浆中各药物的准确度为-12.5%~6.34%;②将QC样本反复冻融3次后处理进样,结果显示各药物的准确度为-5.80%~13.9%;③将QC样品按2.2项下方法处理后,置于4 ℃放置24 h后进样,结果显示各药物的准确度为-12.5%~8.23%;④QC样本置于-20 ℃下儲存2周后,处理进样,各药物的准确度为-7.72%~8.65%。每个浓度点平行制备3份。结果表明血浆样本和脑匀浆样本在上述的4种处理条件下均稳定。
3.7 稀释方法学试验
配制高于定量上限的TSⅡa,SAB,GRg1大鼠血浆样本,分别测定稀释8倍、3倍、8倍后的样品,用实测值乘以稀释倍数后,计算浓度是否为标示值的85%~115%。结果显示TSⅡa稀释8倍、SAB稀释3倍、GRg1稀释8倍不会影响测定的准确度。
3.8 血浆及脑组织药动学研究
所取血浆样本和脑匀浆样本分别按2.2项下方法处理,按2.3.1项下条件测定,记录各检测成分和内标的峰面积,代入回归方程,计算大鼠给药不同时相TSⅡa,SAB,GRg1的血药浓度和脑组织浓度。所得数据用Phoenix WinNolin 6.1药动学程序软件进行非房室模型拟合,采用统计矩法计算药动学参数。各被测成分平均血药浓度-时间曲线、平均脑组织药物浓度-时间曲线见图2,主要药动学参数见表3。
4 讨论
4.1 检测方法的确定
由于TSⅡa,SAB,GRg1的极性、色谱行为等差别很大,SAB结构中有7个酚羟基和2个羧基,流动相的pH直接影响到峰形及响应,本实验考察了不同流动相体系、流动相pH调节剂及色谱柱种类对三者保留时间、峰形、响应的影响,以同时达到峰形对称、分析时间短、响应高的目的。本研究发现以乙腈(0.1%甲酸)-0.25%甲酸水为流动相,在ACQUITY UPLCTM BEH 苯基柱上分析时间较短(7 min),响应较高和峰形对称。
本实验尝试使用正负离子同时检测以及正负离子模式分时间段检测TSⅡa,SAB,GRg1,但效果不理想,即降低了3种被测物质的响应,其中以SAB最为明显,达不到本研究的测定要求,故只能2种模式分开测定。本实验在优选各被测物质及内标的离子对时,发现TSⅡa的离子对m/z 295/277.1比m/z 295/249.30响应更高,但是离子对m/z 295/277.1在空白血浆中干扰很大,且选择离子对m/z 295/249.30仍能满足本实验定量下限的测定要求,故选择离子对m/z 295/249.30对TSⅡa进行检测。同时,本研究在内标化合物选取上也进行了大量的摸索,先后试用了地西泮、多潘立酮、泮托拉唑作为正离子模式内标,以其稳定性、色谱行为、质谱响应及回收率为指标,综合评价后确定以多潘立酮作为检测TSⅡa和GRg1的内标物质;在选择内标物时,本研究曾尝试文献[8]中使用过的氯霉素作为负离子模式下的内标物质,但由于空白血浆中干扰很大,所以选择峰型对称、稳定,与SAB有相似萃取行为的双氯芬酸钠作为内标。
4.2 提取方法的确定
本实验曾尝试使用沉淀法一步进行样品前处理,该法虽简单但同时也稀释了待测样品,导致待测物质SAB定量下限不能满足本实验的测定要求,因此改用液-液萃取法对SAB进行提取。本研究考察了不同提取溶剂,酸化试剂种类、浓度、体积对SAB提取率的影响,发现不同的提取溶剂对SAB的提取率影响较大,乙醚、二氯甲烷、乙酸乙酯-乙醚等有机溶剂提取回收率均低于乙酸乙酯,酸化试剂的种类、浓度及体积对SAB提取回收率影响较大,10%三氯乙酸、10%HCl溶液及其他体积1 mol· mL-1HCl 溶液对SAB的提取率均低于1 mol· mL-1HCl 溶液。同时也考察了1.5,2,3 mL乙酸乙酯对SAB萃取率的影响,2 mL与3 mL并无明显区别,均比1.5 mL 乙酸乙酯提取效率高,所以本实验样品处理时先用80 μL 1 mol· mL-1盐酸酸化血浆样品,然后用2 mL乙酸乙酯直接提取血浆样品,SAB的提取回收率可达70%以上。本实验与文献[10-11]比较,极大地减少了有机溶剂乙酸乙酯的使用,得到了较好的提取回收率。
4.3 血浆及脑组织药动学结果分析
从图2中可知,给药后15 min,大鼠血浆及脑组织中均能测到TSⅡa,SAB,GRg1,说明三者吸收速率和脑分布速率都很快,对脑缺血或脑缺血再灌注损伤等急性脑部疾病能起到速效的作用。TSⅡa和GRg1在给药后10 h仍能在大鼠血浆及脑组织中检测到,但SAB于给药后8,1.5 h,分别在血浆及脑组织中清除完全。从表3中可知,TSⅡa在血浆中的AUC0-t均大于SAB 和GRg1,而TSⅡa的给药剂量(60 mg·kg-1)均小于SAB(300 mg·kg-1)和GRg1(150 mg·kg-1),提示TSⅡa的口服吸收较SAB,GRg1更充分,可能是由于SAB与GRg1为亲水物质,很难透过小肠壁的脂质双分子层而造成口服生物利用度低下。从表3中可知,GRg1的脑选择性指数(0.43±0.24)高于TSⅡa和SAB(分别为0.001 8±0.002 1,0.031±0.013),可能是由于GRg1与血红蛋白结合率较低,使其较易透过血脑屏障。有研究表明,单独静注单体SAB,口服丹参或者静注SAB,TSⅡa与三七总皂苷提取物后,脑内无法检测到SAB[8,12-13],而本研究于给药后15,30,60,90 min内均检测到SAB,可能是本研究用UPLC-MS/MS检测SAB有更低的检出限和更高的灵敏度,或者复方丹参方中复杂的成分以及芳香药冰片有开放血脑屏障的作用所致,同时也提示中医药复方配伍对方中有效成分药代动力学行为有显著影响,这也是中医药复方配伍优势所在,但仍需进一步研究考证。
[参考文献]
[1]Lee K M, Bang J H, Han J S, et al. Cardiotonic pill attenuates white matter and hippocampal damage via inhibiting microglial activation and downregulating ERK and p38 MAPK signaling in chronic cerebral hypoperfused rat[J]. BMC Complement Altern Med, 2013, 13: 334.
[2]张晓燕,覃璇,张一凡,等. 复方丹参片对大脑中动脉缺血再灌注所致血管性痴呆大鼠的影响[J]. 中药药理与临床, 2015, 31(1):177.
[3]陈骞. 复方丹参片药理作用及临床应用研究进展[J]. 中国民族民间医药, 2015(7):30.
[4]Zhou L M, Zuo Z, Chow M S S. Danshen: an overview of its chemistry, pharmacology, pharmacokinetics, and clinical use[J]. J Clin Pharmacol, 2005, 45(12):1345.
[5]张剑峰,张丹参. 三七总皂苷药理作用研究进展[J]. 医学综述, 2007, 13(6):472.
[6]Yang S S, Zhang K R, Lin X, et al. Pharmacokinetic comparisons of single herb extract of Fufang Danshen preparation with different combinations of its constituent herbs in rats[J]. J Pharm Biomed Anal, 2012(67/68): 77.
[7]王世祥,苗文莉,房敏峰,等. 冰片對三七皂苷R1和人参皂苷Rg1,Re家兔组织分布的影响[J]. 第四军医大学学报, 2009, 30(23):2750.
[8]刘胜敏,杨志宏,孙晓波. LC-MS/MS测定6种丹参主要有效成分及脑靶向分布研究[J]. 中国中药杂志,2014, 39(9):1704.
[9]游燕,张启云,郑琴,等.丹参和三七多种有效成分在大鼠体内的药物动力学研究[J]. 中药新药与临床药理, 2010, 21(6):614.
[10]万仁忠,许妍妍,谷元,等. 丹酚酸B及其活性代谢产物在大鼠体内药动学研究[J]. 中草药, 2011, 42 (2): 335.
[11]高子栋. 丹参酚酸B在大鼠体内吸收、分布和排泄的研究[D].开封:河南大学,2009.
[12]Pi J X, Liu Z D, Shu L X, et al. Tissue distribution study of salvianolic acid B long-circulating liosomes in mice by UPLC-MS/MS determination[J]. Pak J Pharm Sci,2015, 28(1):213.
[13]Wei L, Zhang S C, Wen L, et al. In vivo distribution and pharmacokinetics of multiple active components from Danshen and Sanqi and their combination via inner ear administration[J]. J Ethnopharmacol, 2014, 156: 199.
[责任编辑 曹阳阳]

