异丹叶大黄素在Caco—2细胞模型上转运机制的研究
袁紫朔+张婷婷+金波+李彤+马辰

[摘要]异丹叶大黄素具有抗炎、抗氧化、抗癌等药理活性。该文研究了异丹叶大黄素在Caco-2细胞模型上的吸收转运机制。采用UPLC法,应用PDA检测器在310 nm处对异丹叶大黄素进行含量测定并计算表观渗透系数Papp。考察不同浓度异丹叶大黄素在Caco-2细胞上的毒性以确定转运实验的给药浓度。探讨了时间、浓度、温度、转运体抑制剂对异丹叶大黄素在体外细胞模型上跨膜转运的影响。实验结果表明,异丹叶大黄素在10~60 μmol·L-1,孵育14 h内,对Caco-2细胞没有明显毒性。异丹叶大黄素在Caco-2细胞模型上的转运具有一定的浓度依赖性,其表观渗透系数Papp大于10×10-6 cm·s-1,易被Caco-2细胞吸收。 BL侧的转运量在3 h达到最大值,6 h有所下降。4 ℃条件下,Papp(AP-BL)与Papp(BL-AP) 均比37 ℃条件显著减小。加入P-gp转运体抑制剂维拉帕米后Papp(AP-BL)明显增大;加入MRP转运体抑制剂丙磺舒和MK-571后,Papp(BL-AP)明显减小。研究结果提示,异丹叶大黄素在Caco-2细胞模型上的转运方式主要是被动扩散,P-gp及MRP可能参与了异丹叶大黄素的外排转运。
[关键词]Caco-2细胞单层膜模型; 异丹叶大黄素; 转运机制
[Abstract]Isorhapontigenin (ISO) is suggested to have many different kinds of pharmacology activities, such as anti-inflammatory effect, anti-oxidation effect and anti-cancer effect. This paper mainly discussed the transport mechanism of ISO in Caco-2 cell models. The concentration of ISO was determined by UPLC method with PDA detector at 310 nm, and then the apparent permeability coefficient Papp was calculated. The cytotoxic of different concentrations of ISO was investigated on Caco-2 cells to determine the concentration of drug administration. The effects of ISO concentration, time, temperature and transporter inhibitors on the transport of ISO were investigated. The test results showed that, ISO didn′t have significant cytotoxicity at 10-60 μmol·L-1 in 14 hours. The transportation of ISO on Caco-2 cells was related to the concentration to a certain extent. Papp of ISO was higher than 10×10-6 cm·s-1 and ISO was absorbed easily by Caco-2 cells. The transport volume of ISO at BL side reached maximum at 3 h and was slightly decreased at 6 h. Papp (AP-BL) and Papp(BL-AP) at 4 ℃ were lower than those at 37 ℃. Papp (AP-BL) of ISO was significantly increased after adding P-gp inhibitor verapamil and Papp (BL-AP) of ISO was significantly decreased after adding MRP-2 inhibitor (probenecid or MK-571). The results suggested that transport mode of ISO was mainly passive diffusion in Caco-2 cell models, and P-gp and MRP may be involved in the transport of ISO.
[Key words]Caco-2 cell monolayer model; isorhapontigenin; transport mechanism
異丹叶大黄素(isorhapontigenin,ISO)存在于买麻藤类植物中,具有良好的抗炎[1-2],抗氧化[3-5],治疗胰岛素抵抗及肥胖[6]等活性。近年来,有研究发现其有显著的抗膀胱癌活性[7-11]。有研究表明,小鼠灌胃不同浓度的异丹叶大黄素,采用LC-MS/MS测定其不同时间点的血药浓度,发现异丹叶大黄素在小鼠体内迅速达峰,消除迅速,代谢较快[9]。Caco-2细胞来源于人体结肠腺癌细胞,经培养分化后可形成与人体小肠上皮细胞一致的形态及功能,含有广泛存在于人体小肠上皮细胞的药物代谢酶及各种转运体[12],可以用来研究药物在体外吸收和代谢情况。该模型是目前应用最广泛,最经典的用于研究药物吸收转运特性的体外模型。
本文应用Caco-2细胞模型对异丹叶大黄素的吸收转运机制进行研究,探讨药物浓度、时间、温度及转运体抑制剂对其转运的影响,为其后续开发提供有用信息。
1 材料与方法
1.1 仪器與试剂
Waters H-Class超高效液相色谱仪,Empower 3色谱管理站;Transwell(0.4 μm,PET膜, 美国Millipore公司);细胞电阻仪(ERS-2,美国Millipore公司);酶标仪(Synergy H1,美国BIOTEK公司)。
异丹叶大黄素购自梯希爱(上海)化成工业发展有限公司;维拉帕米(消旋体),MK-571,丙磺舒,硫酸酯酶(Type H-2)均购自西格玛奥德里奇(上海)贸易有限公司;α-MEM细胞培养液,标准胎牛血清,双抗,胰蛋白酶(0.05%,0.02% EDTA),MTT(噻唑蓝)均购自美国Gibco公司;其他化学试剂均为色谱纯。
Caco-2细胞株购自中国医学科学院基础医学研究所细胞资源中心,实验所用细胞均在20~40代。
1.2 色谱条件
Waters BEH C18色谱柱(2.1 mm×100 mm,1.7 μm);柱温40 ℃;流动相水(A)-乙腈(B),梯度洗脱,0~2 min,10%B,2~2.5 min,10%~35% B,2.5~6 min,35% B,6~6.5 min,35%~10% B,6.5~8 min,10% B,流速0.3 mL·min-1;样品室的温度4 ℃;进样体积10 μL;检测波长310 nm。
1.3 样品处理
所有经转运实验所得样品溶液均先加入1倍体积的甲醇,然后置于4 ℃,15 000 r·min-1离心15 min,取上清液进行异丹叶大黄素含量测定。
1.4 Caco-2细胞毒性实验
1.4.1 DMSO细胞毒性 待细胞生长状态良好时接种96孔板,接种密度为1×105个/mL,接种48 h后在培养液中加入DMSO,终浓度分别为 0.1%,0.3%,0.5%,1%,2%,3%,每个浓度设6个复孔,随行空白组,孵育24 h后加入MTT溶液(0.5 g·L-1),孵育4 h后每孔加入200 μL DMSO,充分溶解紫色结晶后,于570 nm波长处测量吸光度A,各组所得A分别与空白组A进行t检验,与空白组对比无显著性差异的浓度为安全浓度。
1.4.2 异丹叶大黄素细胞毒性 待细胞生长状态良好时接种96孔板,接种密度为1×105个/mL,接种48 h后在培养液中加入异丹叶大黄素,终浓度分别为10,20,30,40,50,60 μmol·L-1,每个浓度设6个复孔,随行空白组,孵育14 h后加入MTT溶液(0.5 g·L-1),孵育4 h后每孔加入200 μL DMSO,充分溶解紫色结晶后,于570 nm波长处测量A,各组所得A分别与空白组A进行t检验,与空白组对比无显著性差异的浓度视为在14 h内对Caco-2细胞无毒。
1.5 Caco-2细胞单层膜模型的建立
Caco-2细胞培养于37 ℃,含5%CO2的环境中,采用α-MEM培养液,其中添加10%的标准胎牛血清和1%的双抗。待细胞铺满培养瓶瓶底后,用0.05%的胰酶(含有0.02%的EDTA)消化,按1∶3传代继续培养,待细胞状态良好时接种Transwell细胞培养板。采用PET膜的12孔Transwell细胞培养板,按上述消化方法接种Caco-2细胞,接种密度为2×105个/cm2。细胞绒毛面(Apical, AP侧)加入400 μL培养液,细胞基底面(Basolateral, BL侧)加入1 950 μL培养液。前14 d隔天换液,随后7 d每天换液,经过标准化21 d培养后,应用电镜及阳性质控药对单层膜模型形态学,膜完整性及转运功能进行验证,并在实验前用细胞电阻仪测量跨膜上皮细胞电阻(transepithelial electrical resistance, TEER),大于500 Ω×cm2的细胞单层膜可用于转运实验。转运实验前用Hank′s缓冲盐溶液(Hank′s balanced salt solution, HBSS,pH=7.4,含有5 mmol·L-1HEPES)清洗细胞单层膜3次。转运实验之后,需再次用细胞电阻仪测量TEER,TEER大于500 Ω×cm2的孔为实验有效孔,数据可用,TEER小于500 Ω×cm2孔所得数据不可用。
1.6 异丹叶大黄素转运实验
1.6.1 异丹叶大黄素溶液的制备 精密称取异丹叶大黄素适量,用DMSO溶解为20 mmol·L-1的母液;4 ℃冷藏储存。应用时用HBSS稀释至目标浓度,过滤除菌(DMSO总含量不超过0.5%)。
1.6.2 数据处理 采用表观渗透系数(apparent permeability coefficient,Papp)和渗透方向率(PDR)表示。
ΔQ为Δt内的转运量,A为膜面积(1.12 cm2),C0为初始给药浓度。
由于每次取样后需补加HBSS缓冲液,稀释了药物浓度,因此药物的累积吸收浓度使用校正公式。
Ccum表示药物累积浓度,AN表示第n 个样品通透浓度,VN表示第n 个样品的采样体积,V 表示接受池的体积。
PDR=Papp(BL-AP)/Papp(AP-BL)
Papp(BL-AP)为药物从BL侧转运到AP侧的表观渗透系数,Papp(AP-BL)為AP侧转运到BL侧的表观渗透系数。
数据采用SPSS 22.0软件进行t检验分析。
每组数据为3次平行实验平均值,用±s表示。
1.6.3 时间及浓度对异丹叶大黄素转运的影响 根据1.4.2异丹叶大黄素细胞毒性实验结果,分别取浓度为10,20,30,40 μmol·L-1异丹叶大黄素溶液各400 μL,加入AP侧,作为供给池,取HBSS缓冲液1 950 μL加入BL侧,作为接收池,置于转速为35 r·min-1的37 ℃恒温摇床中,分别于1,3,6 h从BL侧取出200 μL样品溶液,同时补加200 μL空白HBSS。样品溶液经处理后测定异丹叶大黄素的含量,并计算Papp。
1.6.4 温度对异丹叶大黄素转运的影响 取浓度为40 μmol·L-1异丹叶大黄素溶液400 μL,加入AP侧,作为供给池,取HBSS缓冲液1 950 μL加入BL侧,作为接收池,平行2份,一份放置于37 ℃恒温摇床中,一份放置于4 ℃冰箱中,均孵育1 h。从接收池取200 μL样品溶液,样品溶液经处理后测定异丹叶大黄素的含量,并计算Papp及PDR。
1.6.5 转运体抑制剂对异丹叶大黄素转运的影响 分别从AP-BL,BL-AP 2个转运方向考察异丹叶大黄素在Caco-2细胞模型中的转运情况,同时考察转运体抑制剂维拉帕米、丙磺舒、MK-571对异丹叶大黄素转运的影响。
异丹叶大黄素组(40 μmol·L-1异丹叶大黄素溶液);异丹叶大黄素+维拉帕米组(40 μmol·L-1异丹叶大黄素溶液配制含有200 μmol·L-1维拉帕米的溶液);异丹叶大黄素+丙磺舒组(40 μmol·L-1异丹叶大黄素溶液配制含有200 μmol·L-1丙磺舒的溶液);异丹叶大黄素+MK-571组(40 μmol·L-1异丹叶大黄素溶液配制含有100 μmol·L-1的MK-571溶液)。
AP-BL方向:AP侧加入各组溶液400 μL作为供给池,BL侧加入1 950 μL的空白HBSS缓冲液作为接收池,置于37 ℃,35 r·min-1的恒温摇床中孵育1 h。从接收池取200 μL样品溶液,样品溶液经处理后测定异丹叶大黄素的含量,并计算Papp。
BL-AP方向:BL侧加入各组溶液1 950 μL作为供给池,AP侧加入400 μL空白HBSS缓冲液作为接收池,置于37 ℃,35 r·min-1的恒温摇床中孵育1 h。从接收池取200 μL样品溶液,样品溶液经处理后测定异丹叶大黄素的含量,并计算Papp。
2 结果
2.1 UPLC含量测定方法学考察
将异丹叶大黄素用HBSS稀释至0.2,1,5,10,50,100 μmol·L-1,按照1.2项下条件进样分析。待测物的峰面积为纵坐标Y,异丹叶大黄素浓度为横坐标X,得到异丹叶大黄素的线性回归方程为Y=43 649X+6 699.3,r=0.999 1,线性范围0.2~100 μmol·L-1。选择低、中、高(5,10,40 μmol·L-1)浓度的异丹叶大黄素溶液按照1.3项所示的样品处理方法处理,分析并计算。结果表明,低、中、高浓度下样品测定的回收率分别为90.92%,96.12%,98.03%;精密度分别为3.0%,1.7%,1.1%。考察5 μmol·L-1异丹叶大黄素在不同温度的稳定性,4 ℃ 4 h,RSD为0.46%,37 ℃ 7 h,RSD为7.8%,溶液稳定。空白溶剂色谱图及异丹叶大黄素专属性色谱图(tR = 4.9 min)分别见图1。实验结果表明所建立方法符合生物样品的定量要求。
2.2 Caco-2细胞毒性实验结果
2.2.1 DMSO细胞毒性实验结果 当DMSO浓度大于0.5%时,开始对细胞产生毒性,浓度越大毒性越大。因此,实验所用的化合物溶液中DMSO浓度应小于0.5%,结果见图2。
2.2.2 异丹叶大黄素细胞毒性实验结果 当孵育时间为14 h,异丹叶大黄素浓度在10~60 μmol·L-1时,其对细胞无明显毒性。转运实验所选取的孵育时间及给药浓度应参照此实验结果,见图3。
2.3 时间及浓度对异丹叶大黄素转运的影响
随着时间增加,透过Caco-2细胞单层膜的异丹叶大黄素的量逐渐增加,并在3 h达到最大值,在6 h有所下降,见图4。在1 h转运实验中,异丹叶大黄素的Papp随着浓度增加而增加,呈现出明显的浓度依赖性,且Papp均大于10×10-6 cm·s-1,属于高渗化合物,见表1。
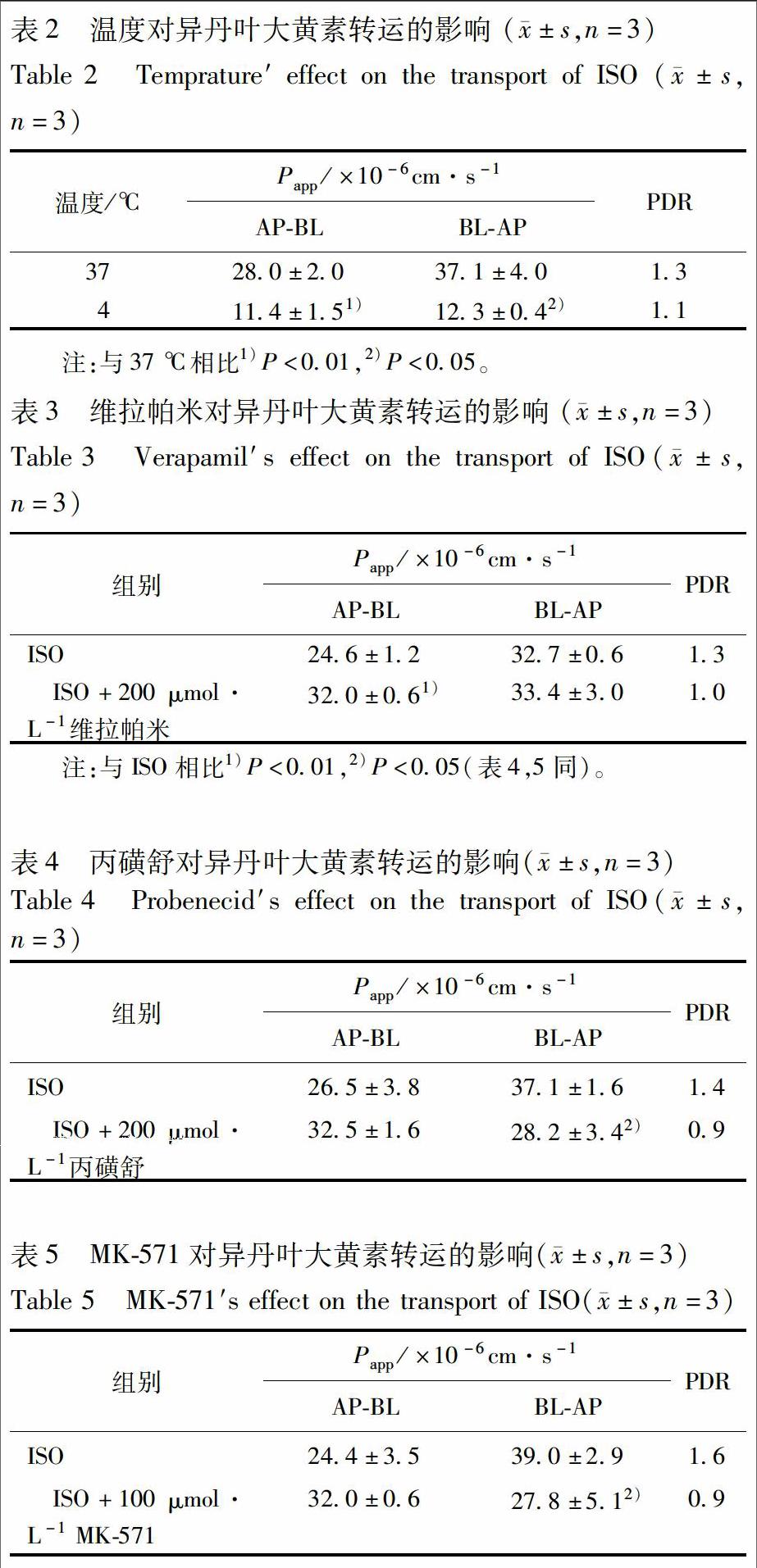
2.4 温度对异丹叶大黄素转运的影响
蛋白在低温条件下活性减弱,因此Caco-2细胞膜上存在的各种转运体在低温条件下其功能会有所降低。4 ℃条件下所测得Papp(AP-BL)和Papp(BL-AP)均显著小于37 ℃所测得的值,见表2。除此之外,37 ℃条件转运结果计算的PDR为1.3,需用转运体抑制剂来确定异丹叶大黄素是否为外排转运的底物。
2.5 转运体抑制剂对异丹叶大黄素转运的影响
常见外排转运体有P-糖蛋白(P-gp)和多药耐药蛋白(MRP)等,分别加入P-gp抑制剂维拉帕米及MRP抑制剂丙磺舒和MK-571后,所测得的异丹叶大黄素的PDR均减小。加入维拉帕米后,异丹叶大黄素AP-BL转运方向的Papp明显增大,见表3;加入丙磺舒和MK-571后,异丹叶大黄素AP-BL转运方向的Papp增大,BL-AP转运方向的Papp明显减小,分别见表4,5。
3 讨论
应用Caco-2细胞单层膜模型对异丹叶大黄素转运机制进行研究,能够在体外细胞水平提供其通过小肠上皮细胞吸收和转运的信息,用以推测其在人体肠道中的吸收和转运特性。
异丹叶大黄素的Papp大于10×10-6 cm·s-1,属于高渗化合物。其吸收迅速,有浓度依赖性,Papp随着给药浓度增加而增大,表明异丹叶大黄素在Caco-2细胞模型中以被动扩散转运为主。
当温度降低到4 ℃时, AP-BL方向和BL-AP方向的跨膜过程都受到了明显抑制,Papp均明显下降。在4 ℃时,需要能量的主动转运过程基本被抑制,结果提示异丹叶大黄素的跨膜过程有主动转运的存在。
P-gp,MRP是Caco-2细胞中的主要转运蛋白,其能发挥外排泵作用,将细胞内的化合物逆浓度梯度运至细胞外,其结果可能会导致药物透膜吸收减少,生物利用度降低。加入P-gp和MRP抑制剂后,明显降低其转运的方向性。加入P-gp抑制剂维拉帕米后,异丹叶大黄素AP-BL转运方向的Papp明显增大,提示异丹叶大黄素可能为P-gp蛋白的底物。加入MRP抑制剂丙磺舒和MK-571后,异丹叶大黄素AP-BL方向的Papp有所增加,BL-AP转运方向的Papp明显减小,提示异丹叶大黄素可能为MRP的底物。P-gp和MRP可能参与了异丹叶大黄素的转运过程。
异丹叶大黄素在Caco-2细胞模型上吸收具有时间依赖性,BL侧异丹叶大黄素的量在3 h达到最大值,随后有所下降。此现象与白藜芦醇在Caco-2细胞模型上的转运特征类似[14]。此外,有文献报道[9],小鼠灌胃异丹叶大黄素单体所得到的tmax为(0.14±0.05) h,t1/2为(1.72±0.27) h,MRT为0.70±0.20,提示异丹叶大黄素在体内吸收迅速且代谢广泛,推测BL侧异丹叶大黄素下降可能与其代谢迅速并被外排有关。
本实验研究了异丹叶大黄素在 Caco-2 细胞上的吸收特征,包括时间、浓度、温度及转运蛋白对异丹叶大黄素转运的影响。 结果表明,异丹叶大黄素在Caco-2细胞模型上吸收迅速,其转运机制以浓度依赖性的被动扩散过程作用为主,同时P-gp,MRP等外排转运体参与其转运过程。推测异丹叶大黄素在人体肠道中可被迅速完全吸收,但因P-gp,MRP的外排作用,可能影响其口服生物利用度,限制其药理活性及应用。
[参考文献]
[1]钟淼,程桂芳,赖春宁,等. 异丹叶大黄素和白藜芦醇对小鼠腹腔巨噬细胞白细胞介素 6 mRNA 表达的影响[J]. 药学学报, 1999, 34(5): 329.
[2]侯琦,李良成,郭颖,等. 异丹叶大黄素对人滑膜细胞白细胞介素-8 生成及 mRNA 表达的影响[J]. 药学学报, 2001, 36(6): 407.
[3]Fang Y, Lin M, Liu G. Inhibitory effect of isorhapontigenin on copper-mediated peroxidation of luman low-density lipoprotein in vitro[J]. J Chi Pharm Sci, 2004, 13(1): 63.
[4]姚柳利. 买麻藤中异丹叶大黄素的提纯及其抗氧化和抗肿瘤的研究[D]. 上海:上海交通大学, 2005.
[5]王庆利,林茂,刘耕陶. 异丹叶大黄素的体外抗氧化作用[J]. 中国药学杂志, 2001, 36(12): 810.
[6]Kawakami S, Kinoshita Y, Maruki-Uchida H, et al. Piceatannol and its metabolite isorhapontigenin Induce SIRT1 expression in THP-1 human monocytic cell line[J]. Nutrients, 2014, 6(11): 4794.
[7]方勇,王章桂,侯琦,等. 异丹叶大黄素下调膀胱癌细胞中细胞周期蛋白 D1表达的分子机制研究[J]. 中国病理生理杂志, 2014, 30(1): 53.
[8]Jiang G, Wu A D, Huang C, et al. Isorhapontigenin(ISO) inhibits invasive bladder cancer (BC) formation in vivo and human BC invasion in vitro by targeting STAT1/FOXO1 Axis[J]. Cancer Prev Res (Phila), 2016,9(7):567.
[9]Fang Y, Cao Z, Hou Q, et al. Cyclin d1 downregulation contributes to anticancer effect of isorhapontigenin on human bladder cancer cells[J]. Mol Cancer Ther, 2013, 12(8): 1492.
[10]Xu Z, Zeng X, Xu J, et al. Isorhapontigenin suppresses growth of patient-derived glioblastoma spheres through regulating miR-145/SOX2/cyclin D1 axis[J]. Neuro Oncol, 2016,18(6):830.
[11]Zeng X, Xu Z, Gu J, et al. Induction of miR-137 by isorhapontigenin (ISO) directly targets Sp1 protein translation and mediates its anticancer activity both in vitro and in vivo[J]. Mol Cancer Ther, 2016, 15(3): 512.
[12]Artursson P, Palm K, Luthman K. Caco-2 monolayers in experimental and theoretical predictions of drug transport[J]. Adv Drug Deliver Rev, 2012, 64: 280.
[13]Tani H, Hikami S, Iizuna S, et al. Pharmacokinetics and safety of resveratrol derivatives in humans after oral administration of melinjo(Gnetum gnemon L.) seed extract powder[J]. J Agr Food Chem, 2014, 62(8): 1999.
[14]Kaldas M I, Walle U K, Walle T. Resveratrol transport and metabolism by human intestinal Caco-2 cells[J]. J Pharm Pharmacol, 2003, 55(3): 307.
[責任编辑 曹阳阳]

