新疆荒地阿魏化学成分的研究
阚萌萌,王恒,康东健,余风华,谭勇
(1石河子大学药学院,新疆 石河子 832002;2青岛农业大学,山东 青岛 266109)
新疆荒地阿魏化学成分的研究
阚萌萌1,王恒1,康东健1,余风华1,谭勇2*
(1石河子大学药学院,新疆 石河子 832002;2青岛农业大学,山东 青岛 266109)
为对新疆荒地阿魏的化学成分进行研究。采用硅胶、ODS以及Sephadex LH-20等柱色谱进行分离纯化,根据理化性质和各种波普数据鉴定化合物结构。从荒地阿魏地上部分分离鉴定出了9个化合物,分别为:伞形花内酯(1)、大果阿魏酮 (2)、Fekrynol(3)、邻苯二甲酸二丁酯 (4)、黑麦草内酯 (5)、异黑麦草内酯 (6)、Farnesiferol A(7)、Acetylferukin(8)、Ferukrin(9)。结果显示,化合物5和6为首次从阿魏属植物中分离得到。
荒地阿魏;化学成分;结构鉴定
伞形科阿魏属植物荒地阿魏Ferula syreitschikowii K.Pol.,全草入药,其味辛、温,具有治疗虫积、痞块、心腹冷痛、活血消疲和兴奋神经的功效[1]。
阿魏属植物全世界约有150余种,主要分布于地中海地区、中亚及其邻近地区[2],我国约有26种1变种,主产于新疆[3],青海、云南、西藏等省也有分布。
目前,国内外学者对该属植物的化学成分研究较多,已从阿魏属植物中提取分离并分析出近300多个单体成分,主要有菇类、香豆素类、挥发油类、苯丙素类和多硫化合物等,具有抗肿瘤、抗氧化、抗HIV、抗炎、抗过敏等多种活性[4-6]。
由于其较高的药用价值,阿魏资源的合理保护与开发利用引起了人们更多的关注与重视,近年来相关的研究也越来越多,为了更好地开发利用荒地阿魏植物资源、进一步阐明其药效物质基础。
本研究对新疆荒地阿魏进行系统的化学成分研究,从其石油醚部位和氯仿部位分离得到了9个化合物,分别鉴定为:伞形花内酯(1)、大果阿魏酮(2)、Fekrynol(3)、邻苯二甲酸二丁酯(4)、黑麦草内酯 (5)、异黑麦草内酯 (6)、FarnesiferolA(7)、Acetylferukin(8)、Ferukrin(9)。其中,化合物5和6为首次从阿魏属植物中分离得到。化合物结构如图1所示。
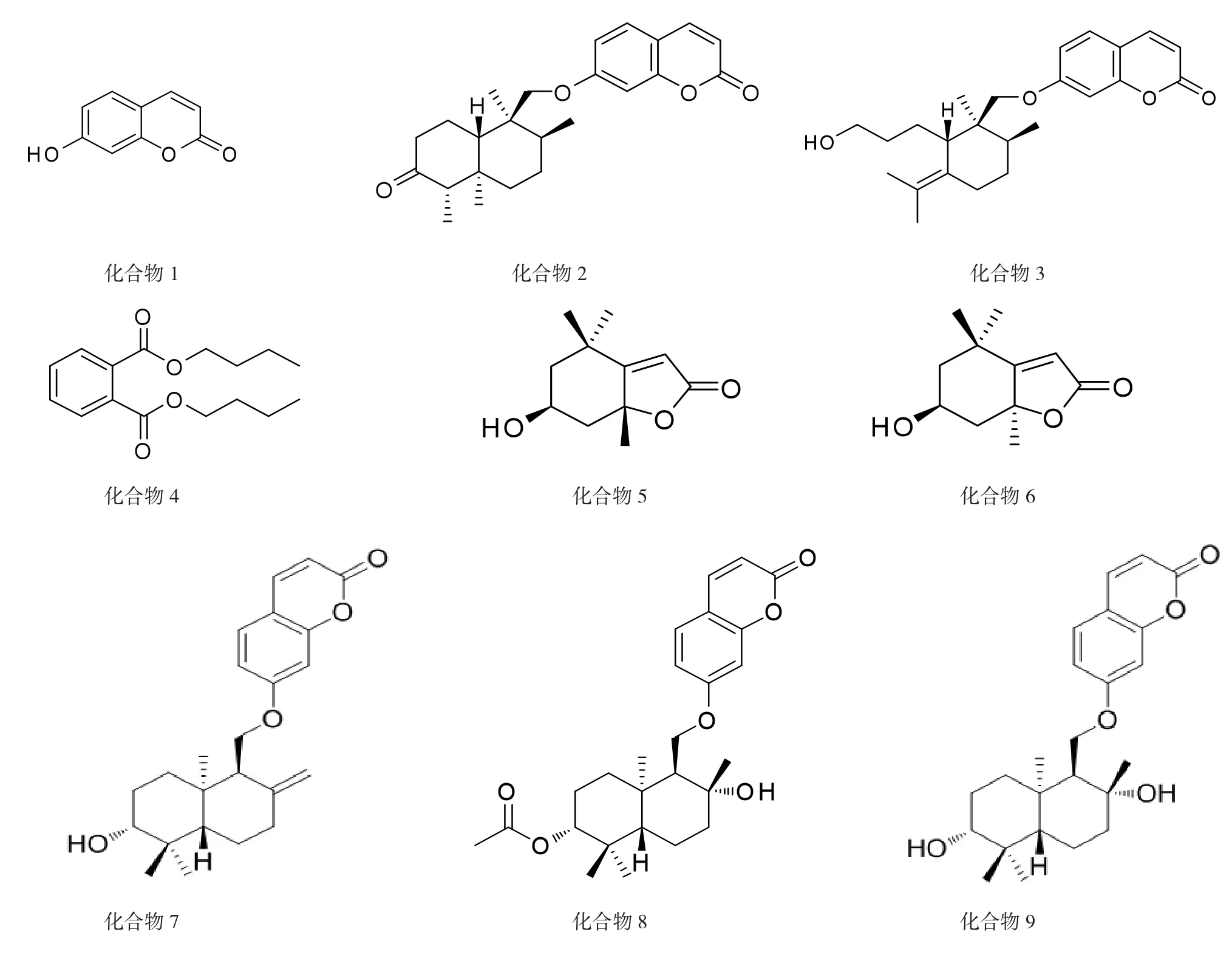
图1 化合物1-9的结构图Fig.1 The structures of compounds 1-9
1 材料与方法
1.1 材料与仪器
VARIAN MR 400 MHz核磁共振光谱仪 (美国Varian公司);VARIAN VNMRS 600 MHz核磁共振光谱仪 (美国 Varian公司);Waters 2695 Separations Module高效液相色谱仪(美国Waters公司);EYBLA旋转蒸发仪(上海爱朗仪器有限公司);SHZ-D9(Ⅲ)循环水式真空泵(巩义市予华有限责任公司);电热恒温水浴锅 (北京市永光明医疗仪器厂);SK5200HP超声波清洗器(上海科导仪器有限公司);柱色谱硅胶 (200-300目);柱色谱反相 ODS(日本 YMC);SephadexLH-20(GE Healthcare);薄层硅胶板(青岛海洋化工厂);所用试剂均为分析纯。
实验用荒地阿魏于2013年3~6月采自新疆石河子市南山阿魏滩。植物样品经中国科学院新疆生态与地理研究所沈冠冕研究员鉴定为荒地阿魏Ferula syreitschikowiiK.Pol.的干燥地上部分。
1.2 提取与分离
荒地阿魏地上部分干燥后粉碎(7.2 kg),依次用95%、75%乙醇10倍、8倍、8倍量回流提取3次,第1次提取3 h,第2、3次各提取2 h。减压回收溶剂得到的浸膏(2.9 kg)。分别将95%、75%乙醇提取物浸膏加适量水分散,依次用石油醚、氯仿、乙酸乙酯和氯仿等体积萃取,萃取三次,回收溶剂得各层浸膏。TLC图谱表明95%乙醇和75%乙醇提取物各层所含化学成分大致相同,故分别合并。合并后得石油醚萃取浸膏(300 g),氯仿萃取浸膏(130 g),乙酸乙酯萃取浸膏(38 g),正丁醇萃取浸膏(186 g)。取石油醚部位浸膏经硅胶柱层析分离,以石油醚-乙酸乙酯溶剂系统梯度洗脱,各流分经硅胶薄层色谱检查后合并相同流分,最后得到19个流分Fr.1-19。流分Fr.7(2.3 g),经反复硅胶柱层析,以石油醚-乙酸乙酯梯度洗脱,再经 ODS低压柱层析(甲醇-水)溶剂系统洗脱以及SephadexLH-20柱色谱(甲醇)洗脱,得到化合物 1(4.6 mg)、2(5.5 mg)、3(13.2 mg);流分Fr.8(5.1 g),经硅胶柱色谱分离,再经SephadexLH-20柱色谱(甲醇)洗脱、制备型高效液相色谱进行分离纯化,得到化合物5(3.7 mg);流分 Fr.12(4.9 g),经硅胶柱色谱分离,以石油醚-乙酸乙酯梯度洗脱,再经SephadexLH-20柱色谱(甲醇)洗脱、制备型高效液相色谱进行分离纯化,得到化合物6(3.4 mg);流分 Fr.14(4.1 g),经硅胶柱色谱分离,以石油醚-乙酸乙酯梯度洗脱,再经SephadexLH-20柱色谱(甲醇)洗脱,得到化合物4(4.4 mg)。取氯仿部位浸膏经硅胶柱层析分离,以石油醚-乙酸乙酯溶剂系统梯度洗脱,各流分经硅胶薄层色谱检查后合并相同流分,最后得到21个流分Fr.1-21。流分Fr.11(356.1 mg)经硅胶柱色谱分离,以石油醚-丙酮系统梯度洗脱,合并流分再经Sephadex LH-20纯化得到化合物7(9.0 mg)、8(12.0 mg);流分Fr.14(278.5 mg)经硅胶柱色谱分离,以石油醚-丙酮系统梯度洗脱,合并流分再经Sephadex LH-20纯化得到化合物9(12.6 mg)。
2 结构鉴定
化合物1:淡黄色粉末,易溶于氯仿,分子式为C9H6O3。1H-NMR (600 MHz,CDCl3)δ:7.82(1H,d,J= 9.2Hz,H-4),7.43(1H,d,J=8.5Hz,H-5),6.78(1H,dd,J=8. 5,2.3Hz,H-6),6.69 (1H,d,J=2.3Hz,H-8),6.16(1H,d, J=9.5Hz,H-3)。以上数据与文献[7]报道对照基本一致,故鉴定化合物1为伞形花内酯(Umbelliferone)。
化合物2:白色针状结晶,易溶于氯仿,分子式为C24H30O4。1H-NMR(600 MHz,CDCl3)δ:6.25(1H,d, J=9.5Hz,H-3),6.88(1H,dd,J=8.4,2.4Hz,H-6),7.63(1H, d,J=9.5Hz,H-4),7.47(1H,d,J=8.5Hz,H-5),6.82(1H,d, J=2.0Hz,H-8)。以上数据与文献[8]报道对照基本一致,故鉴定化合物2为大果阿魏酮(Lehmannolone)。
化合物3:白色粉末,易溶于氯仿,分子式为C24H32O4。1H-NMR (400 MHz,CDCl3)δ:6.22(1H,d,J=9. 0Hz,H-3),7.63(1H,d,J=9.0Hz,H-4),7.34(1H,d,J=8. 7Hz,H-5),6.82(1H,dd,J=8.7,2.0Hz,H-6),6.74(1H,d, J=2.1Hz,H-8),1.53(2H,m,H-1′),1.39(2H,m,H-2′), 3.61(1H,dt,J=6.5,1.5Hz,H-3′),1.86(1H,m,H-6′),2.49(1H, dt,J=13.5,1.5Hz,H-6′),1.19 (1H,m,H-7′),1.56(1H,m, H-7′),1.90 (1H,m,H-8′),2.91(1H,dd,J=11.0,4.5Hz, H-10′),3.69(1H,d,J=8.5Hz,H-11′-a),3.84(1H,d,J=8.5Hz, H-11′-b),0.89(3H,s,H-12′),1.45(3H,d,J=7.0Hz,H-13′), 1.61(3H,s,H-14′),1.12(3H,s,H-15′)。13C-NMR(400MHz, CDCl3)δ:161.4(C-2),113.1(C-3),143.5(C-4),128.3(C-5), 112.6 (C-6),162.9 (C-7),101.1 (C-8),155.4(c-9),112.2 (C-10),22.9(C-1′),30.8(C-2′),63.4(C-3′),124.8(C-4′), 130.5(C-5′),24.4(C-6′),31.9(C-7′),34.7(C-8′),40.6(C-9′), 42.8(C-10′),71.8(C-11′),16.1(C-12′),20.2(C-13′),20.3 (C-14′),22.6(C-15′)。以上数据与文献[9]报道对照基本一致,故鉴定化合物3为Fekrynol。
化合物4:无色油状物,易溶于甲醇,分子式为C16H22O4。1H-NMR(400 MHz,CD3OD)δ:7.72(1H,dd,J=3. 2,5.6Hz,H-2,5),7.62(1H,dd,J=3.2,5.6Hz,H-3,4),4.28(2H,d, J=6.7Hz,H-1′,1′′),1.76(2H,m,H-2′,2′′),1.46(2H,m,H-3′, 3′′),0.98(3H,m,H-4′,4′′)。以上数据与文献[10]报道对照基本一致,故鉴定化合物4为邻苯二甲酸二丁酯(Dibutyl phthalate)。
化合物5:淡黄色油状物,易溶于甲醇,分子式为C11H16O3。1H-NMR(400MHz,CD3OD)δ:5.72(1H,s,H-3), 4.34(1H,q,J=3.5Hz,H-6),2.47(1H,ddd,J=11.5,5.0,2.5 Hz, H2-7),2.03 (1H,ddd,J=11.5,5.0,2.5Hz),1.82(3H,s,7a-Me), 1.82(1H,dd,J=13.5,3.8Hz,H2-7),1.57(1H,dd,J=14.5,3.5 Hz, H2-5),1.49(3H,s,4-Me),1.31(3H,s,4-Me)。13C-NMR(400 MHz,CD3OD)δ:182.7(C-3a),172.3(C-2),113.3(C-3),86.9 (C-7a),67.4(C-6),47.6(C-5),46.1(C-7),36.2(C-4),31.1 (4-Me,C-8),27.3(7a-Me,C-10),26.8(4-Me,C-9)。以上数据与文献[11]报道对照基本一致,故鉴定化合物5为黑麦草内酯(Loliolide)。
化合物6:淡黄色油状物,易溶于甲醇,分子式为C11H16O3。1H-NMR(400 MHz,CD3OD)δ:1.32(1H,dd,J=12. 1,12.1Hz,H-1),2.03 (1H,ddd,J=12.9,4.4,2.2Hz,H-2),4.12 (1H,tt,J=11.6,4.5Hz,H-3),1.51(1H,dd,J=11.7,11.5Hz,H-4), 5.71(3H,s,H-7),1.25(1H,s,H-9),1.31(1H,s,H-10),1.57(1H, s,H-11)。以上数据与文献[11-12]报道对照基本一致,故鉴定化合物6为异黑麦草内酯(Isololiolide)。
化合物7:无色油状物,易溶于甲醇。1H-NMR (400 MHz,CD3OD)谱中:扩大信号的中心在 3.25 ppm相关偕羟基组质子C3(1H,J=16Hz),在0.80,1.00 ppm(s,3H)有偕二甲基信号,在强场区域0.83 ppm(s, 3H)有角甲基质子信号;由于ArOCH2中的质子H(d, J=6.2Hz,2H),其偶极子信号出现在4.16 ppm区域,一个环外亚甲基组(每个1H)质子信号在4.44,4.81 ppm区域。7-羟基取代的香豆素原子核的质子信号出现在6.11-7.79 ppm区域。以上数据与文献[13]报道对照基本一致,故鉴定化合物7为FarnesiferolA。
化合物8:无色油状物,易溶于甲醇,分子式为C26H34O6。1H-NM R (600 MHz,CD3OD)δ7.79(1H,d,J= 9.5Hz,H-4),δ7.45(1H,d,J=8.4Hz,H-5),δ6.83(2H,m,H-6, 8),δ6.15 (1H,d,J=9.5Hz,H-3),δ4.31 (1H,m,J=11.8Hz), δ4.05(m,2H),δ2.05(s,3H),δ1.36(s,3H),δ1.28(s,3H),δ0.83(s,6H).以上数据与文献[14]报道对照基本一致,故鉴定化合物8为Acetylferukrin。
化合物9:无色油状物,易溶于甲醇,分子式为C24H32O5。1H-NMR(400MHz,CD3OD)谱中:δ 7.74(1H,d, J=9.5Hz,H-4),δ7.40 (1H,d,J=8.4Hz,H-5),δ6.77(1H,d, J=1.5Hz,H-8),δ6.11(1H,d,J=9.5Hz,H-3),δ4.17(1H,dd, J=8.9,4.5Hz),δ4.09(1H,dd,J=14.4,7.3 Hz),δ1.22(s,1H, H-15′),δ0.90(s,1H,H-12′),δ0.70(s,1H,H-14′),δ0.66 (s,1H,H-13′)。以上数据与文献[15]报道对照基本一致,故鉴定化合物9为Ferukrin。
3 结论
通过对新疆荒地阿魏化学成分进行研究,从石油醚部位和氯仿部位共分离得到9个化合物,其中,化合物5和6为首次从阿魏属植物中分离得到,对进一步阐明其药效物质基础提供了一定依据。另外,也为新疆荒地阿魏资源的开发利用提供了理论依据。
[1]国家药典委员会.中华人民共和国药典[M].北京:中国医药科学出版社,2015:176.
[2]沈观冕.中草药丛书:阿魏[M].乌鲁木齐:新疆人民出版社, 1986.
[3]单人骅,佘孟兰.中国植物志[M].北京:科学出版社,1992: 85-117.
[4]赵贝,李鸿儒,杜钢军,等.阿魏药酒抗肿瘤作用的初步探讨[J].河南大学学报(医学版),2013(1):24-27. Zhao B,Li H R,Du G J,et al.Preliminary study of awei medicinal liquor on auti-tumor activity[J].Journal of Heman University(Medscal Science),2013(1):24-27.
[5]叶尔波,刘发,熊元君,等.新疆三种阿魏的抗炎与免疫抑制作用[J].西北药学杂志,1993(2):72-75. Ye E B,Liu F,Xiong Y J,et al.Anti Inflammatory and immune suppression effects of three kind of ferula in Xinjiang Province[J].Northest Pharmaceutical Journal,1993 (2):72-75
[6]Zhou P,Takaishi Y,Duan H Q,et al.Comuarins and bieomuarinr from Feurla sumbul:anti-HIV aetivityt and inhibition of eytokine release[J].Phytohcemisyrt,2000,53(6):689-697.
[7]郑兆广,王汝上,汤丹,等.桑白皮化学成分的研究[J].天然产物研究与开发,2011,23(3):399-403. Zheng Z G,Wang R S,Tang D,et al.Chemical constituents of cortex mori[J].Natural product research and development, 2011,23(3):399-403.
[8]J R Yang,Z An,Z H Li,et al.Sesquiterpene coumarins from the roots of Ferula sinkiangensis and Ferula teterrima[J]. Chem Pharm Bull,2006,54(11):1595-1598.
[9]李肖宇,李国玉,王航宇,等.大果阿魏化学成分的研究[J].中国现代中药,2010,12(8):17-20. Li X Y,Li G Y,Wang H Y,et al.Study on the chemical constituents of ferula lehmannii[J].Modern chinese medicine, 2010,12(8):17-20.
[10]侯志帆,梁永红,何礼标,等.灵芝双向固体发酵雷公藤后菌质化学成分变化初步研究[J].中草药,2012,43(2):234-237. Hou Z F,Liang Y F,He L B,et al.Chemical constituents changes in Tripterygium wilfordii after ganoderma bidirectioual solid fermentation[J].Chinese Tradftional and Herbal Druqs,2012,43(2):234-237.
[11]L Jones,B Bartholomew,Z Latif,et al.Constituents of Cassia laevigata[J].Fitoterapia,2000,71(5):580-583.
[12]J Kimura,N Maki.New loliolide derivatives from the brown alga Undaria pinnatifida[J].J.Nat Prod,2002,65(1):57-58.
[13]A I Saidkhodzhaev,G K Nikonov.The configuration of badrakemin and gummosin and the identity of isobadrakemin, colladonin and farnesiferol A[J].Chem Nat Compd,1973,9 (4):462-464.
[14]A A Nabiev,T Kh Khasanov,V M Malikov.A chemical study of the roots of Ferula kopetdagensis[J].Chem Nat Compd,1979,15(1):14-16.
[15]M Iranshahi,M Mojarab,H Sadeghian,et al.Polar secondary metabolites of Ferula perdica roots[J].Phytochemistry,2008, 69(2):473-478.
Study on chemical constituents ofFerula syreitschikowiiin Xinjiang
Kan Mengmeng1,Wang Heng1,Kang Dongjian1,Yu Fenghua1,Tan Yong2*
(1 School of Pharmacy,Shihezi University,Shihezi,Xinjiang 832002,China; 2 Qingdao Agricultural University,Qingdao,Shandong 266109,China)
To investigate the chemical constituents ofFerula syreitschikowiiin Xinjiang Province.The constituents were isolated and purified by silicagel,ODS and Sephadex LH-20 column chromatographic methods.The structures of these compounds were identified on the basis of physicochemical properties and spectral analyses.Nine compounds were isolated from the aerial part ofFerula syreitschikowiiand their structures were identified as Umbelliferone(1),Lehmannolone(2),Fekrynol(3),Dibutyl phthalate (4),Loliolide(5),Isololiolide(6),Farnesiferol A(7),Acetylferukin(8),Ferukrin(9).Compounds 5 and 6 are isolated from this genus for the first time.
Ferula syreitschikowii;chemical constituents;structure identification
R284
A
10.13880/j.cnki.65-1174/n.2017.01.022
1007-7383(2017)01-0129-04
2016-09-28
国家自然科学基金项目(81460574)
阚萌萌(1991-),女,硕士研究生,专业方向为药用植物资源。
*通信作者:谭勇(1976-),男,教授,从事药用植物资源研究,e-mail:xjty321@163.com。

