TGF-β1、LMO1在胃癌组织中的表达及意义
孙云 胡晓杰 马国娟 尹香云 冯博超 彭彦辉
·论著·
TGF-β1、LMO1在胃癌组织中的表达及意义
孙云 胡晓杰 马国娟 尹香云 冯博超 彭彦辉
目的 观察转化生长因子β1(TGF-β1)、LMO1在胃癌组织的表达及二者的相关性,探讨TGF-β1、LMO1在胃癌发生发展中的作用。方法 选取60例胃癌和50例正常胃组织,采用Real time-PCR和Western Blot检测TGF-β1、LMO1 mRNA和蛋白表达水平。采用免疫组织化学SP法检测TGF-β1、LMO1蛋白表达,分析TGF-β1、LMO1表达与胃癌临床病理特征的关系。结果 胃癌组织TGF-β1、LMO1 基因的mRNA和蛋白表达水平均比正常胃黏膜组织明显增强(P<0.05)。TGF-β1、LMO1蛋白在胃癌组织中阳性表达率明显高于正常胃黏膜组织(P<0.05)。TGF-β1、LMO1表达与年龄、性别、发病部位无关(P>0.05),而与肿瘤浸润深度、分化程度、TNM临床分期、淋巴结转移有关(P<0.05)。TGF-β1、LMO1表达呈正相关(r=0.875,P=0.001)。结论 胃癌组织TGF-β1、LMO1表达异常增高,可能参与了胃癌发生发展。TGF-β1、LMO1可作为反映胃癌恶性生物学行为及治疗的分子指标之一。
胃癌;TGF-β1;LMO1;临床意义
胃癌是来源于胃黏膜上皮的消化道恶性肿瘤,其发病率和病死率极高,居恶性肿瘤死亡第二位[1]。目前,胃癌发病机制尚未完全阐明,研究显示多个基因与调控因子参与了胃癌等实体瘤的发生发展,这些基因。转化生长因子β1基因(transforming growth factor beta-1,TGF-β1)与恶性肿瘤关系密切,具有原癌基因的特性,该基因在恶性肿瘤的进展中,在参与恶性肿瘤细胞异常分化、促进细胞增殖和增强肿瘤细胞凋亡抵抗等过程中发挥了重要作用。研究表明,TGF-β1异常表达与胰腺癌、结直肠癌等消化道恶性肿瘤发生[2,3]。单纯LIM结构域(LIM domain only,LMO)是一类富含半胱氨酸且仅由一个或多个LIM结构域串联组成的蛋白质家族,LMO家族成员的蛋白质分子中均含有特征性的LIM结构域[4]。LMO家族目前已发现4个成员,分别为LMO1、LMO2、LMO3和LMO4,其中LMO1是LMO蛋白家族的主要成员之一。LMO1作为细胞核内的辅助转录因子,其LIM 结构域可作为蛋白质相互作用的适配器,通过与其他蛋白相互作用形成复合体,调控基因转录活性,参与细胞分化、增殖等生物学过程[5]。然而,TGF-β1、LMO1在胃癌组织的表达关系及意义目前还没有统一意见。本研究以多种方法检测了胃癌组织TGF-β1、LMO1mRNA和蛋白的表达情况,分析了TGF-β1、LMO1蛋白与胃癌患者临床病理特征的关系,探讨了TGF-β1、LMO1蛋白之间的关系及临床意义,为胃癌发病机制及综合诊疗提供了依据。
1 资料与方法
1.1 一般资料 入组患者为2013年4月至2014年4月于我院确诊为胃癌并行手术切除者,患者共60例。所有患者均为初诊患者,术前未接受过放化疗、靶向治疗或生物治疗。所有患者均有完整的病历资料。患者中男38例,女22例;年龄32~62岁,中位年龄48.4岁;胃癌发生部位:贲门15例,胃体20例,胃窦25例;WHO分型:低分化腺癌34例,中分化腺癌18例,高分化腺癌8例;TNM临床分期:Ⅰ+Ⅱ期20例,Ⅲ+Ⅳ期40例;浸润深度超过浆膜层41例,未超过浆膜层19例;局部淋巴结转移阳性者48例,淋巴结转移阴性者12例。选取同期于我院行胃镜活检病理证实为正常胃黏膜的标本50例作为对照组,其中男28例,女22例;年龄21~63岁,中位年龄44.8岁。
1.2 主要试剂 兔抗人TGF-β1、LMO1多克隆抗体为美国Santa Cruz公司产品。Trizol、实时荧光定量试剂盒购自美国Promega公司。免疫组化试剂盒购自上海生工生物公司。
1.3 实验方法
1.3.1 Real time-PCR检测TGF-β1、LMO1基因mRNA的表达:TGF-β1、LMO1基因的引物均由上海生工生物公司设计并合成。GAPDH为内参照基因。将胃癌及正常胃黏膜组织标本各100 mg于液氮中研磨,一步法Trizol提取组织总RNA,紫外分光光度计测定RNA的纯度和浓度。采用ABI 7300型荧光定量PCR仪进行Real time-PCR实验。实验结束后采用仪器自带的SDS v1. 3软件分析得出各样本的Ct值。将对照组样品Ct值设定为标准1,TGF-β1、LMO1基因表达水平的相对定量值为RQ=2-ΔΔCt,将RQ值用于统计分析,计算TGF-β1、LMO1基因的相对表达量。见表1。

表1 TGF-β1、LMO1、GAPDH引物序列
1.3.2 Western-blot技术检测TGF-β1、LMO1基因蛋白的表达:取新鲜胃癌和正常胃组织标本100 mg,加入裂解液100 μl,冰上静置30 min,4℃ 12 000 g离心30 min,BCA法进行蛋白定量。将50 μg总蛋白进行10%十二烷基磺酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE),电转移至PVDF膜上,10%脱脂奶粉封闭2 h,加入特异性抗TGF-β1、LMO1抗体,4℃孵育过夜,TBST洗膜,加入辣根过氧化物酶标记的羊抗鼠IgG,室温孵育1 h,TBST清洗,ECL化学发光法显色、定影。将目的蛋白吸光度值与内参照蛋白的比值作为目的蛋白的相对表达强度。
1.3.3 免疫组织化学SP法检测TGF-β1、LMO1基因蛋白的表达:采用免疫组织化学SP法检测TGF-β1、LMO1蛋白表达,操作严格按照试剂盒说明进行。具体步骤如下:组织标本中性甲醛固定、包蜡,连续切片,厚度为4 μm,脱蜡至水,PBS漂洗3次,5 min/次,抗原修复后再以PBS漂洗,山羊血清工作液室温封闭15 min,分别滴加TGF-β1、LMO1一抗,4℃过夜,PBS漂洗,滴加二抗,37℃孵育 30 min,滴加辣根酶标记的羊抗鼠IgG,37℃孵育5 min,DAB 显色,苏木精复染后中性树胶封片,镜下读片并对结果进行判断。TGF-β1定位于细胞浆或细胞核,LMO1定位于细胞核。TGF-β1、LMO1均以出现黄色、棕色或棕褐色颗粒为阳性。具体判定标准为:每张切片由两名病理医师盲法测定。随机选取5个200倍的镜下视野,每个视野随机计数100个细胞,当阳性细胞数所占比例≥20%为阳性,<20%计为阴性。
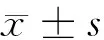
2 结果
2.1 胃癌和正常胃黏膜组织TGF-β1、LMO1mRNA相对表达水平Realtime-PCR结果显示,在胃癌和正常胃组织中,TGF-β1mRNA表达水平分别为(5.33±0.75)、(1.29±0.18),LMO1mRNA表达水平分别为(5.07±0.78)、(1.12±0.15),TGF-β1、LMO1mRNA在胃癌组织的相对表达水平明显高于正常胃黏膜组织(P<0.05)。见表2。
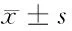

类别TGF-β1mRNA相对表达水平LMO1mRNA相对表达水平胃癌组织(n=60) 5.33±0.75*5.07±0.78*正常胃组织(n=50)1.29±0.181.12±0.15
注:与正常胃组织比较,*P<0.05
2.2 胃癌和正常胃黏膜组织TGF-β1、LMO蛋白相对表达水平Western-blot结果显示,在胃癌和正常胃黏膜组织中,TGF-β1蛋白表达水平分别为(4.56±0.62)、(1.12±0.15),LMO1蛋白表达水平分别为(4.31±0.58)、(0.93±0.15),TGF-β1、LMO1蛋白在胃癌组织的表达水平明显高于正常胃黏膜组织(P<0.05)。见表3。
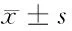

类别TGF-β1蛋白相对表达水平LMO1蛋白相对表达水平胃癌组织(n=60)4.56±0.62*4.31±0.5*正常胃组织(n=50)1.12±0.150.93±0.15
注:与正常胃组织比较,*P<0.05
2.3 胃癌和正常胃黏膜组织TGF-β1、LMO1蛋白阳性表达情况 免疫组化(SP)结果显示,TGF-β1蛋白主要定位于细胞的胞浆或胞膜,LMO1蛋白主要定位于胞核中,以出现黄色、棕色或棕褐色颗粒为阳性。胃癌组织TGF-β1、LMO1蛋白阳性表达率分别为85.0%(51/60)、83.33%(50/60),正常胃组织TGF-β1、LMO1蛋白阳性表达率分别为12.0%(6/50)、8.0%(4/50),胃癌组织TGF-β1、LMO1蛋白阳性表达率显著高于正常胃黏膜组织(P<0.05)。见表4,图1。

表4 胃癌和正常胃组织TGF-β1、LMO1蛋白阳性表达情况
注:与正常胃组织比较,*P<0.05

图1 胃癌组织中LMO1、TGF-β1蛋白阳性表达情况(SP×200)
A胃癌组织中LMO1蛋白表达;B胃癌组织中TGF-β1蛋白表达
2.4 胃癌组织TGF-β1、LMO1蛋白表达与临床病理特征的关系TGF-β1、LMO1蛋白在胃癌组织的表达与患者年龄、性别、胃癌发生部位无明显关系(P>0.05),而与胃癌组织分级、TNM临床分期、肿瘤浸润深度、区域淋巴结转移等特征有关(均P<0.05)。见表5。

表5 TGF-β1、LMO1蛋白表达与胃癌临床病理特征的关系
2.5 胃癌组织TGF-β1、LMO1蛋白表达的相关性 60例胃癌组织中,TGF-β1、LMO1均阳性表达者46例(76.67%),TGF-β1阳性表达且LMO1阴性表达者5例(8.33%),TGF-β1阴性表达且LMO1阳性表达者3例(5.0%)。相关分析显示,TGF-β1、LMO1表达呈明显正相关(r=0.875,P=0.001)。见表6。
3 讨论
胃癌进展迅速,易于发生浸润转移。多基因、多步骤参与这一过程,这些基因的共同作用导致胃癌进展。

表6 TGF-β1、LMO1蛋白在胃癌组织表达的相关性 例
原癌基因激活、抑癌基因失活及其介导的信号转导通路异常贯穿于癌细胞生长、扩散及转移的全过程。胃癌由于具有进展迅速、早期转移等特点,患者在医院就诊时往往已处于进展期,治疗效果不理想,预后差。因此,探讨胃癌发病机制对胃癌综合诊治意义重大。但该领域迄今尚无突破性进展。TGF-β1是淋巴细胞、单核细胞分泌的具有多种生物学活性的多肽类细胞因子,在细胞增殖、分化、血管生成、组织损伤修复、细胞外基质形成、胚胎发育等生理过程中发挥重要调控作用[6-8]。近年来多项研究表明,TGF-β1在多种恶性肿瘤组织过度表达,与肿瘤发生、发展及预后密切相关[9-12]。在肿瘤发生、发展早期,TGF-β1对肿瘤生长发挥抑制作用。然而,在肿瘤发展进展期TGF-β1能够促进肿瘤细胞与细胞外基质相互作用及肿瘤新生血管形成,同时发挥免疫抑制作用,从而促进肿瘤生长、浸润和转移[13]。LMO1是仅含一个或多个LIM结构域的LMO蛋白家族成员,可通过与转录因子或其他蛋白相互作用形成转录复合物调控靶基因转录,在调控细胞生长、分化过程中发挥关键作用。Matthews等[14]研究发现LMO蛋白家族成员(LMO1~LMO4)均与肿瘤发生、发展密切相关。Wang等[15]报道发现,在肿瘤细胞中过表达LMO1基因能够明显增强肿瘤细胞的增殖能力,导致肿瘤进展;反之抑制LMO1基因则能够明显使肿瘤生长减慢。因此,调控胃癌中LOM1表达可能对胃癌的进展过程产生影响。
为了解TGF-β1、LMO1基因在胃癌中的表达及作用,本研究采用Realtime-PCR、Western-blot和免疫组化法等多种分子生物学技术检测了胃癌组织及正常胃黏膜组织TGF-β1、LMO1mRNA和蛋白表达情况。结果显示,TGF-β1、LMO1在胃癌组织中表达显著高于正常胃组织,提示TGF-β1、LMO1基因可能在胃癌发生中发挥了重要作用,促进了胃癌的发生和进展。结合TGF-β1、LMO1表达与胃癌临床病理特征的关系,我们发现TGF-β1、LMO1表达与患者年龄、性别、胃癌发生部位无关,而与肿瘤浸润深度、组织分级、TNM临床分期、淋巴结转移有关,说明TGF-β1、LMO1在胃癌进展中也发挥了重要作用[10,11]。本结果与报道TGF-β1、LMO1在恶性肿瘤高表达的研究结果相符合。相关性分析显示,胃癌组织TGF-β1、LMO1蛋白表达趋势一致,提示TGF-β1、LMO1蛋白可能共同作用在胃癌发生、发展及浸润转移中发挥协同作用,促进了胃癌的进展及侵袭转移。Saeki等[16]研究发现,胃上皮细胞TGF-β1通过上调LMO1、GSDM表达参与调控细胞凋亡过程,说明TGF-β1、LMO1具有正相关性。因此,我们推测胃癌组织TGF-β1、LMO1表达可能存在相互促进作用,LMO1可能参与TGF-β1对肿瘤细胞增殖、分化及扩散转移的调控,但确切机制尚待进一步研究。
本研究结果显示,TGF-β1、LMO1在胃癌组织高表达,且二者阳性表达与胃癌浸润深度、组织分级、TNM临床分期及淋巴结转移密切相关。另外,TGF-β1、LMO1表达具有正相关性,提示胃癌组织在TGF-β1、LMO1高表达基础上,TGF-β1表达可能通过上调LMO1表达促进肿瘤细胞的增殖、分化及浸润转移。总之,TGF-β1、LMO1在胃癌组织的高表达与胃癌的恶性生物学行为有关,联合检测胃癌组织TGF-β1、LMO1表达情况有可能准确反映患者的病情。进一步研究中我们准备扩大样本量并进行体外及体内研究,深入发掘TGF-β1、LMO1基因参与胃癌进展的机制,为寻找新的肿瘤标志物、确定肿瘤治疗靶基因提供有益的思路。
1LuyimbaziD,NelsonRA,ChoiAH,etal.Estimatesofconditionalsurvivalingastriccancerrevealareductionofracialdisparitieswithlong-termfollow-up.JGastrointestSurg,2015,19: 251-257.
2GoreJ,Imasuen-WilliamsIE,ContehAM,etal.CombinedtargetingofTGF-β,EGFRandHER2suppresseslymphangiogenesisandmetastasisinapancreaticcancermodel.CancerLett,2016,379:143-153.
3 杨颖丞,唐小平,喻林,等. 转化生长因子β1基因多态性与消化道恶性肿瘤的相关性.医学综述,2015,21:3310-3312.
4 董成亚,李昊文,刘丽. 脑胶质瘤患者LMO-1和LMO-4基因表达水平的改变及其意义. 标记免疫分析与临床,2014,21:568-580.
5 顾卉,佟宇鑫,刘彤.GST-LMO1融合蛋白表达载体的构建及其在原核细胞中的表达. 中国医科大学学报,2011,40: 961-978.
6MengXM,Nikolic-PatersonDJ,LanHY.TGF-β:themasterregulatoroffibrosis.NatRevNephrol,2016,12:325-338.
7ZhuH,LuoH,ShenZ,etal.Transforminggrowthfactor-β1incarcinogenesis,progression,andtherapyincervicalcancer.TumourBiol,2016,37:7075-7083.
8ZhangX,GuJ,YuFS,etal.TGF-β1-inducedtranscriptionfactornetworksinLangerhanscelldevelopmentandmaintenance.Allergy,2016,71:758-764.
9ZhangGY,LiuAH,LiGM,etal.HPIPSilencingPreventsEpithelial-MesenchymalTransitionInducedbyTGF-β1inHumanOvarianCancerCells.OncolRes,2016,24:33-39.
10ZhaoY,WangL,HuangQ,etal.RadiosensitizationofNon-SmallCellLungCancerCellsbyInhibitionofTGF-β1SignalingWithSB431542IsDependentonp53Status.OncolRes,2016,24:1-7.
11XieF,LiuJ,LiC,etal.SimvastatinblocksTGF-β1-inducedepithelial-mesenchymaltransitioninhumanprostatecancercells.OncolLett,2016,11:3377-3383.
12MariaS,KamathVV,SatelurK,etal.Evaluationoftransforminggrowthfactorbeta1geneinoralsubmucousfibrosisinducedinSprague-Dawleyratsbyinjectionsofarecanutandpanmasala(commercialarecanutproduct)extracts.JCancerResTher,2016,12:379-385.
13KajdaniukD,MarekB,Borgiel-MarekH,etal.Transforminggrowthfactorβ1 (TGFβ1)inphysiologyandpathology.EndokrynolPol,2013,64:384-396.
14MatthewsJM,LesterK,JosephS,etal.LIM-domain-onlyproteinsincancer.NatRevCancer,2013,13: 111-122.
15WangK,DiskinSJ,ZhangH,etal.IntegrativegenomicsidentifiesLMO1asaneuroblastomaoncogene.Nature,2011,469:216-220.
16SaekiN1,KimDH,UsuiT,etal.GASDERMIN,suppressedfrequentlyingastriccancer,isatargetofLMO1inTGF-beta-dependentapoptoticsignalling.Oncogene,2007,26:6488-6498.
Expression and clinical significance of TGF-β1 and LMO1 in gastric cancer tissues
SUNYun*,HUXiaojie*,MAGuojuan,etal.
*TheFourthDepartmentofGeneralSurgery,HebeiProvincialPeople’sHospital,Shijiazhuang050051,China
Objective To observe the expression of transforming growth factor beta 1 (TGF-β1) and LMO1 in gastric cancer tissues,and to explore their roles in the pathogenesis and development of gastric cancer.Methods The expression levels of TGF-β1 and LMO1 mRNA and protein in 60 cases of gastric carcinoma tissues and 50 cases of normal gastric mucosa tissues were detected by Real time-PCR and Western Blot,moreover, the expression levels of TGF-β1 and LMO1 protein were detected by immunohistochemistry (SP).Besides the correlation between expressions of TGF-β1,LMO1 and clinical pathological characteristics was analyzed.Results The expression levels of TGF-β1 and LMO1 mRNA in gastric carcinoma tissues were significantly higher than those in normal gastric mucosa tissues (P<0.05).MoreoverthepositiveexpressionratesofTGF-β1andLMO1proteinsingastriccancertissueswere85.0% (51/60),83.33% (50/60),respectively,whichweresignificantlyhigherthanthoseinnormalgastricmucosatissues[12.0% (6/50), 8.0% (4/50),respectively,P<0.05].TheexpressionsofTGF-β1andLMO1werenotcorrelatedtopatient'sage,sex,tumorposition(P>0.05),however,whichwerecorrelatedwithinfiltrationdepthoftumor,differentiationdegreeoftumor,TNMstagingandlymphnodemetastasis(P<0.05).MoreovertheexpressionofTGF-β1waspositivelycorrelatedtothatofLMO1ingastriccarcinoma(r=0.875,P<0.01).Conclusion The overexpressions of TGF-β1 and LMO1 exist in gastric carcinoma tissues,which may play some roles in the pathogenesis and development of gastric cancer. Therefor TGF-β1 and LMO1 can be regarded as one of molecule indexes to evaluate the malignant biological behavior of gastric cancer and may become potential targets for the treatment of gastric cancer.
gastric cancer; TGF-β1; LMO1; clinical significance
10.3969/j.issn.1002-7386.2017.06.004
050051 石家庄市,河北省人民医院普外四科(孙云、胡晓杰、尹香云、冯博超),门诊部(马国娟),普外三科(彭彦辉)
彭彦辉,050051 石家庄市,河北省人民医院普外三科;
R
A
1002-7386(2017)06-0818-04
2016-10-10)
E-mial:puwaisanke@126.com

