厄洛替尼通过下调CD44表达抑制非小细胞肺癌转移的机制研究
王瑜玲 段媛媛 闫会敏 梁欢 张燕
·论著·
厄洛替尼通过下调CD44表达抑制非小细胞肺癌转移的机制研究
王瑜玲 段媛媛 闫会敏 梁欢 张燕
目的 探讨表皮生长因子受体酪氨酸激酶抑制剂(EGFR-TKI)下调黏附分子CD44表达抑制非小细胞肺癌转移的机制。方法 采用MTT法检测厄洛替尼对HCC827细胞株的增殖抑制效应及计算药物作用48 h的IC50;采用Transwell和划痕实验检测3组[control、EGF(50 ng/ml)刺激组、厄洛替尼(0.323 μmol/L)处理组]细胞侵袭迁移能力的变化;采用流式细胞术及Western blot 方法分别从细胞及蛋白水平检测3组[control、EGF(50 ng/ml)刺激组、厄洛替尼(0.323 μmol/L)处理组]细胞CD44表达水平变化。结果 MTT结果显示,随着药物浓度升高,厄洛替尼对细胞的增殖抑制率也逐渐增大,差异有统计学意义(P<0.05);IC50为0.323μmol/L。Transwell及划痕实验结果显示,厄洛替尼阻断EGFR信号通路后可降低细胞的侵袭迁移能力(P<0.05)。流式细胞术及Westernblot检测三组细胞CD44表达水平变化结果显示:当使用EGF刺激细胞后,CD44表达明显上调,而使用厄洛替尼阻断EGFR信号通路后CD44表达则被明显下调(P<0.05)。结果提示,厄洛替尼抑制肿瘤转移可能与改变CD44表达有关。结论 使用厄洛替尼阻断EGFR信号通路后,可间接下调与肿瘤转移密切相关的黏附分子CD44的表达,进而发挥抑制肿瘤转移的作用。
非小细胞肺癌;EGFR;厄洛替尼;CD44;侵袭转移
厄洛替尼为一种分子靶向药物,是一种小分子化合物,可通过特异性抑制肿瘤细胞内酪氨酸激酶活性进而阻断表皮生长因子受体(epidermal growth factor receptor,EGFR)信号传导通路,发挥抑制肿瘤生长作用。美国国立综合癌症网络(National Comprehensive Cancer Network,NCCN)推荐,针对EGFR突变晚期非小细胞肺癌患者,首选分子靶向治疗。对于厄洛替尼抑制肿瘤细胞增殖的机制目前研究已较深入,结合近年临床效果观察发现,EGFR-TKI药物在抑制肿瘤细胞增殖的同时,对部分肿瘤患者的整体转移趋势也有一定影响。但其发挥作用的具体机制目前尚不明了。而在肿瘤微环境中黏附分子家族是主导肿瘤转移的代表因子之一,其中CD44为细胞表面糖蛋白受体,在多种恶性肿瘤中均有表达,可介导细胞与细胞、细胞与基质间的黏附作用,在促进肿瘤向远处转移机制中发挥重要作用。结合在乳腺癌、头颈部肿瘤等研究中发现[1,2],EGFR信号通路与CD44之间存在着某种交叉关系,并协同影响肿瘤转移。那么,在非小细胞肺癌中厄洛替尼抑制肿瘤转移是否与改变CD44表达有关呢?遂本研究通过一系列体外实验进行验证,为寻找针对肿瘤转移的新药物靶点提供更多思路。
1 材料与方法
1.1 材料及试剂 HCC827(EGFR突变)购自上海中科院细胞库,RPMI-1640培养基购自美国Gibco,胎牛血清购自以色列BI公司,胰蛋白酶购自美国Gibco,表皮生长因子(EGF)购自Sigma,厄洛替尼由罗氏公司惠赠,MTT粉购自Biotopped公司,CD44-FITC 流式单克隆抗体及同型对照均购自美国BioLegnd,CD44蛋白一抗购自Abcam,化学发光二抗购自bioworld公司,Matrigel基质胶购自美国BD公司,Transwell小室购自美国Costar公司。
1.2 方法
1.2.1 细胞培养:使用含20%胎牛血清RPMI-1640培养基培养HCC827细胞株,隔天换液,4~5 d传代,取处于对数生长期细胞进行实验。
1.2.2 四甲基偶氮唑蓝(MTT)法:取对数生长期细胞,10 000个/孔接种于96孔板中,培养至细胞单层铺满孔底。加入不同终浓度厄洛替尼(0、0.001、0.01、0.1、0.5、1、10 μmol/L),每组6个平行复孔,并设置阴性对照组及无细胞调零组,培养48 h后加入20 μl MTT(5 g/L),4 h后弃上清加入150 μl DMSO,震荡至底部结晶全部溶解,酶标仪测定492 nm波长下各孔吸光度(OD)值,计算药物对细胞的增殖抑制率=(阴性对照组OD值-试验组OD值)/阴性对照组OD值×100%,并采用直线回归方法计算药物半数抑制浓度(IC50)。
1.2.3 Transwell侵袭实验:取按1∶8稀释后的Matrigel基质胶混液60 μl,均匀的铺于transwell小室中,置入37℃培养箱中5~6 h,使Matrigel胶充分固化。无血清培养基制备单细胞悬液,调整细胞密度为 105个/200 μl,上室加入200 μl细胞悬液,下室加入600 μl含10%血清培养基,按分组分别加入相应处理因素。培养24 h后吸去上室液体并拭去上层未迁移细胞(切勿损伤底膜),4%多聚甲醛固定30 min后室温晾干,瑞士—姬姆萨染色(A液1 min,B液10 min),显微镜下观察细胞穿膜情况。每组随机选择5个视野,拍照并记录各组穿膜细胞数。
1.2.4 划痕实验:收集对数生长期细胞,制成单细胞悬液,接种于六孔板中,106个/孔,培养至细胞铺满板底。灭菌枪头在板中央小心划痕并记录划痕距离。按分组分别加入相应处理因素,培养24 h后显微镜下观察各组细胞迁移情况,拍照并记录细胞迁移距离。
1.2.5 流式细胞术:取对数生长期细胞,制成单细胞悬液,调整细胞数为105个/ml,接种于24孔板中,按分组[control、EGF(50 ng/ml)刺激组、厄洛替尼(0.323 μmol/L)处理组]加入不同处理因素。24 h后终止培养并收取细胞,加入5 μl CD44-FITC流式抗体及5 μl同型对照,室温避光反应30 min,鞘液洗2遍,200 μl鞘液重悬细胞,流式细胞仪检测各组细胞CD44表达水平。
1.2.6 Western blot:取对数生长期细胞,制成单细胞悬液,调整细胞数为106/孔,接种于6孔板中,并按1.2.5分组情况进行相应处理。终止培养后收取细胞,每组加细胞裂解液50 μl,混匀后冰上裂解30 min,4℃低温离心机高速(12 000 r/min)裂解30 min,取上清并进行蛋白浓度测定(BCA法)。根据上清体积加入相应体积4×上样缓冲液(3∶1),混匀后沸水煮7~8 min。配制10%SDS-PAGE分离胶及5%浓缩胶,上样蛋白量为60 μg,开始电泳、转膜、5%脱脂牛奶室温封闭2 h、一抗孵育过夜(4℃)、37℃二抗孵育1 h、化学发光显色,拍照并进行半定量分析。
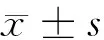
2 结果
2.1 厄洛替尼对细胞的增殖抑制作用 随着厄洛替尼药物浓度增高,对细胞的增殖抑制率逐渐增强。各个药物浓度组对细胞的增殖抑制率不完全相同,差异有统计学意义(F=552.998,P<0.05);而48h厄洛替尼半数抑制浓度IC50=0.323μmol/L。见表1,图1。
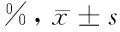

厄洛替尼(μmol/L)48h0100.00±0.000.0019.65±1.840.0127.66±1.870.145.9±1.210.554.36±1.60158.1±2.121071.74±1.01
2.2 厄洛替尼阻断EGFR信号通路对HCC827细胞侵袭迁移能力的影响

图1 不同浓度厄洛替尼对HCC827细胞的增殖抑制率曲线
2.2.1 厄洛替尼对细胞侵袭能力的影响:与对照组比较,EGF处理组细胞侵袭能力明显增强,而厄洛替尼处理组穿膜细胞数明显减少,细胞侵袭能力显著下降,差异有统计学意义(P<0.05)。见表2,图2、3。

表2 3组肿瘤细胞穿膜细胞数
注:与control比较,*P<0.05;与EGF刺激组比较,#P<0.05

注:A:control;B:EGF刺激组;C:加药组
图2 3组肿瘤侵袭能力(瑞士-吉姆萨染色×10)

图3 3组肿瘤细胞侵袭能力检测(*P<0.05)
2.2.2 厄洛替尼对细胞迁移能力影响:处理前后对比,EGF处理组细胞迁移能力明显增强,而厄洛替尼组肿瘤细胞迁移能力则明显减弱,差异有统计学意义(P<0.05)。见表3,图4、5。
2.3 厄洛替尼阻断EGFR信号通路后对CD44细胞


组别迁移距离control114±24.08EGF刺激组227±19.24*加药组39±12.94*#
注:与control比较,*P<0.05;与EGF刺激组比较,#P<0.05
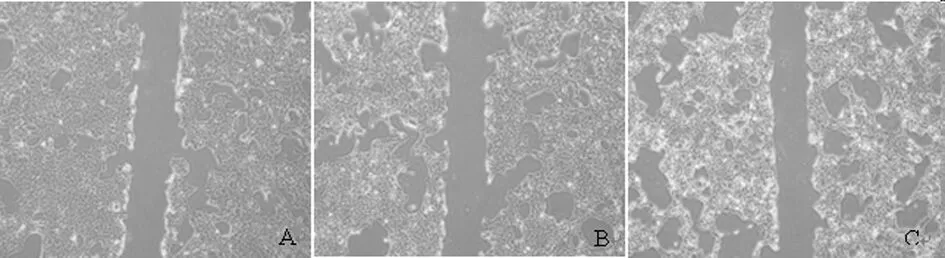
未处理前
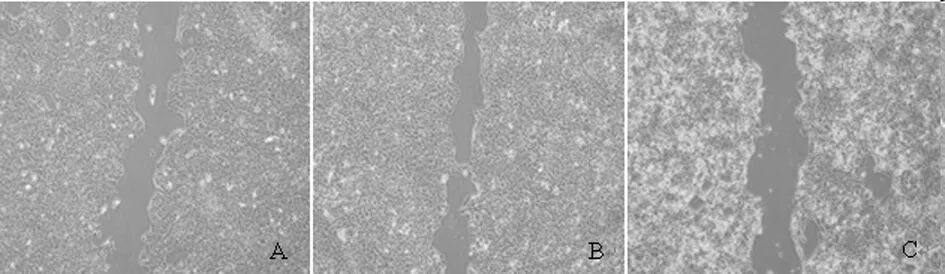
处理24 h后
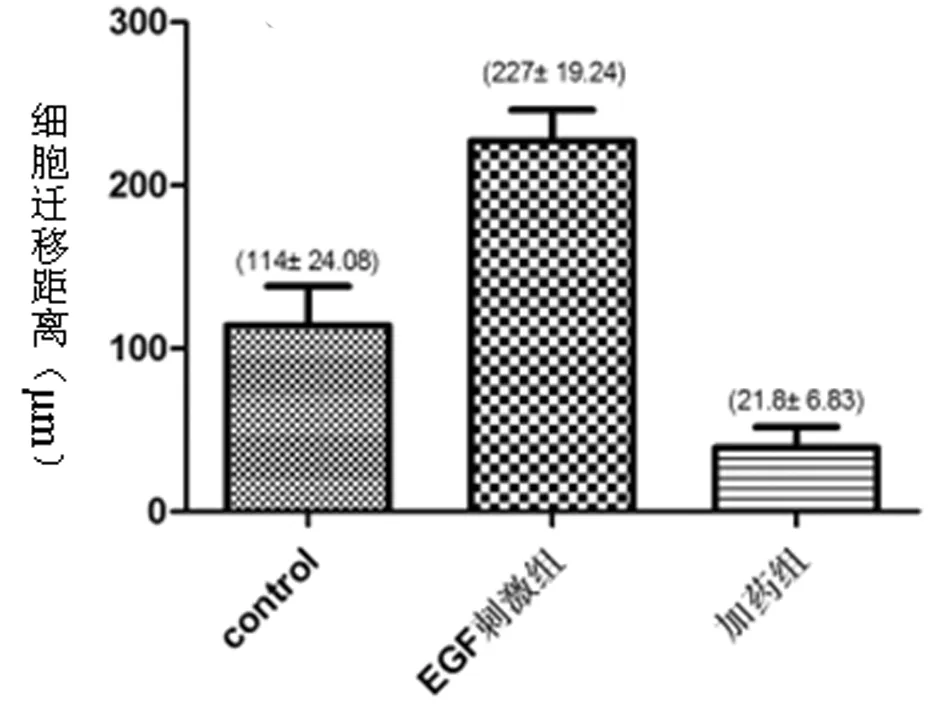
图5 3组肿瘤细胞迁移能力检测
注:处理24h后各组细胞迁移距离(μm) ×4A:controlB:EGF刺激组C:加药组
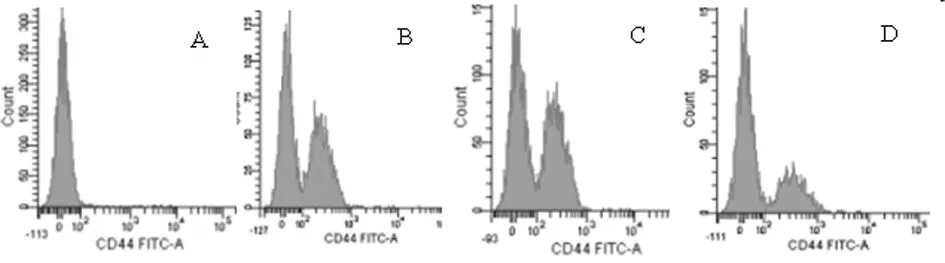
表达水平影响 与control组相比,EGF刺激组CD44表达水平明显升高,厄洛替尼处理组CD44表达水平又明显降低,差异有统计学意义(P<0.05);结果证明厄洛替尼可下调CD44细胞表达水平。见表4,图6。
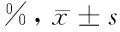

组别CD44+control25.87±3.46EGF刺激组48.37±2.21*加药组15.50±1.11*#
注:与control比较,*P<0.05;与EGF刺激组比较,#P<0.05
2.4 厄洛替尼阻断EGFR信号通路后对CD44蛋白
注:A:同型对照B:controlC:EGF刺激组D:加药组
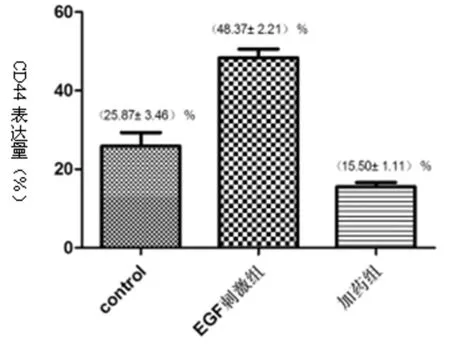
图6 阻断EGFR信号通路后CD44细胞表达水平变化
表达水平影响 与control组相比,EGF刺激组CD44蛋白表达水平明显升高,加药组CD44蛋白表达水平明显降低,差异有统计学意义(P<0.05);进一步从蛋白水平证明厄洛替尼抑制肿瘤转移可能与CD44表达变化有关。见表5,图7。

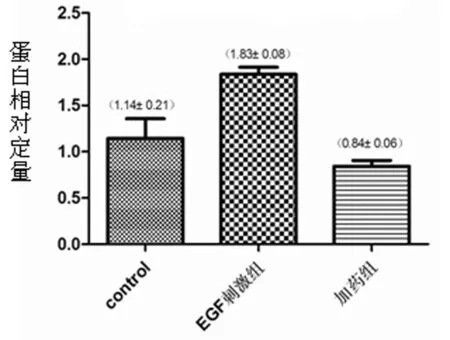
图7 阻断EGFR信号通路后CD44蛋白表达水平变化
3 讨论
EGFR-TKI药物是目前临床用于晚期非小细胞肺癌治疗的首选药物,其主要作用机制是通过抑制EGFR突变阳性肿瘤细胞的自身磷酸化过程,阻断下游信号通路的传递,进而参与抑制肿瘤增殖、侵袭、转移等病理行为[3,4]。尽管其对EGFR突变阳性的非细胞肺癌患者有显著疗效,但仍常因耐药及远处转移而导致治疗失败[5-7]。而恶性肿瘤的远处转移一直是肿瘤临床治疗失败和患者死亡的主要原因,其病理过程极其复杂,并与肿瘤微环境关系密切。所以寻找更多针对肿瘤转移或者联合用药靶点,对此类肺癌的治疗意义重大。
表5 阻断EGFR信号通路后CD44蛋白表达水平

组别CD44蛋白表达水平control0.72±0.03EGF刺激组0.83±0.04*加药组0.21±0.03*
注:与control比较,*P<0.05
在肿瘤微环境中,黏附分子家族在肿瘤转移过程中发挥重要作用。黏附分子CD44是黏附分子家族一类重要的细胞表面糖蛋白受体,通过配体与受体结合的方式介导细胞与细胞,细胞与细胞外基质间的黏附作用;其表达上调,不仅可导致细胞间的黏附性增加,为肿瘤细胞转移提供足够动力[8],亦会导致肿瘤微环境中相关细胞因子的持续变化,引起胞内信号传递发生及Ca2+水平增加等生物学行为[9],参与并影响肿瘤浸润转移过程中的众多环节。
表皮生长因子受体(epidermalgrowthfactor,EGFR)为具有酪氨酸激酶活性的蛋白受体,在多种恶性肿瘤中均有过表达,且在肺癌的所有驱动基因中所占比例最高。当其与配体EGF结合后可激活其胞内区的酪氨酸激酶结构域,使其发生磷酸化,启动下游一系列信号通路传导,在肿瘤增殖、凋亡、侵袭、转移及新生血管形成等生物学行为方面发挥重要作用[10-12]。结合既往在乳腺癌、头颈部肿瘤研究中发现[1,2],EGFR与CD44之间可形成大分子复合物,并可能存在某种交叉关系,协同影响肿瘤转移进程。那么,在非小细胞肺癌中,EGFR信号通路与黏附因子CD44之间是否也存在这种交叉关系并协同影响转移进程,以及他们在肿瘤微环境中是如何发挥协同作用的机制目前还尚不得知。
本实验选用的HCC827细胞是EGFR基因位点上19外显子缺失突变的人非小细胞肺癌细胞,并对厄洛替尼具有高度敏感性。而厄洛替尼在抑制肿瘤细胞增殖、促进肿瘤细胞凋亡方面的研究已渐趋成熟,但对抑制肿瘤转移方面的机制目前还尚不明确。结合以上背景,我们猜想,EGFR-TKIs药物可能不仅仅是作用于肿瘤细胞本身的抗增殖剂,也可能通过某种潜在机制影响肿瘤微环境中与肿瘤转移密切相关因子的表达变化,导致相关信号传导通路传递信息的能力减弱,从而在抑制肿瘤转移方面发挥一定作用。所以,本实验通过使用厄洛替尼阻断EGFR信号通路后,观察黏附分子CD44是否下调,来间接证明EGFR-TKIs药物发挥抑制肿瘤转移作用可能是通过下调黏附分子表达实现的。
首先我们通过MTT实验进一步验证了厄洛替尼对HCC827的增殖抑制作用,并筛选出厄洛替尼的半数抑制浓度IC50;而后我们通过Transwell小室侵袭实验及划痕实验方法发现,EGF刺激细胞后肿瘤侵袭及迁移能力均显著增加,而经厄洛替尼处理后肿瘤的侵袭迁移能力又被显著抑制,由此从功能水平上进一步证明了EGFR-TKI药物在抑制肿瘤转移中发挥重要作用。为了进一步证实厄洛替尼抑制肿瘤转移可能与CD44表达改变有关,我们又通过流式细胞术及Westernblot的实验方法发现,当使用厄洛替尼处理细胞阻断EGFR信号通路后,无论是在细胞水平还是在蛋白水平CD44的表达均显著降低(P<0.05);这一实验结果表明,对于非小细胞肺癌细胞,黏附因子CD44可因EGFR信号通路的激活而表达上调,并在使用EGFR-TKI药物阻断EGFR信号通路后表达下调;综合以上体外实验结果我们推测,在非小细胞肺癌中,EGFR信号通路与黏附因子CD44之间可能存在某种交叉关系,并协同影响肿瘤转移;并初步证明厄洛替尼发挥抑制肿瘤转移的作用很可能就是通过间接下调与肿瘤转移密切相关的黏附分子CD44的表达来实现的。
综上所述,我们通过部分体外实验初步得出EGFR-TKIs药物可通过阻断EGFR信号通路间接下调CD44表达,进而发挥抑制肿瘤侵袭转移作用的结论;使我们初步了解到在非小细胞肺癌中EGFR信号通路与CD44之间可能也存在某种交叉关系,共同在肿瘤侵袭转移方面发挥着作用。但其具体机制及在此交叉信号通路中发挥关键作用的信号分子还需后续体外及体内实验进一步验证。总之,对肿瘤生物学行为细节的更深入了解,是寻找更多新药物靶点的重要途径。
1BourguignonLY,GiladE,BrightmanA,etal.Hyaluronan-CD44interactionwithleukemia-associatedRhoGEFandepidermalgrowthfactorreceptorpromotesRho/Rasco-activation,phospholipaseCepsilon-Ca2+signaling,andcytoskeletonmodificationinheadandnecksquamouscellcarcinomacells.JBiolChem,2006,281:14026-14040.
2KimS,KilWH,LeeJ,etal.ZerumbonesuppressesEGF-inducedCD44expressionthroughtheinhibitionofSTAT3inbreastcancercells.OncolRep,2014,32:2666-2672.
3DienstmannR,DeDossoS,FelipE,etal.DrugdevelopmenttoovercomeresisitancetoEGFRinhibitorsinlungandcolorectalcancer.MolOncol,2012,6:15-26.
4MokT,WuYL,ThongprasertS,etal.PHAseⅢ,randomized,open-label,first-linestudyofgefitinib(G)versuscarboplatin/paclitaxel(C/P)inclinicallyselectedpatients(pts)withadvancednon-small-celllungcancer(NSCLC).AnnOncol,2008,19:1-4.
5MitsudomiT,KosakaT,EndohH,etal.Mutationsoftheepidermalgrowthfactorreceptorgenepredictprolongedsurvivalaftergefitinibtreatmentinpatientswithnon-smallcelllungcancerwithpostoperativerecurrence.ClinOncol,2005,23:2513-2520.
6SeuistLV,MartinsRG,SpigelD,etal.First-linegefitinibinpatientswithadvancednon-small-celllungcancerharboringsomaticEGFRmutations.JThoracOncol,2008,3:S143.
7TamuraK,OkamotoI,KashiiT,etal.MulticentreprospectivephaseIItrialofgefitinibforadvancednon-smallCelllungcancerwithepidermalgrowthfactorreceptormutations:ResultsoftheWestJapanThoracicOncologyGrouptriaI(WTOG0403).BrJCancer,2008,98:907.
8 冯静,张燕,王瑜玲,等.EGFR与黏附分子家族间交叉信号通路在肿瘤发生中作用的研究进展.山东医药,2014,54:93-95.
9 李娜,张贺龙,整合素家族与肿瘤骨转移相关性研究进展.现代肿瘤医学,2011,19:579-582.
10SuzukiS,DobashiY,SakuraiH,etal.Proteinoverexpressionandgeneamplificationofepidermalgrowthfactorreceptorinnonsmallcelllungcarcinomas.Animmunohistochemicalandfluorescenceinsituhybridizationstudy.Cancer,2005,103:1265-1273.
11ItalianoA,VandenbosFB,OttoJ,etal.Comparisonoftheepidermalgrowthfactorreceptorgeneandproteininprimarynon-small-cell-lungcancerandmetastaticsites:implicationsfortreatmentwithEGFR-inhibitors.AnnOncol,2006,17:981-985.
12JorissenRN,WalkerF,PouliotN,etal.Epidermalgrowthfactorreceptor:mechanismsofactivationandsignalling.ExpCellRes,2003,284:31-53.
Study on the action mechanism of erlotinib in inhibiting metastasis of non-small cell lung cancer through down-regulating the expression of CD44 in vitro
WANGYuling*,DUANYuanyuan,YANHuimin*,etal.
TheFifthHospitalofShijiaxhuang,Shijiazhuang050011,China
Objective To investigate the action mechanism of erlotinib in inhibiting metastasis of non-small cell lung cancer (HCC827 cell line) through down-regulating the expression of CD44 in vitro.Methods MTT method was used to detect the inhibitory effects of erlotinib on cell proliferation of HCC827 cell line and to calculate IC50 after 48-hour drug intervention.The changes of invasion and migration ability of lung cancer cells in thee three groups,control group, EGF (50ng/ml) stimulation group and erlotinib (0.323μmol/L) intervention group, were detected by Transwell migration assay and scratch test. Moreover the expression levels of CD44 in the three groups were detected by flow cytometry and Western Blot,respectively.Results MTT assay showed that the inhibition rate of erlotinib on cell proliferation was increased with the increase of drug concentration (P<0.05),withIC50being0.323μmol/L.TranswellmigrationassayandscratchtestshowedthaterlotinibcoulddecreaseinvasionandmigrationabilityoflungcancercellsafterblockingEGFRsignalpathway(P<0.05).TheresultsbyflowcytometryandWesternBlotshowedthatafterthecellswerestimulatedbyEGF,theexpressionlevelsofCD44wereobviouslyincreasedinthreegroups,however,afterEGFRsignalpathwaywasblockedbyerlotinib,theexpressionlevelsofCD44weresignificantlydecreased(P<0.05),whichsuggestedthattheinhibitoryeffectsoferlotinibontumormetastasismightbecorrelatedtoregulatingtheexpressionlevelsofCd44.Conclution The erlotinib can block EGFR signal pathway to down-regulate indirectly the expression levels of CD44 that is closely correlated with tumor metastasis,and then which can play an important role in inhibiting tumor metastasis .
non-small cell lung cancer;EGFR;erlotinib;CD44;invasion and metastasis
10.3969/j.issn.1002-7386.2017.06.006
050024 河北省石家庄市第五医院(王瑜玲、闫会敏);河北医科大学研究生学院(段媛媛);河北省石家庄市第一医院(梁欢、张燕)
张燕,050011 河北省石家庄市第一医院肿瘤四科;
E-mail:13315978336@163.com
R
A
1002-7386(2017)06-0826-05
2016-09-12)

