功能化聚丙烯腈纳米纤维膜同时高效萃取莠去津及其毒性代谢物
曹卫鑫+杨碧漪+祁菲菲+钱靓靓+许茜
摘要 研制了一种新型固相萃取(SPE)介质,用于同时高效萃取莠去津(ATZ)及其两种毒性代谢产物脱乙基莠去津(DEA)和脱异丙基莠去津(DIA),为全面客观地评价ATZ的水污染状况提供基础。以聚丙烯腈纳米纤维(PAN NFs)膜为基底膜,制备了3种功能化的NFs膜。吸附容量和吸附效率实验结果表明,羧基修饰的PAN NFs(COOHPAN NFs)膜对3种目标物的静态和动态吸附容量分别为2.00和0.19 mg/g,动态吸附流出率低于30.0%,显著优于其它3种NFs膜,且对极性较大的目标物保留最强,表明其为同时高效吸附ATZ、 DIA和DEA的优势SPE介质,且主要通过羧基基团与目标物之间形成的氢键进行目标物吸附。采用基于COOHPAN NFs膜的SPE,结合高效液相色谱二极管阵列检测器(HPLCDAD),建立了同时检测水样中ATZ、 DIA和DEA的方法,方法回收率为81.4%~120.3%, DIA检出限(LOD, S/N=3)为0.12 ng/mL,DEA和ATZ的检出限為0.09 ng/mL,可应用于实际水样监测。
关键词 莠去津; 纳米纤维膜; 功能化修饰; 固相萃取; 吸附介质
1引 言
莠去津(Atrazine, ATZ)是一种近几十年来被全球广泛使用的除草剂[1],其代谢产物主要分为两类:脱烷基代谢产物与羟基取代代谢产物。美国环保局的调查数据表明,羟基取代代谢产物毒性较小,而脱烷基代谢产物中的脱乙基莠去津(Deethylatrazine, DEA)和脱异丙基莠去津(Deisopropylatrazine, DIA)内分泌干扰的毒性与莠去津相似[2]。ATZ及其DIA、DEA两种毒性代谢产物的极性较大,水溶性强,常随地表径流进入河流、湖泊,造成水环境污染。因此,同时监测ATZ、DIA及DEA对全面客观地评价ATZ的水污染情况是十分必要的。目前,水体污染监测大多仅限于ATZ。我国环境保护总局(GB 38382002)[3]规定在集中式生活饮用水地表水源地中ATZ的标准限值为0.003 mg/L,DIA和DEA却尚未纳入水质标准。
水体中污染物成分复杂,测定前须经除杂、净化、分离、富集等预处理。固相萃取(Solidphase extraction, SPE)法是常用的样品预处理技术之一[4],其中吸附介质是SPE前处理技术的核心。非极性或弱极性,乃至中等极性的目标物提取技术目前已比较成熟,如何实现水样中极性目标物的高效提取仍是一项具有挑战性的工作。水体中ATZ检测的SPE介质多为Oasis MAX、OASIS HLB、LiChrolut EN等[5~7],处理一份样品需要60~500 mg填料、6~20 mL有机溶剂。实现ATZ及其DIA、DEA两种极性更高的代谢物的同时测定,需研制更为高效的SPE介质。
纳米纤维(Nanofibers, NFs)具有极高的长径比,易于制成膜,并且能保留纳米材料的特性。不同于传统的SPE膜,纳米纤维膜是一种“整体膜”,不需要装填,从根本上避免了“沟流效应”,而极大的比表面积又可提供丰富的与目标物之间的作用位点,为高效提取提供了保证。使用纳米纤维膜处理一份样品仅需几毫克NFs以及不足1 mL有机溶剂,成为极富潜力的绿色、高效的新型SPE介质[8~10]。 迄今为止, 已有数百种聚合物可采用静电纺丝法有效地制备NFs[11],其中,聚丙烯腈纳米纤维(PolyacrylonitrileNFs, PAN NFs)因骨架中存在大量氰基〖JG((〖ZJYC〖ZJSX,YN),〖JG)使其具有较强的功能化改性潜力,可修饰不同官能基团,有利于高效提取极性目标物。前期研究[12,13]发现,NFs经聚吡咯(Polypyrrole, PPy)修饰后,可高效提取水样中的农药、偶氮染料等极性污染物。
本实验采用静电纺丝法制备PAN NFs膜,并以其作为基体材料进行功能化修饰,获得3种功能化NFs膜,分别为PPy修饰的PAN NFs(PPyPAN NFs)膜、氨基修饰的PAN NFs(NH2PAN NFs)膜和羧基修饰的PAN NFs(COOHPAN NFs)膜。通过静态、动态吸附实验,优选其中吸附效能最佳的NFs膜作为SPE介质,并对其可能的吸附机理进行探讨。结合高效液相色谱二极管阵列检测器(HPLCDAD),建立了同时检测水中ATZ、DIA和DEA的方法。
2实验部分
2.1仪器与试剂
LC20AD高效液相色谱仪(HPLC)、SPDM20A二极阵列管检测器、LC Solution色谱工作站、Prominence SIL20AC自动进样器(日本岛津公司);Dikma platisil C18色谱柱(150 mm ×4.6 mm,5 μm);BT25S微量电子天平(赛多利斯科学仪器(北京)有限公司);Hitachi S3000N扫描电子显微镜(SEM,日本日立公司);Nexus 870傅里叶红外光谱仪(FTIR,美国Nicolet公司);Visiprep DL固相萃取仪(美国Supelco公司)。
ATZ、DIA和DEA标准品(纯度>99%,美国SigmaAldrich公司);PAN(上海麦克林生化科技有限公司);吡咯(上海科丰实业有限公司);二甲基甲酰胺、85%水合肼、乙醇、甲醇、FeCl3、NaOH、浓HCl等(国药集团化学试剂有限公司)。
2.2标准溶液的配制
准确称取10 mg的ATZ、DIA和DEA标准品,用甲醇稀释并定容至10 mL, 得到1.0 mg/mL的混合标准储备液(4℃保存)。储备液用二次蒸馏水逐级稀释至所需浓度,得到系列标准溶液。
2.3膜的制备
2.3.1PAN NFs膜以二甲基甲酰胺为溶剂,配制浓度为11%的PAN纺丝溶液,并置于配有6.5号不锈钢针头的20 mL注射器中,针头尖端磨平作为喷针。针头接高压电源正极,铝箔接收屏接高压电源负极。喷射电压设定为12 kV,调整针头至铝箔接收屏的距离为15 cm,纺丝液推进速度为1.0 mL/h。当收集纤维3 h后,将NFs膜连同铝箔在40℃真空干燥箱中放置2 h,挥发残留的溶剂,即得PAN NFs膜。将PAN NFs膜剪裁成质量约200 mg、直径约为15 cm的圆形片作为基底膜,进行如下各官能基团修饰,制得不同功能化的NFs膜。
2.3.2PPyPAN NFs膜将基底膜置于100 mL 0.125 mol/L吡咯单体乙醇溶液中,室温下浸泡1 h,使吡咯单体在纤维表面充分分散。随后加入50 mL 0.125 mol/L氧化剂FeCl3溶液,在室温下通过化学氧化的方式聚合12 h。反应结束后, NFs膜用乙醇和水分别淋洗3次,至洗液无色, 40℃烘干。
2.3.3NH2PAN NFs膜
将基底膜置于100 mL,85%水合肼溶液中,在90℃水浴条件下反应2.5 h后,用甲醇和水交替反复冲洗两遍,于40℃烘箱中烘干。
2.3.4COOHPAN NFs膜
将基底膜置于150 mL PANNaOH(1〖KG-3∶〖KG-530, w/w)中,在90℃水浴条件下反应30 min,得到羧基钠修饰的PAN NFs。反应结束后取出纤维,用蒸馏水冲洗残留的NaOH。2然后浸泡在0.1 mol/L 100 mL HCl中,得到COOHPAN NFs膜,用蒸馏水反复冲洗纤维表面,于40℃烘箱中烘干。
2.4膜的表征
采用SEM观察PAN NFs的表面形貌。样品观察前真空干燥48 h,喷金120 s,加速电压3.0 kV,扫描电镜图片采用Image J软件进行处理,计算NFs的平均直径。采用FTIR分析NFs所含的官能团,将样品与溴化钾粉末按1〖KG-3∶〖KG-5100混合,充分研磨后分散在溴化钾粉末中,压片后进行红外光谱分析,测量范围为400~4000 cmSymbolm@@ 1。
2.5吸附实验
2.5.1静态吸附动力学实验由于SPE过程的实际完成时间通常为30 min以内,故本研究测定各NFs膜在30 min内不同时间对目标物的吸附容量,考察其静态吸附效能。分别取2.0 mg PAN NFs膜、PPyPAN NFs膜、NH2PAN NFs膜和COOHPAN NFs膜于10 mL具塞玻璃小瓶中,依次用丙酮\,二次蒸馏水\,甲醇、二次蒸馏水各200 μL浸洗NFs膜1次。在保持NFs膜浸润的条件下,加入10 mg/L混合目标物溶液2 mL,在298 K条件下进行吸附实验,在不同的时间点(0、5 、10、15 和30 min),分别取样50 μL, 并及时补充相同体积的空白介质,用HPLCDAD检测所取样品中3种目标物的浓度。目标物的吸附量为qt:
qt=(C0-Ct)V/m〖FH(1)
其中, C0为原始溶液中物质的浓度(mg/L); Ct为吸附时间为t时溶液中剩余目标物的浓度(mg/L); qt为吸附容量(mg/g); V为吸附溶液的体积(L); m为NFs膜的质量(g)。
2.5.2动态吸附动力学实验以流出率(Runoff ratio)为指标,通过动态吸附动力学实验考察NFs在SPE过程中的实际吸附效能,采用实验室自制装置对目标物进行动态吸附实验。将PAN NFs膜、PPyPAN NFs膜、NH2PAN NFs膜和COOHPAN NFs膜裁剪为圆形膜(直径2.0 cm,4.0 mg),以筛板上下固定并装填在空固相萃取小柱(1 cm,3 mL)中,制成样品处理器, 并将其置于真空固相萃取仪上。以蒸馏水甲醇蒸馏水(各0.6 mL)的顺序活化NFs膜, 2 mL 0.5 mg/L混合标准样品液以0.6 mL/min的速度通过活化后的NFs膜,取20 μL流出液供HPLC检测。流出率的计算公式如下:
Runoff ratio=C/C0×100%〖FH(2)
其中, C0为原始溶液中物质的浓度(0.5 mg/L); C为流出液中目标物的浓度(mg/L)。
2.6HPLC检测目标物
采用HPLCDAD 检测ATZ、DIA和DEA的濃度。流动相A为乙腈,流动相B为水,梯度洗脱: 0~15 min, 80%~0% B;15~16 min,0%~80% B。柱温30℃;进样量20 μL;流速1.0 mL/min。检测波长222 nm。
2.7SPE过程
取4.0 mg优选NFs膜, 裁剪为直径2.0 cm的圆形膜,依2.5.2节操作,10 mL水样以0.6 mL/min的速度通过NFs膜后,膜用400 μL甲醇洗脱,取20 μL洗脱液直接进行HPLCDAD 检测。
3结果与讨论
3.1NFs膜的形貌及官能团表征
3.1.1SEM各NFs的SEM结果如图1所示。电纺PAN NFs表面光滑,粗细均匀,平均直径约为160 mm; PPy在PAN NFs表面沉积并包裹在NFs外,致使PPyPAN NFs表面变得粗糙,并有少量PPy颗粒沉积,同时纤维直径较修饰前增加,平均直径约为280 mm;NH2PAN NFs和COOHPAN NFs较PAN NFs发生蜷曲,局部可见纤维粘结,可能由于引入亲水基团后,纤维在水溶液中容易溶胀所致[14],但表面形貌均无明显变化,平均直径略有增加,分别为190和180 nm。Symbolm@@ 1处对应的氰基〖JG((〖ZJYCN)〖JG)伸缩振动,1736 cmSymbolm@@ 1处对应的羰基〖JG((〖ZJYC〖ZJLX,YO)〖JG)伸缩振动以及1042~1069 cmSymbolm@@ 1处对应的醚基伸缩振动均是典型的PAN分子结构的特征谱带[15]。但在PPyPAN NFs图谱(曲线b)中,这些特征峰的强度有所减弱甚至消失,取而代之的是PPy的特征峰,包括〖CM(21*31542 cmSymbolm@@ 1 处的吡咯环振动, 1170 cmSymbolm@@ 1 处的〖JG(C〖ZJYN〖JG)〖CM)伸缩振动,1046 cmSymbolm@@ 1处的〖JG(C〖ZJLX,Z;YH〖JG)面内变形振动,895 cmSymbolm@@ 1处的〖JG(C〖ZJLX,Z;YH〖JG)面外变形振动,证明PPy已经包裹修饰在PAN NFs上。由图2B(b)可见,2250 cmSymbolm@@ 1处的氰基峰强度明显变弱,次级氨基基团的〖JG(N〖ZJYH〖JG)的伸缩振动使得在3100~3400 cmSymbolm@@ 1处出现新峰,羰基和〖JG(C〖ZJLX,YN〖JG)键的耦合引起1700~1630 cmSymbolm@@ 1宽带产生。此外,〖JG(C〖ZJYH〖JG)的弯曲振动覆盖了〖JG(N〖ZJYH〖JG)的伸缩振动,从而使1570~1560 cmSymbolm@@ 1峰变弱,表明PAN的氰基与水合肼发生反应,引入〖JG(NH2〖ZJZ〖JG)基团,成功制备了NH2PAN NFs。由图2C可见,经羧基功能化修饰后,PAN NFs的〖JG(CN〖ZJZ〖JG)特征吸收峰明显降低,〖JG(C〖ZJZ;LX,YO〖JG)吸收峰的强度增加,3544 cmSymbolm@@ 1处的〖JG(NH2〖ZJZ〖JG)伸缩振动吸收峰转移至3352 cmSymbolm@@ 1且强度增加,而在1695 cmSymbolm@@ 1处的吸收峰主要是由反应过程中生成的环状中间体上的双键和酰胺基产生[16]。以上结果表明,PAN NFs在羧基功能化修饰后成功引入了〖JG(COOH〖ZJZ〖JG)和〖JG(CONH2〖ZJZ〖JG)基团。
3.2吸附性能考察
3.2.1静态吸附4种NFs膜对于3种目标物在不同时间的吸附容量变化如图3所示。由图3可见,4种吸附材料的吸附效率在0~30 min内有明显区别。COOHPAN NFs膜对3种目标物的吸附更稳定,在前5 min内的吸附效率均大于其余3种膜,吸附目标物更快,同时,在30 min,吸附容量均大于2.0 mg/g,且高于其余3种膜。因此,静态吸附实验表明, COOHPAN NFs膜对3种目标物的吸附效率及吸附容量均具有显著优势。
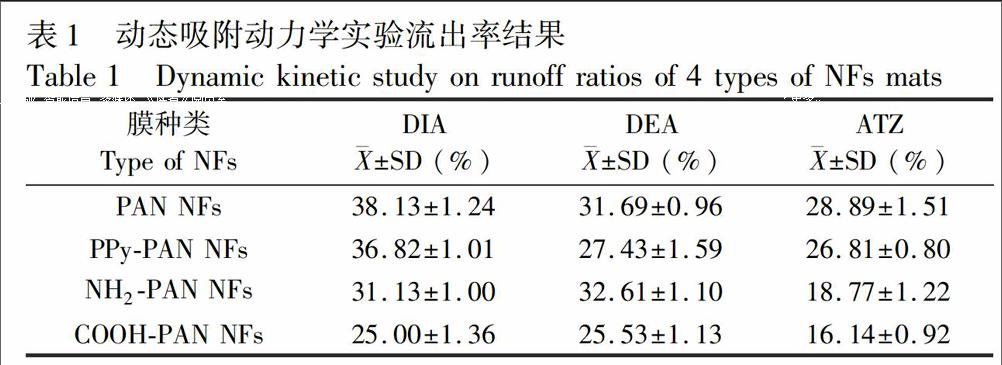
3.2.2动态吸附动态吸附实验结果见表1,COOHPAN NFs膜在3种目标物的SPE过程中与基底膜相比流出率最低(p<0.05),对3种目标物的流出率均小于30.0%,提示能保留更多的目标物,吸附效率最高。高极性目标物是SPE吸附材料研究的难点,3种目标物的极性大小顺序为DIA>DEA>ATZ[17],对于极性最大的目标物DIA,COOHPAN NFs膜吸附优势更明显。
3.3COOHPAN NFs膜吸附机理
考察了COOHPAN NFs膜吸附目〖ZH(标物前后红外图谱的变化。目标物含有三氮杂环、氨基和亚氨基,有可能与羧基基团产生氢键作用而被吸附: 羧基中的〖JG(OH〖ZJZ〖JG)键可以与目标物杂环中的N原子形成氢键〖JG((OH〖ZJYN);〖JG)羧〖ZH)基中的O原子也可以与目标物侧链的〖JG(NH〖ZJZ〖JG)形成氢键〖JG((O〖ZJYNH)。〖JG)由图2D可见,COOHPAN NFs膜吸附目标物后在3500 cm
Symbolm@@ 1处出现明显变化,说明有新键的形成,而这正是由于〖JG(OH〖ZJZ〖JG)的伸缩振动所引起的,证明了氢键的存在[18]。因此,COOHPAN NFs膜的羧基基团与目标物之间形成的氢键可能是主要的吸附作用力。
3.4方法评价及应用
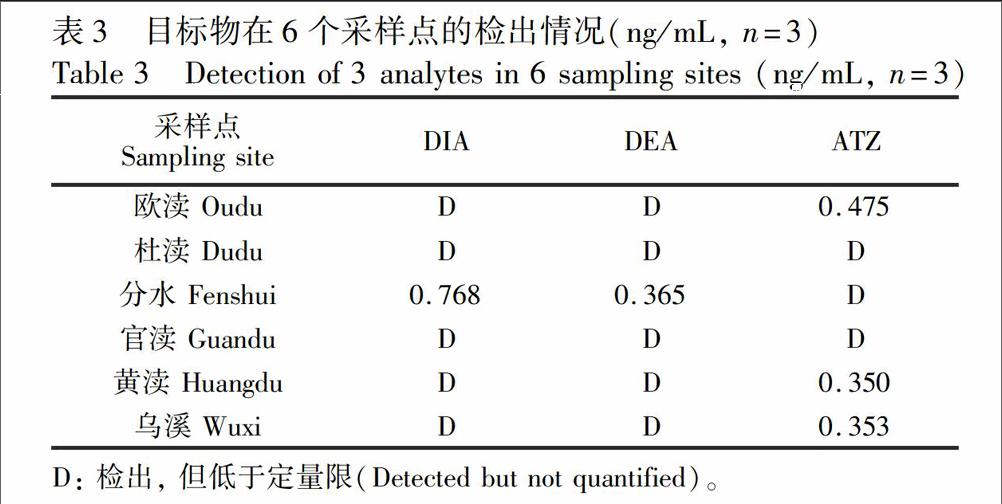
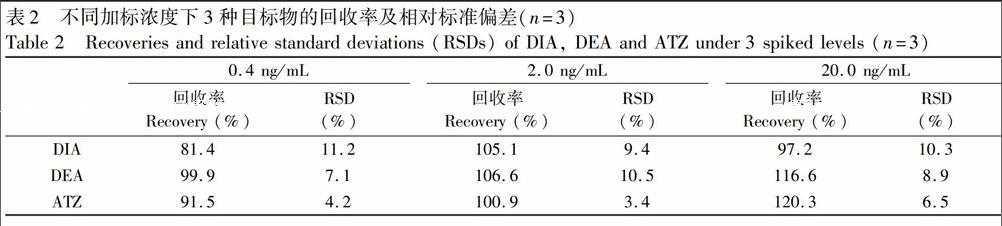
采集太湖西岸入水口6个采样点的水样,按2.7节方法完成样品预处理后进行HPLCDAD检测。同时将收集的6个采样点的水样按同比例混合得到样品基质,并对其中3种目标物的初始(本底)浓度进行了检测。结果表明,样品基质中ATZ浓度为0.3 ng/mL,DIA和DEA则仅能检出。2在样品基质中准确加入标准溶液,制得3种目标物加标水平分别为0.4, 2.0和20.0 ng/mL的样品,进行加标回收实验,计〖CM(44算回收率时, ATZ的测得浓度需扣除其本底浓度。结果如表2所示,表明本方法具有较好的准确〖CM)
度和可靠性。样品中3种目标物的富集〖ZH(倍数为25倍,DIA线性范围为0.4~40.0 ng/mL,DEA和ATZ线性范围为0.3~40.0 ng/mL。以3倍信噪比计,DIA的检出限(LOD)为0.12 ng/mL,DEA和ATZ的LOD为0.09 ng/mL。6个采样点的检测结果如表3所示。
被检测的6个采样点均检出DIA,〖CM(17DEA和ATZ,表明ATZ及其两种代谢产〖CM)〖ZH)物DIA和DEA广泛残留于地表水中,建立环境水中ATZ及其代谢产物的检测方法对于评估地表水农药残留污染具有重要的现实意义。
4结 论
COOHPAN NFs膜兼具纳米材料和功能化材料的优势,仅用少量(4.0 mg)即可同时高效萃取10 mL 环境水样中ATZ及其代谢物。用400 μL甲醇洗脱,洗脱液直接进样检测,无需浓缩、复溶等步骤,样品预处理过程快速、环保。COOHPAN NFs膜对ATZ及其代谢产物的吸附可能是通过羧基基团与目标物之间形成的氢键相互作用,由此可以推测其对极性大且分子中含有电负性较强元素的目标物会有较好的吸附效果,可作为该类目标物的SPE吸附介质。
References
1Solomon K R, Baker D B, Richards R P, Dixon D R, Klaine S J, LaPoint T W, Kendall R J, Weisskopf C P, Giddings J M, Giesy J P, Hall L W, Williams W M. Environ. Toxicol. Chem., 1996, 15(1): 31-74
2NIE Guo, WU ChunXian, GAO LiMing, WANG GuangCheng, CHEN BingKun, ZHANG ZhongMing. Mod. Agrochem., 2007, (04): 32-37, 54
聶 果, 吴春先, 高立明, 王广成, 陈炳坤, 张中明. 现代农药, 2007, (04): 32-37, 54
3GB 38382002, Environmental Quality Standards for Surface Water, National Standards of the People′s Republic of China
地表水环境质量标准. 中华人民共和国国家标准. GB 38382002
4Buszewski B, Szultka M. Crit. Rev. Anal. Chem., 2012, 42(3): 198-213
5Barchanska H, Rusek M, Szatkowska A. Environ. Monit. Assess., 2012, 184(1): 321-334
6REN Jin, JIANG Ke, XU XiaoBai. Chinese J. Anal. Chem., 2004, 32(10): 1273-1277
任 晋, 蒋 可, 徐晓白. 分析化学, 2004, 32(10): 1273-1277
7CarabiasMartinez R, RodriguezGonzalo E, HerreroHernandez E, SanchezSan Roman F J, Flores M G P. J. Chromatogr. A, 2002, 950(12): 157-166
8Chigome S, Torto N. Trends Anal. Chem., 2012, 38: 21-31
9Augusto F, Hantao L W, Mogollon N G S, Braga S C G N. TRACTrend Anal. Chem., 2013, 43: 14-23
10LI XiaoQing, LIU JingJing, QI FeiFei, YANG BiYi, TIAN Tian, XU Qian. Chinese J. Anal. Chem., 2016, 44(3): 474-481
李曉晴, 刘静静, 祁菲菲, 杨碧漪, 田 甜, 许 茜. 分析化学, 2016, 44(3): 474-481
11Deitzel J M, Kleinmeyer J D, Hirvonen J K, Tan N C B. Polymer, 2001, 42(19): 8163-8170
12Yang B Y, Qi F F, Li X Q, Liu J J, Rong F, Xu Q. Int. J. Environ. Anal. Chem., 2015, 95(12): 1112-1123
13Qi F, Li X, Yang B, Rong F, Xu Q. Talanta, 2015, 144: 129-135
14Wang Z G, Wan L S, Xu Z K. J. Membr. Sci., 2007, 304(12): 8-23
15Zhang Z Y, Li X H, Wang C H, Fu S W, Liu Y C, Shao C L. Macromol. Mater. Eng., 2009, 294(10): 673-678
16Dyatlov V A, Grebeneva T A, Rustamov I R, Koledenkov A A, Kolotilova N V, Kireev V V, Prudskov B M. Polym. Sci. Ser. B, 2012, 54(34): 161-166
17Amadori M F, Cordeiro G A, Reboucas C C, PeraltaZamora P G, Grassi M T, Abate G. J. Braz. Chem. Soc., 2013, 24(3): 483-491
18Kica M, Ronka S. Sep. Sci. Technol., 2014, 49(11): 1634-1642
AbstractA novel solidphase extraction (SPE) adsorbent for simultaneous extraction of atrazine (ATZ) and its metabolites, deisopropylatrazine (DIA) and deethylatrazine (DEA) from environmental water samples was prepared. Polyacrylonitrile nanofibers (PAN NFs) mat was prepared via electrospinning, and was further functionalized to obtain polypyrrole modified polyacrylonitrile nanofibers (PPyPAN NFs) mat, hydrazine modified polyacrylonitrile nanofibers (NH2PAN NFs) mat and carboxyl modified polyacrylonitrile (COOHPAN NFs) mat. The results showed that the adsorption capacity of COOHPAN NFs mat was better than other three NFs mats in both static (2.0 mg/g) and dynamic (0.19 mg/g) experiments. Meanwhile, the runoff ratios of COOHPAN NFs mat were the lowest (less than 30.0%) in the adsorption of three analytes, especially for high polar analytes, which showed that the hydrogen bond between carboxyl groups and analytes was the main interactive force. A combination of matbased SPE and high performance liquid chromatographydiode array detection was further established for determination of 3 analytes in environmental water samples. The recoveries were 81.4%-120.3% and the limits of detection were 0.12 ng/mL for DIA, 0.09 ng/mL for DEA and ATZ, respectively.
KeywordsAtrazine; Nanofibers mat; Functionalized modification; Solidphase extraction; Adsorbent
(Received 14 November 2016; accepted 25 January 2017)
This work was supported by the National Natural Science Foundation of China (Nos.81172721, 81473019)

