N-杂环卡宾-硅烷催化二氧化碳合成甲醇
谭正德,黄丽萍,刘 欢, 阳月贝
(湖南工程学院 化学化工学院,湘潭 411104)
N-杂环卡宾-硅烷催化二氧化碳合成甲醇
谭正德,黄丽萍,刘 欢, 阳月贝
(湖南工程学院 化学化工学院,湘潭 411104)
选用噻唑N-杂环卡宾催化剂,通过负载二氧化碳,采用硅烷质子化反应,水解、中和得甲醇.探讨了最佳工艺条件、产率,对产物进行定性与定量测试,用红外光谱对产物进行表征,用反应的化学计量关系对产率进行计算.结果表明:在同样工艺下下,噻唑N-杂环卡宾与咪唑N-杂环卡宾对二氧化碳催化合成甲醇在产率与环境效益方面明显高于掺杂过渡金属的咪唑N-杂环卡宾,而考虑到经济效益与产率,噻唑N-杂环卡宾的催化效果最好.
N-杂环卡宾;二苯基硅烷;二氧化碳;甲醇合成
我国是世界上最大的能源消耗大国之一,能源的利用率低,占能源结构25%左右是以煤、石油、天然气等为主,这些原因也就决定了在短期之内我国二氧化碳排放量持续增长的趋势难以改善.2008 年全球二氧化碳排放量达到 86.7×108 t/a,我国占 21%,居世界第一.在2030年全球二氧化碳排放量将逾400亿公吨,能源的过度消耗、二氧化碳类温室气体排放量的剧增已成为制约经济发展的瓶颈.通过降低能源消耗、能源的利用率的提高,降低二氧化碳的排放速度,其中对其综合利用外排二氧化碳,是实现环境、社会、人类和谐发展的重要方法[1-2].不少国内外的科学研究工作者致力于以二氧化碳为原料的绿色化学与化工,是21世纪全球发展所面临的难题.它的转化与利用对未来社会的能源结构和化工原料来源都将会产生很大的影响,也是一项实现社会的可持续发展和资源生态化利用与研究领域的热点之一,具有非常广阔的发展前景[3-4].
目前,对二氧化碳绿色化利用的研究工作主要是二氧化碳加氢合成甲醇、二氧化碳加氢制取低碳烯烃、合成醛类、二氧化碳加氢制取乙醇、二氧化碳加氢制甲酸、二氧化碳加氢制二甲醚等的研究[5-6].
甲醇是基础有机化工的重要原料,是现代煤化工的中间产品,同时也可广泛用于医药、农药、染料、合成纤维、合成塑料、树脂等工业.并且是低廉的代用燃料.近年来,随着石油资源日益短缺,石油的价格急剧攀升,甲醇作为替代性化工产品,不仅其需求量与日倶增,庞大的“甲醇经济” 也是逐渐的在形成.合成甲醇的主体[9]有:氯甲烷水解法、甲烷部分氧化法、一氧化碳/二氧化碳与氢气合成法等.因技术或经济方面的原因,均未实现工业化.目前甲醇合成的关键技术之一是一氧化碳/二氧化碳与氢气反应合成甲醇所用催化剂[7-8].已报道的催化体系[9]是:N-杂环卡宾催化剂、铜基催化剂、非铜基催化剂、锌铬催化剂、贵金属负载型等.本文为了筛选出有环境效益、经济效益、反应条件温和、高反应产率噻唑型N-杂环卡宾催化剂进行了研究,并对噻唑N-杂环卡宾、咪唑N-杂环卡宾、掺杂过渡金属的咪唑N-杂环卡宾其反应条件、反应产率等进行了比较.
1 实验部分
1.1 实验药品与仪器

表1 实验药品

表2 实验仪器
1.2 实验原理
1.2.1 N-杂环卡宾的结构与性质
一直以来,卡宾都被认为是高活性的物质,因此在有机合成中常被用来增加有机分子上的碳原子.同时,卡宾属于电中性一类的物种,它的反应活性主要来自于电子不饱和性.卡宾具有单线态和三线态两种.它的碳原子的最外层有六个价电子,其中四个价电子以电子对形式填充在两个成键轨道上,另外两个价电子既可分别占有以个未成键轨道形成三线态卡宾(triplet),也可以以电子对的形式只占有一个轨道形成单线态卡宾(singlet).三线态卡宾的反应活性跟自由基非常相似[10].N-杂环卡宾(NHC)研究最早开始于1960年, Wanzlick等[11-12]对噻唑-2-碳烯(图1)作为反应中间体做了详尽的研究,他们认识到咪唑环中邻位N原子的给电子效应能稳定2-位上的卡宾中心,为 N-杂环卡宾化学的发展提供了理论基础,但Wanzlick 没有成功分离得到稳定的噻唑-2-碳烯类化合物[13-14].1964年, Fischer 等[15]通过反应(Eq. 1)合成了第一个稳定的金属卡宾配合物2.1968年, 合成了 N-杂环的金属配合物3[16], 4(图2)[17],但没有得到人们足够重视.直到20世纪90年代, N-杂环卡宾金属配合物才得到人们充分的重视.对于金属卡宾配合物, 根据配体卡宾中与卡宾碳直接相连的元素不同分为两种类型: Schrock和 Fischer 型.Schrock型卡宾配合物,主要是指卡宾配位体中只含有碳和氢的配合物,如5(图 3);这类型的化合物很少能制备得到稳定的纯物质,一般以反应中间体形式存在;Fische型是指卡宾碳原子的邻位含有杂原子的配合物.一般为N、O、S、Se等元素.通常N原子含有孤对电子,通过π键向卡宾配位体中的卡宾碳提供电子,以稳定卡宾中心.所以 N-杂环卡宾一般能在空气中稳定存在.

图1 噻唑-2-碳烯
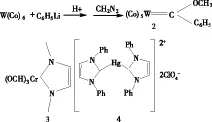
图2 N-杂环的金属配合物

图3 Schrock型卡宾配合物
N-杂环卡宾分很多种[18],如图4所示.
本文选用的是噻唑N-杂环卡宾为催化剂催化二氧化碳合成甲醇,并探讨了其反应的最佳条件.
1.2.2 催化剂作用的机理
催化剂噻唑N-杂环卡宾的结构中含有卡宾电子,亲核卡宾激活二氧化碳的中心碳原子形成一个噻唑羧化物,C—O键断裂生成O—离子.O—离子再去进攻二苯基硅烷的带正电荷的中心Si,促进其氢转移,生成2与3,化合物3再与其它自由硅烷在噻唑N-杂环卡宾催化剂催化下生成4-6,最后生成7-8,反应完全后通过碱性水解Si—O键生成产物甲醇.如图5所示.
由图5中机理[19]可知,噻唑N-杂环卡宾作为催化剂在经过二氧化碳负载后又被二苯基硅烷质子化反应为原先的卡宾,可知,只要在反应过程中不断补充二氧化碳与二苯基硅烷则反应就可以持续不断的进行,这也是本实验上的价值之处.

图4 常见氮杂环卡宾的结构:R=alkyl或aryl
1.3 实验方法
1.3.1 噻唑N-杂环卡宾催化剂的制备
用分析天平准确称取1-(2,4,6-三甲基苯基)噻唑盐0.25 mmol和0.25 mmol的氢化钠放入干燥的烧瓶中,加入0.5 ml的N,N-二甲基甲酰胺(DMF)(用硫酸钙除水,然后减压蒸馏),常温磁力搅拌30 min,离心分离,取清液备用[20-21].
1.3.2 噻唑N-杂环卡宾作催化剂催化二氧化碳制备甲醇
于一干燥洁净50 ml的两口烧瓶中,加入0.2 ml噻唑N-杂环卡宾溶液, 1.8 ml N,N-二甲基甲酰胺(DMF)(用硫酸钙除水,然后减压蒸馏),用橡皮塞密封、抽真空(真空度为0.1 MPa),连通二氧化碳,使反应装置的气压维持在0.5 MPa,磁力搅拌,反应30 min,用微量注射器取分别取样0.1 ml,通过薄层色谱检测二氧化碳与卡宾反应生成噻唑羧酸盐的完全度,当检测反应达95%,用微量注射器向反应体系中注射二苯基硅烷1 mmol(0.18 ml)继续磁力搅拌8 h用微量注射器取分别取样0.1 ml检测体系的质子化反应率,当反应达到95%.停止通二氧化碳,移取4.00 ml 10%的氢氧化钠注入密封体系中,常温水解18 h,水解完全后用配置好的10%的硫酸溶液对水解产物进行中和使其pH达到7,再静置0.5 h,在343.15 K下,常压蒸馏收集馏分,并对其产品进行IR表征及定性与定量检测.
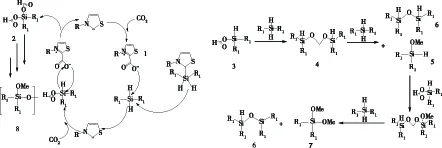
图5 反应机理图其中R为苯基
1.4 产物的检测与表征
1.4.1 产物的检测
(1)定性检测
取一滴液体样品溶于1 ml的丙酮中,加入一滴配置好的6.25 mmol/ml铬酸试剂,震荡观察溶液在5 s内产生的现象,伯醇和仲醇呈阳性试剂,溶液由橙色变为蓝绿色,叔醇不发生反应,溶液仍保持橙色.为了证实丙酮不含被氧化性杂质即不会产生阳性试剂,加入一滴铬酸于1 ml的丙酮中进行空白试验,试剂的橙色应至少保持5 s,说明不是因为丙酮而导致的变色,否则需要更换丙酮.
(2)定量检测
根据反应的机理以噻唑卡宾为基准,利用其化学计量关系对产物进行产率的计算,根据机理,有以下关系:
C12H12Si~~2CO2~~2CH3OH
以二苯基硅烷为反应基准,根据投入的比例来计算产物的产率.
1.4.2 产物的红外光谱表征
红外光谱可用来对化合物进行定性及结构的分析,根据图谱上出现的吸收带的位置、强度、和形状,利用各种基团特征吸收的知识,确定吸收带的归属以确定分子中所含的基团,定性鉴定和推测分子的结构.为确定噻唑N-杂环卡宾与硅烷催化二氧化碳的催化结果,对制得的产物进行红外表征.
2 实验结果与讨论
2.1 比较不同催化剂对产率的影响
对噻唑N-杂环卡宾、咪唑N-杂环卡宾、掺杂过渡金属的咪唑N-杂环卡宾催化剂对其在最佳反应条件下催化二氧化碳合成产物甲醇的产率、催化剂的价格、催化剂的环境效益进行了比较,如表3所示.
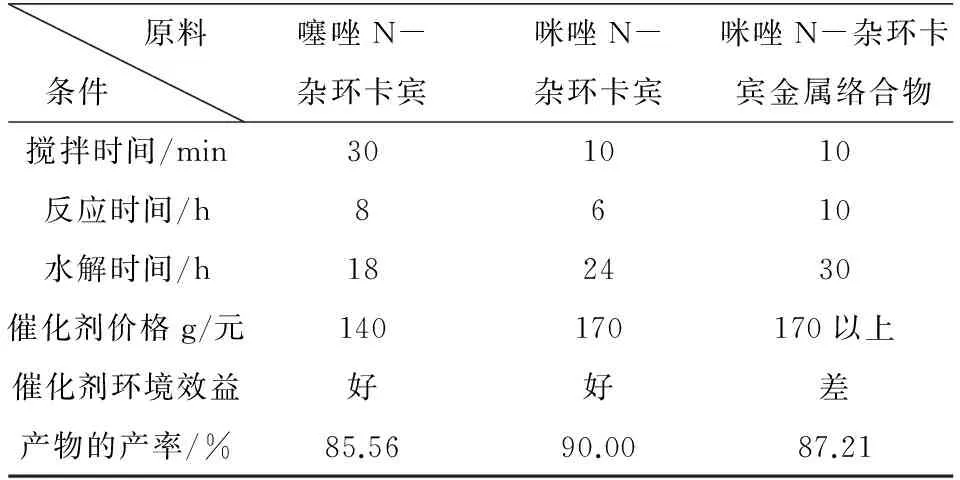
表3 不同催化剂下产率的比较
由表3可知,噻唑N-杂环卡宾、咪唑N-杂环卡宾、掺杂过渡金属的咪唑N-杂环卡宾在搅拌时间、反应时间、水解时间、催化剂价格(经济效益)、环境效益、产物的产率上来看,尽管咪唑N-杂环卡宾金属络合物的合成产率达到87.21%但是其对环境有害.咪唑N-杂环卡宾催化剂的催化产率达到90.00%,环境效益也能符合标准,但是其在三种催化剂中价格却是比较昂贵的,经济效益并不是首选.噻唑N-杂环卡宾的催化产率为85.52%虽然在三种催化剂中是最低的,但是其环境效益与经济效益却是三种催化剂中比较突出的.因此我们可以根据条件的不同,以及不同的需要来选择不同N-杂环卡宾催化剂.
2.2 反应条件对噻唑N-杂环卡宾催化剂合成甲醇产率的影响
2.2.1 二氧化碳与噻唑N-杂环卡宾的反应时间对产率的影响
噻唑N-杂环卡宾的卡宾电子进攻二氧化碳的碳原子在外界搅拌的情况下生成氧负离子噻唑羧化物,其他反应条件是反应时间8 h,水解时间18 h,在此基础上以确定最佳的搅拌时间,如图6所示.

图6 二氧化碳与噻唑N-杂环卡宾的反应时间对产率的影响
由图6可知,二氧化碳与噻唑N-杂环卡宾的反应时间对产率有明显的影响,当其他条件不变时,搅拌时间从10 min延长至50 min,产物的产率随时间的延长而升高,这是因为时间的延长,更多的噻唑N-杂环卡宾与二氧化碳生成更多的噻唑羧化物,当反应到30 min时,产率达到最高,因此,适宜的二氧化碳与噻唑N-杂环卡宾的反应时间为30 min.
2.2.2 二苯基硅烷与噻唑羧化物反应时间对产率的影响
二苯基硅烷与噻唑羧化物在用气球不断供给二氧化碳的情况下,噻唑羧化物的氧负离子不断的进攻二苯基硅烷的带正电荷的Si中心,与其生成Si-O键,同时释放出噻唑N-杂环卡宾,释放出的噻唑N-杂环卡宾又与气球供给的二氧化碳生成噻唑羧化物,在这个不断循环的过程中,二苯基硅烷作为H质子的提供者而被不断的消耗,直至消耗完全.其他反应条件分别是搅拌时间为30 min,水解时间为18 h,在此基础上以确定最佳的反应时间,如图7所示.
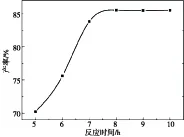
图7 二苯基硅烷与噻唑羧化物反应时间对产率的影响
由图7可知,二苯基硅烷与噻唑羧化物反应时间对产率有明显的影响,当其他条件不变时,反应时间由5 h延长至10 h,产物的产率随反应时间的延长而升高,产率在反应时间达到8 h时是最高的,这是因为反应时间的延长使二苯基硅烷质子化反应更加完全,当反应时间达到8 h时,二苯基硅烷消耗完全,反应时间的延长对反应产率无明显的影响.因此,适宜的苯基硅烷与噻唑羧化物反应时间为8 h.
2.2.3 Si-O键碱性水解时间对产率的影响
用10%的氢氧化钠水解反应后的混合物,使混合物中的Si-O键断裂,生成产物甲醇.采用控制变量法,探讨最佳的水解时间,如图8所示.

图8 Si-O键碱性水解时间对产率的影响
由图8可知,水解时间对水解产率的影响不大,当其他条件控制到最佳时,水解时间由12 h到24 h,产率随水解时间的延长而升高,水解时间达到18 h时产率达到最高,表明混合物水解完全需要18 h,且时间延长,对产率影响不大.因此适宜的水解时间为18 h.
2.3 产物的分析
2.3.1 产物的定性分析
取一滴产物溶于1 ml丙酮中,加入一滴配置好的铬酸试剂,摇荡并注意观察溶液5 s内发生的现象,发现溶液由橙色变为蓝绿色,该反应为有伯醇和仲醇的阴性反应.为了证实丙酮不含被氧化性杂质即不会产生阳性反应,加入一滴铬酸于1 ml的丙酮中进行空白试验,试剂的橙色应至少保持5 s,说明不是因为丙酮而导致的变色.如表4所示.

表4 产物的定性分析
2.3.2 产物的红外分析
红外光谱可用来对化合物进行定性及结构的分析,根据图谱上出现的吸收带的位置、强度、和形状,利用各种基团特征吸收峰值,确定吸收带的归属以确定分子中所含的基团,定性鉴定和推测分子的结构.为确定噻唑N-杂环卡宾与硅烷催化二氧化碳的催化结果,在已压好片的固体KBr上涂上催化产物,对其进行红外光谱表征.

图9 产物的红外光谱图
从图9可以看到产物在3000 cm-1处有一个极强的宽吸收峰,该峰对应醇中的羟基峰,说明产物中有甲醇.
3 结论
(1)选用噻唑N-杂环卡宾催化剂,通过负载二氧化碳,采用硅烷质子化反应,水解、中和得甲醇,产率达85.56%;
(2)对产物进行定性与定量测试,用红外光谱对产物进行表征,其结果在预先设定的目标;
(3)对比咪唑N-杂环卡宾及掺杂过渡金属的咪唑N-杂环卡宾在催化二氧化碳合成甲醇的催化条件、产率、经济效益、环境效益等.结果表明:噻唑N-杂环卡宾与咪唑N-杂环卡宾对二氧化碳催化合成甲醇在产率与环境效益方面明显高于掺杂过渡金属的咪唑N-杂环卡宾,而考虑到经济效益与产率,噻唑N-杂环卡宾的催化效果最好.
(4)探索其他的氢源来代替昂贵的二苯基硅烷,有待更深层次的探讨.
[1] 程明珠,刘忠生.二氧化碳减排技术和发展趋势[J].当代化工,2011,13(8):824-826.
[2] R.Lal. Sequestration of Atmospheric CO2in Global Carbon Pools [J].Energy and Environmental Science,2008,1(1):86-100.
[3] 赵云鹏.温室气体CO2加氢合成甲醇CuO-ZnO/TiO2催化剂的制备与性能研究[D].哈尔滨工业大学硕士学位论文,2013.
[4] 黄树鹏.二氧化碳加氢合成甲醇反应的研究[D].大连理工大学硕士学位论文,2009.
[5] 孙鲤鹏,丘凤炎,徐贤伦.二氧化碳催化转化在化学合成中的应用[J].现代化工,2002,22(11):57-61.
[6] 倪小明,谭骑生,韩怡卓.二氧化碳催化转化的研究进展[J].石油化工,2005,34(6):505-509.
[7] 魏 明.甲醇合成催化剂KATALC051-9工艺条件优化[D].大连理工大学硕士学位论文,2013.
[8] 杨 澜.二氧化碳合成甲醇的铜基催化剂的研究[D].西安石油大学硕士学位论文,2013.
[9] 谢克昌,房鼎业.甲醇工艺学[M].北京:化学工业出版社,2010:196-209.
[10]P.S.Skell,S.R.Sandler,Reaction of Kl-dihalocyclopropanes with Electrophilic Reagents Synthetic Route for Inserting a Carbon Atom Between the Atoms of a Double Bond[J].Am.Chem.Soc.1958,80:2024-2025.
[11]JSeayad, PKPatra, YZhang, JYYing. Organocatalytic Synthesis of N-Phenylisoxazolidin-5-ones and a One-pot Synthesis of β-amino Acid Esters[J].Org Lett,2008,10:953-956.
[12]FTWong, PKPatra, JSeayad, YZhang, JYYing. N-heterocyclic Carbene (NHC)-catalyzed Direct Amidation of Aldehydes with Nitroso Compounds[J]. Org Lett,2008,10:2333-2336.
[13]付 军.新型氮杂环卡宾的合成、性质及其金属络合物的研究[D].华东理工大学博士学位论文,2013.
[14]SNRiduan, YZhang , JYYing. Conversion of Carbon Dioxide into Methanol with Silanes Over N-heterocyclic Carbene Catalysts[J]. Angew Chem, Int Ed,2009,48:3322-3325.
[15]KZeitler. Extending Mechanistic Routes in Heterazolium Catalysis-promising Concepts for Versatile Synthetic Methods[J]. Angew Chem, Int Ed,2005,44:7506-7510.
[16]Enders D, Niemeier O, Henseler A. Organocatalysis by N-heterocyclic Carbenes[J]. Chem Rev,2007,107:5606-5655.
Conversion of Carbon Dioxide into Methanol with Silanes over N-Heterocyclic Carbene Catalysts
TAN Zheng-de,HUANG Li-ping,LIU Huan,YANG Yue-bei
(College of Chemistry and Chemical Engineering, Hunan Institute of Engineering, Xiangtan 411104, China)
In this paper, we report the conversion of carbon dioxide into methanol over the thiazole N-heterocyclic carbene catalyst. With the adsorption of carbon dioxide and through steps of silane protonation, hydrolysis and neutralization, methanol is generated in satisfactory yield. We explore the conditions for optimal production, and conduct qualitative and quantitative analysis of products. We verify the reaction mechanism by means of gas chromatography and mass spectrometry, and characterize the product by IR. The methanol yield is calculated on the basis of reaction stoichiometry. The results show that under the condition of: stirring time=30 min, reaction time=18 h, and hydrolysis time=18 h at room temperature, the methanol yield is 85.56%. Following the same procedure, we also study the use of the imidazole N-heterocyclic carbene and transition metal-doped imidazole N-heterocyclic carbene as catalysts. The results show that in terms of yield and environmental benefits, the thiazole N-heterocyclic carbene and imidazole N-heterocyclic carbene catalysts are superior to the transition metal-doped imidazole N-heterocyclic carbene catalyst. From the aspects of economic and productivity efficiency, the thiazole N-heterocyclic carbene catalyst has good prospect in the fixation of carbon dioxide and the production of methanol.
N-heterocyclic carbene; diphenyl silane; carbon dioxide; methanol synthesis
2016-09-16
谭正德(1970-),男,教授,研究方向:光催化合成与应用.
文献标识码:A 文章编号:1671-119X(2017)01-0065-07

