鸭坦布苏病毒JM株E蛋白的截断表达及间接ELISA方法的建立
董嘉文,李林林,孙敏华,张建峰,邝瑞欢,胡奇林,张春红
(1. 广东省农业科学院动物卫生研究所 广东省兽医公共卫生公共实验室 广东省畜禽疫病防治研究重点实验室,广州 510640;2.福建省农业科学院畜牧兽医研究所,福州 350013)
·研究论文·
鸭坦布苏病毒JM株E蛋白的截断表达及间接ELISA方法的建立
董嘉文1,李林林1,孙敏华1,张建峰1,邝瑞欢1,胡奇林2,张春红1
(1. 广东省农业科学院动物卫生研究所 广东省兽医公共卫生公共实验室 广东省畜禽疫病防治研究重点实验室,广州 510640;2.福建省农业科学院畜牧兽医研究所,福州 350013)
本研究利用RT-PCR扩增鸭坦布苏病毒(Duck Tembusu virus,DTMUV)JM株E基因截断片段(822 bp),并将其克隆至原核表达载体pET32a ( + ),成功构建了重组质粒pET32a-E。重组质粒转化大肠杆菌Rosseta,经IPTG诱导得到了高效表达。Western blot分析表明,重组蛋白能与DTMUV阳性血清发生特异性反应。将纯化好的DTMUV E蛋白作为包被抗原,建立了检测DTMUV血清抗体的间接ELISA方法。经过条件优化,确定了抗原最适包被浓度为0.093 μg/孔,血清的最佳稀释度为1∶100。批内和批间重复试验的最大变异系数分别为3.53%和9.73%。用建立的ELISA方法对免疫鸭坦布苏病毒灭活疫苗的鸭血清和对照鸭血清进行抗体检测,同时与攻毒保护试验进行比较,两者的阳性符合率为86.67% ,阴性符合率为100%。
鸭坦布苏病毒;JM株;E 蛋白;截断表达;ELISA
鸭坦布苏病毒病是由属于黄病毒科(Flaviviridae)、黄病毒属(Flavivirus)、恩塔亚病毒群的坦布苏病毒(Duck Tembusu virus,DTMUV)感染引起的。该病2010年春季在浙江省、江苏省、上海市等华东地区首次发生,并迅速传播到全国大多数水禽养殖地区,给养鸭业造成巨大损失[1-5]。TMUV主要感染蛋鸭和种鸭,发病率几乎100%,死亡率为5%~10%。临床上主要表现为发病5 d内,蛋鸭群的产蛋量骤然下降,从产蛋高峰迅速下降至30%~10%,严重的甚至停产。近年来有报道该病毒感染的宿主范围有扩大趋势,从自然感染蛋鸭,到能够感染蛋鸡、蛋鹅等禽类[6,7]。
鸭坦布苏病毒(Duck Tembusu virus,DTMUV)呈球形,直径30~50 nm,是不分节段的单股正链RNA病毒[8,9]。DTMUV编码结构蛋白(C、prM和E)和非结构蛋白(NS1、NS2A、NS2B、NS3、NS4A、NS4B和NS5)。E蛋白是DTMUV的外膜蛋白,参与病毒的细胞膜融合和穿入,能刺激机体产生保护性的中和抗体,是主要的免疫原性蛋白[10-13]。本研究截取了E基因的主要抗原表位区段(822 bp),将该基因片段克隆到表达载体,在大肠杆菌中进行表达和鉴定。然后以纯化的pET32a-E蛋白作为抗原,建立了快速检测DTMUV抗体的间接ELISA方法,为鸭坦布苏病毒病的诊断以及流行病学调查奠定了基础。
1 材料与方法
1.1 病毒、菌株和质粒 DTMUV JM株[9,10]、DTMUV阳性血清、大肠埃希菌工程菌株DH5α、Rosseta感受态细胞(DE3)、pET32a(+)质粒均为广东省农业科学院动物卫生研究所保存。
1.2 主要试剂 BamH I、XhoI 、T4 DNA连接酶和RNA抽提试剂盒购于宝生物工程有限公司;DNA凝胶回收试剂盒购和小量质粒提取试剂盒购于天根生物科技有限公司;预染蛋白质Marker为Fmentas公司产品;兔抗鸭IgG为Nordic公司产品;鸭坦布苏病毒灭活疫苗为本实验室制备。
1.3 实验动物 蛋鸭购自广东省佛山市三水区某鸭场,经检测蛋鸭未感染过鸭坦布苏病毒。
1.4 重组蛋白pET32a-E的表达和鉴定
1.4.1 引物设计和合成 根据DTMUV JM毒株E基因序列(GenBank登录号:JN811559),设计扩增E基因截断片段大小为822 bp。引物由上海英潍捷基生物技术公司合成。上游引物:5'-CTAGGATCCC AGAAGGAAAACGTCCAGT -3'(BamH I);下游引物:5'-CCGCTCGAGTTACCACTGGTACCTGAT -3'(XhoI)
1.4.2 RNA的抽提及cDNA的反转录 参照TaKaRa公司的RNA抽提试剂盒操作说明抽提RNA。40 μL逆转录反应体系:21 μL RNA、2 μL 随机引物、4 μL dNTP Mixture(2.5 mmol/ L),65℃水浴5 min,在冰浴下依次加入8 μL 5×First strand buffer、4 μL DTT和1 μL 反转录酶,混匀,于37℃水浴1 h,取出置于-20℃备用。
1.4.3 DTMUV-E基因的PCR扩增 25μL PCR反应体系:10×ExTaq buffer 2.5μL、dNTPs(2.5 mmol/ L) 2.0 μL、P1(10 pmol/μL) 1.0 μL、P2(10 pmol/μL)1.0 μL、ExTaq DNA聚合酶(5 U/μL)0.125 μL、cDNA 2 μL,加ddH2O至25μL。首先94℃预变性5 min,然后进入94℃变性30 s,53℃退火30 s,72℃ 延伸1 min,循环30次后,最后72℃再延伸10 min。
1.4.4 重组表达质粒的构建与鉴定 截断E基因PCR产物纯化回收后和表达载体pET32a(+)用BamH I、Xho I进行双酶切,16℃连接过夜后转化DH5α感受态细胞,将培养液涂布于含Amp (100 mg/ L) 的平板上,37℃培养过夜。挑选单个菌落进行菌落PCR和酶切鉴定,将鉴定的阳性重组质粒送测序。然后把测序正确的阳性重组质粒转化Rosseta感受态细胞,挑取单菌落进行PCR鉴定。
1.4.5 重组表达质粒pET32a-E最佳诱导时间的确定按照1∶50比例将阳性菌液加入含Amp的LB培养基中振荡培养,待OD600值达到0.5~0.8时,加入终浓度为1.0 mmol/ L的IPTG,然后继续振荡培养,分别在诱导前和诱导后2、3、4、5 、6 h吸取1 mL菌液于4℃保存,10 800×g 离心1 min,收集细菌沉淀进行SDS-PAGE,同时以诱导的空载体和未诱导的重组质粒为对照。
1.4.6 pET32a-E表达产物的可溶性分析 按照确定的最佳诱导表达条件对pET32a-E阳性菌进行诱导表达。然后4℃、7378×g 离心10 min,收集菌体,加入20 mLPBS重悬菌体,于冰浴中进行超声裂解。超声完毕后于4℃、转速必须是10 800×g 离心20 min,分离超声产物的上清和沉淀,用10 mL PBS重悬沉淀。取50 μL的超声上清和沉淀重悬液,分别加入50 μL上样缓冲液,混匀,置沸水浴中煮10 min后离心1 min,最后分别取10 μL上清进行SDSPAGE分析。
1.4.7 重组蛋白PET32a-E的提取及纯化 采用上述最佳诱导条件进行大量表达蛋白并超声破碎,弃去上清,15 mL(含8 mol/L尿素)重悬菌体,冰浴2 h后,4℃、8928 ×g 离心20 min,收集上清,即为溶解的包涵体。按照Novagen 公司的Ni-NTA His·Bind 树脂说明书对重组蛋白进行纯化,将纯化好的目的蛋白用超滤管进行浓缩,-80℃保存备用。
1.4.8 Western blot检测 重组蛋白pET32a-E经SDSPAGE电泳分离后,将预先在转印缓冲液中浸泡后的滤纸、胶、NC膜,按以下顺序组装:平板阳极-三层滤纸-NC 膜-凝胶-三层滤纸-平板阴极,15 mA转1.5 h。电转印结束后, NC膜用5%脱脂奶粉封闭1 h,用PBST洗涤3次,每次5 min;加入1∶50稀释的DTMUV阳性血清,37℃作用1 h后,再用PBST洗涤3次;加入1∶2000稀释的HRP标记的兔抗鸭IgG 37 ℃作用1 h,用PBST洗涤3次;用DAB显色,然后用ddH2O终止,拍照保存。
1.5 间接ELISA方法的建立
1.5.1 重组蛋白抗原最适包被浓度和血清最适稀释浓度的确定 用包被液将重组蛋白抗原进行倍比稀释后包被酶标板,浓度分别为0.047、0.093、0.186、0.372、0.744、1.448μg/孔,4℃过夜。用血清稀释液将DTMUV阳性血清和健康鸭阴性血清分别进行50、100、200及400倍稀释,与重组蛋白不同稀释度进行方阵滴定[8],100 μL/孔,每个浓度设1个重复,HRP兔抗鸭二抗浓度为1∶16 000,按常规进行ELISA,测定血清的OD490值。
1.5.2 间接ELISA方法阴、阳临界值的确定 用以上确定的最适反应条件进行ELISA,分别检测健康鸭阴性血清40份,测定OD490,对结果进行统计学分析。计算平均值() 和标准差(s),按照公式:+ 2s判定阳性和阴性。
1.5.3 间接ELISA方法的特异性试验 用纯化的重组蛋白作为包被抗原,分别与番鸭细小病毒(Muscovy duck parvovirus disease,MPV)、鹅细小病毒(Goose parvovirus,GPV)、鸭甲肝病毒I 型(Duck Hepatitis A virus type-1,DHAV-I)、鸭瘟病毒(DPV)和鸭疫里默氏杆菌(Rhemerellc anatioesfifer,RA)阳性血清反应,同时设DTMUV阳性和阴性血清对照,按照以上建立的ELISA方法检测其OD490值。
1.5.4 间接ELISA方法的敏感性试验 将DTMUV阳性血清分别进行100、200、400、800、1600、3200、6400倍和12 800倍稀释,按照以上建立的ELISA方法检测其OD490值。
1.5.5 间接ELISA方法的重复性试验 取4份阳性血清和4份阴性血清进行批内重复性试验,每份样品平行设6个重复,在4个不同试验日重复测定4份阳性血清和4份阴性血清,每份样品平行设4个重复,进行批间重复试验。
1.5.6 间接ELISA方法的临床应用 120日龄非免蛋鸭30只随机分成3组,每组10只,腿部肌肉注射DTMUV灭活疫苗(1 mL/只),同时设立对照组10只。21 d后加强免疫1次,28 d后采血,分离血清用所建立的ELISA方法检测抗体。采血完后用鸭坦布苏病毒强毒株腿部肌肉注射攻击,103.0ELD50/只,攻毒后4 d后,全部剖杀,记录卵巢的病变情况。
2 结果
2.1 DTUMV-E基因的RT-PCR扩增 经RT-PCR扩增后电泳,截断E基因扩增产物在750~1000 bp条带之间获得一条特异性的条带,与预期片段大小相一致(图1)。
2.2 重组表达载体的构建与鉴定 pET32a-E质粒经过BamH I和XhoI双酶切后,电泳可见在1000 bp和7000 bp附近出现2条清晰条带,前者为E基因,后者为pET32a (+)载体片段,说明截断E基因片段正确插入到表达载体中(图2)。
2.3 重组表达质粒pET32a-E最佳诱导时间的确定 如图3所示,pET32a-E阳性菌诱导2~6 h均在48 kDa左右出现特异性蛋白条带,与预期的蛋白分子量大小一致,而未诱导的pET32a-E没有出现相应的条带,且诱导5~6 h的蛋白表达量最大,考虑到实验的效率,故选取5 h作为最佳诱导时间。

图 1 DTUMV-E基因RT-PCR产物电泳结果Fig. 1 PCR-amplifi ed E gene from DTMUVM∶ DNA分子量标准(DL2000); 1∶ E 基因 RT-PCR 产物M∶ DNA Marker(DL2000); 1∶ PCR products of E gene

图 2 pET32a-E质粒双酶切鉴定电泳结果Fig. 2 Identifi cation of recombinant plasmid pET32a-E by restriction enzymes digestionM∶ DNA分子量标准(DL10000); 1∶ pET32a-E质粒双酶切产物M∶ DNA Marker (DL10000); 1∶ Restriction enzymes digestion products of pET32a-E
2.4 pET32a-E表达产物的可溶性分析 pET32a-E表达蛋白经过超声波破碎、离心后,分别取上清和沉淀进行SDS-PAGE电泳,结果显示表达产物主要以包涵体形式存在(图4)。
2.5 Western blot检测结果 pET32a-E重组蛋白经过纯化后进行Western blot,结果显示在48 kDa左右出现特异条带,说明纯化重组蛋白在大肠杆菌中获得正确表达,并且能被DTMUV阳性血清所识别,表明该蛋白具有良好的反应原性(图5)。

图 3 不同诱导时间pET32a-E蛋白表达的SDS-PAGE电泳分析Fig.3 SDS-PAGE analysis of recombination protein pET32a-EM∶ 蛋白分子量标准; 1∶ 重组质粒pET32a-E未诱导菌; 2~6∶分别为IPTG诱导2、3、4、5、6 h的重组质粒pET32a-E; 7∶pET32a ( + )诱导菌M∶ Protein Marker; 1∶ Un-induced recombinant plasmid pET32a-E; 2-6∶ Recombinant plasmid pET32a-E induced with IPTG for 2, 3, 4, 5, 6 h, respectively; 7∶ pET32a (+) /Rosetta induced with IPTG

图4 pET32a-E表达产物的可溶性分析图Fig. 4 The analysis of solubility of pET32a-E expression productsM∶ 蛋白分子量标准; 1∶ 重组质粒pET32a-E 诱导菌裂解上清; 2∶ 重组质粒pET32a-E 诱导菌裂解沉淀M∶ Protein Marker; 1∶ Supernatant of ultrasonicated pET32a-E/ Rosetta after induction; 2∶ Pellets of ultrasonicated pET32a-E/ Rosetta after induction
2.6 间接ELISA方法的建立
2.6.1 重组蛋白抗原最适包被浓度和血清最适稀释浓度的确定 纯化重组蛋白用brandford方法测定其浓度为0.370 mg/mL。从方阵试验结果可以看出,pET32a-E 抗原浓度为0.093 μg/孔,血清的稀释度为1∶100时,阳性血清的OD490值在1.0左右,且阴性血清的OD490较低,P/N值最高(表1)。因此,我们确定pET32a-E 抗原的最适浓度为0.093 μg/孔,血清的最适稀释度为1∶100。

图5 重组蛋白pET32a-E Western blot分析结果Fig. 5 Western blot analysis of pET32a-E protein M∶ 预染蛋白Marker ; 1∶ 阴性对照; 2∶ pET32a-E 蛋白M∶ Protein Marker; 1∶ Negative control; 2∶ pET32a-E protein

表1 重组蛋白抗原最适包被浓度与血清稀释度的确定Table 1 The optimization of coating concentration with E protein by checkerboard titration
2.6.2 间接ELISA阴、阳性血清临界值的确定 按照以上确定的ELISA 反应条件检测34份健康鸭阴性血清,同时做标准阳性和阴性对照。结果经统计学分析,40份健康鸭血清OD490值平均数()等于0.24,方差(s)等于0.096,“+2s”等于0.432,因此阴、阳性血清临界值为0.432。
2.6.3 间接ELISA方法的特异性试验 用建立的间接ELISA方法对GPV、MPV、DHAV-I、DPV和RA阳性血清进行测定,其OD490值分别为0.203、0.144、0.113、0.167、0.11,均小于阴阳性临界值0.432,见表2。表明重组蛋白pET32a-E均不与GPV、MPV、DHAV-I、DPV和RA阳性血清反应,建立的间接ELISA方法具有较好的特异性。
2.6.4 间接ELISA方法的敏感性试验 抗原按最佳包被浓度和条件进行包被,将DTMUV阳性血清分别做100、200、400、800、1600、3200、6400、12 800倍稀释,其他条件按最适反应条件进行间接ELISA测定。结果显示,阳性血清1∶1600稀释后其OD490值仍大于临界值0.432,而3200倍之后稀释的阳性血清OD490值则小于0.432(表3)。
2.6.5 间接ELISA方法的重复性试验 批内重复和批间重复试验结果显示,批内重复的吸收变异系数为2.69%~4.32%(表 4),表明同一样品在同一批试验中变异程度很小,具有良好的重复性;批间重复的吸收变异系数为3.53%~9.73%(表5),其批间变异系数控制在10%以下,表明同一样品在同一批试验中变异程度较小,具有较好的重复性。
2.6.6 间接ELISA方法的临床应用 鸭坦布苏病毒疫苗灭活疫苗免疫120日龄麻鸭采血,用建立的ELISA方法检测血清抗体效价,采血完后用鸭坦布苏病毒强毒攻毒,4 d后剖检,检查卵巢病变情况,试验结果见表6。当抗体效价ELISA OD490值≥0.821时,攻毒后卵巢没有出现病变;当抗体效价ELISA OD490值为0.432~0.821,即可实现攻毒保护,攻毒后剖检至少80%的鸭卵巢没有出现病变。攻毒对照组抗体效价小于0.432时,攻毒后剖检蛋鸭卵巢中100%出现病变。本研究建立的间接ELISA方法与攻毒保护试验进行比较,结果见表7,两者的阳性符合率为86.67%,阴性符合率为100%。
3 讨论
鸭坦布苏病毒病是从2010年春季在我国华东地区出现的一种感染鸭的新病,经过病原分离和系统的实验室诊断,确定了病原为鸭坦布苏病毒,该病主要引起蛋鸭的产蛋下降。DTMUV基因组含有3个结构基因(C、prM、E)和非结构基因NS。E蛋白是主要的免疫原性蛋白,能刺激机体产生保护性的中和抗体。此外,该蛋白可能在病毒粒子的组装、在病毒入侵过程中介导细胞的融合等有着重要作用。因此,开展对DTMUV E蛋白的研究,对深入了解DTMUV的感染和致病机理有重要的意义。

表2 间接ELISA特异性试验结果Table 2 The specifi city test of the indirect ELISA

表3 间接ELISA敏感性试验结果Table 3 The sensitivity test of the indirect ELISA

表4 间接ELISA批内重复试验结果Table 4 The result of intra-assay of indirect ELISA
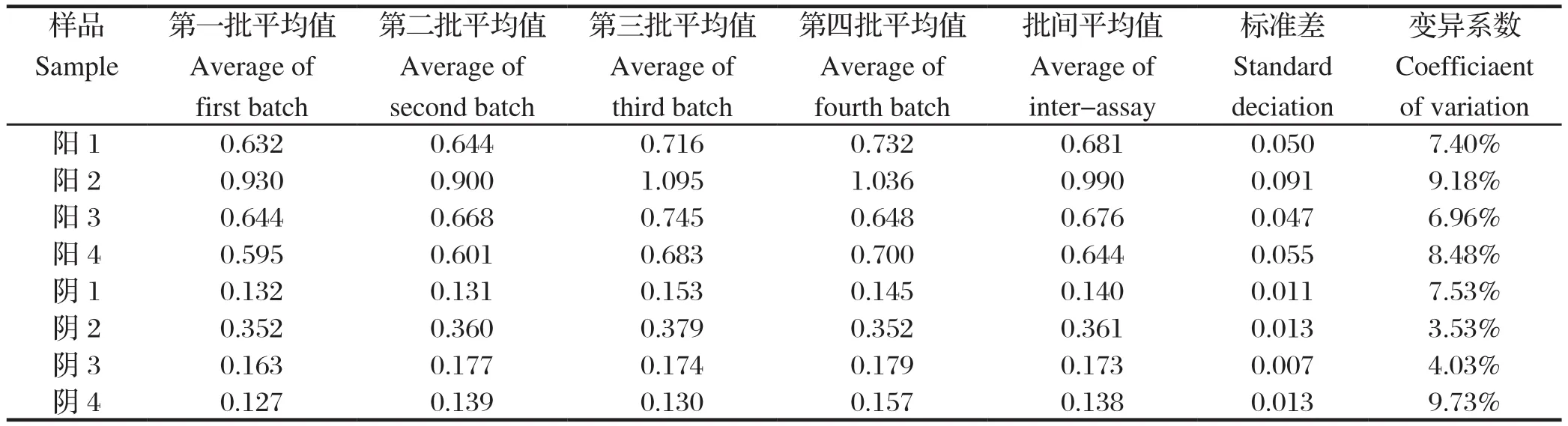
表5 间接ELISA批间重复试验结果Table 5 The result of inter-assay of indirect ELISA

表6 鸭坦布苏病毒灭活疫苗二免120日龄麻鸭后的抗体效价试验结果Table 6 The antibody titer results of 120-day-old duck after the second immunization by Duck Tembusu virus inactivated vaccine

表7 间接ELISA方法与攻毒保护试验的比较结果Table 7 The comparison result of indirect ELISA and challenge-protection test
本试验利用RT-PCR方法扩增出822 bp的DTMUV E 基因截断片段,将其克隆至原核表达载体pET32a(+),构建了表达质粒pET32a-E。结果表明E蛋白在大肠杆菌中得到了高效表达,重组蛋白的表达主要以包涵体的形式存在。Western blot分析表明表达的E蛋白能与DTMUV阳性血清产生特异性反应。此外,原核表达系统表达的E蛋白在用于制备诊断抗原、单克隆抗体以及疫苗等[14-16]方面具有广阔的应用前景,同时为探索以融合蛋白作为诊断抗原建立DTMUV血清抗体的检测方法提供了理论依据,奠定了良好的基础。
因此,本研究利用该重组蛋白作为检测抗原,建立了间接ELISA抗体检测方法。根据方阵滴定法确定了DTMUV E蛋白ELISA方法的抗原最适包被浓度为0.093μg/孔,血清的最佳稀释度为1∶100,并确定了其阴、阳临界值为0.432,通过进一步试验验证所建立的间接ELISA方法具有较好的特异性、敏感性和可重复性。用建立的ELISA方法对免疫鸭坦布苏病毒灭活疫苗的鸭血清和对照鸭血清进行抗体检测,同时与攻毒保护试验进行比较,试验结果表明两者的阳性符合率为86.67%,阴性符合率为100%。综上所述,本研究所建立的DTMUV间接ELISA抗体检测方法具有实际的临床应用价值,可用于检测感染DTMUV鸭群的血清抗体,以及监测免疫接种后鸭群的免疫状况,从而评估疫苗的免疫效果。
[1] 滕巧泱, 颜丕熙, 张旭, 等. 一种新的黄病毒导致蛋鸭产蛋下降及死亡[J].中国动物传染病学报, 2010, 18(6)∶1-4.
[2] 苏敬良. 鸭的新型黄病毒BYD引起的产蛋下降综合征[J].兽医导刊, 2011, 4∶ 27-29.
[3] 万春和, 施少华, 程龙飞, 等. 一种引起种(蛋)鸭产蛋骤降新病毒的分离与初步鉴定[J]. 福建农业学报, 2010, 25(6)∶ 663-666.
[4] Su J, Li S, Hu X, et al. Duck egg-drop syndrome caused by BYD virus, a new Tembusu-related flavivirus[J]. PLoS ONE, 2011, 6(3)∶18106-18117.
[5] 刘友生, 彭春香, 傅光华, 等. 2010~2011年中国部分地区禽坦布苏病毒感染调查及分子变异分析[J]. 中国动物传染病学报, 2012, 20(1)∶ 47-53.
[6] Han K K, Huang X M, Li Y, et al. Complete genome sequence of Goose Tembusu Virus, isolated from Jiangnan White Geese in Jiangsu, China [J]. Genome Announc, 2013, 1(2)∶ e00236-12.
[7] 陈仕龙, 陈少莺, 王劭, 等. 一种引起蛋鸡产蛋下降的新型黄病毒的分离与初步鉴定[J].福建农业学报, 2011, 26(2)∶ 170-174.
[8] Yan P, Zhao Y, Zhang X, et al. An infectious disease of ducks caused by a newly emerged Tembusu virus strain in mainland China[J]. Virology, 2011, 417(1)∶1-8.
[9] Li L, An H, Sun M, et al. Identification and genomic analysis of two duck-origin Tembusu virus strains in southern China[J].Virus Genes, 2012, 45(1)∶ 105-112.
[10] 孙敏华, 胡奇林, 董嘉文, 等. 鸭坦白苏病毒江门株的分离鉴定及其E基因系统进化分析[J]. 广东农业科学, 2012, 11∶158-160.
[11] Modis Y, Ogata S, Clements D, et al. A ligand-binding pocket in the dengue virus envelope glycoprotein[J]. Proc Natl Acad Sci USA, 2003,100(12)∶ 6986-6991.
[12] Zhang Y, Zhang W, Ogata S, et al. Conformational changes of the flavivirus E glycoprotein [J].Structure[J]. 2004, 12(9)∶ 1607-1618.
[13] 邓永强, 秦鄂德. 虫媒黄病毒包膜E蛋白的研究进展[J].军事医学科学院院刊, 2006, 30(6)∶ 575-579.
[14] Ma T, Liu Y, Cheng J, et al. Liposomes containing recombinant E protein vaccine against duck Tembusu virus in ducks[J].Vaccine, 2016, 34(19)∶ 2157-2163.
[15] Li X, Li G, Teng Q, et al. Development of a blocking ELISA for detection of serum neutralizing antibodies against newly emerged duck Tembusu virus[J]. PLoS ONE, 2012, 7(12)∶ e53026. doi∶10.1371/journal, pone, 0053026.
[16] 姬希文, 李雪松, 李国新, 等. 鸭坦布苏病毒E蛋白中和性单克隆抗体的制备[J]. 中国家禽, 2012, 34(4)∶ 25-32.
ESTABLISHMENT OF AN INDIRECT ELISA ASSAY FOR DETECTION OF ANTIBODIES AGAINST DUCK TEMBUSU VIRUS
DONG Jia-wen1, LI Lin-lin1, SUN Min-hua1, ZHANG Jian-feng1, KUANG Rui-huan1, HU Qi-lin2, ZHANG Chun-hong1
(1. Guangdong Provincial Key Laboratory of Livestock Disease Prevention, Guangdong Open Laboratory of Veterinary Public Health, Institute of Veterinary Medicine, Guangdong Academy of Agriculture Sciences, Guangzhou 510640, China; 2. Institute of Animal Health and Veterinary Medicine, Fujian Academy of Agricultural Sciences, Fuzhou 350013, China)
The E gene of Duck Tembusu virus, (DTMUV) JM strain was amplifi ed in RT-PCR and cloned into pET32a (+) vector. The recombinant protein was highly expressed in E. coli Rosseta by induction with IPTG and exhibited a favorable reactivity against the DTMUV antibodies in Western blot. The recombinant protein was used as coating antigen to develop an indirect ELISA. The reaction conditions were optimized and determined to be 0.093μg/well coating antigen of E protein and 1∶100 dilution of antiserum. The intraand inter-assay demonstrated that the coeffi cient of maximum varation was 3.53% and 9.73%. Clinical antiserum samples from vaccinatedducks and non- vaccinated ducks were tested using this ELISA. As compared with vaccination-challenge experiment, the results revealed that the correlation rates of positive serum samples from vaccinates and negtive serum samples from non-vaccinated controls were 86.67% and 100%, respectively.
Duck Tembusu virus ; JM strain; E protein; truncated expression; ELISA
S852.659.6
A
1674-6422(2017)01-0012-07
2016-06-06
广东省科技计划项目(2013B020307001、2014A040401049、2014A020208052、2015B020203003、2015B070701015、2016A020210049);广州市科技计划项目(201510010250);广东省农业科学院院长基金项目(201436、201412)
董嘉文,女,硕士,助理研究员,主要从事动物疾病研究
胡奇林,E-mail:hql562713@163.com;张春红,E-mail:13660450420@139.com
——一道江苏高考题的奥秘解读和拓展

