Toll样受体4在百草枯中毒急性肺损伤中的作用
刘伟,董雪松,刘晓伟,陈昕明,刘焕植,刘志
(中国医科大学附属第一医院急诊科,沈阳110001)
Toll样受体4在百草枯中毒急性肺损伤中的作用
刘伟,董雪松,刘晓伟,陈昕明,刘焕植,刘志
(中国医科大学附属第一医院急诊科,沈阳110001)
目的探讨Toll样受体4(TLR4)在百草枯(PQ)中毒急性肺损伤中的作用及相关机制。方法野生小鼠(C57BL/6J)和TLR4基因敲除小鼠(C57BL/10ScN)各20只,随机分成野生小鼠对照(WT)组、WT+PQ组,TLR4基因敲除小鼠对照(TLR4⁃ko)组、TLR4⁃ko+PQ组,每组10只。腹腔注射PQ,24 h后处死小鼠,观察各组小鼠肺脏病理改变(HE染色和电镜)、血气分析结果、肺脏TLR4和炎症介质的表达情况。结果腹腔注射PQ 24 h后野生小鼠出现明显急性肺损伤表现,包括血气氧分压明显下降、肺脏损伤急性期病理改变、TLR4表达明显升高(伴随肺脏TNF⁃α、IL⁃1β和NF⁃κB p65表达明显升高);而TLR4基因敲除小鼠在接触PQ后肺损伤情况明显减轻,WT+PQ组和TLR4⁃ko+PQ组比较差异具有统计学意义(P<0.05)。结论TLR4是PQ中毒急性肺损伤的重要介质,阻断TLR4信号通路对PQ中毒所致肺损伤具有保护作用。
百草枯;中毒;肺损伤;Toll样受体4;炎症
百草枯(paraquat,PQ)是世界上应用广泛的有机杂环类除草剂,中毒后病死率高达60%~80%[1]。PQ经胃肠道吸收入血后主要聚集于肺脏,肺脏PQ浓度可达血液的10~90倍[2]。肺脏是PQ中毒后损伤的主要靶器官,早期表现为明显肺水肿、肺出血等急性肺损伤(acute lung injury,ALI)表现,后期发展为不可逆的肺间质纤维化而导致死亡[3]。然而目前PQ中毒的机制尚未完全明了,亦无有效拮抗药物,因此对于PQ中毒肺损伤的研究具有重要意义。
Toll样受体4(Toll⁃like receptor 4,TLR4)是一种细胞内源免疫的跨膜受体和病原识别受体,在调节急性炎性反应、细胞信号转导和凋亡过程发挥重要作用,它可以介导肿瘤坏死因子α(tumor necrosis factor⁃α,TNF⁃α)、白细胞介素6(interleukin⁃6,IL⁃6)和白细胞介素1β(interleukin⁃1β,IL⁃1β)等炎症介质释放并参与炎症信号转导通路,在炎性反应过程中发挥重要作用[4]。已有研究显示在脂多糖(lipopoly⁃saccharides,LPS)或其他非炎性细胞因子诱导的ALI过程中,TLR4通过促进炎症介质释放而导致肺损伤加重[5]。本研究利用TLR4基因敲除小鼠研究TLR4在PQ中毒肺损伤过程中的作用及相关机制。
1 材料与方法
1.1 实验动物及分组
野生雄性小鼠(C57BL/6J,8~10周龄,18~22 g)和TLR4基因敲除雄性小鼠(C57BL/10ScN)均购自中国医科大学实验动物部,饲养条件相同,恒温恒湿,人工照明12 h/d,24 h自由进食水。整个实验过程遵从动物实验伦理委员会要求进行。
野生小鼠20只,随机分成2组:对照(WT)组、WT+PQ组,每组10只;TLR4基因敲除小鼠20只,随机分成2组:对照(TLR4⁃ko)组、TLR4⁃ko+PQ组,每组10只。PQ中毒组小鼠经腹腔注射PQ(40 mg/kg,美国Sigma公司),对照组腹腔注射等量生理盐水。各组小鼠于腹腔注射24 h后经深度麻醉并腹主动脉放血致死,取0.2 mL动脉血行血气分析,开胸取出肺组织,左肺上叶用2.5%戊二醛固定,留作电镜分析,左肺下叶4℃4%多聚甲醛固定,留作HE染色分析,右肺上叶和下叶取出后立即-80℃冷冻,留作Western blotting、实时PCR以及ELISA检测。
1.2 方法
1.2.1 血气分析:抽取0.2 mL动脉血后,立即于急诊中毒室进行血气分析(AVLOMNI血气分析仪,瑞士AVL公司),记录pH值、PO2(mmHg)和PCO2(mmHg)结果。
1.2.2 HE染色:肺组织以4%多聚甲醛浸泡24 h以上,常规脱水、包埋,切成4 μm切片,用苏木素-伊红(HE)染色,光镜下观察肺组织病理改变。
1.2.3 电镜观察:肺组织用2.5%戊二醛固定,经过脱水、环氧树脂包埋、超薄切片,透射电镜(JEM⁃1200EX)下观察细胞器的变化。
1.2.4 实时PCR检测:取-80℃冷冻肺组织(20 mg),总RNA提取使用RNAiso Reagent(宝信生物科技有限公司),操作严格按照说明进行。在260 nm处用分光光度计对总RNA进行定量。反转录使用SYBR PrimeScript RT⁃PCR试剂盒(宝信生物科技有限公司)。得到的RT反应液加入到下一步的实时荧光PCR反应体系中。实时荧光PCR分析使用7500型实时荧光定量PCR系统(美国Applied Biosystems公司)。引物如下:TLR4,上游引物5’⁃CAGCAAAG TCCCTGATGACA⁃3’,下游引物5’⁃CCTGGGGAAAA ACTCTGGAT⁃3’;GAPDH,上游引物5’⁃TGTGTCCG TCGTGGATCTGA⁃3’,下游引物5’⁃TTGCTGTTGAA GTCGCAGGAG⁃3’。TLR4mRNA扩增需要在94℃预变性30 s,进行40个PCR循环(95℃5 s,60℃60 s),72℃延伸90 s。每个样本重复测定3次,取3次测定的Ct平均值作为该样本的Ct值。GAPDH作为看家基因,各组均进行检测。采用相对定量法计算TLR4在各组的表达。
1.2.5 Western blotting检测:冻存肺组织20 mg,RI⁃PA裂解液匀浆化,收集上清液,使用蛋白浓度测定试剂盒(上海碧云天生物技术有限公司)检测上清液蛋白浓度。样品被稀释到合适的浓度,每孔20 μg上样量,12%十二烷基硫酸钠聚丙烯酰胺凝胶电泳后,转移到硝酸纤维素膜,封闭,用一抗TLR4抗体(1∶200,美国圣克鲁斯生物技术公司)孵育,4℃,60 min,洗涤液清洗,加入辣根过氧化物酶(HRP)标记的二抗(1∶200,武汉博士德生物工程有限公司),使用加强的化学发光试剂盒(美国PIERCE公司)检测TLR4蛋白表达。GAPDH作为内对照。
1.2.6 ELISA检测TNF⁃α、IL⁃1β和NF⁃κB p65在肺组织的表达:将冻存的肺组织用生理盐水冲洗后在冰上匀浆,3 000g离心15 min(4℃),取上清,按照试剂盒操作说明检测肺组织中TNF⁃α、IL⁃1β和核因子κB p65(nuclear factor⁃κB p65,NF⁃κB p65)的表达(武汉博士德生物工程有限公司)。
1.3 统计学分析
2 结果
2.1 动脉血气分析
结果如表1所示,与WT组比较,TLR4⁃ko组小鼠pH、PaO2、PaCO2值无明显改变(P>0.05)。PQ腹腔注射24 h后WT+PQ组和TLR4⁃ko+PQ组的PaO2和PaCO2与WT组比较均明显下降(P<0.05);但TLR4⁃ko+PQ组PaO2和PaCO2降低情况较WT+PQ组明显改善(P<0.05),4组中pH值比较无统计学差异(P>0.05)。
2.2 光镜下病理改变
HE染色结果显示,WT组肺泡结构完整,未见明显充血、中性粒细胞浸润和间质水肿;TLR4⁃ko组和WT组比较肺脏病理结构无明显变化;WT+PQ组肺脏呈现明显炎症细胞浸润、肺泡壁破坏、肺泡和肺间质出血及肺泡壁增厚的急性肺损伤的病理改变;而TLR4⁃ko+PQ组小鼠在接触PQ后肺脏病理损伤情况明显改善。见图1。

图1 各组小鼠肺脏HE染色×200Fig.1HE staining of lung sections in different groups rats×200
2.3 电镜下肺组织超微结构(Ⅱ型肺泡上皮细胞)
WT组和TLR4⁃ko组电镜下Ⅱ型肺泡上皮细胞的超微结构无明显差异,均表现为胞核形状大致正常,胞质内线粒体较多,嗜锇小体内可见较多板层结构。WT+PQ组胞核形状不规则,核内大量异染色质凝聚、边集,线粒体嵴减少、外膜破坏,嗜锇小体及板层结构减少,核膜水肿。TLR4⁃ko+PQ组上述细胞器的损伤情况较WT+PQ组明显减轻。见图2。
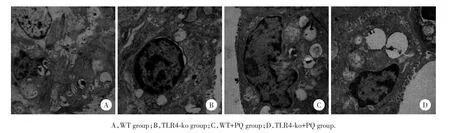
图2 各组小鼠肺脏超微结构×6 000Fig.2Electron microscope of lung sections in different groups rats×6 000
2.4 PQ中毒后TLR4在肺组织的表达
TLR4蛋白和mRNA水平,WT+PQ组(1.13± 0.06、1.37±0.11)均较WT组(0.69±0.05、0.86±0.08)表达明显增高(P<0.05),而在TLR4⁃ko组和TLR4⁃ ko+PQ均无表达。见图3。

图3 各组小鼠TLR4蛋白表达Fig.3TLR4 protein expression detected by Western blotting
2.5 肺脏炎症介质的表达
ELISA结果显示:与WT组比较,WT+PQ组小鼠肺组织中TNF⁃α、IL⁃1β和NF⁃κB p65均明显升高(P<0.05);TLR4⁃ko组炎症介质表达无统计学差异(P>0.05);而TLR4+PQ组炎症介质表达较WT+PQ组明显下降(P<0.05)。见表2。
3 讨论
近年来对PQ中毒肺损伤的研究越来越多,但仍缺乏有效的治疗方法[6⁃7]。PQ中毒成为死亡率最高的农药中毒事件。ALI和后续的肺纤维化是PQ中毒后最严重的并发症,也是影响预后的关键因素[8]。本研究应用WT和TLR4⁃ko小鼠探讨PQ中毒早期肺损伤改变发现,PQ注射24 h后,WT小鼠出现明显的肺脏病理学改变(光镜和电镜),并伴随明显的PaO2和PaCO2下降,这与在临床上观察到的PQ中毒患者早期出现气促、呼吸困难的临床表现相符。TLR4基因敲除后小鼠在接触PQ后,上述肺损伤情况明显改善,提示TLR4参与了PQ中毒肺损伤的过程。
表2 各组小鼠肺脏炎症介质表达比较Tab.2Comparison of inflammation mediator expression in lung tissues

表2 各组小鼠肺脏炎症介质表达比较Tab.2Comparison of inflammation mediator expression in lung tissues
1)P<0.05 vs WT group;2)P<0.05 vs WT+PQ group.
GroupnTNF⁃αIL⁃1βNF⁃κB p65 WT1069.35±4.41238.43±10.2648.19±4.59 TLR4⁃ko1070.11±4.35236.58±11.9747.93±4.85 WT+PQ10148.59±7.831)423.67±19.641)92.49±5.781)TLR4⁃ko+PQ10106.64±6.122)334.51±15.372)58.25±5.232)
TLR4作为细胞的跨膜受体,被证实在炎症诱导的ALI中发挥病原识别受体的功能,参与肺损伤的发生与进展[9]。外源性配基(LPS)可以激活TLR4通路[10],同时细胞损伤坏死后产生的内源性配基(HSP60和HSP70)亦可激活TLR4信号通路[11]。激活的TLR4通过髓样分化蛋白88(myeloid differentia⁃tion 88,MyD88)依赖性途径,介导炎性信号转导,参与炎性反应,以诱导下游的NF⁃κB和丝裂原活化蛋白激酶的早期相活化为特征,主要介导炎性细胞因子(TNF⁃α、IL⁃6、IL⁃1β)产生。
研究报道在LPS诱导ALI的过程中,TLR4⁃MyD88信号通路被激活,促进大量炎症介质释放,导致ALI加重[5]。在本研究中,WT小鼠在接触PQ后,TLR4在mRNA和蛋白水平表达均明显升高,伴随急性肺损伤的发生,而TLR4基因敲除后,PQ诱导的急性肺损伤程度明显改善,提示TLR4在PQ中毒过程中被过度激活并加重肺损伤,TLR4基因敲除后明显降低了PQ中毒后肺脏的炎性反应。
虽然PQ中毒肺损伤的机制复杂,但炎症介质的过度释放在此过程扮演重要角色。然而炎症通路是如何被过度激活依然未完全明了。PQ中毒过程中可以诱导大量活性氧簇释放,致使脂质过氧化和细胞损伤[3],另外有研究[12]报道,细胞损伤过程释放的内源性配基(损伤相关分子模式、DAMPs)可以激活TLR4信号通路。因此推测在PQ中毒过程中,肺泡上皮细胞和血管内皮细胞受到活性氧族的攻击而损伤,并形成大量DAMPs,后者作为内源性配基激活TLR4信号通路。激活的TLR4信号通路导致大量炎症介质(NF⁃κB、TNF⁃α和IL⁃1β)的过度释放,诱发加重肺损伤同时继续产生大量DAMPs。TLR4与DAMPs可能形成正反馈环,导致肺损伤的持续发酵。TLR4基因敲除后阻断了TLR4信号通路,降低了炎症介质的释放,最终对PQ中毒诱导的ALI具有保护作用。
综上所述,本研究通过TLR4基因敲除小鼠,明确了TLR4信号通路在PQ中毒诱导急性肺损伤过程中发挥重要作用,阻断TLR4信号通路可以减少炎症介质的表达,从而保护肺功能,为临床治疗提供了新的靶点。但本研究选择的时间点有限(中毒后24 h),相关实验还有待进一步深入。
[1]BERTOLOTE JM,FLEISCHMANN A.Deaths from pesticide poison⁃ing:a global response[J].Br J Psychiatry,2006,189:201-203. DOI:10.1192/bjp.bp.105.020834.
[2]GUNNELL D,EDDLESTON M,PHILLIPS MR,et al.The global distribution of fatal pesticide self⁃poisoning:systematic review[J]. BMC Public Health,2007,7:357.DOI:10.1186/1471⁃2458⁃7⁃357.
[3]DINIS⁃OLIVEIRA RJ,DUARTE JA,SÁNCHEZ⁃NAVARRO A,et al.Paraquat poisonings:mechanisms of lung toxicity,clinical fea⁃tures and treatment[J].Crit Rev Toxicol,2008,38(1):13-71. DOI:10.1080/10408440701669959.
[4]ZHOU B,ZHOU H,LING S,et al.Activation of PAR2 or/and TLR4 promotes SW620 cell proliferation and migration via phosphoryla⁃tion of ERK1/2[J].Oncol Rep,2011(25):503-511.DOI:10.3892/ or.2010.1077.
[5]VILLAR J,CABRERA N,CASULA M.Mechanical ventilation mod⁃ulates Toll⁃like receptor signaling pathway in a sepsis⁃induced lung injury model[J].Intensive Care Med,2010,36(6):1049-1057. DOI:10.1007/s00134⁃010⁃1799⁃3.
[6]CHANGJB,LINCC,CHIOUJF,etal.Treatmentofacute paraquat in⁃toxication using recommended megadose of vitamin C:a reappraisal[J].Free Radic Res,2013,47(12):991-1001.DOI:10.3109/1071 5762.2013.838321.
[7]YANG H,WEN Y,HOU⁃YOU Y,et al.Combined treatment with bone marrow mesenchymal stem cells and methylprednisolone in paraquat⁃induced acute lung injury[J].BMC Emerg Med,2013,13(Suppl 1):S5.DOI:10.1186/1471⁃227X⁃13⁃S1⁃S5.
[8]WHITEHEAD GS,GRASMAN KA,KIMMEL EC.Lung function and airway inflammation in rats following exposure to combustion products of carbon⁃graphite/epoxy composite material:comparison to a rodent model of acute lung injury[J].Toxicology,2003,183(1/ 3):175-197.DOI:10.1016/S0300⁃483X(02)00542⁃5.
[9]AKIRA S.Mammalian Toll⁃like receptors[J].Curr Opin Immunol,2003,15(1):5-11.DOI.:10.1016/S0952⁃7915(02)00013⁃4.
[10]TSAN MF,GAO B.Heat shock proteins and immune system[J].J Leukoc Biol,2009,85(6):905-910.DOI:10.1189/jlb.0109005.
[11]SWAROOP S,SENGUPTA N,SURYAWANSHI AR,et al.HSP60 plays a regulatory role in IL⁃1β⁃induced microglial inflammation via TLR4⁃p38 MAPK axis[J].J Neuroinflammation,2016,13:27. DOI:10.1186/s12974⁃016⁃0486⁃x.
[12]TSUNG A,HOFFMAN RA,IZUISHI K,et al.Hepatic ischemia/re⁃perfusion injury involves functional TLR4 signaling in non⁃paren⁃chymal cells[J].J Immunol,2005,175(11):7661-7668.DOI:10.4049/jimmunol.175.11.7661.
(编辑武玉欣)
Role of TLR4 in Lung Injury Induced by Paraquat Poisoning
LIU Wei,DONG Xuesong,LIU Xiaowei,CHEN Xinming,LIU Huanzhi,LIU Zhi
(Department of Emergency,The First Hospital,China Medical University,Shenyang 110001,China)
ObjectiveTo investigate the role of Toll⁃like receptor 4(TLR4)in acute lung injury induced by paraquat(PQ)poisoning.Meth⁃odsTwenty wild⁃type mice(C57BL/6J)andTLR4knockout mice(C57BL/10ScN)were randomly divided into 4 groups:WT group,WT+PQ group,TLR4gene knockout(TLR4⁃ko)group and TLR4⁃ko+PQ group,with 10 mice in each group.After paraquat treatment for 24 hours,mice were euthanized and sacrificed.TLR4 expression and pro⁃inflammatory cytokines were evaluated.ResultsAfter 24 hours of intraperitoneal injec⁃tion of PQ,wild⁃type mice showed significant acute lung injury,including decreased oxygen tension in blood gas,pathological changes in the acute stage of lung injury and increased TLR4 expression(accompanied by increased levels of TNF⁃α,IL⁃1β and NF).TLR4⁃deficient mice exhibited significantly reduced level of paraquat⁃induced lung injury.ConclusionTLR4 may be required as a mediator and play an important role in acute lung injury induced by paraquat.Inhibition of TLR4 signaling has protection of lung injury induced by PQ.
paraquat;poisoning;acute lung injury;Toll⁃like receptor 4;inflammation
R363
A
0258-4646(2017)01-0007-05
10.12007/j.issn.0258⁃4646.2017.01.002
国家自然科学基金(81571882);辽宁省科学技术计划(2013225303);沈阳市科技计划(F16⁃206⁃9⁃02)
刘伟(1979-),女,副主任医师,博士研究生.
刘志,E-mail:lzsy2014@163.com
2016-06-06
网络出版时间:

