ATP结合盒转运体G1与动脉粥样硬化的研究进展
李瞿,张小倩,刘旭,张慧媛,何志义
(中国医科大学附属第一医院神经内科,沈阳110001)
·综述·
ATP结合盒转运体G1与动脉粥样硬化的研究进展
李瞿,张小倩,刘旭,张慧媛,何志义
(中国医科大学附属第一医院神经内科,沈阳110001)
ATP结合盒转运体G1(ABCG1)是人类ATP结合盒转运体超家族的成员之一,可促进细胞内的胆固醇和磷脂外流,维持细胞脂质稳态平衡。ABCG1缺乏可参与泡沫细胞形成、内皮细胞功能紊乱和炎症反应等,进而影响动脉粥样硬化的形成和发展。但是无论在动物实验还是人体研究,ABCG1在动脉粥样硬化中的作用都有争议,本文针对ABCG1在动脉粥样硬化疾病中的研究进展进行综述。
ATP结合盒转运体G1;动脉粥样硬化;单核苷酸多态性
迄今为止,人类ATP结合盒(ATP⁃binding cas⁃sette,ABC)转运体超家族包括7个亚族(ABCA~ABCG),皆含有膜结合蛋白,以ATP为能源跨膜转运两亲分子或亲脂分子[1]。1999年发现Tangier病和家族性高密度脂蛋白缺乏是由ATP结合盒转运体A1(ATP⁃binding cassette transporter A1,ABCA1)缺失所致,患者体内的胆固醇和磷脂完全不能流出至乏脂的载脂蛋白A⁃Ⅰ(apo A⁃Ⅰ),部分不能流出至高密度脂蛋白(high density lipoprotein,HDL)[2],这意味着脂质流出至HDL存在其他未知途径。之后研究[3⁃5]证实,ATP结合盒转运体G1(ATP⁃binding cassette transporter G1,ABCG1)可在巨噬细胞中丰富表达,促进细胞内的胆固醇和磷脂外流至HDL,与ABCA1一样在胆固醇的逆向转运中起到重要作用。ABCG1表达可促进巨噬细胞胆固醇外流,抑制过量胆固醇蓄积,减少泡沫细胞的形成[6]。这似乎预示着ABCG1可抑制动脉粥样硬化的发生发展,具有抗动脉粥样硬化形成的作用。然而无论是动物实验还是人体研究所得结果皆有争议。
1 ABCG1基因表达、结构、分布和基本功能
人类ABCG1基因位于21q22.3,是果蝇白色基因的1个人类同源基因,又称为人白色基因或ABC8。1996年CHEN等通过外显子捕获技术最早发现并克隆了ABCG1基因,确定在人视网膜细胞可表达ABCG1cDNAs[7]。ABCG1基因全长98 000 bp,包括23个外显子,在第1、4、5、6、8外显子上游存在5个启动子。由于转录起始点和剪切方式不同可产生多种异构体[8⁃10]。其中,在外显子1上游推定存在PPAR/RXR结合基序,在外显子5上游推定存在固醇反应元件,而在外显子8上游发现含有1个TATA盒和2个LXRα反应元件,可通过以上位置进行表达调控。
ABCG1是一种跨膜蛋白,N末端和C末端都位于细胞质内,以半转运体的形式存在,需要通过形成同源或异源二聚体构建成一个功能性转运体。每个半转运体由1个跨膜结构域(transmembrane do⁃main,TMD)和1个核苷酸结合域(nucleotide binding domain,NBD)组成。每个TMD由6个α螺旋构成液性通道,具有底物特异性,胆固醇和磷脂等可经此穿过细胞膜或细胞器膜;NBD包括3个小的保守结构域,Walker A(12个氨基酸)、Walker B(5个氨基酸)和位于Walker B上游的信号基序S(5个氨基酸),负责结合并水解ATP,为转运底物提供能量。
ABCG1mRNA和蛋白分布广泛,可在多种组织器官中表达,在巨噬细胞丰富的组织中表达最高,如脾、肺、胸腺及脑。最初,研究[5,11]证实ABCG1过度表达可致细胞质膜外层的胆固醇水平增加,认为ABCG1在细胞质膜上表达,介导细胞内的胆固醇外流与细胞外HDL相结合。然而,近期通过生物素标记法、免疫荧光、离心等方法研究提示ABCG1是细胞内的胆固醇转运体,定位在细胞内的囊泡/内涵体,而在细胞表面并未检测到。推测ABCG1转运胆固醇至囊泡/内涵体膜的内层,通过其与细胞质膜融合,致胆固醇重分布到细胞质膜外层,然后非特异性释放与多种外源性脂质受体相结合[12⁃13]。其输出脂质多样,包括胆固醇前体脱氢胆固醇、胆固醇氧化产物(7⁃酮胆固醇,7⁃β羟基胆固醇以及24⁃羟基、25⁃羟基和27⁃羟基胆固醇)、鞘磷脂和磷脂酰胆碱[14];结合受体除HDL外,还包括低密度脂蛋白(low density lipoprotein,LDL)、无蛋白磷脂囊泡以及环糊精等[5,15⁃16]。
2 ABCG1与动脉粥样硬化
泡沫细胞形成、内皮细胞功能紊乱、炎症反应等在动脉粥样硬化形成和发展中起到重要作用,ABCG1可能通过参与以上过程影响动脉粥样硬化的进程。
2.1 促进巨噬细胞胆固醇外流
2000年SCHMITZ等发现在人类巨噬细胞胆固醇外流过程中ABCG1表达上调,KLUCKEN等[17]应用特异性的反义寡核苷酸探针抑制人类巨噬细胞ABCG1表达,可减少胆固醇和磷脂外流至HDL。2005年KENNEDY等[3]应用转基因鼠进行研究显示,经过高脂饲料喂养的Abcg1-/-小鼠的肝细胞及多种组织的巨噬细胞中可见大量的中性脂质和磷脂沉积,相反,过表达ABCG1可减少脂质沉积。与野生型相比,Abcg1-/-小鼠肺部大量胆固醇沉积在肺泡巨噬细胞和Ⅱ型细胞,并且细胞表面堆积过多磷脂从而发生严重的肺脂质沉积症[18]。以上研究证实ABCG1在促进巨噬细胞内胆固醇外流,调节细胞内脂质平衡,防止脂质蓄积中起重要作用。ABCG1缺乏可致巨噬细胞内脂质蓄积进一步形成泡沫细胞,是早期动脉粥样硬化的典型病理特征,可能通过影响泡沫细胞的形成参与动脉粥样硬化。
2.2 维护内皮细胞功能
除了巨噬细胞,ABCG1在内皮细胞中也高度表达,其促进内皮细胞固醇流出的作用对维护内皮细胞的正常功能具有重要意义[19⁃21]。TERASAKA等发现Abcg1-/-内皮细胞7⁃酮胆固醇水平增加,内皮型一氧化氮合酶(endothelial NOS,eNOS)活性下降。WHETZEL等研究发现从Abcg1-/-小鼠主动脉分离的内皮细胞与对照组相比胆固醇外流至HDL下降,而血清角质细胞诱导因子(keratinocyte chemoattrac⁃tant,KC)、核细胞趋化蛋白1(monocyte chemotactic protein 1,MCP⁃1)和白细胞介素6(interleukin⁃6,IL⁃6)的分泌增加,且表面表达的细胞间黏附分子1(in⁃tercellular cell adhesion molecule⁃1,ICAM⁃1)及E⁃选择素增加数倍,单核细胞黏附增加,主动脉内皮细胞ABCG1缺乏能激活IL6⁃IL6受体⁃STAT3信号途径,增加单核细胞和内皮细胞的相互作用、促进炎症发生。此外,胆固醇聚集可诱导内皮细胞产生氧化应激,进一步损伤内皮功能,ABCG1表达增加能明显降低细胞内氧化应激,保护eNOS活性,其作用机制可能与ABCG1促进细胞内胆固醇外流,从而抑制氧化应激发生相关[22]。
2.3 参与炎症反应
大量研究[23⁃24]证实,ABCA1和ABCG1表达可抑制Toll样受体(Toll⁃like receptors,TLRs)介导炎症信号通路。与野生型细胞相比,用脂多糖激活Abca1-/-Abcg1-/-巨噬细胞,其表面TLR4/髓样分化蛋白2(myeloid differentiation protein,MD2)复合物增加、MyD88信号通路增强。转运体ABCA1和ABCG1缺乏会导致胆固醇在细胞膜脂筏蓄积,进一步增强细胞表面的TLR4表达,因此放大TLR4信号和增加炎症基因的表达[23]。
考虑到ABCG1在泡沫细胞形成、维护内皮细胞正常功能和炎症反应中的作用,普遍观点认为ABCG1具有抗动脉粥样硬化的作用,但无论是动物实验还是人体研究,结果却并不一致。
2.4 ABCG1在动脉粥样硬化动物模型中的研究
总结不同动物实验研究ABCG1在动脉粥样硬化中的作用,结果如表1所示,OUT等将Abcg1-/-小鼠骨髓移植到具有动脉粥样硬化倾向的Ldlr-/-小鼠,用15%脂肪和0.25%胆固醇喂养6~12周,血浆总胆固醇浓度分别为511 mg/dL、670 mg/dL,与Abcg1+/+小鼠相比,动脉粥样硬化斑块体积表现出“中度”增加(33%~36%)[25];而另一项实验用15%脂肪、1%胆固醇及0.5%胆盐喂养Abcg1-/-小鼠12周,血浆总胆固醇浓度220 mg/dL,与对照组相比其动脉粥样硬化斑块体积明显增加(Abcg1-/-/Abcg1+/+动脉粥样硬化病灶体积=1.92)[26]。LAMMERS等[27]及YVAN⁃CHARVET等[28]通过各自不同的动物实验亦得出相似结论。
然而,另有研究[29⁃31]显示ABCG1缺失能够减少动脉粥样硬化形成。RANALLETTA等[31]同OUT一样利用骨髓移植构建Abcg1-/-Ldlr-/-小鼠模型,用21.2%脂肪和0.2%胆固醇喂养7周时,血浆总胆固醇浓度为829 mg/dL,动脉粥样硬化斑块较对照组无明显变化;11周时血浆总胆固醇浓度升高至1 172 mg/dL,动脉粥样硬化斑块体积减少34%。BALDAN等[29]用21%脂肪和1.25%胆固醇喂养16周,血浆总胆固醇浓度为1 043 mg/dL,斑块面积亦明显减小。
以上数据表明,ABCG1在动脉粥样硬化中的作用似乎与血浆总胆固醇浓度有关,当其较低时,ABCG1缺失可增加动脉粥样硬化病灶形成;而当血浆总胆固醇浓度相对较高时,ABCG1缺失则可减少病灶形成。
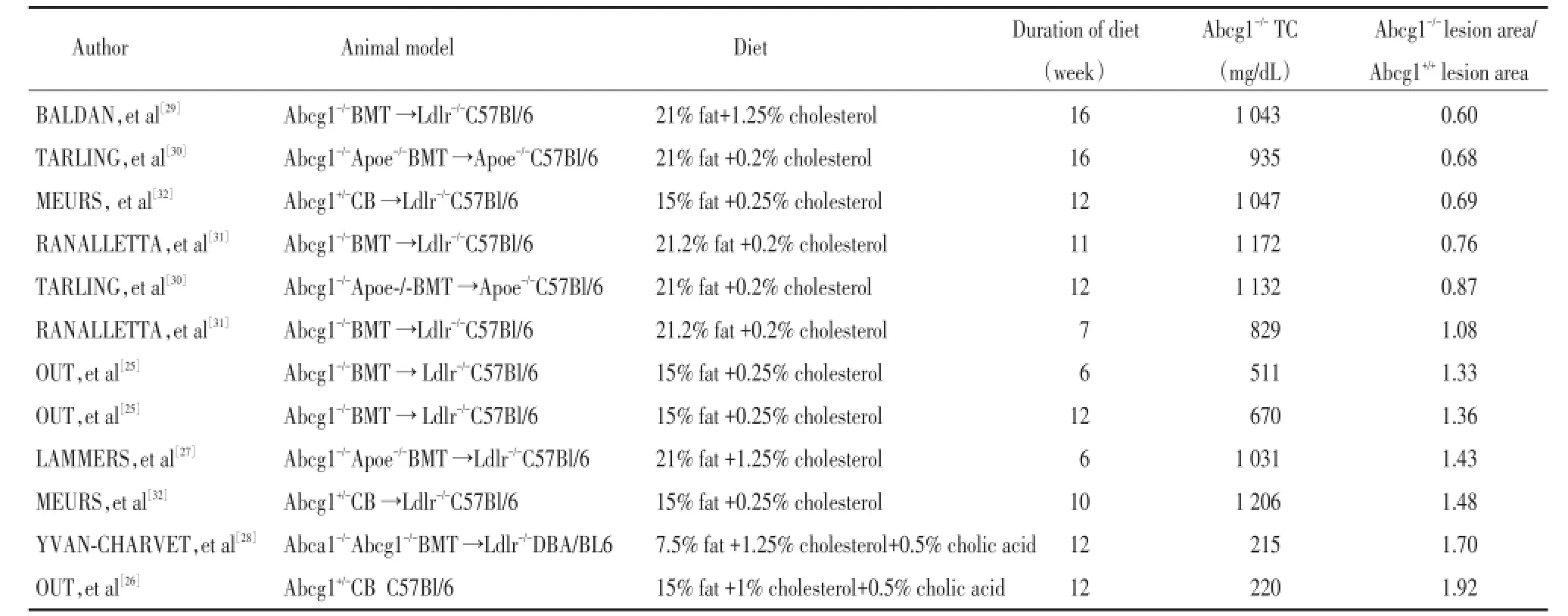
表1 不同动物实验中ABCG1在动脉粥样硬化中的作用Tab.1 Overview of the different studies on the role of ABCG1 in atherosclerosis
MEURS等[32]总结分析了以上学者的研究,发现ABCG1是抗动脉粥样硬化还是致动脉粥样硬化与斑块大小有关,推测其作用与动脉粥样硬化形成阶段有关。为了进一步阐明ABCG1的作用,MEURS等使用高脂饮食喂养Abcg1-/-Ldlr-/-小鼠,与对照组Abcg1+/+Ldlr-/-小鼠相比,喂养10周后早期的动脉粥样硬化斑块体积增加了近1.5倍;而喂养12周后进展期的动脉硬化斑块体积与对照组相比却明显减少。提示ABCG1在动脉粥样硬化中的作用与其形成阶段有关:在斑块形成的早期,由于ABCG1表达缺失致巨噬细胞中的胆固醇外流减少,泡沫细胞形成从而促进动脉粥样硬化的发展;而在进展期ABCG1缺失致胆固醇进一步大量蓄积导致巨噬细胞凋亡增加,从而减缓了动脉粥样硬化的进展。
2.5 ABCG1与人类动脉粥样硬化性疾病易感性
在人类ABCG1主要存在两种异构体(长的和短的),而在啮齿动物中只有其中一种较短的异构体表达[33⁃34],将ABCG1在动物实验中的结论直接推广到人类具有一定的局限性。
单核苷酸多态性(single nucleotide polymor⁃phism,SNP)指在基因组水平上由单个核苷酸的变异所引起的DNA序列多态性,它是人类可遗传的变异中最常见的一种,有些SNP位点会影响基因的功能,导致生物性状改变甚至致病。目前国内外已有数个基于SNP的基因关联研究探讨ABCG1在人类动脉粥样硬化疾病中的作用。
日本研究[35]显示位于ABCG1基因外显子1上游启动子区域的-257T>G位点(rs1378577)的多态性可影响其转录活性,G等位基因可降低ABCG1的转录活性,增加日本男性心肌梗死的风险。在哥本哈根人群中的研究显示:ABCG1启动子的另一个位点-376C>T,含T等位基因的杂合子(-376CT)与不含T等位基因的纯合子(-376CC)相比,ABCG1 mRNA表达下降近40%,患心肌梗死的风险为其2.2倍;并分别通过体外和体内实验证实此位点为特异蛋白(specificity protein 1,Sp1)结合位点,-376 T等位基因可降低与Sp1结合的亲和力,从而导致ABCG1转录活性下降[36]。以上数据提示在人体ABCG1表达缺乏与动脉粥样硬化疾病风险增高相关。
然而,在人类中的研究结论也并不一致。在一项中国人群中的研究示,ABCG1基因rs57137919位点携带AA基因型可致巨噬细胞ABCG1蛋白表达减少,而携带A等位基因可降低冠状动脉粥样硬化性心脏病和心肌梗死的发病风险[37]。在中国北方汉族人群中统计调查发现,在高甘油三酯血症的人群中,ABCG1基因的功能性位点rs57137919和rs1378577与缺血性卒中的患病风险下降有关[38]。OLIVER等的实验可在一定程度上对这一现象进行解释:脂蛋白酯酶(lipoprotein lipase,LPL)定位在人单核巨噬细胞表面胆固醇丰富的区域—脂质筏,在富含甘油三酯脂蛋白的环境下,通过小干扰RNAs敲除ABCG1基因表达后,LPL的分泌及活性明显下降;而LPL的主要作用是促进细胞摄取脂蛋白,促进泡沫细胞形成;从而,在富含甘油三酯脂蛋白的环境下,ABCG1表达抑制后,可致LPL生物利用度下降,其将人单核巨噬细胞转化为泡沫细胞的作用明显减弱,进而抑制动脉粥样硬化的发展。这些结果表明:ABCG1表达减少可降低人类动脉粥样硬化疾病的易感性,尤其在高甘油三酯血症的人群中,ABCG1表达可促进动脉粥样硬化的发展。
综上所述,从众多的动物与人体实验研究中可以看出,ABCG1参与动脉粥样硬化的形成,但其具体作用机制还未阐明,需进一步研究。
[1]HIGGINS CF.ABC transporters:from microorganisms to man[J]. Annu Rev Cell Biol,1992,8(11):67-113.DOI:10.1146/annurev. cb.08.110192.000435.
[2]BROOKS⁃WILSON A,MARCIL M,CLEE SM,et al.Mutations in ABC1 in Tangier disease and familial high⁃density lipoprotein defi⁃ciency[J].Nat Genet,1999,22(4):336-345.DOI:10.1038/ 11905.
[3]KENNEDY MA,BARRERA GC,NAKAMURA K,et al.ABCG1 has a critical role in mediating cholesterol efflux to HDL and pre⁃venting cellular lipid accumulation[J].Cell Metab,2005,1(2):121-131.DOI:10.1016/j.cmet.2005.01.002.
[4]WANG N,LAN D,CHEN W,et al.ATP⁃binding cassette transport⁃ ers G1 and G4 mediate cellular cholesterol efflux to high⁃density li⁃poproteins[J].Proc Natl Acad Sci USA,2004,101(26):9774-9779.DOI:10.1073/pnas.0403506101.
[5]VAUGHAN AM,ORAM JF.ABCG1 redistributes cell cholesterol to domains removable by high density lipoprotein but not by lipid⁃de⁃pleted apolipoproteins[J].J Biol Chem,2005,280(34):30150-30157.DOI:10.1074/jbc.M505368200.
[6]BROWN MS,GOLDSTEIN JL.Lipoprotein metabolism in the mac⁃rophage:implications for cholesterol deposition in atherosclerosis[J].Annu Rev Biochem,1983,52(7):223-261.DOI:10.1146/an⁃nurev.bi.52.070183.001255.
[7]CHEN H,ROSSIER C,LALIOTI MD,et al.Cloning of the cDNA for a human homologue of the Drosophila white gene and mapping to chromosome 21q22.3[J].Am J Hum Genet,1996,59(1):66-75.
[8]KENNEDY MA,VENKATESWARAN A,TARR PT,et al.Charac⁃terization of the human ABCG1 gene:liver X receptor activates an internal promoter that produces a novel transcript encoding an alter⁃native form of the protein[J].J Biol Chem,2001,276(42):39438-39447.DOI:10.1074/jbc.M105863200.
[9]LORKOWSKI S,RUST S,ENGEL T,et al.Genomic sequence and structure of the human ABCG1(ABC8)gene[J].Biochem Bio⁃phys Res Commun,2001,280(1):121-131.DOI:10.1006/ bbrc.2000.4089.
[10]LANGMANN T,PORSCH⁃OZCURUMEZ M,UNKELBACH U,et al.Genomic organization and characterization of the promoter of the human ATP⁃binding cassette transporter⁃G1(ABCG1)gene[J].Biochim Biophys Acta,2000,1494(1/2):175-180.DOI:10.1016/S0167⁃4781(00)00215⁃3.
[11]WANG N,RANALLETTA M,MATSUURA F,et al.LXR⁃induced redistribution of ABCG1 to plasma membrane in macrophages en⁃hances cholesterol mass efflux to HDL[J].Arterioscler Thromb Vasc Biol,2006,26(6):1310-1316.DOI:10.1161/01.ATV.0000 218998.75963.02.
[12]TARLING EJ,EDWARDS PA.ATP binding cassette transporter G1(ABCG1)is an intracellular sterol transporter[J].Proc Natl Acad Sci USA,2011,108(49):19719-19724.DOI:10.1073/ pnas.1113021108.
[13]STUREK JM,CASTLE JD,TRACE AP,et al.An intracellular role for ABCG1⁃mediated cholesterol transport in the regulated secreto⁃ry pathway of mouse pancreatic beta cells[J].J Clin Invest,2010,120(7):2575-2589.DOI:10.1172/JCI41280.
[14]KOBAYASHI A,TAKANEZAWA Y,HIRATA T,et al.Efflux of sphingomyelin,cholesterol,and phosphatidylcholine by ABCG1[J].J Lipid Res,2006,47(8):1791-1802.DOI:10.1194/jlr. M500546⁃JLR200.
[15]SANKARANARAYANAN S,ORAM JF,ASZTALOS BF,et al.Ef⁃fects of acceptor composition and mechanism of ABCG1⁃mediated cellular free cholesterol efflux[J].J Lipid Res,2009,50(2):275-284.DOI:10.1194/jlr.M800362⁃JLR200.
[16]GELISSEN IC,HARRIS M,RYE KA,et al.ABCA1 and ABCG1 synergize to mediate cholesterol export to apoA⁃I[J].Arterioscler Thromb Vasc Biol,2006,26(3):534-540.DOI:10.1161/01.ATV.0000200082.58536.e1.
[17]KLUCKEN J,BUCHLER C,ORSO E,et al.ABCG1(ABC8),the human homolog of the Drosophila white gene,is a regulator of mac⁃rophage cholesterol and phospholipid transport[J].Proc Natl Acad Sci USA,2000,97(2):817-822.DOI:10.1073/pnas.97.2. 817.
[18]BALDAN A,GOMES AV,PING P,et al.Loss of ABCG1 results in chronic pulmonary inflammation[J].J Immunol,2008,180(5):3560-3568.DOI:10.4049/jimmunol.180.5.3560.
[19]TERASAKA N,YU S,YVAN⁃CHARVET L,et al.ABCG1 and HDL protect against endothelial dysfunction in mice fed a high⁃cholesterol diet[J].J Clin Invest,2008,118(11):3701-3713. DOI:10.1172/JCI35470.
[20]WHETZEL AM,STUREK JM,NAGELIN MH,et al.ABCG1 defi⁃ciency in mice promotes endothelial activation and monocyte⁃endo⁃thelial interactions[J].Arterioscler Thromb Vasc Biol,2010,30(4):809-817.DOI:10.1161/ATVBAHA.109.199166.
[21]RUBIC T,LORENZ RL.Downregulated CD36 and oxLDL uptake and stimulated ABCA1/G1 and cholesterol efflux as anti⁃athero⁃sclerotic mechanisms of interleukin⁃10[J].Cardiovasc Res,2006,69(2):527-535.DOI:10.1016/j.cardiores.2005.10.018.
[22]LI D,ZHANG Y,MA J,et al.Adenosine monophosphate activated protein kinase regulates ABCG1⁃mediated oxysterol efflux from en⁃dothelial cells and protects against hypercholesterolemia⁃induced endothelial dysfunction[J].Arterioscler Thromb Vasc Biol,2010,30(7):1354-1362.DOI:10.1161/ATVBAHA.110.204230.
[23]YVAN⁃CHARVET L,WELCH C,PAGLER TA,et al.Increased in⁃flammatory gene expression in ABC transporter⁃deficient macro⁃phages:free cholesterol accumulation,increased signaling via toll⁃like receptors,and neutrophil infiltration of atherosclerotic lesions[J].Circulation,2008,118(18):1837-1847.DOI:10.1161/CIR⁃CULATIONAHA.108.793869.
[24]KOSEKI M,HIRANO K,MASUDA D,et al.Increased lipid rafts and accelerated lipopolysaccharide⁃induced tumor necrosis factor⁃alpha secretion in Abca1⁃deficient macrophages[J].J Lipid Res,2007,48(2):299-306.DOI:10.1194/jlr.M600428⁃JLR200.
[25]OUT R,HOEKSTRA M,HILDEBRAND RB,et al.Macrophage ABCG1 deletion disrupts lipid homeostasis in alveolar macro⁃phages and moderately influences atherosclerotic lesion develop⁃ment in LDL receptor⁃deficient mice[J].Arterioscler Thromb Vasc Biol,2006,26(10):2295-2300.DOI:10.1161/01.ATV.0000 237629.29842.4c.
[26]OUT R,HOEKSTRA M,MEURS I,et al.Total body ABCG1 ex⁃pression protects against early atherosclerotic lesion development in mice[J].Arterioscler Thromb Vasc Biol,2007,27(3):594-599.DOI:10.1161/01.ATV.0000257136.24308.0c.
[27]LAMMERS B,OUT R,HILDEBRAND RB,et al.Independent pro⁃tective roles for macrophage Abcg1 and Apoe in the atherosclerotic lesion development[J].Atherosclerosis,2009,205(2):420-426. DOI:10.1016/j.atherosclerosis.2009.01.017.
[28]YVAN⁃CHARVET L,RANALLETTA M,WANG N,et al.Com⁃bined deficiency of ABCA1 and ABCG1 promotes foam cell accu⁃mulation and accelerates atherosclerosis in mice[J].J Clin In⁃vest,2007,117(12):3900-3908.DOI:10.1172/JCI33372.
[29]BALDAN A,PEI L,LEE R,et al.Impaired development of athero⁃sclerosis in hyperlipidemic Ldlr-/-and ApoE-/-mice transplanted with Abcg1-/-bone marrow[J].Arterioscler Thromb Vasc Biol,2006,26(10):2301-2307.DOI:10.1161/01.ATV.0000240051.22 944.dc.
[30]TARLING EJ,BOJANIC DD,TANGIRALA RK,et al.Impaired de⁃velopment of atherosclerosis in Abcg1-/-Apoe-/-mice:identification of specific oxysterols that both accumulate in Abcg1-/-Apoe-/-tis⁃sues and induce apoptosis[J].Arterioscler Thromb Vasc Biol,2010,30(6):1174-1180.DOI:10.1161/ATVBAHA.110.205617.
[31]RANALLETTA M,WANG N,HAN S,et al.Decreased atheroscle⁃rosis in low⁃density lipoprotein receptor knockout mice transplant⁃ed with Abcg1-/-bone marrow[J].Arterioscler Thromb Vasc Biol,2006,26(10):2308-2315.DOI:10.1161/01.ATV.0000242275.92 915.43.
[32]MEURS I,LAMMERS B,ZHAO Y,et al.The effect of ABCG1 de⁃ficiency on atherosclerotic lesion development in LDL receptor knockout mice depends on the stage of atherogenesis[J].Athero⁃sclerosis,2012,221(1):41-47.DOI:10.1016/j.atherosclero⁃sis.2011.11.024.
[33]BURNS V,SHARPE LJ,GELISSEN IC,et al.Species variation in ABCG1 isoform expression:implications for the use of animal mod⁃els in elucidating ABCG1 function[J].Atherosclerosis,2013,226(2):408-411.DOI:10.1016/j.atherosclerosis.2012.12.009.
[34]GELISSEN IC,CARTLAND S,BROWN AJ,et al.Expression and stability of two isoforms of ABCG1 in human vascular cells[J]. Atherosclerosis,2010,208(1):75-82.DOI:10.1016/j.atheroscle⁃rosis.2009.06.028.
[35]FURUYAMA S,UEHARA Y,ZHANG B,et al.Genotypic effect of ABCG1gene promoter-257T>G polymorphism on coronary artery disease severity in Japanese men[J].J Atheroscler Thromb,2009,16(3):194-200.DOI:10.5551/jat.E380.
[36]SCHOU J,FRIKKE⁃SCHMIDT R,KARDASSIS D,et al.Genetic variation in ABCG1 and risk of myocardial infarction and ischemic heart disease[J].Arterioscler Thromb Vasc Biol,2012,32(2):506-515.DOI:10.1161/ATVBAHA.111.234872.
[37]XU Y,WANG W,ZHANG L,et al.A polymorphism in the ABCG1 promoter is functionally associated with coronary artery disease in a Chinese Han population[J].Atherosclerosis,2011,219(2):648-654.DOI:10.1016/j.atherosclerosis.2011.05.043.
[38]LI Q,LIU X,ZHU R,et al.Association of ATP⁃binding cassette transporter G1 polymorphisms with risk of ischemic stroke in the chinese han population[J].J Stroke Cerebrovasc Dis,2015,24(6):1397-1404.DOI:10.1016/j.jstrokecerebrovasdis.2015.02. 024.
(编辑 武玉欣)
Role of ATP⁃binding Cassette Transporter G1 in Atherosclerosis
LI Qu,ZHANG Xiaoqian,LIU Xu,ZHANG Huiyuan,HE Zhiyi
(Department of Neurology,The First Hospital,China Medical University,Shenyang 110001,China)
The adenosine triphosphate(ATP)⁃binding cassette transporter G1(ABCG1),a member of the superfamily of ATP⁃binding cassette transporters,is involved in the efflux of cholesterol and phospholipids from cells,and it maintains the intracellular lipid homeostasis.ABCG1 defi⁃ciency results in foam cell formation,endothelial dysfunction,and inflammatory reaction,and it further leads to the development and progression of atherosclerosis.However,the role of ABCG1 in atherosclerosis in animal experiments and human studies is still a debatable matter.In this paper,the recent findings on the role of ABCG1 in atherosclerotic disease are reviewed.
ATP⁃binding cassette transporter G1;atherosclerosis;single nucleotide polymorphism
R743
A
0258-4646(2017)04-0289-05
10.12007/j.issn.0258⁃4646.2017.04.001
国家自然科学基金(81070913,81400950)
李瞿(1981-),女,主治医师,博士.
何志义,E-mail:hezhiyi0301@126.com
2016-12-09
网络出版时间:

