葛根素治疗急性脊髓缺血再灌注损伤大鼠的神经保护机制
季相禄,田峰,王斌,肖万安
(中国医科大学附属盛京医院骨外科,沈阳110024)
葛根素治疗急性脊髓缺血再灌注损伤大鼠的神经保护机制
季相禄,田峰,王斌,肖万安
(中国医科大学附属盛京医院骨外科,沈阳110024)
目的探索葛根素在治疗急性脊髓缺血再灌注损伤(ASII)大鼠中的作用机制。方法28只雄性大鼠阻断主动脉来实施ASII。实验动物随机分为4组:阴性对照(NC)组(假手术处理)、阳性对照(IR+S)组(脊髓缺血再灌注损伤+盐水处理)、IR+P组(脊髓缺血再灌注损伤+葛根素处理)、IR+R组(脊髓缺血再灌注损伤+细胞周期蛋白B激酶抑制剂处理)。检测各组大鼠运动机能、脊髓梗死体积、细胞凋亡指数及细胞周期素依赖性激酶5(CDK5)和P25的活性。结果IR+S组与NC组比较,P35和P25蛋白表达差异有统计学意义(P<0.01);IR+P组、IR+R组与IR+S组比较差异亦有统计学意义(P<0.05)。提示葛根素对ASII神经保护可能通过类似抑制剂的作用,并且与P35和P25的表达相关。结论脊髓损伤减小与CDK5及P25活性受抑制相关;在ASII大鼠治疗过程中,抑制CDK5及P25活性是葛根素的神经保护机制之一。
葛根素;脊髓缺血再灌注损伤;细胞周期素依赖性激酶5;细胞周期蛋白B激酶抑制剂;大鼠
脊髓缺血及随后的截瘫是胸主动脉或胸腹主动脉的外科治疗过程中有可能产生的并发症。葛根素由葛根中提取,因其具有显著的神经保护特性(尤其是治疗脊髓缺血损伤)而受到关注。已有文献[1-3]报道,葛根素的神经保护性作用涉及许多因素(炎症反应、氧化应激和细胞凋亡等)。另外,本组近期研究[4]表明,葛根素的神经保护作用与抑制谷氨酸盐释放作用有关,但葛根素在脊髓缺血损伤中的治疗机制仍不明确。此外,细胞周期素依赖性激酶5(cyclin⁃dependent kinase 5,CDK5)是一种脯氨酸介导的多效蛋白激酶,首要作用是调节哺乳动物的中枢神经系统发育和脊髓神经元的迁移过程。众所周知,CDK5的超活化会导致神经炎症及体外或体内神经元死亡。这种情况在不同的毒性刺激物作用下发生,可引起细胞内钙离子升高而激活钙蛋白酶,参与P35裂解为P25的过程。P25对于CDK5是一种缩短后的活化剂,P25的超表达引起CDK5活性升高,导致神经元死亡。因此,抑制CDK5活性在脊髓缺血再灌注损伤的保护中起重要作用。
本研究旨在探讨大鼠急性脊髓缺血再灌注损伤(acute spinal ischemia⁃reperfusion injury,ASII)是否导致CDK5超活化,应用葛根素是否能防止CDK5和P25超活化后导致的神经病理学改变。
1 材料与方法
1.1 动物分组及处理
28只雄性大鼠,体质量230~250 g。随机均分为4组,每组7只。阴性对照(NC)组以假手术处理,阳性对照(IR+S)组以脊髓缺血再灌注损伤+盐水处理,IR+P组以脊髓缺血再灌注损伤+葛根素处理,IR+R组以脊髓缺血再灌注损伤+细胞周期蛋白B激酶抑制剂处理。IR+P组腹腔内注射葛根素(50 mg/ kg),该剂量在之前的研究[4]中证明有效。在开始再灌注后第1、2、4、6小时,分别注射葛根素(50 mg/kg),2 d内每24 h同样处理1次。抑制剂则在开始实施脊髓缺血前60 min鼠尾静脉注射,剂量为30 mg/ kg。各组大鼠血流动力学变量[心率、血压、血气(PaO2和PaCO2)和血液pH]实验处理前、处理过程中及处理后无统计学差异(均P>0.05),体温维持在正常范围内。所有大鼠完成实验研究。
1.2 ASII模型构建[5]
腹腔内注射水合氯醛(350 mg/kg)维持实验动物麻醉状态。用聚乙烯导管(PE⁃50)插入尾动脉以监测远端动脉压和注射肝素用。经左股动脉向胸降主动脉植入1个2F的Fogarty导管,导管尖端到达左锁骨下动脉的水平。在主动脉阻断期间,控制近端动脉血压在40 mmHg,应用连接到1个外部储血器(37.5°C)20 G的聚四氟乙烯导管插入左颈总动脉。在主动脉阻断期间,应用常温的水(38.0~38.3°C)通过热交换器(100 mL/min)灌注控制并保持脊髓正常温度。在所有插管完成后,肝素(200 U)注入尾动脉。为了诱导脊髓缺血,生理盐水膨胀导管球囊0.05 mL并让血液流入外部储血器中。缺血时间维持60 min,继之48 h再灌注。阴性对照组动物施行假手术,施以相同处理,但不阻断主动脉。
1.3 神经功能评定
以Tarlov评分系统对神经功能进行评分,标准如下:0分,后肢完全屈曲,无活动;1分,后肢不完全严重屈曲;2分,后肢可以活动,但不能跳跃;3分,后肢可以跳跃,但活动明显不稳;4分,后肢可以跳跃,活动轻度不稳;5分,后肢活动正常。
1.4 脊髓缺血梗死体积评定
通过之前研究[6]方法评定脊髓缺血梗死的体积。简言之,即通过快速切除脊髓来测量梗死体积。制备2 mm的切片,在磷酸盐缓冲溶液的2%三苯基氯化四氮唑中培养。染色后的脊髓切片保存在10%甲醛溶液中。梗死区域通过图像分析软件(NIH图像分析仪)进行分析。
1.5 细胞死亡数量评定
大鼠处死,取出L2~3节段的脊髓断面。使用追踪检测试剂盒(美国Gen Script公司),利用TdT介导的dUTP缺口末端标记法(TUNEL)染色技术对脊髓切片进行处理。对每个切片的TUNEL阳性细胞进行计数,其总数作为TUNEL指数。
1.6 CDK5、P35和P25评定
CDK5活性通过厂家试剂盒(加拿大Signal Chem公司)分析测定。CDK5活性作为积分光密度值。P35和P25蛋白提取物进行12%丙烯酰胺的SDS聚丙烯酰胺凝胶电泳,以及聚偏二氟乙烯膜的免疫印迹。该膜在P35/P25的初级抗体(美国Cell Signaling Technology公司)中培养,在室温下阻断或者以β⁃肌动蛋白的初级抗体作为内部控制性稀释。
1.7 统计学分析
2 结果
2.1 应用葛根素及抑制剂预处理可改善神经功能
NC组大鼠后肢运动功能无改变。神经功能评分结果显示,与NC组比较,IR+S组有统计学差异(P<0.01),提示有显著的神经功能缺陷;IR+P组、IR+R组与IR+S组比较差异亦有统计学意义(P< 0.05),施加葛根素可明显改善功能,抑制剂预处理也显著防止了由ASII引起的神经功能缺陷。IR+P组和IR+R组比较运动功能评分没有统计学差异(P>0.05)。见表1。
2.2 应用葛根素及抑制剂预处理可减小脊髓梗死体积
与NC组比较,IR+S组脊髓梗死体积差异有统计学意义(P<0.01);IR+P组、IR+R组与IR+S组比较差异亦有统计学意义(P<0.05);而IR+R组与IR+P组比较差异没有统计学意义(P>0.05)。急性脊髓缺血48 h再灌注导致脊髓广泛的梗死,然而葛根素、抑制剂处理能够使梗死体积显著减小。见表1。
2.3 应用葛根素及抑制剂预处理可稳定P35和P25蛋白表达
结果显示,IR+S组与NC组比较,P35和P25蛋白表达有统计学差异(P<0.01);IR+P组、IR+R组与IR+S组比较差异亦有统计学意义(P<0.05);
ASII引起P25蛋白表达升高、P35蛋白表达下降,提示ASII通过加快P35裂解而导致P25表达上调,P25表达上调导致CDK5超活化。抑制剂预处理组显著地抑制了P25的上调和P35的下调,在葛根素处理组也观察到类似的结果,提示葛根素对ASII神经保护可能通过类似抑制剂的作用,并且与P35和P25的表达相关。见表1、图1。
2.4 应用葛根素及抑制剂预处理可抑制由急性脊髓缺血再灌注引起的CDK5升高
表1 各组大鼠神经功能评分,灌注48 h后的脊髓梗死体积,P35、P25表达及CDK5活性水平比较Tab.1 Comparison of neurological function score,spinal infarction volume,P35,P25 and CDK5
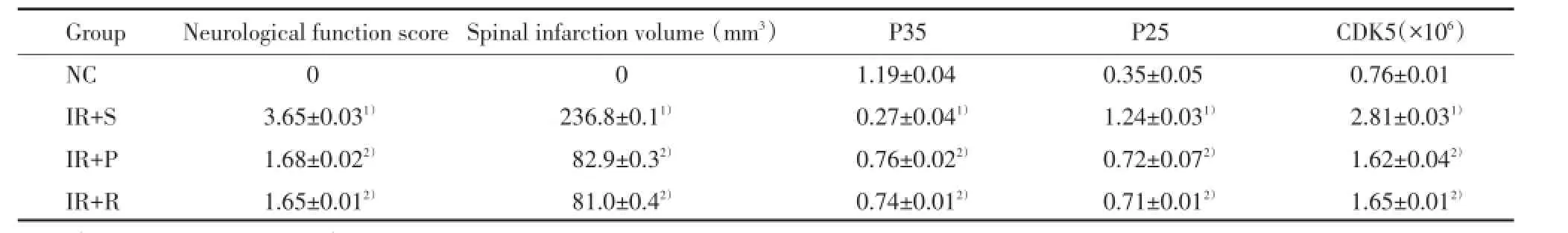
表1 各组大鼠神经功能评分,灌注48 h后的脊髓梗死体积,P35、P25表达及CDK5活性水平比较Tab.1 Comparison of neurological function score,spinal infarction volume,P35,P25 and CDK5
1)P<0.01 vs NC group;2)P<0.05 vs IR+S group.
?
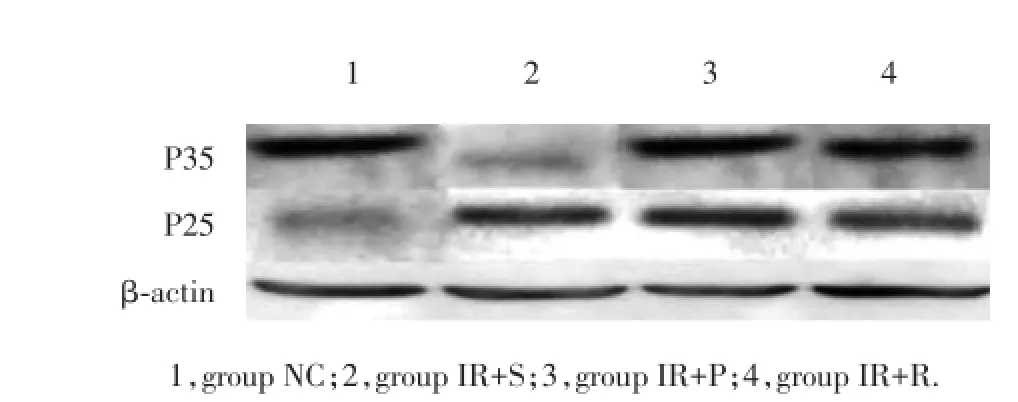
图1 各组大鼠P35、P25蛋白表达比较Fig.1 Comparison of P35 and P25 protein expression
IR+S组与NC组比较CDK5活性显著升高(P<0.01);IR+P组、IR+R组与IR+S组比较CDK5活性明显抑制(P<0.05),提示对CDK5的抑制作用是葛根素在治疗缺血再灌注损伤中的神经保护性机制之一。见表1。
2.5 应用葛根素及抑制剂预处理可减少细胞凋亡
结果显示,NC组大鼠未见凋亡细胞,但IR+S组可见大量凋亡细胞[(13.1±1.8)%]。与IR+S组比较,IR+P组凋亡细胞显著减少[(7.66±2.4)%,P< 0.01]。IR+R组凋亡细胞也减少[(7.26±1.8)%,P< 0.01]。见图2。
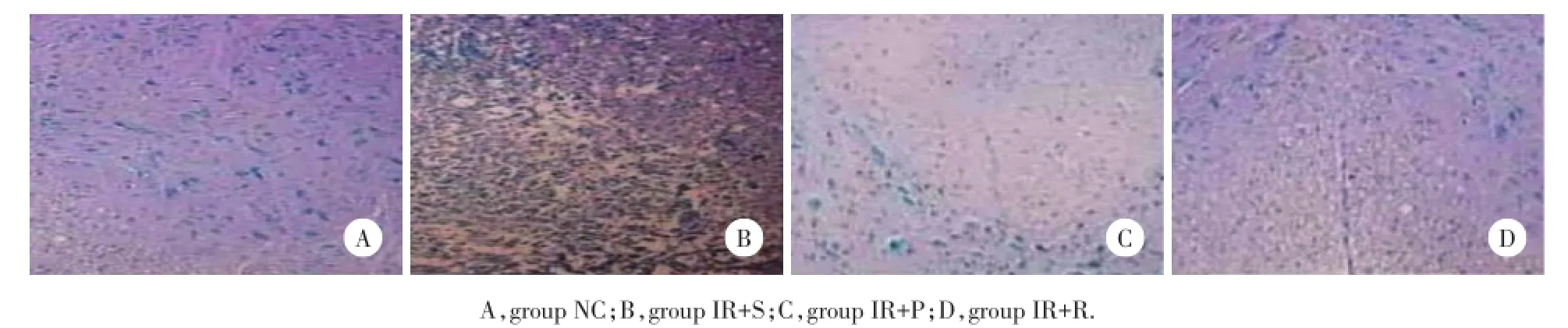
图2 各组大鼠再灌注48 h后凋亡细胞比较×200Fig.2 Comparison of apoptotic cells after reperfusion for 48 hours×200
3 讨论
研究[1⁃3,7⁃9]表明,葛根素的神经保护作用涉及包括氧化应激、炎症效力及神经元凋亡等在内的多种机制,但具体机制仍待研究。众所周知,急性脊髓缺血可导致脊髓梗死,而缺血之后再灌注则会导致脊髓的继发再损伤。缺血和再灌注都是能够产生氧自由基的链式反应。主动脉的再灌注导致组织的进一步损伤,能引起灾难性的链式反应。细胞凋亡很大程度上参与到继发损伤过程中,并受半胱氨酸蛋白酶活性调节。因此猜想,某种可抑制半胱氨酸蛋白酶的化学剂也许能够阻止继发损伤过程中的细胞凋亡。
CDK5是丝氨酸/苏氨酸激酶CDK家族的成员,对脊髓神经元的迁移过程至关重要。CDK5活性升高与神经元凋亡直接相关。一些数据[10⁃12]已证明细胞周期蛋白B激酶抑制剂能抑制CDK5的活性,防止神经元凋亡。
本研究结果显示,抑制剂预处理可防止缺血再灌注损伤导致的神经元凋亡,提示脊髓缺血再灌注通过CDK5的超活化导致神经元凋亡。此外,缺血再灌注损伤提高了CDK5和P25的表达。缺血再灌注损伤后P25的表达上调和P35的表达下调,提示了P35向P25的裂解,P25刺激CDK5的活性升高。与以往研究发现一致[13⁃15]。
目前研究[10⁃12]显示CDK5的抑制剂——细胞周期蛋白B激酶抑制剂明显防止细胞凋亡,改善脊髓运动功能,提示脊髓缺血再灌注导致的神经元凋亡与CDK5的活化相关。本研究显示,除了细胞周期蛋白B激酶抑制剂有特异性神经保护作用,葛根素也发挥了类似抑制剂的功能,提示葛根素对ASII神经保护作用是通过抑制CDK5和P25实现的。本研究结果显示,对CDK5和P25活性的抑制是葛根素治疗急性脊髓损伤的重要机制之一。细胞周期蛋白B激酶抑制剂是CDK5的选择性抑制剂,而葛根素涉及多种不同机制,并不仅仅是抑制CDK5。因此,对于葛根素治疗脊髓缺血再灌注损伤中存在的其他可能的机制(清除氧自由基的特性或其他神经性调节等)应进行更广泛的研究。
综上所述,葛根素明显防止了缺血再灌注所引起的脊髓损伤及神经元凋亡。CDK5超活化参与缺血再灌注所致的脊髓神经元凋亡,葛根素的神经保护性作用与抑制CDK5和P25相关。
[1]SINGH AK,JIANG Y,GUPTA S,et al.Anti⁃inflammatory potency of nano⁃formulated puerarin and curcumin in rats subjected to the li⁃popolysaccharide⁃induced inflammation[J].Med Food,2013,16(11):899-911.DOI:10.1089/jmf.2012.0049.
[2]WANG JW,WANG HD,CONG ZX,et al.Puerarin ameliorates oxi⁃dative stress in a rodent model of traumatic brain injury[J].Surg Res,2014,186(1):328-337.DOI:10.1016/j.jss.2013.08.027.
[3]XU X,ZHANG S,ZHANG L,et al.The neuroprotection of puerarin against cerebral ischemia is associated with the prevention of apop⁃tosis in rats[J].Planta Med,2005,71(7):585-591.DOI:10.1055/ s⁃2005⁃871261.
[4]TIAN F,XU LH,ZHAO W,et al.The neuroprotective mechanism of puerarin treatment of acute spinal cord injury in rats[J].Neurosci Lett,2013,543:64-68.DOI:10.1016/j.neulet.2013.03.039.
[5]KAKINOHANA M,NAKAMURA S,FUCHIGAMI T,et al.Tran⁃scranial motor⁃evoked potentials monitoring can detect spinal cord ischemia more rapidly than spinal cord⁃evoked potentials monitor⁃ing during aortic occlusion in rats[J].Eur Spine,2007,16(6):787-793.DOI:10.1007/s00586⁃006⁃0165⁃1.
[6]FAN L,WANG K,SHI Z,et al.Tetramethylpyrazine protects spinal cord and reduces inflammation in a rat model of spinal cord ischemia⁃reperfusion injury[J].Vasc Surg,2011,54(1)192-200.DOI:10.1016/j.jvs.2010.12.030.
[7]ZHANG D,MA G,HOU M,et al.The neuroprotective effect of puer⁃arin in acute spinal cord injury rats[J].Cell Physiol,2016,39(3):1152-1164.DOI:10.1159/000447822.
[8]JIANG M,YUN Q,NIU,et al.Puerarin prevents inflammation and apoptosis in the neurocytes of a murine Parkinson’s disease model[J].Genet Mol Res,2016.DOI:10.4238/gmr.15047501.
[9]ZHOU F,WANG L,LIU PP,et al.Puerarin protects brain tissue against cerebral ischemia/reperfusion injury by inhibiting the in⁃flammatory response[J].Neural Regen Res,2014,9(23):2074-2080.DOI:10.4103/1673⁃5374.147934.
[10]AMIN ND,ALBERS W,PANT HC.Cyclin⁃dependent kinase 5(CDK5)activation requires interaction with three domains of p35[J].Neurosci Res,2002,67(3):354-362.DOI:10.1002/jnr.1011 6.
[11]ZHENG YL,KESAVAPANY S,GRAVELL M,et al.A CDK5 in⁃hibitory peptide reduces tau hyperphos⁃phorylation and apoptosis in neurons[J].EMBO,2005,24(1):209-220.DOI:10.1038/sj. emboj.7600441.
[12]EWEKA AO,EWEKA A,OM’INIABOHS FAE.Histological stud⁃ies of the effects of monosodium glutamate of the Fallopian tubes of adult female Wistar rats[J].N Am J Med Sci,2010,2(3):146-149.DOI:10.4297/najms.2010.3146.
[13]CRUZ JC,TSENG HC,GOLDMAN JA,et al.Aberrant CDK5 acti⁃va⁃tion by P25 triggers pathological events leading to neurodegen⁃eration and neurofibrillary tangles[J].Neuron,2003,40(3):471-483.DOI:10.1016/S0896⁃6273(03)00627⁃5.
[14]PATRICK GN,ZUKERBERG L,NIKOLIC MMS,et al.Conversion of P35 to P25 deregulates CDK5 activity and promotes neurodegen⁃eration[J].Nature,1999,402(6762):615-622.DOI:10.1038/ 45159.
[15]CHEUNG ZH,FU AK,IP NY.Synaptic roles of CDK5:implica⁃tions in higher cognitive functions and neurodegenerative diseases[J].Neuron,2006,50(1):13-18.DOI:10.1016/j.neuron.2006. 02.024.
(编辑 武玉欣)
The Mechanism of Neuroprotective Effects of Puerarin for the Treatment of Acute Spinal Ischemia⁃reperfusion Injury in Rats
JI Xianglu,TIAN Feng,WANG Bin,XIAO Wanan
(Department of Orthopedic Surgery,Shengjing Hospital,China Medical University,Shenyang 110024,China)
ObjectiveTo explore the mechanism of neuroprotective effects of puerarin for the treatment of acute spinal ischemia⁃reperfusion inju⁃ry in a rat model.MethodsAcute spinal ischemia⁃reperfusion injury was induced via aortic occlusion in 28 male Sprague⁃Dawley rats.The ani⁃mals were randomly divided into four groups,as follows:group negative contrast(NC sham operation),group positive control group(IR+S isch⁃emia/reperfusion+saline),group puerarin(IR+P ischemia/reperfusion+puerarin),group roscovitine(IR+R ischemia/reperfusion+roscovitine). The motor function,spinal infarction volume,apoptosis indices,and CDK5 and P25 activities were examined.ResultsSpinal ischemia⁃reperfu⁃sion caused the injury of the spines and was associated with motor deficit,elevation of CDK5 and P25 activities,and increase in the spinal apopto⁃sis and spinal infarction volume.Puerarin improved motor function and decreased apoptosis,spinal infarction volume,and CDK5 and P25 activi⁃ties.ConclusionThe findings of the present study indicated that puerarin treatment⁃mediated reduction of spinal injury was associated with the inhibition of CDK5 and P25,and that the inhibition was one among the neuroprotective mechanisms of puerarin against acute ischemia/reperfusion⁃induced spinal injury in rats.
puerarin;spinal ischemia⁃reperfusion;cyclin⁃dependent kinase 5;cyclin B kinase inhibitor;rat
R34
A
0258-4646(2017)04-0313-04
10.12007/j.issn.0258⁃4646.2017.04.007
辽宁省教育厅科学技术研究项目(l2015589)
季相禄(1981-),男,讲师,硕士.
田峰,E-mail:tianfeng2002@sina.com
2016-09-01
网络出版时间:

