生长抑制因子4对内皮细胞增殖、迁移及血管形成相关因子表达的影响
李悦,杨向红
(中国医科大学附属盛京医院病理科,沈阳 110004)
生长抑制因子4对内皮细胞增殖、迁移及血管形成相关因子表达的影响
李悦,杨向红
(中国医科大学附属盛京医院病理科,沈阳 110004)
目的 观察生长抑制因子4(ING4)对人脐静脉内皮细胞增殖、迁移及血管内皮生长因子(VEGF)、基质金属蛋白酶2(MMP⁃2)、基质金属蛋白酶9(MMP⁃9)活性的影响,探讨ING4对血管内皮细胞及血管生成的调控作用。方法 人脐静脉内皮细胞株(HUVECs)体外培养,构建ING4质粒及干扰RNA转染至HUVECs,MTT法检测细胞增殖,Transwell实验检测细胞迁移,实时PCR及Western blotting实验检测血管形成相关因子VEGF、MMP⁃2、MMP⁃9mRNA及蛋白表达水平。结果 MTT及Transwell实验结果显示转染ING4质粒能够抑制HUVECs的增殖及迁移,而转染ING4 siRNA则能够促进HUVECs增殖及迁移,实时PCR及Western blotting实验结果显示转染ING4质粒能够抑制血管形成相关因子VEGF、MMP⁃2、MMP⁃9mRNA及蛋白的表达水平。结论 ING4能够通过抑制血管内皮细胞的增殖及迁移能力,下调血管形成相关因子VEGF、MMP⁃2、MMP⁃9的表达,进而抑制新血管形成。
生长抑制因子4;血管内皮细胞;血管内皮生长因子;基质金属蛋白酶
血管生成在肿瘤发生和演进中起着至关重要的作用,肿瘤组织中的血管密度与肿瘤的恶性程度有关,并能够预示肿瘤的生长、转移和复发趋势。血管内皮细胞是覆盖在血管内腔面的连续单层扁平细胞,既能够发挥屏障作用,又具有内分泌功能,参与体内细胞功能的调控以及多种重要平衡的调节,参与机体器官的缺血缺氧、炎性免疫反应等过程。血管新生过程主要包括基底膜的溶解、内皮细胞活化,随后内皮细胞从血管壁游离并迁移至新的位置增殖,相互连接形成管腔结构最终相互吻合形成新毛细血管网。血管新生的过程需要多种诱发因子,其中血管内皮生长因子(vascular endothelial growth factor,VEGF)、基质金属蛋白酶2(matrix me⁃talloproteinase⁃2,MMP⁃2)、基质金属蛋白酶9(matrix metalloproteinase⁃9,MMP⁃9)等起着尤为关键作用。
生长抑制因子(inhibitor of growth,ING)家族作为一种候选抑癌基因,参与肿瘤的发生、发展,ING4能够通过激活P53、抑制NF⁃κB等机制抑制肿瘤生长,并能够增强肿瘤细胞对化疗药物的敏感性。目前国内外学者[1-8]多集中于ING4的表达下降与肿瘤发生的关系以及ING4过表达载体对肿瘤细胞生长及耐药的相关研究。为明确ING4对血管内皮细胞功能的调控作用,本研究拟构建ING4过表达质粒和干扰RNA,转染至人脐静脉内皮细胞株(human um⁃bilical vein endothelial cells,HUVECs)。观察ING4对HUVECs的生长、迁移及其对血管形成相关因子VEGF、MMP⁃2、MMP⁃9的调节作用。
1 材料与方法
1.1 细胞传代培养及分组
HUVECs细胞培养于含有10%胎牛血清的1640培养基中,置于37℃、5%CO2培养箱中,细胞贴壁生长。每3 d传代1次,实验均选用对数生长期细胞。实验设置空白质粒转染组(EV组)、ING4质粒转染组(ING4组)、siRNA对照组(Con siRNA组)、ING4 siRNA转染组(ING4 siRNA组)。
1.2 细胞转染
1.2.1 ING4 siRNA转染至HUVECs:转染前将HU⁃VECs细胞接种于6孔板,待细胞融合达80%即可进行转染。将6孔板内培养基更换为无血清1640培养基继续培养1 h左右。按照DharmaFECT转染试剂盒说明书操作,准备2个EP管。管1,将1.5 μL、5 μmol/L miRNA加入28.5 μL无血清培养液。管2,将0.6 μL转染试剂加入29.4 μL无血清培养液。将管1和管2分别混合均匀,室温孵育5 min。将管1和管2内容物混合,终体积为60 μL,混匀,室温孵育20 min。将240 μL无抗生素培养液加入混合物,终体积为300 μL。将6孔板中的细胞用无血清1640培养液冲洗2遍。将上述转染液逐滴加入6孔板中,轻轻摇动培养板,使转染液混合均匀,37℃,5%CO2培养箱中培养,12 h后更换为含10%FBS的1640培养基继续培养,48 h后检测转染效率。
1.2.2 ING4质粒转染至HUVECs细胞:转染前将HUVECs细胞接种于6孔板,待细胞融合达80%即可进行转染。将6孔板内培养基更换为无血清1640培养基继续培养1 h左右。按照转染试剂盒说明书操作,用TE缓冲液稀释1.2 μg DNA,pH 7~8,DNA浓度≥0.1 μg/μL,加入无血清1640培养液至体积100 μL。加入4.5 μL转染试剂,震荡混匀,室温孵育15~20 min,制成转染复合物。将6孔板中的细胞用无血清1640培养液冲洗2遍。将上述转染复合物逐滴加入6孔板中,轻轻摇动培养板,使转染液混合均匀,37℃,5%CO2培养箱中培养,12 h后更换为含10%FBS的1640培养基继续培养,48 h后检测转染效率。
1.3 MTT实验检测细胞增殖
转染48 h后,0.25%胰蛋白酶消化,收集细胞,制成细胞悬液,调节细胞浓度,将细胞悬液接种于96孔培养板中,每孔体积200 μL,约含细胞2×103个,37℃,5%CO2培养箱中分别培养24、48、72、96 h,每孔加入5 mg/mL MTT溶液(美国Sigma公司),继续培养4 h,弃去上清液,加入150 μL DMSO(美国Sigma公司),振荡10 min,490 nm波长下测定各孔光吸收值,以不含细胞的等体积培养基作对照,绘制细胞生长曲线。
1.4 Transwell实验
将转染后的各组细胞弃培养基,用PBS清洗3次,0.25%胰蛋白酶消化收集细胞,加入无血清培养基吹打制成单细胞悬液。进行细胞计数,调节细胞密度为1×105/mL备用。将含有包被好Matrigel胶小室的24孔板取出,在下室内加入1640培养液(含20%FBS)800 μL;在上室加入上述的细胞悬液,每孔200 μL,细胞数约为2×104/孔。置于37℃、5%CO2培养箱中继续培养24 h。取出培养板中的小室,PBS冲洗2次,用棉签将位于微孔膜上层的细胞轻轻擦去,在室温下,置于多聚甲醛溶液中固定20 min;在室温下,置于苏木素染液中染色5 min,蒸馏水冲洗。在倒置相差显微镜下(200倍)拍照,对细胞进行计数。每个样本计数5个视野的细胞个数,并取平均数。
1.5 实时PCR检测
应用RNAiso plus试剂盒(日本TaKaRa公司)提取细胞总RNA,反转录试剂盒(日本TaKaRa公司)进行反转录反应。采用SYBR®Premix Ex TaqTMPer⁃fect Real Time(日本TaKaRa公司)试剂盒,使用Ap⁃plied Biosystems 7900HT Fast Real⁃Time PCR系统。GAPDH为内参对照。引物由广州瑞博生物技术有限公司设计。为了校正加样误差,以内参引物GAP⁃DH的CT值校正样本拷贝数,利用2-△△Ct计算样本基因和GAPDHmRNA的相对表达量,其中CT是PCR产物的荧光达到检测阈值时的扩增循环数。每组样本设3个复孔。
1.6 Western blotting检测
提取细胞总蛋白,应用BCA将各样品蛋白定量。本实验采用浓度为4%的浓缩胶,浓度为8%和10%的分离胶。经SDS⁃PAGE电泳、转膜、封闭、孵育一抗(稀释比例1∶400),孵育二抗(稀释比例1∶2 000),ECL底物发光。内参抗体选用GAPDH⁃HRP,稀释比例为1∶10 000。
1.7 统计学分析
2 结果
2.1 实时PCR检测转染效率
结果显示,ING4在EV组表达为(0.844±0.086),ING4组48 h后表达(14.589±0.117)显著升高(t= 473.89,P=0.001),ING4 siRNA组表达(0.207± 0.083)与CON sRNA组(1.013±0.109)比较下降(t= 41.00,P=0.001)。
2.2 MTT实验检测细胞增殖
MTT实验结果显示:HUVECs转染ING4质粒后,与对照组比较增殖活性降低,而转染ING4 siRNA则能够促进HUVECs的增殖。见表1。
表1 ING4对各组细胞HUVECs增殖的影响()Tab.1 Effect of ING4 on the proliferation of HUVECs()

表1 ING4对各组细胞HUVECs增殖的影响()Tab.1 Effect of ING4 on the proliferation of HUVECs()
1)P<0.05 vs EV group;2)P<0.01 vs CON siRNA group.
Group HUVECs proliferation 1 d 2 d 3 d 4 d EV 0.211±0.074 0.624±0.085 0.845±0.107 1.211±0.081 ING4 0.229±0.109 0.403±0.1031) 0.781±0.1211) 0.831±0.1141)CON siRNA 0.303±0.114 0.738±0.117 0.934±0.094 1.198±0.096 ING4 siRNA 0.218±0.097 0.804±0.1092) 1.197±0.0792) 1.572±0.1252)
2.3 Transwell实验检测细胞迁移
结果显示:EV组、ING4组、Con siRNA组和ING4 siRNA组细胞迁移分别为48.571±0.324、32.049±0.179、39.213±0.204、60.017±0.331。与EV组比较ING4组细胞迁移差异有统计学意义(t= 23.780,P=0.002);与Con siRNA组比较,ING4 siRNA组细胞迁移差异亦有统计学意义(t=32.215,P= 0.001)。HUVECs转染ING4质粒能够降低细胞的迁移能力,而转染ING4siRNA后,HUVECs的迁移能力增强,见图1。
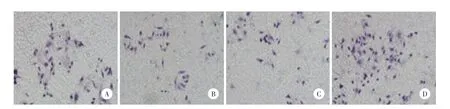
图1 ING4对各组细胞HUVECs迁移的影响 ×200Fig.1 Effect of ING4 on the migration of HUVECs in groups×200
2.4 实时PCR检测血管形成相关因子mRNA表达
VEGF、MMP⁃2、MMP⁃9mRNA表达结果显示,ING4组与EV组比较差异有统计学意义(t分别为12.488、7.563、12.124,P分别为0.006、0.017、0.007);ING4 siRNA与CON siRNA比较差异有统计学意义(t分别为4.850、7.361、26.050,P分别为0.040、0.018、0.001)。在mRNA水平,过表达ING4能够抑制血管形成相关因子VEGF、MMP⁃2、MMP⁃9的表达水平,而转染ING4 siRNA则能够增强其表达。见表2。
2.5 Western blotting检测血管形成相关因子蛋白表达
VEGF、MMP⁃2、MMP⁃9蛋白表达检测结果显示,ING4组与EV组比较差异有统计学意义(t分别为23.305、22.360、13.777,P分别为0.002、0.002、0.005);ING4 siRNA与CON siRNA比较差异有统计学意义(t分别为27.471、21.599、24.750,P分别为0.001、0.002、0.024),结果与PCR实验一致。见表3、图2。在蛋白水平,过表达ING4能够抑制血管形成相关因子VEGF、MMP⁃2、MMP⁃9的表达水平,而转染ING4 siRNA则能够增强其表达。
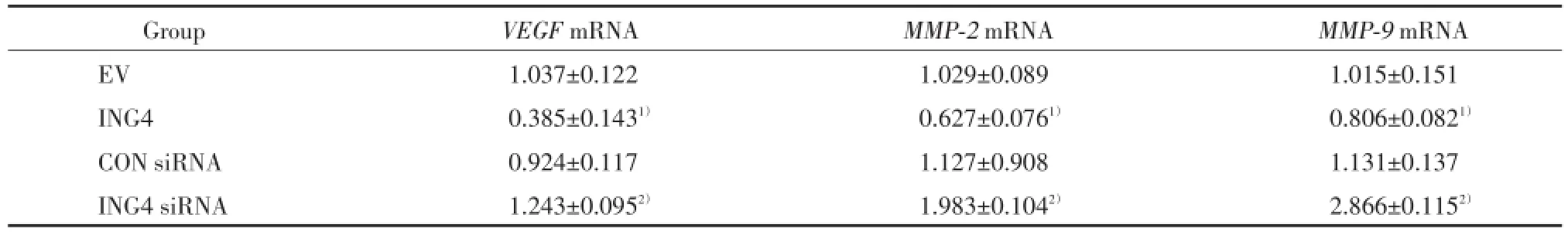
表2 ING4对血管形成相关因子VEGF、MMP⁃2、MMP⁃9mRNA表达的影响Tab.2 Effect of ING4 on mRNA levels ofVEGF,MMP⁃2andMMP⁃9
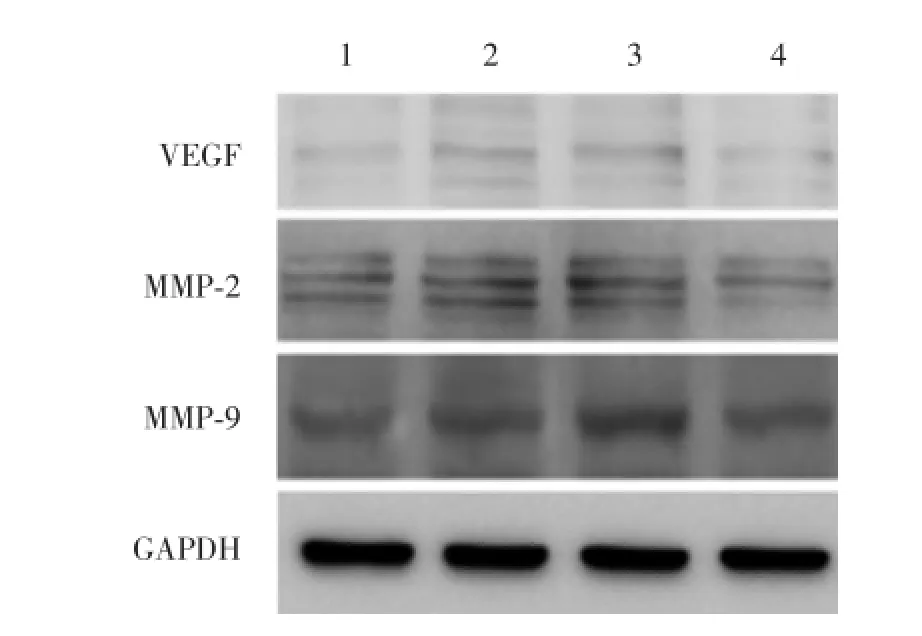
图2 Western blotting检测ING4对血管形成相关因子表达的影响Fig.2 Effect of ING4 on the protein expression of angiogenesis related factors
3 讨论
血管形成是人体内的一种非常重要的过程,不仅参与组织再生、创伤愈合等生理过程,还参与许多疾病的病理过程。生长期的肿瘤如同发育中的器官,肿瘤组织中血管形成的作用与器官发生中同样重要[9-10]。
在缺血、缺氧条件下,VEGF表达上调能够保持内皮细胞的活性,诱导内皮细胞增殖,并能够调节血管的通透性,进而促进血管的生成。MMP能够降解细胞外基质、促进内皮细胞的游走和迁移。缺氧是肿瘤微环境的一个重要特征,因此,抑制肿瘤微环境内VEGF、MMP的表达能够抑制肿瘤内新血管的形成,进而抑制肿瘤的生长及侵袭。ING4基因是肿瘤抑制因子家族的新成员,近来研究[11]发现,ING基因在正常组织中表达丰富,但在多种恶性肿瘤组织(卵巢癌、乳腺癌、胃癌、结直肠癌、恶性黑色素瘤、胶质瘤、肺癌等)的表达明显下调[1-8]。ING4基因定位于12p13⁃32区,由8个外显子和7个内含子构成,范围覆盖约13 000个碱基对[12]。

表3 ING4对血管形成相关因子VEGF、MMP⁃2、MMP⁃9蛋白表达的影响Tab.3 Effect of ING4 on protein expression of VEGF,MMP⁃2 and MMP⁃9
大量研究显示,ING4在大多数肿瘤组织中呈低表达,并且与肿瘤的恶性程度相关。GARKAVT⁃SEV等[11]研究发现,ING4mRNA的含量在胶质母细胞瘤(WHOⅣ级)中较瘤旁正常的脑组织下降6倍多。CAO等[1]研究发现ING4蛋白在乳腺癌组织中的表达显著低于良性乳腺增生组织,证明乳腺癌的发生也与ING4蛋白表达缺失有关。WANG等[5]的研究发现在非小细胞肺癌中ING4mRNA和蛋白表达水平均较癌旁正常组织显著降低,且与非小细胞肺癌的病理分期及淋巴结转移情况呈负相关。LI等[13]检测ING4基因在恶性黑色素瘤中的表达水平,结果发现与痣相比,ING4的表达水平在恶性黑色素瘤中显著降低,并且与瘤组织的厚度、溃疡形成呈负相关,是黑色素瘤预后差的标志物之一。LI等[6]的研究显示ING4基因与头颈部原发性鳞状细胞癌的低分化状态、TNM分期呈负相关。近期研究[8,14]显示,ING4基因在结肠癌、胃肠道间质瘤中也呈低表达,并且与肿瘤组织大小、病理分级、临床分期和淋巴结转移等呈显著相关。本研究结果显示,ING4在HUVECs中表达,通过MTT及Transwell实验证实,ING4对HUVECs具有直接调控作用,转染ING4质粒能够抑制HUVECs的增殖及迁移,而转染ING4 siRNA则能够促进HUVECs增殖及迁移,并且,实时PCR及Western blotting实验结果显示转染ING4质粒能够下调血管形成相关因子VEGF、MMP⁃2、MMP⁃9mRNA及蛋白的表达水平。
据文献[15⁃20]报道,ING4基因对肿瘤的抑制作用表现为抑制肿瘤细胞的生长、调节细胞周期、诱导细胞凋亡、抑制肿瘤侵袭转移、增加肿瘤细胞对化疗药物的敏感性以及抑制肿瘤血管的生成。在抑制肿瘤血管生成方面,SHI等[21]研究发现,在胶质瘤细胞系U87MG中,ING4能够通过与P65亚基结合,抑制NF⁃κB转录活性,使IL⁃8表达水平下降,从而使肿瘤组织内的微血管密度降低,肿瘤血管生成减少。但也有研究[22]表明ING4可通过抑制HIF的活性,抑制IL⁃8的表达,进而抑制肿瘤血管的生成。目前对何种机制起主导作用,尚不清楚,仍需进一步实验研究。
本研究发现ING4能够直接作用于HUVECs,过表达ING4能够抑制HUVECs的增殖及迁移,并能够下调血管形成相关因子VEGF、MMP⁃2、MMP⁃9的表达水平,因此推测,ING4能过通过双重作用抑制新血管的形成。
综上所述,ING4不仅能够抑制肿瘤细胞的增殖及侵袭,对血管内皮细胞也具有直接的调控作用。本研究从全新角度探讨了ING4的抗肿瘤作用机制,为肿瘤发生发展及靶向治疗提供了新的理论依据。
[1]CAO F,WEI QJ,LU YJ,et al.The inhibitory effects of exogenousING4gene expression on the growth of breast cancer cells[J].Tu⁃mor,2008,289(4):301-304.DOI:10.3781/j.issn.1000⁃7431.2008. 04.007.
[2]TAPIA C,ZLOBEC I,SCHNEIDER S,et al.Deletion of the inhibi⁃tor of growth 4(ING4)tumor suppressor gene is prevalent in human epidermal growth factor 2(HER2)⁃positive breast cancer[J].Hum Pathol,2011,42(7):983-990.DOI:10.1016/j.humpath.2010.10. 012.
[3]LIU Y,YU L,WANG Y,et al.Expression of tumor suppressorgene ING4 in ovarian carcinoma is correlated with microvesseldensity[J].J Cancer Res Clin Oncol,2012,138(4):647-655.DOI:10. 1007/s00432⁃011⁃1099⁃5.
[4]ZENG ZL,LI FJ,GAO F,et al.Upregulation of miR⁃650 is correlat⁃edwith down⁃regulation of ING4 and progression of hepatocellular carcinoma[J].J Surg Oncol,2013,107(2):105-110.DOI:10.1002/ jso.23210.
[5]WANG QS,LI M,ZHANG LY,et al.Down⁃regulation of ING4 is as⁃sociated with initiation and progression of lung cancer[J].Histopa⁃thology,2010,57(2):271-281.DOI:10.1111/j.1365⁃2559.2010. 03623.x.
[6]LI XH,KIKUCHI K,ZHENG Y.Downregulation and translocation of nuclear ING4 is correlated with tumorigenesis and progression of head and neck squamous cell carcinoma[J].Oral Oncol,2011,47(3):217-223.DOI:10.1016/j.oraloncology.2011.01.004.
[7]YOU Q,WANG XS,FU SB,et al.Downregulated expression of in⁃hibitor of growth 4(ING4)in advanced colorectal cancers:a non⁃randomizedexperimental study[J].Pathol Oncol Res,2011,17(3):473-477.DOI:10.1007/s12253⁃010⁃9301⁃7.
[8]NANDING A,TANG L,CAI L,et al.Low ING4 protein expression detectedby paraffin⁃section immunohistochemistry is associatedwith poor prognosis in untreatedpatients with gastrointestinal stromal⁃tumors[J].Gastric Cancer,2014,17(1):87-96.DOI:10.1007/s10 120⁃013⁃0248⁃8.
[9]FERRARA N,CHEN H,DAVIS⁃SMYTH T,et al.Vascular endo⁃thelial growthfactor is essential for Corpusluteum angiogenesis[J]. Nat Med,1998,4(3):336-340.DOI:10.1038/nm0398⁃336.
[10]SCAPPATICCI FA.Mechanisms and future directions for angiogen⁃esis⁃basedcancertherapies[J].J Clin Oncol,2002,20(18):3906-3927.
[11]GARKAVTSEV I,KOZIN SV,CHENOVA OV,et a1.The candi⁃date tumor suppressor protein ING4 regulates brain tumor growth andangiogenesis[J].Nature,2004,428(6980):328-332.DOI:10.1038/nature02329.
[12]KIM S,CHIN K,GRAY JW,et al.A screen for genes that suppress loss of contact inhibition:identification of ING4 as a candidate tu⁃mor suppressor gene in human cancer[J].Proc Natl Acad Sci USA,2004,101(46):16251-16256.DOI:10.1073/pnas.0407 158101.
[13]LI J,MARTINKA M,LI G.Role of ING4 in human melanoma cell migration,invasion and patient survival[J].Carcinogenesis,2008,29(7):1373-1379.DOI:10.1093/carcin/bgn086.
[14]LOU C,JIANG S.ING4 is negatively correlated with microves⁃seldensity in colon cancer[J].Tumour Biol,2012,33(6):2357-2364.DOI:10.1007/s13277⁃012⁃0498⁃9.
[15]SHISEKI M,NAGASHIMA M,PEDEUX RM,et al.p29ING4 and p28ING5 bind to p53 and p300,and enhance p53 activity[J]. Cancer Res,2003,63(10):2373-2378.
[16]王金志,缪竞诚,盛伟华,等.ING4基因真核表达载体的构建及其功能[J].解剖学杂志,2005,28(4):383-386.
[17]王家融,韩亚丽,缪竞诚,等.ING4及IL⁃24双基因共表达腺病毒载体对MG⁃63人骨肉瘤细胞体外抑癌增效作用研究[J].北华大学学报(自然科学版),2013,14(3):294-298.DOI:10.11713/j.issn.1009⁃4822.2013.03.010.
[18]XIE Y,SHENG W,MIAO J,et al.Enhanced antitumor activity by combining anadenovirus harboring ING4 with cisplatin for hepato⁃carcinoma cells[J].Cancer Gene Ther,2011,18(3):176-188. DOI:10.1038/cgt.2010.67.
[19]ZHANG XJ,YE H,ZENG CW,et al.Dysregulation of miR⁃15a and miR⁃214 in human pancreatic cancer[J].J Hematol Oncol,2010,24(3):46-54.DOI:10.1186/1756⁃8722⁃3⁃46.
[20]XIE YF,SHENG W,XIANG J,et al.Adenovirus⁃mediated ING4 expressionsuppresses pancreatic carcinoma cell growth via induc⁃tion of cell⁃cyclealteration,apoptosis,and inhibition of tumor an⁃ giogenesis[J].Cancer Biother Radiopharm,2009,24(2):261-269.DOI:10.1089/cbr.2008.0582.
[21]SHI X,HONG T,WALTER KL,et al.ING2PDH domain links his⁃tone H3 lysine 4 methylation to active gene repression[J].Nature,2006,442(7098):96-99.DOI:10.1038/nature04835.
[22]COLLA S,TAGLIAFERRI S,MORANDI F,et al.The new tumor suppressor gene inhibitor of growth family member 4(ING4)regu⁃lates the production of proangiogenic molecules by myeloma cells and suppresses hypoxia inducible factor⁃1α(HIF⁃1α)activity be⁃ing involved in myeloma⁃inducedangiogenesis[J].Blood,2007,110(13):4464-4475.DOI:10.1182/blood⁃2007⁃02⁃074617.
(编辑 武玉欣)
Effects of Inhibitor of Growth 4 on the Proliferation,Migration and Expression of Angiogenesis Related Factors in Endothelial Cells
LI Yue,YANG Xianghong
(Department of Pathology,Shengjing Hospital,China Medical University,Shenyang 110004,China)
Objective To investigate the effects of inhibitor of growth 4(ING4)on the proliferation,migration and the expression of angiogenesis related factors such as VEGF,MMP⁃2,MMP⁃9 in endothelial cells.Methods Human umbilical vein endothelial cells(HUVECs)were cultured in vitro;ING4 plasmid and siRNA were constructed and transfected to HUVECs;the proliferation of HUVECs was evaluated by MTT assay;the ability of migration was evaluated by Transwell assay;real⁃time PCR and Western blotting were used to determine the expression of mRNA and pro⁃tein of angiogenesis related factors such as VEGF,MMP⁃2,and MMP⁃9.Results MTT and Transwell assay showed that ING4 has the ability to inhibit the proliferation and migration of HUVECs,and the results of real⁃time PCR and Western blotting proved that ING4 can inhibit the expres⁃sion of angiogenesis related factors such as VEGF,MMP⁃2,and MMP⁃9.Conclusion ING4 can inhibit the proliferation and migration of HU⁃VECs,down⁃regulate the expression of angiogenesis related factors such as VEGF,MMP⁃2,MMP⁃9,and inhibit angiogenesis.
inhibitor of growth 4;vascular endothelial cell;vascular endothelial growth factor;matrix metalloproteinase
R363.2
A
0258-4646(2017)02-0160-05
10.12007/j.issn.0258⁃4646.2017.02.015
李悦(1984-),女,主治医师,博士研究生.
杨向红,E-mail:xhyang4933@vip.sina.com
2016-06-08
网络出版时间:
——一道江苏高考题的奥秘解读和拓展

