农杆菌介导的小麦成熟胚遗传转化影响因素分析
彭亚博,田保明,崔明珠,师恭曜,李 瑞,位 芳,曹刚强
(郑州大学生命科学学院,河南郑州 450001)
农杆菌介导的小麦成熟胚遗传转化影响因素分析
彭亚博,田保明,崔明珠,师恭曜,李 瑞,位 芳,曹刚强
(郑州大学生命科学学院,河南郑州 450001)
为解决农杆菌介导的小麦成熟胚遗传转化效率较低的难题,以春小麦Bobwhite成熟胚为外植体,分析植物激素、愈伤组织预培养时间、侵染时间和共培养阶段干燥处理对小麦成熟胚愈伤组织遗传转化的影响,并在遗传转化处理中辅以3个组织再生相关基因( TaSERK1、 TaSERK2、 TaNiR)的qRT-PCR分析。结果表明,愈伤组织预培养阶段添加适量的2,4-D和Picloram均可诱导成熟胚愈伤组织的形成,但是2 mg·L-1Picloram培养基中愈伤组织的胚萌发率为20.78%,远高于2,4-D诱导的胚萌发率(11.38%);共培养阶段对农杆菌侵染的愈伤组织进行干燥处理能适当提高愈伤组织的转化效率; qRT-PCR分析发现再生相关基因 TaNiR相对表达量的增加能适当提高愈伤组织的转化率。
小麦;成熟胚;农杆菌;再生;遗传转化
1992年Vasil等[1]以小麦幼胚的愈伤组织为外植体,利用基因枪法获得了第一例转基因小麦植株。随后,国内外小麦转基因研究取得了很多突破性进展。Cheng等[2]首次采用农杆菌介导法获得转基因小麦,并初步建立了一套较为完整的农杆菌介导的小麦遗传转化体系。在此基础上,Hu等[3]又对农杆菌介导转化的相关因素进行了系统研究,并将小麦的遗传转化效率提升至4.4%。但是由于小麦属于典型的单子叶植物和严格的自花授粉植物,其细胞诱导高质量愈伤组织的能力较弱。Medvecka等[4]在农杆菌侵染Bobwhite S56品种小麦的愈伤组织中发现只有10.5%的高质量愈伤组织适用于农杆菌侵染。单子叶植物不是农杆菌的天然寄主,在受到农杆菌侵染时不能和双子叶植物一样大量分泌促进农杆菌吸附植物受伤部位的乙酰丁香酮[5],所以在遗传转化过程中存在DNA导入频率低等问题。因此,提高农杆菌介导小麦愈伤组织的再生和遗传转化效率是转基因小麦研究的关键。
影响植物组织离体再生能力和遗传转化效率的因素很多,如基因型、激素、培养环境、外植体的生理状态等。邱肖迪等[6]研究发现,四倍体硬粒小麦成熟胚愈伤组织和再生能力远高于二倍体野生一粒小麦Tb。Ding 等[7]使用Picloram(毒莠定,一种人工合成的类生长素)诱导小麦成熟胚的再生频率(27.1%)高于2,4-D(12.3%),并发现1 mg·L-1Picloram诱导的愈伤组织再生频率最高(30.6%),2,4-D浓度(2~4 mg·L-1)增加会导致愈伤组织再生频率降低。程在全等[8]分别采用光照和暗培养诱导小麦愈伤组织,发现两种处理方式虽然不会引起愈伤组织生长速率的明显变化,但光照条件下形成的愈伤组织颜色为浅黄绿色,质地紧密,而暗培养条件下的愈伤组织色泽偏白,排列疏松,两种愈伤组织在质量上存在一定差异。
目前报道的转基因小麦大多是以小麦幼胚作为研究对象[9],因为幼胚具有较强的再生能力,与其他外植体相比更容易获得转基因植株[10]。但是小麦幼胚同样受到季节和发育阶段等因素的限制[11],相比之下,以小麦成熟胚为材料既能保证一定的再生能力,又具有取材方便、实验周期较短等优势。因此,本实验选用模式小麦品种Bobwhite的成熟胚为外植体,农杆菌菌株LBA4404(含pCAMBIA3304质粒)作为供体材料,对影响农杆菌介导小麦成熟胚遗传转化的3个因素进行研究,以期为小麦成熟胚转基因研究提供参考。
1 材料与方法
1.1 材 料
春小麦品种Bobwhite,由江苏省农业种质资源保护与利用研究中心提供。根癌农杆菌(Agrobacteriumtumefacience)LBA4404,携带Gus(β-glucuronidase)基因和Bar(biolaphos resistance)基因,并具有卡那霉素抗性(Kan+)和链霉素抗性(Sp+)的植物表达载体pCAMBIA3304,均由郑州大学生命科学学院提供。
愈伤诱导培养基MS2P:MS培养基+2 mg·L-1Picloram;愈伤诱导培养基MS2D:MS培养基+2 mg·L-12,4-D;根癌农杆菌YEP液体培养基:10 g·L-1牛肉浸膏+10 g·L-1酵母提取液+5 g·L-1NaCl;农杆菌侵染培养液:1/10 MS培养基+0.75 g·L-1MgCl2+0.02% SilwetL-77+200 μmol·L-1AS;共培养基:1/10 MS培养基+2 mg·L-1Picloram+0.75 g·L-1MgCl2+0.02% SilwetL-77+200 μmol·L-1AS;恢复培养基:MS培养基+2 mg·L-1Picloram+250 mg·L-1羧苄青霉素(cb);筛选培养基:MS培养基+1 mg·L-16-BA+0.5 mg·L-1IBA+250 mg·L-1羧苄青霉素(cb)+10 mg·L-1草丁膦(PPT)。以上所有培养基pH值均为5.8,121 ℃高压灭菌20 min,现配现用。
1.2 方 法
1.2.1 小麦成熟胚愈伤组织诱导
挑选当年收获的籽粒饱满、大小和色泽相对一致的Bobwhite品种小麦成熟种子,先用70%的无水乙醇消毒3 min,无菌水清洗2次,再用0.1%的升汞(HgCl2)消毒15 min,无菌水清洗3~5次后,室温下浸泡过夜。用镊子将成熟胚完整挤出,均匀分成4块,分别接种于MS2D/MS2P愈伤诱导培养基中,黑暗条件下25 ℃预培养28 d,统计愈伤组织诱导率、胚萌发率。本实验无特殊说明,每组处理均为30个外植体,每组重复3次。
1.2.2 农杆菌介导的小麦愈伤组织的遗传转化
将本实验室保存的含有pCAMBIA3304质粒的农杆菌LBA4404接种到含有100 mg·L-1卡那霉素(k+)、100 mg·L-1链霉素(sp+)、100 mg·L-1利福平(Rif+)的YEP液体培养基中,28 ℃、180 r·min-1震荡培养至菌液OD600=1.0~2.0时,5 000 r·min-1离心8 min收集菌体,再用农杆菌侵染培养液重悬菌体至OD600=1.0,用于转化小麦愈伤组织。首先,选取在MS2P培养基中预培养一定时间(3 d、14 d和28 d)的愈伤组织浸泡在农杆菌重悬液中,25 ℃黑暗培养一定时间(0.5 h、1 h、3 h、5 h),用无菌滤纸吸干愈伤组织表面的重悬液,转入共培养基中或转入铺有干燥无菌滤纸的平皿中,25 ℃黑暗条件下共培养3~4 d后移至恢复培养基中,25 ℃光照恢复培养5~6 d(光照时间16 h·d-1,光照强度1 500 lx),最终在筛选培养基中25 ℃光照培养20 d左右,统计愈伤组织绿斑分化率。
1.2.3 组织化学染色检测(GUS染色法)
挑选1.2.2节中共培养3~4 d的愈伤组织放入1.5 mL离心管中,添加适量的GUS组织化学染液,37 ℃过夜,70%乙醇脱色后肉眼观察GUS基因表达情况,统计GUS瞬时表达率。
1.2.4 组织培养再生相关基因的qRT-PCR分析
使用SuperPure Plantpoly RNA Kit(Gene Answer)试剂盒分别提取不同预培养时间、不同侵染时间以及共培养阶段不同处理方式(共培养3~4 d)的愈伤组织总RNA,M-MLV反转录试剂盒(晶彩生物)合成cDNA,-20 ℃保存,再以cDNA为模板,2×Sybr Green qPCR Mix(Gene Answer)qRT-PCR分析组织培养相关再生基因的相对表达量。利用Primer 5.0设计小麦内参基因β-actin(Accession number:KC77578.1)、小麦亚硝酸还原酶 TaNiR(Triticumaestivumnitrite reductase,Accession number:FJ527909.1)、小麦体细胞胚胎发生受体激酶1 TaSERK1(Triticumaestivumsomatic embryogenesis receptor kinase 1,Accession number:JF808017.1)和小麦体细胞胚胎发生受体激酶2 TaSERK2(Triticumaestivumsomatic embryogenesis receptor kinase 2,Accession number:JF808018.1)基因的特异扩增引物(表1)。

表1 qRT-PCR分析所用引物
1.3 数据处理
试验数据采用Excel 2007和SPSS 21.0软件进行统计分析。GUS瞬时表达率、愈伤组织诱导率、胚萌发率、绿斑分化率分别用以下公式进行计算。
GUS瞬时表达率=GUS染色呈蓝色的外植体数/检测外植体总数×100%;
愈伤组织诱导率=愈伤组织数/接种外植体数×100%;
胚萌发率=胚萌发外植体数/接种外植体数×100%;
绿斑分化率=分化绿斑的愈伤组织数/接种愈伤组织数×100%。
2 结果与分析
2.1 不同植物激素对小麦成熟胚愈伤组织诱导的影响
将消毒处理过的小麦成熟胚接种于MS2D/MS2P愈伤组织诱导培养基中,在25 ℃黑暗条件下进行培养。由图1A、1B可以观察到预培养14 d时2 mg·L-12,4-D诱导的愈伤组织呈透明的水渍状;在添加相同浓度Picloram的培养基中愈伤组织表面有许多的白色根状毛。预培养28 d 时,观察到2,4-D诱导的愈伤组织结构疏松,表面光滑,呈乳白色;Picloram诱导的愈伤组织结构致密,表面粗糙,呈米黄色(图1C、1D)。统计结果表明,Picloram和2,4-D对小麦成熟胚愈伤组织的诱导率分别为90.26%和85.37%,差异显著(P<0.05);胚萌发率分别为20.78%和11.38%,差异极显著(P<0.01)。
2.2 预培养时间对成熟胚愈伤组织转化的影响
选取新鲜剥离的小麦成熟胚消毒处理后接种于MS2P愈伤组织诱导培养基上,用农杆菌重悬液分别侵染预培养3 d、14 d、28 d的愈伤组织,统计共培养3~4 d后的GUS瞬时表达率,以及筛选培养20 d的愈伤组织绿斑分化率。由图2可以发现,随着预培养时间的延长,愈伤组织GUS瞬时表达率显著提升,绿斑分化率则缓慢降低。因此,在保证一定绿斑分化率的同时应选择遗传转化效率较高的愈伤组织(以预培养14 d最合适)作为转化受体进行下一步研究。
2.3 侵染时间对成熟胚愈伤组织转化的影响
将预培养14 d的愈伤组织农杆菌侵染时间分别设置为0.5h、1h、3h和5h,统计共培养3~4 d后的GUS瞬时表达率以及筛选培养20 d的愈伤组织绿斑分化率(图3)。结果表明,随着农杆菌侵染时间的延长,愈伤组织的GUS瞬时表达率迅速提升,在侵染3 h时达到最高,超过3 h则明显下降,而整个侵染周期绿斑分化率的变化并不明显,说明长时间的侵染并不能提高农杆菌的转化效率,反而会降低愈伤组织对农杆菌的耐受性。因此,农杆菌侵染愈伤组织的最佳侵染时间为3 h左右。
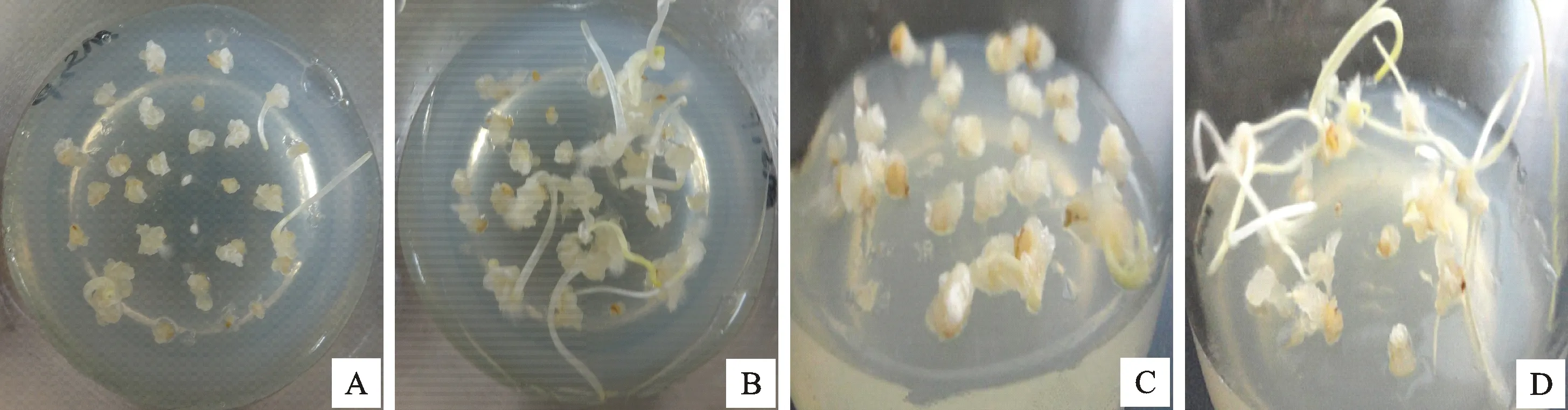
A:2,4-D诱导的愈伤组织(14 d);B:Picloram诱导的愈伤组织(14 d);C:2,4-D诱导的愈伤组织(28 d);D:Picloram诱导的愈伤组织(28 d)。
A:2,4-D induced callus(14 days) ;B:Picloram induced callus(14 days);C:2,4-D induced callus(28 days);D:Picloram induced callus(28 days).
图1 不同植物激素诱导的愈伤组织
Fig.1 Callus induced by different plant hormones
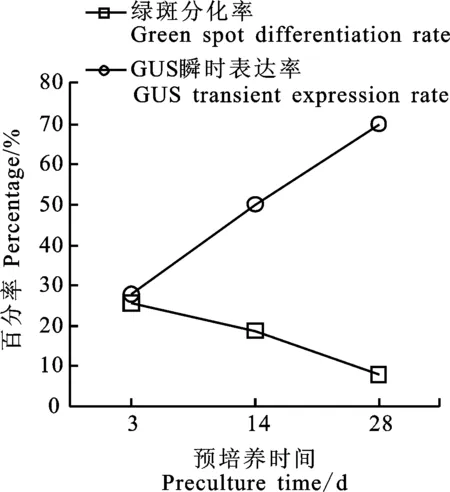
图2 预培养时间对转化后愈伤组织绿斑分化率及GUS瞬时表达率的影响
2.4 干燥处理对成熟胚愈伤组织转化的影响
以预培养 3 d、14 d和28 d的小麦愈伤组织为转化体,农杆菌重悬液浸泡3 h后共培养阶段分别采用两种方式处理愈伤组织:(1)用无菌滤纸吸干愈伤组织表面的培养液,转入共培养基中黑暗条件下共培养3~4 d;(2)用无菌滤纸吸干愈伤组织表面的培养液,随后转入铺有干燥无菌滤纸的平皿中,黑暗条件下共培养3~4 d。在共培养阶段对两种处理方式的愈伤组织进行GUS组织化学染色鉴定,统计愈伤组织GUS瞬时表达率;提取相对应的愈伤组织总RNA,用于组织培养再生相关基因的实时荧光定量分析。筛选培养20 d左右,统计愈伤组织绿斑分化率。

图3 侵染时间对转化后愈伤组织绿斑分化率及GUS瞬时表达率的影响
由图4可以发现,预培养时间较短(3 d)的愈伤组织在共培养阶段经干燥处理能够显著提升绿斑分化率。但随着预培养时间的增加,未干燥处理和干燥处理的愈伤组织在绿斑分化率上并没有太大的差异。
随机挑取3块转化后的愈伤组织进行追踪GUS化学染色,结果(图5)发现,在共培养阶段未经过干燥处理的小麦愈伤组织均未染色;而干燥处理的小麦愈伤组织中,仍有一块可以观察到GUS蓝色斑点存在。说明共培养阶段干燥处理的确可以适当提高小麦愈伤组织的转化率。
2.5 植物组织培养再生相关基因的qRT-PCR分析结果
分别从预培养时间、农杆菌侵染时间和共培养阶段干燥处理3个方面进行植物组织再生相关基因( TaSERK1、 TaSERK2、 TaNiR)的qRT-PCR分析。结果表明,预培养3 d的愈伤组织转化前后3个基因的相对表达量均无明显变化;预培养第14 d,转化后的愈伤组织中仅发现基因 TaNiR的表达量显著上调,提高了约1.21倍;预培养至28 d,转化后的愈伤组织三个再生相关基因表达量均明显上调(图6)。结合图2结果可知,随着预培养时间的增加,GUS瞬时表达率升高,愈伤组织转化处理前后基因 TaNiR的相对表达量也显著提升。
以0 h为对照,侵染时间为0.5 h、1 h、3 h和5 h的愈伤组织3个基因的相对表达量均有变化(图7)。结合图3和图7结果表明,农杆菌侵染3 h的愈伤组织GUS瞬时表达率和基因 TaNiR的相对表达量均达到最大值,侵染时间超过3 h的 TaNiR基因的相对表达量和GUS瞬时表达率均大幅度下调。

图4 干燥处理对转化后愈伤组织绿斑分化率的影响

A:干燥处理;B:未干燥处理(箭头指向GUS蓝色斑点)。
A:Drying treatment;B:No drying treatment(Arrow points to the GUS blue spot).
图5 转化后的愈伤组织GUS染色
Fig.5 GUS staining of callus after the transformation
由图8可以发现,与未干燥处理相比较,干燥处理预培养3 d的愈伤组织 TaSERK1、 TaNiR基因的相对表达量下降;预培养至14 d,只有 TaNiR基因相对表达量大幅度提升;预培养28 d的愈伤组织,3个基因相对表达量均无明显差异。结合图6结果表明,基因 TaNiR在农杆菌介导小麦愈伤组织遗传转化中起着至关重要的作用。预培养14 d经干燥处理的愈伤组织GUS瞬时表达率增加伴随着基因 TaNiR表达量的大幅度提高。
3 讨 论
前人研究表明,不同种类的植物激素形成愈伤组织的质量存在明显的差异[12]。本研究中,虽然2,4-D和Picloram均可高频率诱导小麦成熟胚愈伤组织,但2 mg·L-1Picloram诱导的愈伤组织结构致密,表面粗糙,呈米黄色,且胚萌发率远高于2,4-D诱导的愈伤组织胚萌发率。
外植体的生理状态对转化频率起着至关重要的作用[13]。本研究发现预培养14 d的愈伤组织既能保证一定的转化效率(GUS瞬时表达率),又有较强的恢复再生能力(绿斑分化率),可作为合适的转化受体。

图6 预培养时间对愈伤组织再生相关基因相对表达量的影响

0~5 h:侵染时间。
0-5 h:infection time.
图7 侵染时间对愈伤组织再生相关基因相对表达量的影响
Fig.7 Effects of different infection time on the relative expression of callus regeneration related genes
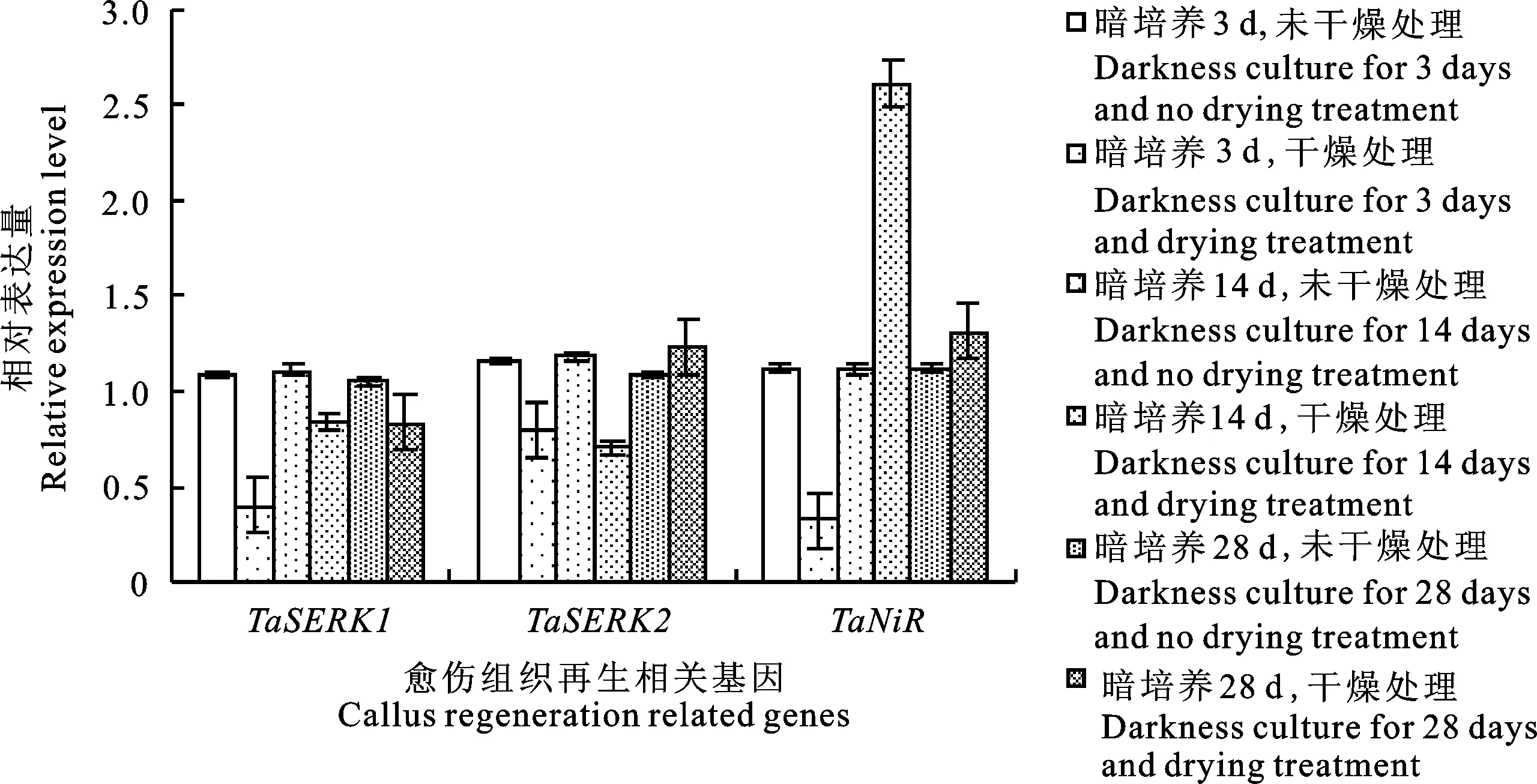
图8 干燥处理对愈伤组织再生相关基因相对表达量的影响
农杆菌侵染时间是决定愈伤组织转化率高低的主要因素之一。本试验中,以预培养14 d的小麦愈伤组织为外植体,农杆菌重悬液浸泡3 h左右的愈伤组织既不严重影响分化频率,同时又能够保证较高的转化效率。本研究结果和前人报道的侵染时间相差很大[14],分析其原因可能是外植体基因型的差异造成的。由于不同基因型的受体细胞对农杆菌的敏感程度不同,受到胁迫后个体恢复能力的差异导致最适侵染时间不同。
郭向云等[15]将小麦幼胚形成的愈伤组织在转入分化培养基前干燥处理12 h,结果显著提高了分化频率。本研究发现,当愈伤组织发育到一定程度(预培养14 d),共培养阶段干燥处理3~4 h并不会严重影响愈伤组织的分化能力,反而有利于提高愈伤组织的转化效率。分析其原因可能是由于受体细胞失水,提高了渗透势,促进了农杆菌的吸附和T-DNA的转移。其次,干燥处理还能抑制农杆菌的过度生长,减少后期对愈伤组织的伤害,使受体细胞能够更好的恢复活力,间接保证了愈伤组织的分化能力。
体细胞胚胎发生受体激酶SERKs(Somatic embryogenesis receptor kinases)是体细胞再生的标记基因[16],在大多数植物中均发现胚性愈伤组织的该基因表达量高于非胚性愈伤组织[17]。本研究发现,小麦成熟胚愈伤组织遗传转化频率的改变并没有引起SERK家族基因相对表达量的显著变化。推断SERK家族基因的表达量的改变可能与愈伤组织转化频率无明显关系。NiR(Ferredoxin-nitrite reductase)作为植物硝态氮向铵态氮转化的关键控制酶,在氮的利用及同化过程中发挥着重要作用[18]。本研究对不同因素进行优化后发现,农杆菌介导的小麦成熟胚愈伤组织遗传转化频率提高伴随着 TaNiR基因相对表达量的增加。推测小麦亚硝酸还原酶 TaNiR在小麦成熟胚愈伤组织转化过程中起着重要作用。由于小麦遗传转化频率是由多基因调控的[19],具体某个基因的变化对小麦愈伤组织转化的影响,还有待进一步深入研究。
[1] VASIL V,CASTILLO A M,FROMM M E,etal.Herbicide resistant fertile transgenic wheat plants obtained by microprojectile bombardment of regenerable embryogenic callus [J].Bio/Technology,1992,10(6):6674.
[2] CHENG M,HU T,LAYTON J,etal.Desiccation of plant tissues post-Agrobacteriuminfection enhances T-DNA delivery and increases stable transformation efficiency in wheat [J].InVitroCellular&DevelopmentalBiology-Plant,2003,39(6):5954.
[3] HU T,METZ S,CHAY C,etal.Agrobacterium-mediated large-scale transformation of wheat (TriticumaestivumL.) using glyphosate selection [J].PlantCellReports,2003,21(10):1010.
[4] MEDVECKA E,HARWOOD W A.Wheat (TriticumaestivumL.) transformation using mature embryos [J].MethodsinMolecularBiology,2015,1223(16):199.
[5] 董喜才,杜建中,王安乐,等.乙酰丁香酮在植物转基因研究中的作用 [J].中国农学通报,2011,27(5):292.
DONG X C,DU J Z,WANG A L,etal.Role of acetosyringone in plants transformation researcher [J].ChineseAgriculturalScienceBulletin,2011,27(05):292.
[6] 邱肖迪,雍遇乐,刘小刚,等.不同二倍体和四倍体小麦成熟胚再生体系研究 [J].中国农学通报,2012,28(15):126.
QIU X D,YONG Y L,LIU X G,etal.Study on regeneration system of mature embryo diploid and tetraploid wheat [J].ChineseAgriculturalScienceBulletin,2012,28(15):126.
[7] DING L,LI S,GAO J,etal.Optimization ofAgrobacterium-mediated transformation conditions in mature embryos of elite wheat [J].MolecularBiologyReports,2009,36(1):29.
[8] 程在全,王 芳,宋令荣,等.提高小麦体细胞诱导出胚性愈伤组织的方法研究 [J].西南农业学报,1999,13(3):4.
CHENG Z Q,WANG F,SONG L R,etal.Research on increasing the induction ratio of callus from somatic cells in wheat [J].SouthwestChinaJournalofAgriculturalSciences,1999,13(3):4.
[9] 张月婷,廖玉才,黄 涛,等.农杆菌介导的小麦转化体系的优化 [J].华中农业大学学报,2012,31(1):23.
ZHANG Y T,LIAO Y C,HUANG T,etal.Optimization of genetic transformation of wheat cultivars mediated byAgrobacteriumtumefaciens [J].JournalofHuazhongAgriculturalUniversity,2012,31(1):23.
[10] 栗 聪,皱景吾,张 磊,等.小麦成熟胚再生体系优化及优良受体基因型筛选 [J].麦类作物学报,2014,34(5):5830.
LI C,LUO J W,ZHANG L,etal.Optimizing the regenration system from mature embryo and screening of elite wheat genotypes [J].JournalofTriticeaseCrops,2014,34(5):583.
[11] 郭志江,张凤路,王金明等.农杆菌介导小麦成熟胚体系的优化 [J].中国农学通报,2008,24(4):181.
GUO Z J,ZHANG F L,WANG J M,etal.Agrobacterium-mediated wheat mature embryos optimization system [J].ChineseAgriculturalScienceBulletin,2008,24(4):181.
[12] SATYAVATHI V V,JAUHAR P P,ELIAS M E,etal.Effects of growth regulator on in vitro plant regeneration in durum wheat [J].CropScience,2004,44(5):1839.
[13] SHRAWAT A K,BECKER D,LORZ H,etal.Agrobacteriumtumefaciens-mediated genetic transformation of barley (HordeumvulgareL.) [J].PlantScience,2007,172(2):281.
[14]DEBASIS P,VISHNUDASAN D,KHURANA P.Agrobacterium-mediated transformation of mature embryos ofTriticumaestivumandTriticumdurum[J].CurrentScience,2006,91(3):307.
[15] 郭向云,尹 钧,余桂荣,等.VB1和干燥处理对小麦幼胚愈伤组织培养的影响 [J].华北农学报,2003,18(4):19.
GUO X Y,YIN JUN,YU G R,etal.Effects of VB1 and desiccation on callus culture of wheat immature embryos [J].ActaAgriculturaeBoreali-Sinica,2003,18(4):19.
[16] SINGLA B,TYAGI A K,KHURANA J P,etal.Analysis of expression profile of selected genes expressed during auxin-induced somatic embryogenesis in leaf base system of wheat (Triticumaestivum) and their possible interactions [J].PlantMolecularBiology,2007,65(5):677.
[17] GONG H,PUA E C.Identification and expression of genes associated with shoot regeneration from leaf disc explants of mustard (Brassicajuncea) in vitro [J].PlantScience,2004,167(6):1191.
[18] SHE M Y,CHEN D D,FENG C,etal.Isolation,chromosome assignment,and expression assay of nitrite reductase gene and regulatory sequence in wheat [J].ActaAgronomicaSinica,2011,37(1):28.
[19] 于月华,张跃强,刘真芳,等.小麦TaMSR基因的克隆与表达分析 [J].华北农学报,2014,29(4):32.
YU Y H,ZHANG Y Q,LIU Z F,etal.Cloning and expression analysis ofTaMSRgene fromTriticumaestivum[J].ActaAgriculturaeBoreali-Sinica,2014,29(4):32.
Factors InfluencingAgrobacteriumMediated Transformation in Mature Embryo of Wheat (Triticumastivum)
PENG Yabo,TIAN Baoming,CUI Mingzhu,SHI Gongyao, LI Rui,WEI Fang,CAO Gangqiang
(College of Life and Sciences,Zhengzhou University,Zhengzhou,Henan 450001,China)
To solve the problem ofAgrobacteriummediated transformation in mature embryo of wheat(Triticumastivum),spring wheat ‘Bobwhite’ was used as receptor.The effects of plant hormones,the pre-culture time,Agrobacteriummediated transformation time and co-culture methods on wheat mature embryo callus induction and differentiation were analysed. During the transformation,three regeneration related genes ( TaSERK1、 TaSERK2, TaNiR) were analysed by qRT-PCR. The results showed that adding 2,4-D and Picloram could induce the formation of mature embryo callus,but the germination rate of callus induced by 2 mg·L-1picloram(20.78%) is higher than that induced by 2,4-D(11.38%). Dry processing in co-culture stage could obviously improve the transformation efficiency of callus. It was found that the change of the relative expression regeneration related genes ( TaNiR) could increase the transformation rate of callus by qRT-PCR.
Wheat (Triticumastivum); Mature embryo;Agrobacterium; Regeneration; Transformation
时间:2017-04-07
2016-07-07
2016-08-25 基金项目:NSFC-河南人才培养联合基金项目(U1204308);河南省科技厅重点攻关科研项目(15210210044) 第一作者E-mail:396977982@qq.com 通讯作者:位 芳(E-mail:fangwei@zzu.edu.cn)
S512.1;S336
A
1009-1041(2017)04-0458-07
网络出版地址:http://kns.cnki.net/kcms/detail/61.1359.S.20170407.1020.010.html

