肝癌细胞转移与PI3K-Akt-PAK1通路的相关性研究
张雷,王林,耿智敏,万永,孟凡迪,孟宪魁
肝癌细胞转移与PI3K-Akt-PAK1通路的相关性研究
张雷,王林,耿智敏,万永,孟凡迪,孟宪魁
目的研究肝细胞癌(HCC)组织PI3K/Akt/p21活化蛋白激酶1(PAK1)信号通路的表达对于HCC发生及转移的重要性,以期为HCC的预防和预后提供一个有效的分子标志,并为HCC的治疗提供一定的理论基础。方法自NCBI中GEO数据库中的GES364数据集提取数据,对PI3K/Akt/PAK1信号通路基因的表达量进行分析。结果将数据库中HCC组织分为肝内扩散组(PS)、肝外转移组(PM)、无转移组(PN)和正常肝对照组(H)。分析发现PS组和PM组PAK1和MMP-9表达量明显高于H组和PN组(P<0.0001);PS组、PM组和PN组AKT(1/2)和Girdin表达量明显高于H组(P<0.05),PS组和PM组AKT2和Girdin表达量也明显高于PN组(P<0.05);在PM组,AKT2与PAK1表达呈正相关(r=0.5679,P=0.0013)。结论PAK1和MMP-9高表达可以促进HCC的扩散和转移,而AKT的表达和活性对于HCC的转移也是至关重要的,提示PI3K/AKT/PAK1信号通路与HCC转移密切相关。
肝细胞癌;转移;PAK1;AKT
HCC是一种占全球癌症发病率第五和癌症致死率第三的常见肿瘤[1],每年引起大约60万人死亡[2]。HCC的发生与乙型肝炎(hepatitis B)和丙型肝炎(hepatitis C)病毒感染、肝硬化和黄曲霉毒素B1(aflatoxin B1,AFB1)的摄取等密切相关[3]。然而,HCC发生发展的具体分子机制仍然未被阐明。关于HCC发病机理的研究表明,HCC发生的分子机制存在高度的异质性,一些蛋白在这一过程中所发挥的具体作用仍不清楚[4-6]。尽管有些分子标志,如血管上皮生长因子(vascular endothelial growth factor,VEGF)、骨桥蛋白(osteopontin)和转化生长因子β(transforming growth factor β,TGF-β)等可能参与了HCC的发生,但是大量的临床和基础研究表明,现有的分子标志仍不足以精确地预测HCC患者的预后和生存[7]。由于缺乏特异性的靶向治疗,晚期HCC患者的预后都很差[8]。p21活化蛋白激酶(p21-activated protein kinases,PAKs)是一种很早就被鉴定的丝氨酸/苏氨酸激酶,能够被p21 GTPases、GTP-Cdc42和GTP-Rac等活化。每一个PAKs都包含有一个高度保守的氨基末端的Cdc42/Rac结合结构域和一个羧基末端的激酶结构域[9-12]。以往研究表明,PAKs参与多种细胞功能的调节,包括细胞骨架动态、细胞生存、细胞凋亡、激素信号和基因转录,并且能够促进细胞的增殖[13-17]。哺乳动物体内的PAKs家族包含有6个成员,根据其序列、结构和功能的不同可分为两组,分别为组I(PAK1-3)和组II(PAK4-6)[16,18-20]。众多研究表明,PAKs家族成员在多种恶性肿瘤中明显上调,尤其是PAK1在结直肠癌(colorectal cancer,CRC)、乳腺癌(breast cancer)、卵巢癌(ovarian cancer)和HCC中都表现出明显的上调[21-24]。此外,在CRC肿瘤细胞向淋巴结转移的过程中,PAK1的表达显著性增加[21]。在生长因子诱导的乳腺癌的发展和转移过程中,PAK1也是必需的调节因子[25,26]。PAK1过表达不仅增加卵巢癌细胞的迁移和浸润[23],而且在HCC的转移过程中也发挥重要的作用[24],而PAK1过表达与多种细胞内信号通路的活化具有密切的关系。
PI3K/Akt信号通路参与包括细胞增殖、细胞分化、细胞运动、肿瘤发生发展和血管生成等在内的多种细胞活动[27,28]。有研究表明,PAK1可以协同PI3K/ Akt信号通路,促进肝癌细胞的增殖和转移[29]。PI3K/AKT/PAK1信号通路对于乳腺癌的发展也发挥着重要的作用[30]。这些都暗示PI3K/AKT/PAK1信号通路对于HCC的发展和转移有着重要的作用,但其具体的作用机制仍有待于进一步的研究。本研究通过对数据库中HCC患者相关基因和信号分子的表达量和相关性的分析,揭示了PI3K/Akt/PAK1信号通路对于HCC发生及转移的重要性,明确了该信号通路及其部分调控的靶基因对HCC转移的正向调控作用,以期为HCC的预防和预后预测提供一个有效的分子标志,并为HCC的治疗提供一定的理论基础。
1 材料与方法
1.1 研究材料通过NCBI GEO Home入口检索GSE364数据集关于HCC的相关资料,最近更新时间为2012年2月23日,根据获得样本的特性,具体分组信息如表1。

表1 GSE364数据集样本分组情况
1.2 基因表达量分析基于数据库特定研究样本数据集中特定目标基因表达量的相对值进行表达量分析,所有数据都经过对数转换和中位数中心化处理。根据表达量处理后数据进行聚类和差异分析。文中比较差异分析图由GraphPad Prism 5软件制作(P<0.05、P<0.01、P<0.001均表示差异有统计学意义)。
1.3 相关性分析基于数据库特定研究样本数据集中特定目标基因表达量的相对值进行相关性分析,所有数据都经过对数转换和中位数中心化处理。文中相关性分析图由GraphPad Prism 5软件制作(P<0.05表示差异有统计学意义,r<0表示负相关,r>0表示正相关)。
2 结果
2.1 PAK1及其相关基因表达分析为了评估PAK1及活性与HCC发生发展的关系,我们选取了PAK1及其下游靶基因MMP-9作为分析对象。据以往的相关研究表明,活化的PAK1可以促进MMP-9的表达,所以MMP-9表达量的增加不仅可以反映肝癌发生发展过程的恶化,同时也可以在一定程度上反映PAK1的活性。据此,我们根据HCC的扩散转移情况,将NCBI数据库GSE364数据集中的HCC和正常标本进行分类(表1),然后对分类样本进行了PAK1和MMP-9的表达分析。结果表明,与正常对照组(H)相比,PAK1在PS、PM和PN中均存在不同程度的高表达(P<0.0001,P<0.0001,P=0.0026),与H组相比,MMP-9在PS组和PM组中均存在不同程度的高表达(P<0.0001,P<0.0001),而其在PN组中的表达与H组无明显差异(P=0.6371)。此外,与PN组相比,PAK1和MMP-9在PS组和PM组中均存在不同程度的高表达(P<0.0001,P<0.0001),说明在扩散和转移过程中癌细胞需要PAK1和MMP-9的参与,即PAK1和MMP-9的高表达可以促进HCC的扩散和转移,这也与以往的一些研究结果相一致。除此之外,与PS组比,PAK1和MMP-9在恶性化程度更高的PM组中也表现为高表达(P<0.0001,P=0.001),更说明PAK1的表达和活性及MMP-9的表达对于HCC的转移是至关重要的(图1)。
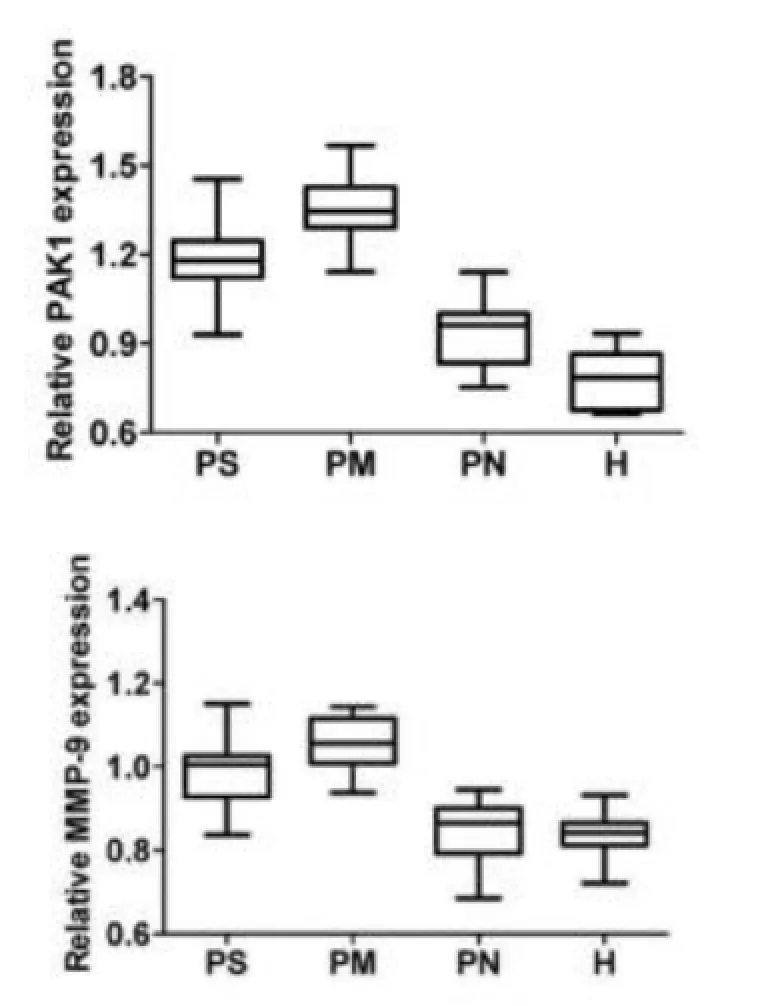
图1 各肝癌组织PAK1及其靶基因MMP-9表达差异比较
2.2 PI3K/AKT及其相关基因的表达量分析据以往的研究,PI3K/AKT信号通路对于HCC患者的发生发展都具有重要作用,而且PAK1也会协同活化PI3K/AKT信号通路以促进肝癌细胞的迁移和浸润。所以,鉴于上述的研究,为了进一步探究PI3K/AKT信号通路与HCC发生和转移的相关性,我们选取了AKT(1/2)及其下游靶基因Girdin和FAK作为分析对象。据以往的相关研究,活化的AKT(pAKT)可以促进FAK的活化和Girdin的表达。所以,Girdin表达量的增加不仅可以反映肝癌的发生发展过程的恶化,同时也可以在一定程度上反映AKT的活性。据此,我们对分类样本中AKT(1/2)、FAK和Girdin表达进行了分析,结果表明,与H组比,PS组、PM组和PN组AKT(1/2)和Girdin存在不同程度的高表达(AKT1:P=0.0005,P=0.0002,P=0.0018;AKT2:P=0.0007,P=0.0008,P= 0.0915;Girdin:P<0.0001,P<0.0001,P=0.025),而各组FAK表达量均无明显的差异,可能是因为即便是对于正常细胞FAK也发挥着重要的作用,所以其表达量相对恒定,体现在HCC转移过程中信号的增加可能是由于其活性的增强,而非表达量的变化。此外,与PN组比,PS组和PM组AKT2和Girdin存在不同程度的高表达(AKT2:P=0.01,P<0.0068;Girdin:P<0.0001,P<0.0001),说明在扩散和转移过程中HCC要比无转移的HCC更需要AKT2和Girdin的参与,即AKT2和Girdin的高表达可以促进HCC的扩散和转移。除此之外,恶性程度更高的PM组Girdin比PS组有更高的表达(P<0.0001),也说明Girdin表达和AKT活性对于HCC的转移是至关重要的(图2)。

图2 各组肝癌组织AKT及其相关靶基因表达差异比较
2.3 PI3K/AKT/PAK1信号通路及其靶基因相关性分析在上述的研究中,我们对PAK1及其靶基因MMP-9和AKT,及其后者的靶基因Girdin在各组HCC样本和正常对照样本中的表达分别进行了比较分析。为了进一步确定PAK1和AKT激酶的表达量和活性的同步变化,我们对PAK1和AKT2及其各自的靶基因的表达量进行了相关性分析。结果表明,HCC组织AKT2与其靶基因Girdin表达呈明显的正相关(r=0.6708,P<0.0001),PAK1与其靶基因MMP-9表达也呈明显的正相关(r=0.6458,P<0.0001,图3)。

图3 PI3K/AKT/PAK1信号通路及其相关基因的表达相关性分析
2.4 PI3K/AKT/PAK1信号通路与HCC转移的相关性分析在上述研究中,我们分析了PAK1及其靶基因MMP-9和AKT及其靶基因Girdin在不同HCC样本和正常对照样本中的表达,并对其差异进行了比较分析。已有研究表明,PAK1与PI3K/AKT信号通路有协同作用,为了进一步研究其在HCC发生及转移过程中的作用,我们分析了PM组HCC组织PAK1和PI3K/AKT表达量,结果表明,AKT2与PAK1表达呈正相关(r=0.5679,P=0.0013,图4),说明PAK1与PI3K/AKT信号通路在HCC转移过程中是有关联的,而且这一关联对于HCC的发展和恶化有着密切的关系,很可能PI3K/AKT/PAK1形成一条正向扩大的信号通路,从而促进早期HCC向恶性的可转移的方向发展,并影响患者的生存及预后。

图4 PM组HCC组织AKT2与PAK1表达呈正相关
3 讨论
在近十年,对于肝癌发生的分子机制的研究取得了巨大的进展。许多关键的信号通路都被证明在HCC发生和发展的过程中发挥着重要的作用,而且这些信号通路相关分子的异常表达以及它们之间的交互作用更是促进了HCC的发展及恶化,尤其是PI3K/AKT/PAK1信号通路在此过程中的作用越来越受到人们的关注。
研究表明,在HepG2肝癌细胞敲除PAK1会导致pERK和pAKT表达量减少[31,32],结合本研究中PAK1和AKT的相关性分析表明,在HCC组织PAK1不仅可以增加AKT的磷酸化水平,促使其活化,而且还有可能促进AKT表达量的增加,这样使得PI3K/AKT信号通路进一步活化,进而促进肿瘤的发展和转移。
我们的研究分析表明,与H组比,PS组、PM组和PN组PAK1存在不同程度的高表达,PS组和PM组MMP-9也存在不同程度的高表达,与PN组比,PS组和PM组PAK1和MMP-9均存在高表达。与PS组比,恶性化程度更高的PM组PAK1和MMP-9也表现为高表达,这些结果说明PAK1和MMP-9高表达可以促进HCC的扩散和转移,也进一步说明了PAK1表达和活性对于HCC的转移是至关重要的。鉴于此,我们也对PI3K/AKT信号通路及其相关基因的表达水平进行了分析,其结果与PAK1相似,说明癌细胞在扩散和转移过程中,需要AKT2和Girdin的参与。与PS组比,PM组Girdin呈高表达,也说明Girdin的表达和AKT的活性对于HCC的转移是至关重要的。最后,通过对PI3K/AKT信号通路和PAK1在HCC转移样本中的相关性分析,我们发现,PAK1与PI3K/AKT信号通路在HCC转移的过程中是有关联的,而且其对于HCC的转移有着密切的关系,PI3K/AKT/PAK1可能形成一条促癌的信号通路,从而促进早期HCC的转移。
通过对本研究结果的分析讨论,我们提出了PAK1和AKT信号在HCC转移过程中不仅表达量增多,而且其活性也有明显的增强。此外,PI3K/AKT信号通路和PAK1信号密切相关,鉴于以往的一些研究结果,PI3K/AKT信号通路很可能协同PAK1信号形成共同的促癌信号,协同调控HCC的恶化转移。本研究不仅揭示了这一相关性的存在,而且也为预防及治疗HCC,防止其恶化转移提供了一个新的切入点。
[1]LlovetJM,BurroughsA,BruixJ.Hepatocellularcarcinoma. Lancet,2003,362:1907.
[2]Parkin DM,Bray F,Ferlay J,et al.Global cancer statistics,2002. CA Cancer J Clin,2005,55:74.
[3]Chen CJ,Yu MW,Liaw YF.Epidemiological characteristics and risk factors of hepatocellular carcinoma.J Gastroenterol Hepatol,1997,12:S294.
[4]Thorgeirsson SS,Grisham JW.Molecular pathogenesis of human hepatocellular carcinoma.Nat Genet,2002,31:339.
[5]Bruix J,Boix L,Sala M,et al.Focus on hepatocellular carcinoma.Cancer Cell,2004,5:215.
[6]Laurent-Puig P,Legoix P,Bluteau O,et al.Genetic alterations associated with hepatocellular carcinomas define distinct pathways of hepatocarcinogenesis.Gastroenterology,2001,120:1763.
[7]Wang XM,Yang LY,Guo L,et al.p53-induced RINGH2 protein,a novel marker for poor survival in hepatocellular carcinoma after hepatic resection.Cancer,2009,115:4554.
[8]Lau WY,Lai EC.Hepatocellular carcinoma:current management and recent advances.Hepatobiliary Pancreat Dis Int,2008,7:237.
[9]Manser E,Leung T,Salihuddin H,et al.A brain serine/threonine protein kinase activated by Cdc42 and Rac1.Nature,1994,367:40.
[10]Knaus UG,Morris S,DongHJ,etal.Regulationofhuman leukocyte p21-activated kinases through G proteinecoupled receptors.Science,1995,269:221.
[11]Martin GA,Bollag G,McCormick F,et al.A novel serine kinase activated by rac1/CDC42Hs-dependent autophosphorylation is related to PAK65 and STE20.EMBO J,1995,14:1970.
[12]Bagrodia S,Taylor SJ,Jordon KA,et al.A novel regulator of p21-activated kinases.J Biol Chem,1998,273:23633.
[13]Kumar R,Vadlamudi RK.Emerging functions of p21-activated kinases in human cancer cells.J Cell Physiol,2002,193:133.
[14]Bokoch GM.Biology of the p21-activated kinases.Annu Rev Biochem,2003,72:743.
[15]Hofmann C,Shepelev M,Chernoff J.The genetics of Pak.J Cell Sci,2004,117:4343.
[16]Kumar R,Gururaj AE,Barnes CJ.p21-activated kinases in cancer.Nat Rev Cancer,2006,6:459.
[17]Wells CM,Jones GE.The emerging importance of group II PAKs.Biochem J,2010,425:465.
[18]Jaffer ZM,Chernoff J.p21-activated kinases:three more join the Pak.Int J Biochem Cell Biol,2002,34:713.
[19]Zhao ZS,Manser E.PAK and other Rho-associated kinaseseef fectorswithsurprisinglydiversemechanismsofregulation. Biochem J,2005,386:201.
[20]Arias-Romero LE,Chernoff J.A tale of two Paks.Biol Cell,2008,100:97.
[21]Carter JH,Douglass LE,Deddens JA,et al.Pak-1 expression increases with progression of colorectal carcinomas to metastasis. Clin Cancer Res,2004,10:3448.
[22]Bekri S,Adelaide J,Merscher S,et al.Detailed map of a region commonly amplified at 11q13>q14 in human breast carcinoma. Cytogenet Cell Genet,1997,79:125.
[23]Siu MK,Wong ES,Chan HY,et al.Differential expression and phosphorylation of Pak1 and Pak2 in ovarian cancer:effects on prognosis and cell invasion.Int J Cancer,2010,127:21.
[24]Ching YP,Leong VY,Lee MF,et al.P21-activated protein kinase is overexpressed in hepatocellular carcinoma and enhances cancer metastasis involving c-Jun NH2-terminal kinase activation and paxillin phosphorylation.Cancer Res,2007,67:3601.
[25]Vadlamudi RK,Adam L,Wang RA,et al.Regulatable expression of p21-activated kinase-1 promotes anchorageindependent growth andabnormalorganizationofmitoticspindlesinhuman epithelial breast cancer cells.J Biol Chem,2000,275:36238.
[26]Adam L,Vadlamudi R,Mandal M,et al.Regulation of microfilament reorganization and invasiveness of breast cancer cells bykinasedeadp21-activatedkinase-1.JBiolChem,2000,275:12041.
[27]Engelman JA,Luo J,Cantley LC.The evolution of phosphatidylinositol 3-kinases as regulators of growth and metabolism.Nat Rev Genet,2006,7(8):606-619.
[28]Bellacosa A,Kumar CC,Cristofano AD,et al.Activation of AKT kinasesincancer:implicationsfortherapeutictargeting.Adv Cancer Res,2005,94:29-86.
[29]Iyer SC,Gopal A,Halagowder D.Myricetin induces apoptosis by inhibiting P21 activated kinase 1(PAK1)signaling cascade in hepatocellular carcinoma.Mol Cell Biochem,2015,407(1-2): 223-237.
[30]Li YY,Li J,Chen L.Axl as a downstream effector of TGF-β1 via PI3K/Akt-PAK1 signaling pathway promotes tumor invasion and chemoresistance in breast carcinoma.Tumour Biol,2014,35(4):3809-3817.
[31]Huynh N,Kevin HL,Baldwin GS,et al.P21-activated kinase 1 stimulates colon cancer cell growth and migration/invasion via ERK-andAKT-dependent pathways.Biochim Biophys Acta,2010,1803:1106-1113.
[32]Balmanno K,Chell SD,Gillings AS,et al.Intrinsic resistance to the MEK1/2 inhibitorAZD6244(ARRY-142886)is associated with weak ERK1/2 signalling and/or strong PI3K signalling incolorectalcancercelllines.IntJCancer,2009,125: 2332-2341.
(收稿:2016-09-10)
(本文编辑:陈从新)
Expression of PI3K-Akt-PAK1 pathway in the process of metastasis of hepatocellular carcinoma
Zhang Lei,Wang Lin,Geng Zhimin,et al.Department of Elderly Surgery,First Affiliated Hospital,Jiaotong University,Xi'an 710061,Shaanxi Province
ObjectiveBased on relevant database data,we tried to explore the importance of PI3K/Akt/ PAK1 signaling pathway to HCC metastasis and provide an effective molecular marker for the prevention of HCC. MethodsFrom GES364 data sets of GEO in the NCBI database,we searched the materials about the PI3K/Akt/ PAK1 expression in intrahepatic spread(IHS),entrahepatic metastasis(EHM),non-metastasis(NM)and normal livers(N).ResultsThe expression of PAK1 and MMP-9 were up-regulated in IHS and EHM group(P<0.0001)as compared with those in normal liver and NM group;the expression of AKT(1/2)and Girdin were upregulated in the IHS,EHM and NM group(P<0.05)as compared with in normal liver;in the EHM group,the expression of AKT2 was positively correlated to PAKI(r=0.5679,P=0.0013).ConclusionsThe up-regulation of PAK1 and MMP-9 could promote the spread and metastasis of HCC cells,the increased expression and activities of AKT are crucial for metastasis of liver cancer,and the PI3K/AKT/PAK1 signaling pathway is closely related to the development and metastasis in patients with HCC.
Hepatocellular carcinoma;Metastasis;PAK1;AKT
10.3969/j.issn.1672-5069.2017.03.013
710061西安市西安交通大学第一附属医院老年外科
张雷,男,43岁,医学博士,副主任医师。主要从事胆道和肝脏外科疾病诊治研究。E-mail:zhanglei723d@126.com

