超声引导下经皮射频消融与激光消融治疗微小肝癌患者疗效初步比较研究
余红星,陈颖,刘自鹏,张丽
超声引导下经皮射频消融与激光消融治疗微小肝癌患者疗效初步比较研究
余红星,陈颖,刘自鹏,张丽
目的比较超声引导下经皮激光消融(LA)与经皮射频消融(RFA)治疗微小肝癌患者的临床疗效。方法54例微小(<2 cm)肝癌患者被分为LA组和RFA组,每组27例。比较两组疗效、肿瘤局部控制(LC)和无进展生存时间(PFS)。结果LA组近期有效率(RR)为81.5%,与RFA组的77.8%比,差异无统计学意义(P>0.05);RFA组一年LC为77.8%,显著高于LA组的51.9%,差异有统计学意义(P<0.05);RFA组PFS为(12.5±6.6)个月,显著长于LA组的(8.7±5.1)个月,差异有统计学意义(P<0.05);两组术后局部疼痛、腹腔出血、胆道出血和腹腔感染等并发症发生率无显著性相差(P>0.05)。结论与LA治疗比,RFA可提高治疗微小HCC患者的肿瘤局部控制率,并延长患者的肿瘤无进展生存时间,具有一定的临床应用价值。
肝细胞癌;激光消融;射频消融;无进展生存时间
研究表明,HCC患者术后5年内的复发率约为77%~100%[1~3],即使诊断为微小HCC,术后5年复发率也可达40%~50%[4~6]。微创治疗HCC的方法主要包括传统的超声引导下经皮射频消融(radiofrequency ablation,RFA)和超声引导下经皮激光消融(laser ablation,LA)[7-9]。其中RFA因其基本不受患者心肺功能、肝功能状况的影响,同时不受肿瘤位置的限制,且创伤小、恢复时间短[10],而被广泛用于治疗微小(<2 cm)HCC,其临床疗效与手术相当[11]。LA主要是针对肝癌伴门静脉癌栓患者的治疗[12]以及对肝癌高危结节的消融[13]。本研究旨在研究比较超声引导下LA与RFA治疗微小HCC患者的疗效及安全性,以及对患者预后的影响。
1 资料与方法
1.1 病例选取回顾性分析2010年~2014年于我院接受放射治疗的89例微小肝癌患者,诊断标准参照文献[2]进行,所有患者在行影像学检查发现肝脏占位性病变后,行穿刺组织病理学检查,诊断为HCC。排除标准:既往有其他部位肿瘤病史。7例患者因资料不全被排除,3例患者因有胃癌病史、1例因有结肠癌病史被排除,最终有78例患者被纳入本研究。27例患者接受了超声引导下LA术,从另51例接受了传统超声引导下经皮RFA治疗的患者中,选取27例患者作为对照,两组年龄、性别、肿瘤所在部位和肿瘤分期均无明显统计学差异(P>0.05),具有可比性(表1)。
1.2 治疗方法治疗前1周,进行常规超声检查,主要观察微小HCC病灶的位置、大小、范围、内部回声及血流信息。使用意大利百胜Mylab Twice彩色超声诊断仪,配端进式穿刺导向器和百胜ECHO LASER集成激光治疗仪,激光介质为砷化镓铝,光纤直径400 μm,探头频率为6~18 MHz,18 G套管穿刺针。先使用彩色多普勒超声仪定位肝癌病灶。患者取平卧位,硬膜外麻醉或局部麻醉,常规消毒铺巾,暴露肝区。使用一次性无菌袖套包扎穿刺探头,在超声引导下寻找合适的进针位置。确定穿刺点后,采用2%利多卡因局部麻醉,在超声引导下使用18G PTC穿刺针经皮刺入肝癌组织,将激光光纤插入引导套管针内,送光纤头端至肝癌组织深部。开启激光仪进行脉冲激光照射,将激光功率设置为30 w,模式设置为连续波,脉冲间隔时间为0.3~0.4 s,频率为1 Hz。开启后逐渐向体表退出穿刺针和光纤,直至完成整块占位的消融。在退出肝表面前于正常肝组织内停留,并以3 w功率激光光凝针道10~30 s,以止血。对有明显出血倾向者,在针道内注入纤维蛋白组织凝胶止血。术后,立刻进行超声造影检查,并与术前超声检查图像进行比较,评估消融区域是否覆盖并超过原病灶范围。消融满意后,停止治疗。术后1 w,行常规超声复查,同时行彩色多普勒超声检查,观察血管内血流情况。术后1 m,行常规超声及增强CT/MRI检查,评价激光治疗的疗效,以后1~3 m复查。
表1 两组基线临床资料(%,±s)比较

表1 两组基线临床资料(%,±s)比较
LA(n=27)RFA(n=27)x2值/t值P值年龄(岁)55.96±7.0655.33±7.210.3280.744男/女16(59.3)/11(40.7)16(59.3)/11(40.7)部位2.0090.366肝门部13(48.2)8(29.6)肝左叶9(33.3)13(48.2)肝右叶5(18.5)6(22.2)临床分期0.3510.839 IIa14(51.9)12(44.5)IIb9(33.3)11(40.7)IIIa4(14.8)4(14.8)
1.3 近期疗效评价依据WHO制定的实体瘤疗效评估标准,在治疗后4 w,依据影像学上肿瘤大小的变化评价近期疗效,分为:1.完全缓解(complete remission,CR):肿瘤在CT或MRI片上完全消失;2.部分缓解(partial response,PR):肿瘤较治疗前缩小>50%,但未消失;3.稳定(stable disease,SD):肿瘤较治疗前缩小<50%,或>25%;4.进展(progressive disease,PD):肿瘤较治疗前增大>25%以上。治疗总有效率(response rate,RR)为CR+PR。
1.4 远期疗效评价治疗后前6个月,每1个月随访一次,第6~12个月每2个月随访1次,第12月后每3个月随访1次,随访时间为11~57个月,中位随访时间为37个月。依据美国国立综合癌症网络(NCCN)制定的标准,至少3 m后复查CT或MRI,提示肿块无增大,或肿瘤有缩小并维持6 m以上者称为局部控制(local control,LC),无进展生存时间(progression free survival,PFS)是指患者从开始接受治疗到影像学检查发现肿瘤出现继发性生长的时间。
1.5 统计学分析应用SPSS 18.0软件对数据进行统计学处理与分析。计量资料以±s表示,采用t检验,计数资料用%表示,采用x2检验,采用Kaplan-Meier法进行生存分析,生存时间比较采用Log-rank检验。P<0.05表示差异有统计学意义。
2 结果
2.1 HCC患者腹部影像学表现在激光消融术前、术中和术后,典型HCC患者超声造影表现见图1、图2和图3。
2.2 两组患者并发症发生率比较两组近期并发症发生率无明显差异(P>0.05,表2)。
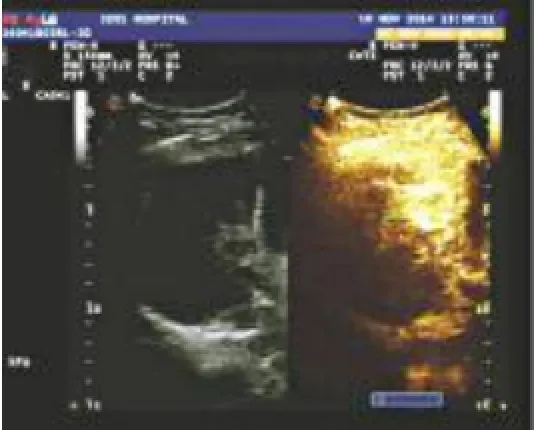
图1 HCC患者腹部超声造影表现激光消融术前,肝脏内混合型回声巨大包块,造影显示包块回声增强

图2 HCC患者腹部超声造影表现正在行激光消融术

图3 HCC患者腹部超声造影表现激光消融术后,腹部超声造影示包块较术前明显缩小
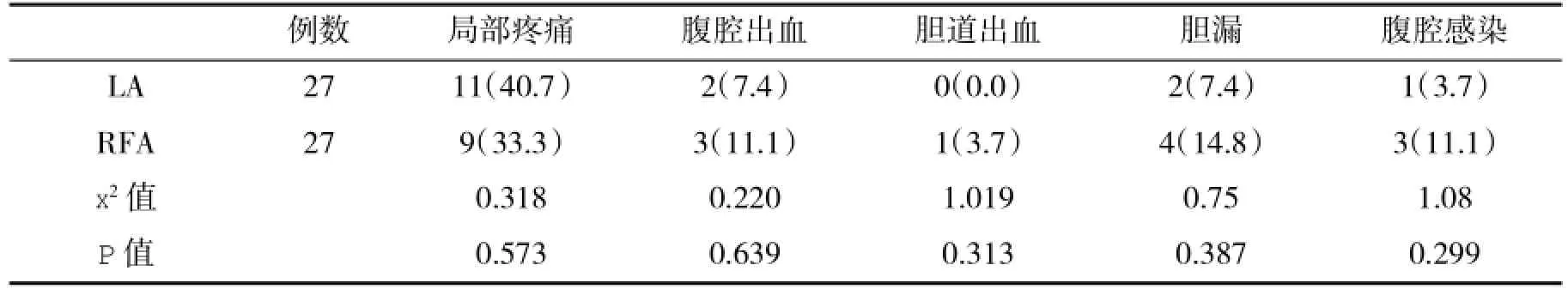
表2 两组接受消融治疗患者近期并发症(%)比较
2.3 两组近期疗效比较LA治疗组RR与RFA组比,差异无统计学意义(P>0.05);LA组CR、PR、 SD和PD与RFA组比,均无统计学差异(P>0.05,表3)。

表3 两组近期疗效(%)比较
2.4 远期疗效情况随访1年后,LA组患者LC为77.8%(21/27),显著高于RFA组的51.9%(14/27,x2=3.979,P<0.05);LA组肿瘤PFS为(12.52± 6.57)个月,显著长于RFA组的【(8.67±5.13)个月,P<0.05,图4】。

图4 两组肿瘤无进展生存时间比较
3 讨论
微小肝细胞癌属于肝癌比较早期的一种表现,瘤体较小,行根治性切除后复发率较低,预后较好[13]。对于微小肝细胞癌患者,接受微创治疗,由于创伤小,手术时间短,术后并发症少,因而疗效与接受开腹手术相近[14]。
当前,应用较多的两种微创治疗肝癌的方法是超声引导下RFA和LA[15]。RFA能杀死肿瘤细胞,其优点在于能避免周围正常肝脏组织的损伤[16]。LA是采用可弯曲的光导纤维或特殊设计的内部水冷光纤在影像设备的引导下插入肿瘤组织,组织吸收激光后通过热效应、压强效应、光化学效应和电磁效应,产生热量,使肿瘤组织变性、凝固、汽化,进而达到杀灭肿瘤的目的[17]。接受过微创治疗的患者,在手术后早期复查,若发现肿瘤残余或复发的小肝癌,可再次接受治疗[11],以巩固治疗效果。RFA在肝脏产生的消融灶通常为圆柱形,而大多数肝脏肿瘤为类球形,因此RFA消融并不能很好地覆盖整个瘤体,使得部分肿瘤组织逃避了攻击而得以残留。同时,过热的活动电极针可导致肿瘤周围组织发生快速炭化改变,可使得射频电流中断,影响治疗效果[11]。LA是近些年被应用于治疗肝细胞癌的另一种微创治疗手段。Vogl et al最早在影像学引导下经皮穿刺激光消融治疗发生于肝脏的肿瘤。该治疗创伤小,手术并发症少,可以根据影像学复查结果多次重复治疗。他们首先使用LA对肝癌高危结节进行消融,研究表明,通过LA治疗,可以准确而完整地消除高危结节,治疗相关的并发症如腹水、肝脓肿、出血等的几率非常小,许多患者可以接受门诊治疗[12]。LA也被应用于治疗位于肝脏的转移瘤,患者术后生存时间较姑息治疗的患者明显延长[18]。上海第二军医大学吴孟超及其团队在国内率先研究了LA对于肝癌伴门静脉癌栓患者的治疗结果,他们发现患者接受手术切除肝癌原发灶联合LA治疗门静脉癌栓,患者1 a、2 a、3 a生存率分别为55.5%、35.2%、20.3%,效果与接受肝癌原发灶合并门静脉癌栓联合切除的患者预后相当,但是患者术后并发症发生率及肿瘤复发率有所下降[12]。其他学者亦研究了LA治疗门静脉癌栓,并获得了不错的临床疗效[19]。
微小肝癌瘤体的直径较小,早期发现,使用微创治疗,疗效与接受手术治疗相近,且能显著降低术后并发症[17]。本研究比较了LA与RFA治疗微小肝细胞癌的效果,结果显示,与RFA治疗相比,LA可以显著提高微小肝细胞癌患者肿瘤局部控制率,并提高无肿瘤进展生存时间。与此同时,LA并没有增加治疗相关的副反应发生率。可能原因有:1)LA的电极除了具有电磁效应外,还有其他热效应、压强效应、光化学效应,从而大大加强了对肿瘤瘤体的杀伤效果,在相同的时间内,LA的治疗效果要优于RFA;2)患者接受LA治疗时的脉冲频率和强度可以根据治疗中的影像学反馈进行调整,可控性较RFA更强;3)LA对瘤体周围正常肝脏组织的血供影响较RFA小,因而可降低腹腔出血等副反应的发生,减少对患者肝功能的影响。下一步,我们将纳入更多病例,不仅包括微小肝细胞癌,还将包括大直径的肝细胞癌,并更加深入分析比较两种治疗方法对于患者肿瘤复发、总生存时间的差别,进一步深入探讨超声引导下经皮LA治疗肝癌的临床价值。
综上所述,超声引导下经皮LA比RFA更具有一定的治疗优势,可改善微小肝细胞癌患者肿瘤局部控制率,提高无肿瘤进展生存时间,具有一定的临床应用价值。
[1]Torre LA,Bray F,Siegel RL,et al.Global cancerstatistics,2012. CA Cancer J Clin,2015,65(2):87-108.
[2]BensonAB,AbramsTA,Ben-JosefE,etal.NCCNclinical practiceguidelinesinoncology:hepatobiliarycancers.JNatl Compr Canc Netw,2009,7(4):350-391.
[3]荚卫东.精准肝脏外科时代肝癌多学科治疗.实用肝脏病杂志,2015,18(2):120-123.
[4]Kinoshita A,Onoda H,Fushiya N,et al.Staging systems for hepatocellular carcinoma:Current status and future perspectives. World J Hepatol,2015,7(3):406-424.
[5]Lim C,Vibert E,Azoulay D,et al.Indocyanine green fluorescence imaging in the surgical management of liver cancers: current facts and future implications.J Visc Surg,2014,151(2):117-124.
[6]Rahbari NN,Mehrabi A,Mollberg NM,et al.Hepatocellular carcinoma:current management and perspectives for the future.Ann Surg,2011,253:453-469.
[7]吴秀栓,李建生,许戈良,等.超声造影在肝细胞癌诊断及治疗中的应用进展.实用肝脏病杂志,2011,14(2):158-160.
[8]Selvaraj RJ,Sarin K,Singh VR,et al.Radiofrequency ablation of posteroseptal accessory pathways associated with coronary sinus diverticula.J Interv Card Electrophysiol,2016,47(2):253-259.
[9]Di Costanzo GG,D'Adamo G,Tortora R,et al.A novel needle guide system to perform percutaneous laser ablation of liver tumors using the multifiber technique.Acta Radiol,2013,54(8):876-881.
[10]任炜,杨薇.射频消融治疗复发性肝癌疗效及预后因素分析.介入放射学杂志,2015,24(10):923-927.
[11]杨薇.影像引导射频消融治疗较大肝癌的现状及前景.世界华人消化杂志,2015,23(30):4771-4777.
[12]Eichler K,Zangos S,Gruber-Rouh T,et al.MR-guided laser-induced thermotherapy(LITT)in patients with liver metastases of unveal melanoma.J Eur Acad Dermatol Venereol,2014,28(12): 1756-1760.
[13]喻昊,俞花,李晓欢,等.小肝细胞癌术后早期复发的危险因素分析.实用肝脏病杂志,2016,19(3):358-360.
[14]Kudo M.Recent trends in the management of hepatocellular carcinoma with special emphasis on treatment with regorafenib andimmunecheckpointinhibitors.DigDis,2016,34(6): 714-730.
[15]杨家进,吴建兵.原发性肝癌综合介入治疗进展.实用肝脏病杂志,2015,18(2):118-119.
[16]李金瑞,钟鑫平.射频消融联合DC-CIK治疗中晚期肝细胞癌的疗效评价.检验医学与临床,2015,12(19):2830-2833.
[17]黄真辉,聂生东.经皮激光消融技术应用研究进展.生物医学工程学进展,2014,35(4):228-232.
[18]Lehmann KS,Frericks BB,Holmer C,et al.In vivo validation of a therapy planning system for laser-induced thermotherapy(LITT)of liver malignancies.Int J Colorectal Dis,2011,26(6): 799-808.
[19]朱东升,吴志华,彭国林,等.超声引导下经皮穿刺治疗门静脉癌栓的疗效探讨.临床超声医学杂志,2015,17(7):488-490.
(收稿:2016-11-07)
(本文编辑:陈从新)
Comparisonofultrasound-guidedpercutaneouslaserablationandradiofrequencyablationforthe treatment of patients with small hepatocellular carcinoma
Yu Hongxing Chen Ying Liu Zipeng,et al. Department of Ultrasound,Central Hospital,Hanzhong 723000,Shaanxi Province
ObjectiveTo compare the efficacies of ultrasound-guided percutaneous laser ablation(LA)and radiofrequency ablation(RFA)for the treatment of patients with small hepatocellular carcinoma(HCC).Methods We retrospectively analyzed the data of 54 patients with small HCC admitted to our department between 2010 and 2014.The patients with HCC were randomly divided into LA(n=27)and RFA group(n=27).The response rates(RR),local control(LC)rates and progression free survival(PFS)between the two groups were compared. ResultsThe RR in LA group was 81.5%,not statistically significantly different compared with 77.8%(P>0.05)in the RFA group;The LC at the end of one year in RFA group was 77.8%,significantly higher than 51.9%in LA group(P<0.05);The PFS in RFA group was(12.5±6.6)months,significantly longer than(8.7±5.1)months in LA group(P<0.05);There was no significant difference as respect to the incidence of postoperative complications(P> 0.05).ConclusionsRFA can improve LC,and prolong PFS in patients with small HCC,which warrants further clinical application.
Hepatoma;Laser ablation;Radiofrequency ablation;Progression free survival
10.3969/j.issn.1672-5069.2017.03.016
723000陕西省汉中市中心医院超声诊断科
余红星:男,41岁,大学本科,主治医师。主要从事超声影像学诊断及治疗学研究。E-mail:yuhongxing1975@163.com

