胰高血糖素样多肽- 1在2型糖尿病治疗中的新进展
许晓娜,乔虹
(哈尔滨医科大学第二附属医院 内分泌代谢病科五病区,黑龙江 哈尔滨 150086)
·综 述·
胰高血糖素样多肽- 1在2型糖尿病治疗中的新进展
许晓娜,乔虹
(哈尔滨医科大学第二附属医院 内分泌代谢病科五病区,黑龙江 哈尔滨 150086)
胰高血糖素样多肽(GLP- 1)是由进食刺激肠道L细胞分泌的肠促胰素,通过与GLP- 1R结合发挥胰腺内和胰腺外两方面的功能。在人体,GLP- 1R广泛分布在肠道、中枢神经系统、肺脏、肾脏、垂体、心脏及血管内皮等部位。越来越多的研究发现,GLP- 1除了有促胰岛素分泌、抑制胰高血糖素分泌、促进胰岛β细胞增生且抑制其凋亡等胰腺内作用外,还表现出许多令人欣喜的胰腺外功能,如:抑制胃排空、增加饱腹感、增加外周组织对胰岛素的敏感性及心血管、神经系统等保护作用。基于GLP- 1独特的胰腺内和胰腺外生理功能,在2型糖尿病(T2DM)的病理生理中GLP- 1成为重要的阻止疾病进展的保护性因素。近年来研究者一直试图拓展以GLP- 1为靶点的治疗策略在T2DM中的应用。因此,作者对GLP- 1在T2DM病理生理中的作用、相关分子作用机制的研究新进展以及GLP- 1在T2DM治疗方面的新突破进行综述。
胰高血糖素样多肽- 1; 2型糖尿病; 胰岛素抵抗; L细胞; 肠促胰素;综述
我国糖尿病患病率呈迅速增加趋势,最新调查结果显示,截止到2010年中国成年人患病率达到11.6%,患病人数居于世界首位。由于糖尿病不可彻底治愈,所以糖尿病患者的生命质量严重下降[1]。胰岛素抵抗和胰岛β细胞分泌胰岛素功能缺陷是2型糖尿病(type 2 diabetes mellitus,T2DM)公认的两大发病机制,而前者贯穿于T2DM的始终,后者随着疾病的进展逐渐加重。多年来,各种降糖药物和胰岛素制剂即使能将血糖控制良好,也不能阻止胰岛β细胞的衰竭和T2DM相关并发症的进展。但是,以胰高血糖素样多肽- 1 (glucagon like peptide- 1,GLP- 1)为基础的新型降糖药物,在改善血糖代谢的同时亦能改善胰岛素抵抗,抑制胰岛β细胞凋亡,此外,还表现出许多令人欣喜的胰腺外功能,抑制胃排空、增加饱腹感、增加外周组织对胰岛素的敏感性及心血管、神经系统等保护作用。基于GLP- 1独特的胰腺内和胰腺外功能,以GLP- 1为靶点的新型治疗策略一直是近年的研究热点。因此,作者对GLP- 1在T2DM病理生理中的作用、相关分子作用机制的研究新进展以及GLP- 1在T2DM治疗方面的新突破进行综述如下。
1 GLP- 1的概述
1926年,Zunz和LaBarre首次提出“肠促胰素”的概念,并大胆猜想肠促胰素可用于治疗T2DM。GLP- 1主要由肠道L细胞分泌,有研究发现胰岛α细胞也可分泌少量的GLP- 1。在人体,L细胞的密度从近端肠道到远端肠道逐渐增加,在回肠下端和结肠中密度最高。研究发现餐后GLP- 1的分泌呈双相性,早相大约在餐后30 min出现,与进食后肠道迷走神经通路激活有关;第2相中GLP- 1的分泌峰值延长,在餐后60~120 min,与未完全消化的食物对下段肠道中L细胞的直接刺激有关[2]。
研究证明,GLP- 1必须与GLP- 1受体(GLP- 1R)结合才能发挥生理作用。在人体,GLP- 1R广泛分布在肠道、中枢神经系统、肺脏、肾脏和心脏等部位。因此,越来越多研究发现,GLP- 1除了有促胰岛素分泌、抑制胰高血糖素分泌、促进胰岛β细胞增生且抑制其凋亡等胰腺内作用外,还表现出许多令人欣喜的胰腺外功能[3]。见表1。
表1 GLP- 1的胰腺外功能
Tab 1 The extrapancreatic functions of GLP- 1
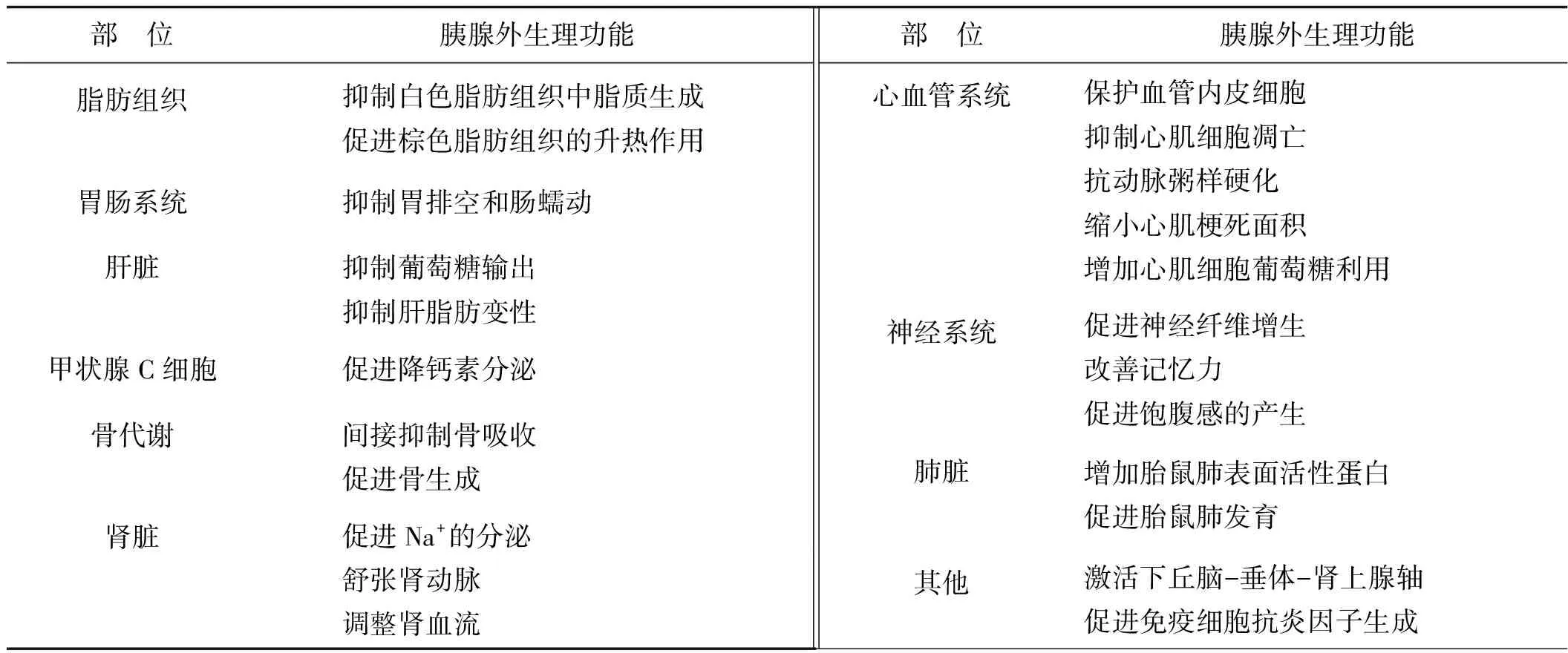
部 位胰腺外生理功能部 位胰腺外生理功能脂肪组织抑制白色脂肪组织中脂质生成促进棕色脂肪组织的升热作用胃肠系统抑制胃排空和肠蠕动肝脏抑制葡萄糖输出抑制肝脂肪变性甲状腺C细胞促进降钙素分泌骨代谢间接抑制骨吸收促进骨生成肾脏促进Na+的分泌舒张肾动脉调整肾血流心血管系统保护血管内皮细胞抑制心肌细胞凋亡抗动脉粥样硬化缩小心肌梗死面积增加心肌细胞葡萄糖利用神经系统促进神经纤维增生改善记忆力促进饱腹感的产生肺脏增加胎鼠肺表面活性蛋白促进胎鼠肺发育其他激活下丘脑-垂体-肾上腺轴促进免疫细胞抗炎因子生成
2 GLP- 1是阻止T2DM进展的保护性因素
数十年来,关于T2DM患者GLP- 1分泌情况说法不一。最新Meta分析显示:T2DM患者在口服葡萄糖或者进餐之后,与非T2DM患者相比并没有表现出明显的GLP- 1分泌减少。T2DM患者的GLP- 1功能,与健康个体相比相对保持不变。但是,高HbA1c水平与GLP- 1的分泌呈负相关[4]。有趣的是,除此之外GLP- 1的分泌在T2DM的进展中似乎发生了“代偿性的变化”。龋齿动物和人体实验证明,IL- 6可通过促进L细胞和胰岛α细胞分泌GLP- 1,增加胰岛素分泌;而且,T2DM患者胰岛α细胞分泌的GLP- 1要比健康人多[5]。这说明,随着T2DM的进展,胰高血糖素原的加工处理过程发生了朝向GLP- 1的动态转变,以“援救”衰弱的胰岛β细胞功能。GLP- 1也可以通过旁分泌的方式刺激小肠绒毛的迷走传入神经,将肠道信息传至下丘脑和延髓的饱食中枢,通过调节进食和胃排空间接调节血糖代谢[6]。
临床研究证明,以GLP- 1为基础的治疗在减轻体重和控制血糖方面疗效显著。这与GLP- 1在T2DM病理生理中独特的胰腺内和胰腺外功能密切相关,如图1所示,GLP- 1在T2DM的发生发展中是非常重要的阻止疾病进展的因素。

图1 GLP- 1在T2DM病理生理中的作用
Fig 1 The role of GLP- 1 in the pathophysiology of T2DM
3 GLP- 1阻止T2DM进展的分子机制
正常情况下,GLP- 1通过与胰腺β细胞上的GLP- 1R结合提高细胞内cAMP和PKA的水平,促进胰岛素的分泌。近来研究发现,GLP- 1可以通过多种方式阻止T2DM进展。(1) GLP- 1可修复葡萄糖依赖性胰岛素分泌(GSIS)信号系统:对于T2DM,胰腺β细胞长期暴露于高糖环境,胞内应力纤维的含量增加,能抵抗葡萄糖诱导的肌动蛋白的重构,而肌动蛋白的重构对GSIS信号系统来说非常重要。GLP- 1可以修复糖毒性导致的肌动蛋白骨架的改变,通过PKA依赖的方式抑制RhoA- ROCK信号途径,将糖毒性诱导的应力纤维拆解,修复GSIS信号系统[7]。(2) GLP- 1抑制胰高血糖素的分泌:研究认为,这种作用与胰腺β细胞功能状态无关,可能是通过生长抑素依赖的方式间接地抑制胰腺α细胞分泌胰高血糖素[8]。(3) GLP- 1促进胰岛β细胞增殖:TCF7L2是通过Wnt/连环蛋白b途径激活的转录因子,在胰腺β细胞的生理功能中起关键作用。TCF7L2基因变异与胰腺β细胞功能衰竭和T2DM发病明显相关。有研究发现,GLP- 1类似物可以通过cAMP/PKA敏感性机制抑制AKT和ERK1/2,提高连环蛋白b的磷酸化和稳定性,激活胰岛β细胞内的Wnt/连环蛋白b信号途径,促进转录因子TCF7L2的生成,改善胰腺β细胞功能;同时,通过提高连环蛋白b/TCF7L2介导的周期蛋白D1mRNA的转录促进β细胞的增殖[9]。(4) GLP- 1抑制胰岛β细胞凋亡:关于GLP- 1抑制胰腺β细胞凋亡的机制仍不完全清楚;近来发现,内质网中Ca2+耗竭引起的内质网氧化应激反应是胰腺β细胞凋亡的机制之一,Kim等[10]曾证明,艾塞那肽可以通过调节内质网的氧化应激反应修复肌浆网中的钙泵,补充内质网中过度消耗的Ca2+,阻止磺脲类药物诱导的胰腺β细胞的凋亡。(5) GLP- 1改善胰岛素抵抗:在胰岛素抵抗状态下GLP- 1可以通过一系列间接机制,如改变能量利用率,减少肝内脂质合成或依赖完整的副交感神经系统阻止果糖诱导的脂质代谢紊乱,抑制肝内VLDL的过度生成等,在一定程度上改善胰岛素抵抗[11]。总之,进一步探索GLP- 1阻止T2DM进展的分子机制,可以发现更多以GLP- 1为基础的治疗T2DM的新靶点。
4 以GLP- 1为基础的降糖药物研究进展
由于GLP- 1极不稳定,在体内易被二肽基肽酶Ⅳ(DPPⅣ)降解,半衰期不足2 min。因此,外源性的GLP- 1无法直接制作成药物用于糖尿病的治疗。针对体内GLP- 1 迅速被DPPⅣ降解的问题,研制可耐受DPPⅣ的GLP- 1类似物及DPPⅣ抑制剂是主要的解决办法。
4.1 GLP- 1受体激动剂
Exendin- 4是从美洲希拉毒蜥的唾液中提取的,是GLP- 1的天然类似物,与其有着相似的作用,其氨基酸序列中8甘氨酸(8Gly)位点不是DPPⅣ酶的降解位点,并且其氨基酸序列中C末端多出GLP- 1所没有的9个残基(PSSGAPPPS),不易被肽链内切酶降解。目前以GLP- 1及其天然类似物Exendin- 4为基础研发的长效GLP- 1受体激动剂,已成为新型糖尿病治疗药物的研究热点。2005年首个获准上市的GLP- 1受体激动剂艾塞那肽(Exenatide, ByettaR)就是人工化学合成的Exendin- 4。目前常用的短效制剂有艾塞那肽、利司那肽(lixisenatide),长效制剂有利拉鲁肽、艾塞那肽周制剂、阿必鲁肽(albiglutide)和度拉糖肽(dulaglutide)等等。
此外,国内外各大制药公司正在试图用各种方法研制新型GLP- 1受体激动剂,例如:(1)通过基因工程手段对GLP- 1或Exendin- 4的氨基酸序列进行改造,以得到稳定性较高的长效GLP- 1受体激动剂;(2)对GLP- 1或Exendin- 4结构进行糖基化、酰化、聚乙二醇等化学修饰,来保持或增强其生物活性;(3)使用载体蛋白如人血清白蛋白、免疫球蛋白(主要是IgG)的Fc片段及转铁蛋白(transferrin, Tf)等构建GLP- 1及其类似物Exendin- 4融合蛋白,以延长GLP- 1受体激动剂的半衰期[12]。
4.2 DPPⅣ抑制剂
DPPⅣ抑制剂具有与DPPⅣ的天然底物GLP- 1相似的结构,因而可竞争性地与DPPⅣ的活性部位结合,防止GLP- 1被DPPⅣ水解,减少GLP- 1的降解,增加GLP- 1的血液浓度,从而改善血糖控制。目前DPPⅣ抑制剂在我国上市的主要药物有西格列汀、维格列汀、沙格列汀、阿格列汀和利格列汀,此几种药物服药时间与进食无关,维格列汀需每天2次给药,余者均为每天给药1次。不同DPPⅣ抑制剂之间在半衰期、达峰时间、口服生物利用度及蛋白结合率等方面存在一定差异。DPPⅣ抑制剂针对α、β细胞进行双向调节,单用或与其他降糖药物联用均显示出良好的降糖效果,且耐受性和安全性较好[13]。
5 以GLP- 1为基础的研究在T2DM治疗中的新突破
近来研究发现,多种新型的基于GLP- 1的治疗策略,如增加对远端肠道L细胞的刺激、提高GLP- 1的分泌水平和作用效应等均表现出明显的抗T2DM的效果。比如,Ma等[14]曾尝试将特制的含少量营养物质的肠溶丸直接送至小鼠的远端回肠和结肠,结果发现,通过增加对远端肠道L细胞的刺激提高GLP- 1的分泌,可以改善T2DM小鼠的血糖代谢和胰岛素抵抗。随后,Chambers等[15]的研究得出相似的结论——即通过特制的菊糖丙酸盐酯/短链脂肪酸复合物将丙酸盐特定地输送至人体结肠,可以刺激L细胞分泌更多的GLP- 1。早先研究认为,12α羟化酶胆汁酸可以促进脂质吸收,加重胰岛素抵抗[16];而近来研究发现,12α羟化酶胆汁酸基因Cyp8b1缺失的小鼠,其上段肠道对脂质的吸收受抑制,到达远端回结肠的游离脂肪酸增多,对L细胞的刺激增加,GLP- 1的分泌水平同样升高[17]。此外,有研究者通过特制的GLP- 1/雌激素结合物,将雌激素特异性地送至表达GLP- 1R的细胞,结果发现雌激素可增强GLP- 1对胰岛β细胞的保护作用[18]。而Irwin等[19]发现,对高脂饮食喂养的小鼠来说,缩胆囊素(cholecystokinin,CCK)/GLP- 1复合物与单独的CCK类似物和GLP- 1类似物相比,表现出更强的促胰岛素分泌、降低血糖、增加饱腹感的作用。可见,这类激素复合制剂很有可能成为将来T2DM治疗的新方向。另外,小鼠实验发现,葡萄籽提取物原花青素可以增加血浆中活性GLP- 1的水平,改善小鼠的糖代谢[20]。综上所述,基于GLP- 1在T2DM病理生理中的独特的胰腺内和胰腺外功能,未来以GLP- 1为基础的治疗方法会越来越丰富。
6 结 语
GLP- 1是机体重要的肠促胰素之一,发挥着独特的胰腺内和胰腺外功能,是非常重要的抵制T2DM进展的保护性因素。研究GLP- 1在T2DM中的病理生理作用及相关分子机制,将有助于发现更多的以GLP- 1为基础的治疗靶点。此外,基于GLP- 1多样的胰腺外功能,相信以GLP- 1为基础的研究成果不仅可以丰富T2DM的治疗,而且在T2DM合并心血管、肾脏及神经系统等疾病的治疗中也会有令人欣喜的突破。
[1] 谢琨,吴晶.中国糖尿病患者生命质量的荟萃分析[J].现代医学,2014,42(12):1462- 1468.
[2] CAMPBELL J E,DRUCKER D J.Pharmacology physiology and mechanisms of incretin hormone action[J].Cell Metab,2013,17:819- 837.
[3] MATHER K.Extrapancreatic effects of GLP- 1 and other incretins[J].Rev Endocr Metab Disord,2014,15(3):169.
[4] CALANNA S,CHRISTENSEN M,HOLST J J,et al.Secretion of glucagon- like peptide- 1 in patients with type 2 diabetes mellitus:systematic review and meta- analyses of clinical studies[J].Diabetologia,2013,56(5):965- 972.
[5] ELLINGSGAARD,H,HAUSELMANN,I,SCHULER B,et al.Interleukin- 6 enhances insulin secretion by increasing glucagon- like peptide- 1 secretion from L cells and alpha cells[J].Nat Med,2011,17(11):1481- 1489.
[6] HAYES M R,KANOSKI S E,de JONGHE B C.The common hepatic branch of the vagus is not required to mediate the glycemic and food intake suppressive effects of glucagon- like- peptide- 1[J].Am J Physiol Regul Integr Comp Physiol,2011,301(5):R1479- 1485.
[7] KONG X,YAN D,SUN J,et al.Glucagon- like peptide 1 stimulates insulin secretion via inhibiting RhoA/ROCK signaling and disassembling glucotoxicity- induced stress fibers[J].Endocrinology,2014,155(12):4676- 4685.
[8] de HEER J,RASMUSSEN C,COY D H,et al.Glucagon- like peptide- 1,but not glucose- dependent insulinotropic peptide,inhibits glucagon secretion via somatostatin (receptor subtype 2) in the perfused rat pancreas[J].Diabetologia,2008,51(12):2263- 2270.
[9] LIU Z,HABENER J F.Stromal cell- derived factor- 1 promotes survival of pancreatic beta cells by the stabilisation of beta- catenin and activation of transcription factor 7- like 2 (TCF7L2)[J].Diabetologia,2009,52(8):1589- 1598.
[10] KIM J Y,LIM D M,PARK H S,et al.Exendin- 4 protects against sulfonylurea- induced β- cell apoptosis[J].J Pharmacol Sci,2012,118(1):65- 74.
[11] TAHER J,BAKER C L,CUIZON C.GLP- 1 receptor agonism ameliorates hepatic VLDL overproduction and de novo lipogenesis in insulin resistance[J].Mol Metab,2014,3(9):823- 833.
[12] BIHAN H,NG W L,MAGLIANO D J,et al.Predictors of efficacy of GLP- 1 agonists and DPP- 4 inhibitors:a systematic review[J].Diabetes Res Clin Pract,2016,121:27- 34.
[13] BAPTISTA A,TEIXEIRA I,ROMANO S,et al.The place of Dpp- 4 inhibitors in the treatment algorithm of diabetes type 2:a systematic review of cost- effectiveness studies[J].Value Health,2014,17(7):A347- 348.
[14] MA J,CHECKLIN H L,WISHART J M,et al.A randomised trial of enteric- coated nutrient pellets to stimulate gastrointestinal peptide release and lower glycaemia in type 2 diabetes[J].Diabetologia,2013,56(6):1236- 1242.
[15] CHAMBERS E S,VIARDOT A,PSICHAS A,et al.Effects of targeted delivery of propionate to the human colon on appetite regulation,body weight maintenance and adiposity in overweight adults[J].Gut,2015,64(11):1744- 1754.
[16] HAEUSLER R A,ASTIARRAGA B,CAMASTRA S,et al.Human insulin resistance is associated with increased plasma levels of 12α- hydroxylated bile acids[J].Diabetes,2013,62(12):4184- 4191.
[17] KAUR A,PATANKAR J V,de HAAN W,et al.Loss of Cyp8b1 improves glucose homeostasis by increasing GLP- 1[J].Diabetes,2015,64(4):1168- 1179.
[18] SCHWENK R W,BAUMEIER C,FINAN B,et al.GLP- 1- oestrogen attenuates hyperphagia and protects from beta cell failure in diabetes- prone New Zealand obese (NZO) mice[J].Diabetologia,2015,58(3):604- 614.
[19] IRWIN N,PATHAK V,FLATT P R.A novel CCK- 8/GLP- 1 hybrid peptide exhibiting prominent insulinotropic,glucose- lowering and satietyactions with significant therapeutic potential in high- fat fed mice[J].Diabetes,2015,64(8):2996- 3009.
[20] GONZLEZ- ABUíN N,MARTNEZ- MICAELO N,MARGALEF M,et al.A grape seed extract increases active glucagon- like peptide- 1 levels after an oral glucose load in rats[J].Food Funct,2014,5(9):2357- 2364.
(本文编辑:周兰波)
2016- 08- 22
2016- 12- 05
国家自然科学基金资助项目(81172742、81473053);黑龙江省自然科学基金重点项目(ZD201220)
许晓娜(1989-),女,河南郑州人,在读硕士研究生。E- mail:18845077275@163.com
乔虹 E- mail:qiaoh0823@sina.com
许晓娜,乔虹.胰高血糖素样多肽- 1在2型糖尿病治疗中的新进展[J].东南大学学报:医学版,2017,36(2):270- 274.
R587.1
A
1671- 6264(2017)02- 0270- 05
10.3969/j.issn.1671- 6264.2017.02.028

