scFv-RBP4融合蛋白的构建
李红侠,刘崇东,曹广明,娄 彤,张震宇*
(1.民航总医院 妇产科,北京100123;2.首都医科大学附属北京朝阳医院 妇产科,北京100020)
scFv-RBP4融合蛋白的构建
李红侠1,刘崇东2,曹广明2,娄 彤2,张震宇2*
(1.民航总医院 妇产科,北京100123;2.首都医科大学附属北京朝阳医院 妇产科,北京100020)
目的 构建scFv-RBP4融合蛋白。方法 采用德泰生物最新开发的密码子优化软件MaxCodonTM Optimization Program (V13)对提供的scFv- RBP4蛋白氨基酸序列进行优化,设计全长拼接引物,通过双酶切法将scFv- RBP4基因插入到表达载体proEM中,并通过酶切法和测序确认最终表达载体的准确性,最终转到DH5a克隆菌株中,通过质粒大抽试剂盒提取转染级质粒,之后将质粒通过转染试剂转染到哺乳动物细胞HEK293T中进行瞬时表达,再通过Ni-IDA亲和层析纯化scFv- RBP4蛋白。结果 酶切和测序结果显示,scFv-RBP4蛋白构建正确,目标蛋白纯度>90%。结论 构建的scFv-RBP4融合蛋白可以在HEK293T细胞内获得稳定表达,为后期融合蛋白的提取及功能研究打下基础。
RBP4;融合蛋白;scFv;HEK293T;构建
(ChinJLabDiagn,2017,21:1082)
子痫前期(preeclampsia,PE)是一种妊娠相关的疾病,通常因妊娠20周后出现高血压及蛋白尿等症状,占妊娠总数的3-8%[1]。临床上处理子痫前期主要是终止妊娠和对症处理,由于缺乏有效的预测手段和防治对策,使子痫前期成为孕产妇死亡的主要原因。其发病机制尚不十分明确,现在被广泛接受的假说是具有侵袭性的绒毛外滋养细胞侵袭母体子宫内膜及肌层,并重塑子宫螺旋动脉,最终提供有效稳定的胎盘血流,在胎盘形成过程中,发挥至关重要的作用。因此,如果绒毛外滋养细胞侵袭不足,诱发螺旋动脉重塑失败,最终可导致胎盘浅着床[2],引起子痫前期。人绒毛膜促性腺激素(human chorionic gonadotropin,hCG)是胎盘滋养细胞分泌的一种由α和β两个亚基组成的糖蛋白激素,它为胚胎的子宫内着床和维持妊娠所必需。视黄醇结合蛋白-4(retinol-binding protein 4,RBP4)最初被认为是肝脏和脂肪组织分泌的一种维生素A的特异性转运蛋白。近期大量研究提示其参与了肥胖和胰岛素抵抗的发生发展,因此被认为是一种新的脂肪因子[3,4]。本课题前期研究中,利用蛋白质组学方法发现子痫前期发病机制中RBP4含量较正常孕妇低并存在明显差异[5],并验证了血清及胎盘组织中RBP4含量低于正常组[6],因此提出RBP4在子痫前期发病机制中可能起作用的假设。融合蛋白是通过重组DNA技术将两个或多个不同蛋白结构域融为一个蛋白分子的一类蛋白的总称,融合蛋白技术的目的主要是使不同蛋白功能协同作用从而拥有更好的性能、实现新的功能[7]。本研究通过制备RBP4与抗HCG抗体融合蛋白,以抗HCG抗体为介导,使RBP4靶向聚集于胎盘组织,提高胎盘局部RBP4浓度,为子痫前期的治疗提供新的思路。
1 材料与方法
1.1 主要生化试剂和材料
表达载体proEM由系由德泰生物技术(南京)有限公司自主研发, 大肠杆菌Escherichia coli DH5a克隆菌株、HEK293T细胞来源于美国模式培养物集存库(ATCC);质粒提抽试剂盒、DNA回收试剂盒(天根生化科技有限公司);T4 DNA连接酶、Taq DNA聚合酶(宝生物工程大连有限公司);酵母提取物、蛋白胨(OXOID)。
1.2 方法
1.2.1 scFv-RBP4融合蛋白的构建 从NCBI上获得RBP4、anti-hCG scFv的序列,采用串联融合方式,与德泰生物技术(南京)有限公司合作,进行全基因合成,利用密码子优化软件对序列进行优化,合成模板DNA,通过双酶切法将RBP4/anti-hCG scFv基因插入到表达载体proEM中,并通过酶切法和测序确认最终表达载体的准确性。1.2.2 HEK293细胞的培养 转染前2天将HEK293T细胞悬浮培养至1L,接种密度为4-5*105cells/ml,置于培养箱中110 rpm,37℃,5% CO2培养。
1.2.3 转染级质粒抽提扩增 采用Qiagen的转染级质粒抽提试剂盒,提取表达质粒并用1%琼脂糖凝胶分析。
1.2.4 scFv- RBP4质粒转染HEK293T细胞
将抽提后的scFv- RBP4质粒通过转染试剂转染到1L的HEK293T细胞中,置于培养箱中110 rpm,37℃,5% CO2培养;转染当天使细胞密度控制在1.5-2.106cells/ml;将转染缓冲液、PEI等试剂提前放入培养箱或水浴锅37℃预热(10-20 min);DNA-PEI混合物(质量比1∶5),向转染缓冲液中加入DNA和PEI混匀,37℃,5%CO2培养;转染后约4-6天,取出细胞培养物,离心,收集上清和细胞。
1.2.5 scFv- RBP4蛋白纯化 取转染培养6天后的细胞培养液离心,上清用0.22 μm膜过滤,在4℃环境下透析至缓冲液(25 mM Tris,150 mM NaCl,pH8.0)中,透析结束后再用Ni-IDA柱纯化。经Ni-IDA亲和层析纯化,收集目标蛋白,并将其透析到1*PBS,10% Glycerol,pH7.4中,透析结束后用0.22 μm膜过滤,并分装冻于-80℃。
1.2.6 scFv- RBP4蛋白稳定性测试(冻融实验) 取一支分装后冻于-80℃的scFv- RBP4蛋白,放置于冰水混合物中待其缓慢融化,融化后无异常现象,说明scFv- RBP4蛋白冻融实验是正常的。
1.2.7 scFv- RBP4蛋白浓度测定 采用Bradford法测定蛋白浓度。用电子天平称量1.0 g BSA溶于去离子水中,配成100 ml的原液,然后根据表2-1配置得到一组浓度为1.0 mg/ml、0.8 mg/ml、0.6 mg/ml、0.4 mg/ml、0.2 mg/ml的BSA溶液。另外量取1 ml的PBS溶液(BSA溶液浓度为0 mg/ml)作对照试验。用移液枪分别移取50 μl配好的一组BSA溶液,滴加到96孔板中,另起一行加入同样体积待测蛋白,再分别加入200 μl的考马斯亮蓝(CBB)。静置10 min后,用酶标仪测得这组BSA溶液OD595 nm值。绘制标准曲线,计算蛋白浓度。
1.2.8 scFv- RBP4蛋白SDS-PAGE及WB检测
SDS-PAGE及Western Blot免疫印记检测scFv-RBP4蛋白表达 细胞贴壁长满瓶底后收集细胞,用细胞裂解液(RIPA)加蛋白酶抑制剂裂解细胞后提取总蛋白,采用BCA 法测定蛋白含量。稀释蛋白样品为3 μg,加入上样缓冲液后煮沸10 min 后离心,进行10 % SDS-PAGE 凝胶电泳。电泳后将凝胶放于一洁净的玻璃容器中加入5倍于凝胶体积的考马斯亮蓝,室温下孵育1 h,排干液体,摇动考马斯亮蓝G-250染液,使大颗粒胶体分散,加至凝胶内。室温下振摇温育过夜,用水清洗凝胶并观察脱色效果。电泳后电转至NC膜上,PBS封闭缓冲液封闭2 h 后滴加一抗scFv-RBP4(1∶1 000)。4 ℃孵育过夜,二抗孵育2 h,PBST 洗膜4次,每次5 min后,置于ECL化学发光试剂中反应1-3 min显影。ChemiDoc XRS 化学发光成像系统检测蛋白印记条带,Quantity One 图像分析软件进行分析。
2 结果
RBP4融合蛋白全长453个氨基酸,目标序列:VL+VH+RBP4scFv- RBP4 protein Length=453 MW=50242.7 Predicted I=6.581 DIVMSQSPSS LAVSVGEKVT MTCKSSQSLL YSSNQMNYLA WYQQKPGQSP KLLIYWASTR61 ESGVPDRFTG SGSGTDFTLT ISSVEAEDLA VYYCQQYHSY PFTFGSGTKL EIKRGGGGSG 121 GGGSGGGGSE VNLEESGGGL VQPGGSMKLS CVASGFTFSN YWMNWVRQSP EKGLEWVADI181 RLKSNNYATL YAESVKGRFT ISRDDSKSSV YLQMNNLRAE DTGIYYCTRG AYYRYDYAMD241 YWGQGTSVTV SSGGGGSGGG GSERDCRVSS FRVKENFDKA RFSGTWYAMA KKDPEGLFLQ 301 DNIVAEFSVD ETGQMSATAK GRVRLLNNWD VCADMVGTFT DTEDPAKFKM KYWGVASFLQ361 KGNDDHWIVD TDYDTYAVQY SCRLLNLDGT CADSYSFVFS RDPNGLPPEA QKIVRQRQEE421 LCLARQYRLI VHNGYCDGRS ERNLLHHHHH HHH
2.1 转染级质粒扩增抽提结果
表达质粒双酶切后用1%琼脂糖凝胶分析。电泳结果显示目的条带位置正确,见图1。
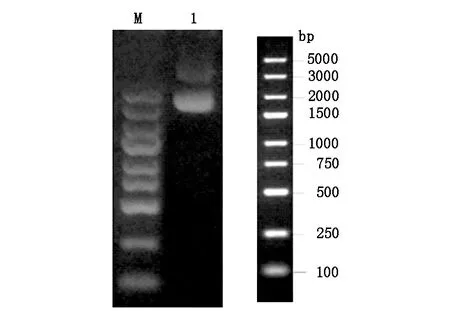
Lane M:DNA marker Lane 1:转染级质粒图1 琼脂糖凝胶分析scFv- RBP4抽提质粒
2.2 scFv- RBP4蛋白纯化结果
目标蛋白scFv- RBP4主要存在于洗脱组分Lane 5-7中,目的条带位于40-60 kD之间,分子量大约为50 kD,见图2。
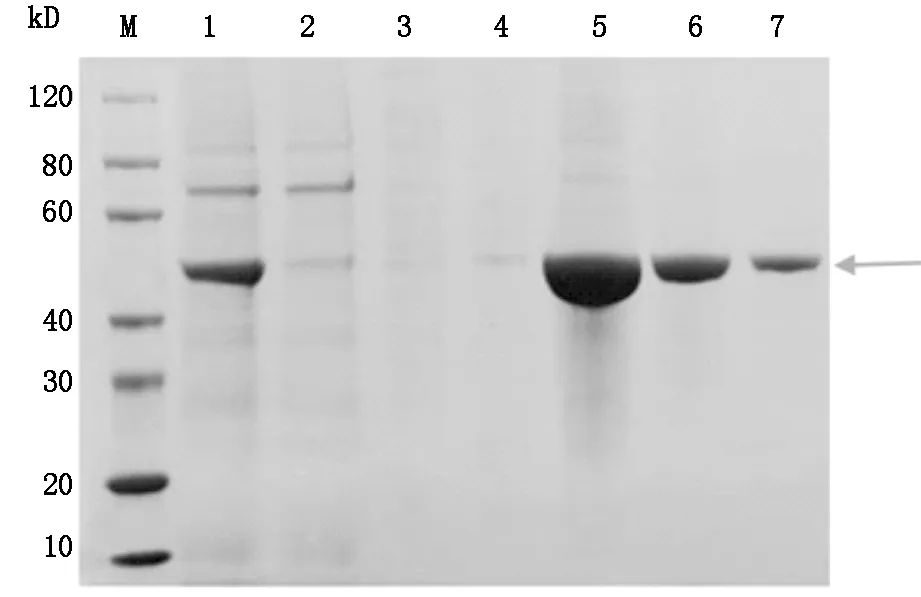
Lane M:SDS-PAGE Protein marker Lane 1:离心后上清 Lane 2:上清同Ni-IDA孵育后流出液 Lane 3-4:30 mM Imidazole洗脱组分 Lane 5-7:300 mM Imidazole洗脱组分
图2 SDS-PAGE 分析scFv- RBP4蛋白纯化
2.3 蛋白浓度测定 应用BSA做标准品,采用Bradford法测定蛋白浓度,最终浓度为1.04 mg/ml。蛋白纯度>90%,评估来源于R250染色的SDS-PAGE胶。
2.4 scFv-RBP4蛋白、SDS-PAGE及WB检测结果 SDS-PAGE蛋白测定:用考马斯亮监对SDS-PAGE胶进行染色,结果显示,纯化得到的scFv-RBP融合蛋白纯度高,分子量为40-60 kD之间。对scFv-RBP4融合蛋白进行Western Blot定性验证:一抗为兔抗人RBP4单抗(Abcam,1∶50);二抗为辣根过氧化物酶标记的山羊抗兔二抗(Abcam,1∶2000),曝光后的条带位于40-60 kD之间。
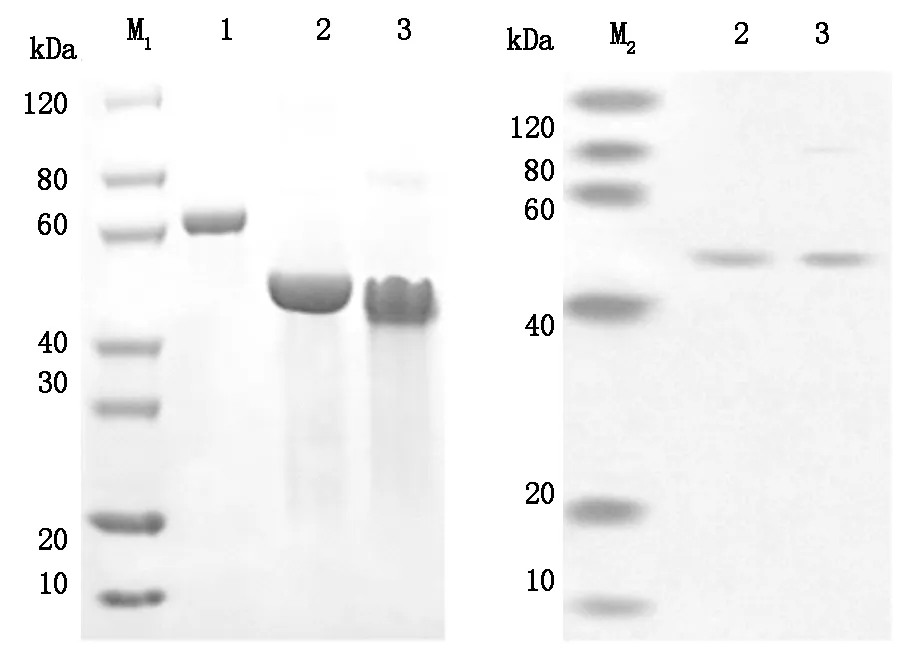
Lane 1:BSA (1.0 μg) Lane 2:scFv-RBP4 protein(3.0 μg) (Reduced) Lane 3:scFv-RBP4 protein(3.0 μg) (Non-Reduced) M1:SDS-PAGE Marker M2:Western Blot Marker Using Anti-His tag antibody
图3 SCFv-RBP4蛋白,SDS-PAGE及WB检测结果
3 讨论
正常妊娠过程中,在胎盘发育的早期阶段,绒毛外滋养细胞向母体蜕膜和子宫肌层侵袭迁移。部分绒毛外滋养细胞侵入母体子宫螺旋动脉内并替代血管壁中的内皮细胞,将高阻低容性的子宫螺旋动脉转化成为高容低阻性的子宫胎盘血管,完成子宫螺旋动脉重铸过程,使子宫螺旋动脉容受性增加,增加胎盘的血流灌注。有研究表明子痫前期患者绒毛外滋养细胞向母体蜕膜和子宫肌层的侵袭很浅,而且范围非常局限,几乎没有血管内绒毛滋养细胞的侵袭[8]。因此,滋养细胞侵袭能力下降是子痫前期发生的关键因素。
单链抗体(single chain fragment,scFv)是利用基因工程技术将免疫球蛋白的重链可变区和轻链可变区通过一段肽链连接成重组蛋白而得到的,具有完全抗原结合位点的微小抗体片段,其免疫原性较小,能在细菌中表达,易于基因操作和基因工程大量生产,并可用基因工程方法构建与其他效应分子链接的融合蛋白,因此,在疾病治疗方面有着广泛的应用前景。scFv对肿瘤组织的穿透力强,可以与其他效应分子连接成抗肿瘤融合蛋白,是保护抗体亲和性和特异性的最小功能性抗体片段[9]。
RBP4属于RBP家族,RBP是在体内负责结合并转运维生素A(ⅥtA)视黄醇类活性代谢物的一类蛋白质[10,11],RBP4分子质量21 000 ku[12],主要由肝细胞合成,其次为脂肪组织。RBP4广泛分布于人体血液、脑脊液、尿液及其他体液中[13]。以往,人们仅认识到,RBP4功能障碍会导致VitA储存、转运、分布及代谢异常,进而引发各种疾病,并影响上皮和骨组织的生长、分化、繁殖与胚胎发育。但在2005年美国哈佛大学医学院Yang等[14]利用基因芯片技术比较脂肪组织的基因表达谱,提出RBP4是一种新的脂肪因子,与糖代谢的调节及胰岛素抵抗有重要关系。
目前,scFv融合蛋白的最主要的临床应用是免疫导向。scFv减少了抗体的非特异性结合而更集中到达肿瘤等部位,因为被视为导向药物的理想载体,目前已经广泛应用于肿瘤细胞、血栓溶解等临床疾病的治疗中。对于RBP4在针对子痫前期发病机制,提高滋养细胞浸润能力,改善胎盘浅着床,进而有可能达到疾病治疗目地相关研究目前鲜有报道。本研究成功在体外人工构建RBP4和anti-HCG scFv融合蛋白,融合蛋白两个结构各自独立,RBP4功能不受anti-HCG scFv结构域影响,进而可以靶向作用于胎盘组织,提高胎盘局部的RBP4水平,增加滋养细胞的侵袭性。
融合蛋白技术尚未在产科领域体现其优势,因此我们需要更进一步的研究,为子痫前期的治疗开辟新的方法。
[1]Poon LC,Nicolaides KH.Early prediction of preeclampsia[J].Obstetrics and gynecology international,2014,2014:297.
[2]Damsky CH,Fisher SJ.Trophoblastpseudo vasculogenesis:fakingitwithendothelialadhesionreceptors[J].Cxirr Opin Cell Biol,1998,10(5):660.
[3]Christou GA,Tselepis AD,Kiortsis DN.The metabolic role of retinol binding protein 4:an update [J].HormMetab Res,2012,44:6.
[4]Kotnik P,Fischer-Posovszky P,Wabitsch M.RBP4:a controversial adipokine[J].Eur J Endocrinol,2011,165:703.
[5]Liu C,Zhang N,Yu H,et al.Proteomic analysis of human serum for finding pathogenic factors and potential biomarkers in preeclampsia[J].Placenta,2011,32:168.
[6]Lu Q,Liu C,Liu Y,et al.Serum markers of pre-eclampsia identified on proteomics[J].J Obstet Gynaecol Res,2016,42(9):1111.
[7]Gronwall C,Stahl S.Engineered affinity proteins-generation and applications[J].Journal of biotechnology,2009,140(3-4):254.
[8]North R A,Ferrier C,Long D,et al.Uterine artery Doppler flow velocity waveforms in the second trimester for the prediction of preeclampsia and fetal growth retardation[J].Obstet Gynecol,1994,83(3):378.
[9]Laginha KM,Moase EH,Yu N,et al.Bioavailability and therapeutic efficacy of HER2 scFv-targeted liposomal doxorubicin in a murine model of HER2 overexpressing breast cancer[J].J Drug Target,2015,16(7):605.
[10]Newcomer ME,Ong DE.Plasma retinol binding protein:structure and function of the prototypic lipocalin[J].BiochimBiophysActa,2000,1482(1-2):57.
[11]Zanotti G, Bemi R.Plasma retinol-binding protein:structure and interactions with retinol,retinoids,and transthyretin[J].Vitam Horm,2004,69:271.
[12]Craig RL,Chu WS,Elbein SC.Retinol binding protein 4 as a candidate gene for type 2 diabetes and prediabetic intermediate traits[J].Mol Genet Metab,2007,90(3):338.
[13]Meigs JB,Panhuysen CI,Myers RH,et al.A genome wide scan for loci linked to plasma levels of glycose and HBA1c in a community-based sample of Caucasian pedigrees:The Framingham offspring Study [J].Diabetes Care,2002,25(10):1845.
[14]Yang Q,Graham TE,Mody M,et al.Serum retinol binding protein 4 contributes to insulin resistance in obesity and type 2 diabetes.[J].Nature,2005,436(7049):356.
Construction of Fusion Protein of Single Chain Variable Fragment and RBP4
LIHong-xia1,LIUChong-dong2,CAOGuang-ming2,etal.
(1.DepartmentofGynecologyandObsterics,CivilAviationGeneralHospital,Beijing100123,China;2.DepartmentofGynecologyandObsterics,BeijingChaoyangHospitalofCapitalMedicalUniversity,Beijing100020,China)
Objective Construction of fusion protein of single chain variable fragment and RBP4.Methods MaxCodonTM Optimization Program (V13) was used to optimize the amino acid sequence of scFv-RBP4 protein,and the full-length splice primers were designed by Detai Bio.The scFv-RBP4 gene was inserted into the expression vector proEM by double digestion,and the accuracy of the final expression vector was confirmed by restriction enzyme digestion and sequencing.The plasmid was transfected into DH5a clone strain and the plasmid was extracted from themammalian cell HEK293T by transfection reagent.The plasmid was purified by Ni-IDA affinity chromatography.The scFv-RBP4 was purified by Ni-IDA affinity chromatography.Results The results of digestion and sequencing showed that the scFv-RBP4 protein was constructed correctly and the purity of the target protein was> 90%.Conclusion The scFv-RBP4 fusion protein can be expressed stably in HEK293T cells,which will be the foundation for the extraction and functional study of late fusion proteins.
RBP4;fusion protein;scFv;HEK293T;construction
国家自然科学基金面上项目(81571455)
*通讯作者
1007-4287(2017)06-1082-04
R714.2
A
2016-11-28)
——一道江苏高考题的奥秘解读和拓展

