斜纹夜蛾视黄酸结合蛋白(Slcrabp)基因的克隆、表达及功能
陈亚青,夏 亭,郑思春,冯启理,刘 琳
斜纹夜蛾视黄酸结合蛋白(Slcrabp)基因的克隆、表达及功能
陈亚青*,夏 亭*,郑思春,冯启理,刘 琳**
(广州市昆虫发育调控与应用重点实验室,昆虫科学与技术研究所,华南师范大学生命科学学院,广州 510631)
视黄酸结合蛋白(Cellular retinoic acid binding protein, CRABP)属于胞内脂质结合蛋白超基因家族,参与了许多生理活动,如细胞分化、组织重建和信号转导等,但其在昆虫中肠的作用尚不明确。研究从斜纹夜蛾Spodopteralitura中肠基因表达序列标签(EST)文库中克隆获得一个编码Slcrabp的全长cDNA,该cDNA由396个核苷酸组成,编码132个氨基酸。预测CRABP蛋白质的空间结构与脂肪酸结合蛋白非常相似,含一个由10个反平行的β折叠和2个α螺旋形成的配体结合中心结构域。SlCRABP基因具有4个外显子,与脊椎动物crabp基因类似。RT-PCR检测表明,在转录水平上,Slcrabp在6龄幼虫中肠的各个时期均有较高表达。Western blot分析结果显示,SlCRABP蛋白分布广泛,在中肠、脂肪体、精巢等组织上大量表达。在中肠,其表达峰值出现在预蛹期。利用荧光标记物质8-苯胺基-1-萘磺酸(1,8-ANS)分析了重组SlCRABP蛋白与不同底物的亲和力,发现SlCRABP与不饱和长链脂肪酸有较高结合活性,如花生四烯酸钠、亚麻酸、油酸钠和油酸,但与视黄酸、视黄醇的结合力却很弱或几乎不结合,暗示斜纹夜蛾SlCRABP功能与同家族脂肪酸结合蛋白(FABP)性质相似。对6龄幼虫进行饥饿处理,结果显示经过经24 h和48 h饥饿处理后,虫体中肠SlCRABP蛋白质的表达量有显著上升,暗示SlCRABP可能参与了斜纹夜蛾体内脂类的转运过程。
视黄酸结合蛋白;中肠;脂肪酸;视黄酸;斜纹夜蛾
胞内脂类结合蛋白(intracellular lipid binding proteins, iLBPs)是一类超基因家族的低分子量的蛋白质(14-16 kDa),分布广泛(Bernlohretal., 1997)。这个家族主要包括视黄酸结合蛋白(Cellular retinoic acid binding protein, CRABP)、脂肪酸结合蛋白(Fatty acid binding protein, FABP)和视黄醇结合蛋白(Cellular retinol binding protein, CRBP)三大类(Schaapetal., 2002; Follietal., 2005)。这些结合蛋白能够按1∶1的比例与疏水性底物结合(Bernlohretal., 1997)。iLBPs家族成员之间氨基酸序列相似性为20%-70%(Simpsonetal., 1999),它们由共同的祖先基因进化而来,从无脊椎动物向脊椎动物进化(Donovanetal., 1995)。
iLBPs作为细胞内转运蛋白,广泛存在于哺乳动物的各种组织,而且在鸟、鱼类等脊椎动物的脂类代谢组织中亦有发现,同时也存在于无脊椎动物中。1980年,首次从沙漠蝗(Schistocerca gregaria)的飞翔肌中分离得到了第一个无脊椎动物的iLBP:SgMFABP(Haunerland and Chisholm, 1990)。随后在其他无脊椎动物的组织中也相继发现了iLBP,例如:烟草天蛾、线虫、扁形动物等(Esteves and Ehrlich, 2006)。
在哺乳动物中,不同类型的iLBPs基因结构相似,均由3个内含子和4个外显子组成,内含子插入的位置相对保守,但是内含子大小相差较大(Hohoff and Spener, 1998)。与哺乳动物相比,无脊椎动物iLBPs的基因结构变化较大,一般含有2-4个外显子,0-4个内含子。例如沙漠蝗M-FABP基因由3个外显子组成(Wuetal., 2001),细粒棘球绦虫EgFABP1、EgFABP2分别含有2个外显子和1个内含子(Esteves and Ehrlich, 2006)。除了SlFABP2没有内含子外,其他斜纹夜蛾SlFABPs均由有4个外显子和3个内含子组成(Huangetal., 2010)。
在生物体内,iLBPs是细胞内转运疏水性配体最重要的一种蛋白质,可以将不同类型的底物运输到相应的细胞器中发挥作用。不同类型的iLBPs家族成员结合底物的特性不同。脊椎动物CRABPs能与纳摩尔级的视黄酸结合(Dongetal., 1999),CRABPs与视黄醇、视黄醛有非常高的亲和力(Levinetal., 1988; Noeyetal., 1988),而FABPs结合底物的种类则相对广泛,与不同底物结合的亲和性差异较大。此外,iLBPs也可以作为信号分子,调节相关基因的转录表达(Schaapetal., 2002)。如CRABP-II,K-FABP和A-FABP能够分别结合到相应的核受体RARα,PPARβ/δ和PPARγ,激活靶基因,从而调节基因转录。由于iLBPs成员属于同一个超基因家族,它们之间与底物结合和调控功能会有重叠,如CRABP-II能够结合和转运RA和RAR;在一定条件下FABP5也能将RA或RAR运输到PPARβ/δ受体上。结合底物和受体取决于CRABP-II/FABP5比例,当比值高时,RA调节PPARβ/δ受体的代谢途径;比值低时,RAR被上调表达,激活相关基因表达,介导细胞凋亡(Schugetal., 2002)。
视黄酸结合蛋白是一种低分子量的胞内蛋白质,分子量约15-16 kDa,含有134-136个氨基酸,属胞内脂类结合蛋白超基因家族。1985年首次报道了牛CRABP完整的氨基酸序列(Sundelinetal., 1985)。后来研究发现,脊椎动物细胞中存在两种不同类型的CRABPs:CRABP I和CRABPII(Wangetal., 1997; Weietal., 1997)。它们的表达模式各不相同,分布具有一定的特异性。在胚胎期,两种蛋白质均广泛存在,通常它们不在同一细胞中表达。在成体组织中,CRABPII在皮肤﹑子宫﹑卵巢和脉络膜中表达,CRABP I的分布相对更加广泛,几乎存在于所有的组织。脊椎动物CRABP I和CRABP II通过两种不同的方式参与视黄酸的代谢。CRABPII能够转运RA进入细胞核,与转录因子结合到靶基因的启动子区,激活基因的转录表达,但CRABPI却把RRA转运至细胞核,它主要通过提高RA代谢酶(CYP26A1)的产生,协助RA在细胞内质网被细胞色素P450酶系降解,防止过量的RA对机体组织造成损伤,负向调节RA的活性(Niles, 2004)。无脊椎动物CRABP的研究比脊椎动物起步晚,在无脊椎动物细胞中只存在一种视黄酸结合蛋白(Goodman, 1981)。1998年Mansfield等首次克隆得到了烟草天蛾CRABP完整的cDNA序列,通过序列的分析和空间结构的预测,认为无脊椎动物体内存在可与RA结合的蛋白;但是Folli否定了这个结论,他发现烟草天蛾CRABP并不能结合RA(Follietal., 2005),因此,对无脊椎动物CRABP是否结合RA以及其生理功能到目前为止尚有争议。
斜纹夜蛾Spodopteralitura是杂食暴发性食叶害虫,是全球热带和亚热带的主要农业害虫之一,目前以使用化学农药为主的防治措施,已使斜纹夜蛾普遍产生了抗药性(周晓梅和黄炳球,2002),因此新型专一杀虫剂的开发已势在必行。中肠是昆虫对药物吸收的主要部位,是研究杀虫剂分子机理、开发新型生物杀虫剂的重要靶标。视黄酸结合蛋白在脊椎动物中主要参与细胞内视黄酸的转运、代谢,维持胞内视黄酸的稳态平衡,但目前昆虫对CRABP方面的研究相对较少,缺乏生物学功能的具体研究,对于无脊椎动物CRABP是否具有视黄酸结合蛋白活性尚未有定论。通过对本实验室EST文库分析发现,视黄酸结合蛋白在6龄第6天预蛹期(L6D6)的幼虫中肠中的表达水平高于6龄蜕皮时期(L6D0)和6龄第3天(L6D3)。我们推测视黄酸结合蛋白在斜纹夜蛾中肠中起着非常重要的作用,尤其是在预蛹期。
1 材料与方法
1.1 实验材料
1.1.1 供试昆虫
所用的斜纹夜蛾S.litura幼虫来自中山大学有害生物控制与资源利用国家重点实验室,用人工饲料培养,饲养温度27±1℃,光周期12 h∶12 h(光∶暗),相对湿度65%-75%(Huangetal., 2011)。
1.1.2 菌株与载体
所用的大肠杆菌DH5α(E.coliDH5α)、BL21(E.coliBL21)是实验室保存的菌种。蛋白表达载体pET-28a和pBluescript® II SK (+)及克隆载体pMD18-T DNA购自TAKARA公司。
1.1.3 主要的试剂和试剂盒
Taq酶、dNTP、T4DNA连接酶、DNA限制性内切酶、dNTP、低分子量标准蛋白Marker、RT-PCR试剂盒均购自TAKARA公司。质粒提取试剂盒、胶回收试剂盒和DNA Marker(1 kb ladder)购自天根生化科技(北京)有限公司。羊抗兔IgG-SABC-FITC(Strept Avidin-Biotin Complex-fluorescein isothiocyanate)、NBT、BCIP和预染蛋白Marker均购自广州斯佳生物科技有限公司。蛋白纯化试剂盒His Bind Kit购自德国Novagen公司。不同类型脂肪酸、视黄醇和视黄酸购自美国Sigma公司。1,8-ANS购自美国Fluka公司。Western blot中的硝酸纤维素膜购自瑞典Amersham Biosciences HybondTM-C Extra公司。实验所用其他试剂均为国产分析纯试剂。
1.1.4 主要分子生物学软件
引物设计采用Primer premier 5.0(PREMIER Biosoft International, 美国)软件;实验数据分析做图采用GraphPad Prism 5.0(GraphPad Software Inc., 美国);序列组装和序列比对采用DNAStar(DNASTAR, Inc., 美国)内相关软件。
1.2 实验方法
1.2.1Slcrabp基因的克隆
根据实验室EST文库中已有的Slcrabp基因序列,设计特异性引物(表1),以斜纹夜蛾6龄中肠cDNA为模板,进行PCR反应,反应体系参考TAKARA Taq酶试剂盒说明书,10 μL的反应总体系包括2 μM的上下游引物,0.5 mM dNTP,0.5U Tag酶。
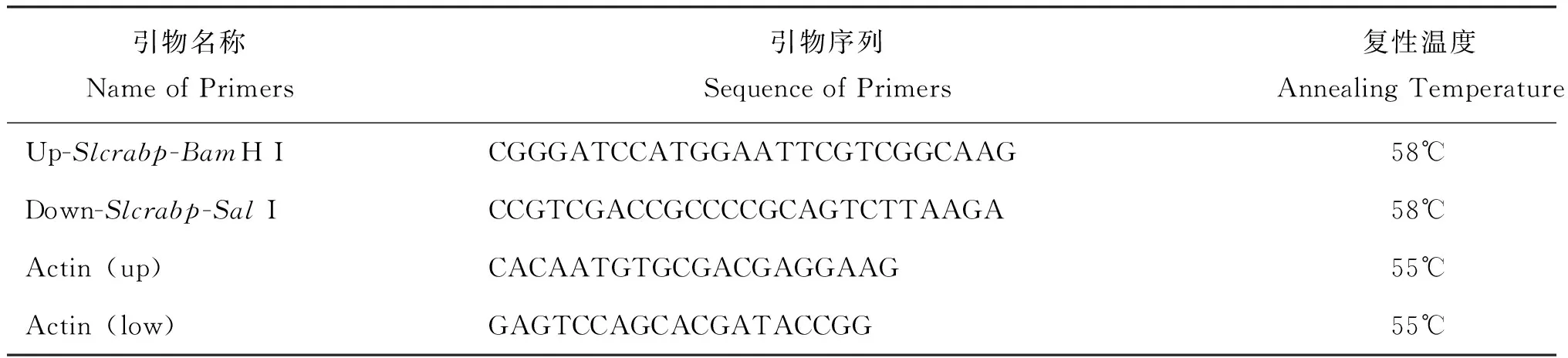
表1 本研究所用的引物Table 1 Primers used in this study
1.2.2SlCRABP重组蛋白的表达
构建SlCRABP表达载体pET-28a-Slcrabp,经PCR、酶切及测序检测是否正确构建。用pET-28a-Slcrabp转化DH5ɑ后,将重组菌种接种到10 mL含有卡那霉素的LB液体培养基中,37℃ 220 rpm,培养过夜。将活化的重组菌种以1∶100的比例接种到新的含有卡那霉素的LB液体培养基中,37℃,220 rpm培养2 h,至OD600=0.4-0.6时,加入终浓度为0.6 mM的IPTG,在同样的条件下继续培养4 h。4℃,5000 rpm离心3 min弃除上清,收集菌体,对其进行可溶性表达分析以及重组蛋白纯化。
为了确定获得的重组蛋白是否以可溶的形式存在,收集经IPTG诱导的菌体后,加入PBS缓冲液,混匀。用超声波破碎仪在冰上进行超声波破碎细胞直至溶液变清。12000 g离心10 min,分别收集上清和沉淀。通过12% SDS-PAGE检测目的蛋白在上清液和沉淀中的分布。获得的重组蛋白用于体外结合实验和抗体制备。
1.2.3 斜纹夜蛾总RNA的提取和RT-PCR
分离斜纹夜蛾各组织材料,具体操作参照TRI Reagent总RNA抽提试剂盒(TaKaRa)的说明书及前期优化的提取条件提取总RNA(Huangetal., 2011)。将RNA进行反转录合成cDNA,具体操作参考Reverse Transcriptase M-MLV(RNase H-)(TaKaRa)说明书及前期优化的提取条件(在10 μL反转录的终反应体系里,包括2 μg总RNA,50 μM Oligo(dT)18Primer,dNTP Mixture各5 mM,RNase Inhibitor 10 U,RNase M-MLV(RNase H-)90U。将反转录合成的cDNA用ddH2O稀释至100 μL。取3 μL cDNA为模板,actin基因为内参,进行RT-PCR反应。反应条件同前。
1.2.4 组织蛋白的提取和检测
将斜纹夜蛾置于冰上约5 min,使其休克。在装有PBS的蜡盘里进行解剖,分别提取斜纹夜蛾的中肠、精巢、表皮和脂肪体等组织。按照2.5 mL/g的比例,在样品中加入适量的蛋白抽提缓冲液(50 mM Tris, 10 mM EDTA, 15%甘油,pH 7.8),在冰上用研磨棒充分研磨,4℃,12000 g离心15 min,取上清置于新的1.5 ml离心管中,重复上述操作,直到提取的蛋白样品没有沉淀,置于-80℃保存备用。蛋白样品质量检测:向待检测的样品中加入等体积的2×Protein Loading(100 mM Tris-HCl,2% β-巯基乙醇,4% SDS,0.2%溴酚蓝,20%甘油,pH 6.8),混合均匀后,在沸水中加热5 min,使蛋白变性,接着在冰上放置3 min。然后按常规的方法进行电泳分析。
1.2.5 Western blot分析
SDS-PAGE电泳分离蛋白后,将蛋白转至硝酸纤维素膜上,按前期优化的方法进行western blot(Huangetal., 2011)。按1∶2000加SlCRABP抗体;1∶10000加碱性磷酸酶标记的羊抗兔第二抗体。经洗涤,最后加生色底物四氮唑蓝(NBT)和5-溴-4-氯-3-吲哚磷酸(BCIP)的混合物,于室温平缓摇动进行显色反应。
1.2.6SlCRABP重组蛋白的结合取代实验
1.2.6.1 SlCRABP重组蛋白的纯化
重组蛋白的纯化参照Novagen公司的His Bind Kit说明书。在resin柱中(PD-10, GE, 美国),依次用无菌水、1×Charge buffer、1×Binding buffer平衡柱子。将在1.2.2中收集的上清液沿柱壁缓慢加入柱中,控制流速3-4滴/min。依次按要求用1×Binding buffer,1×Washing buffer冲洗柱子,最后用1×Elute buffer洗脱蛋白。收集的蛋白用12% SDS-PAGE检测蛋白纯度。
1.2.6.2 蛋白的浓缩
根据蛋白大小,选择相应孔径大小的超滤管(Millipore,美国),将收集的蛋白加到超滤管中,4000 rpm,4℃离心20-30 min;更换2-3次缓冲液,加所需缓冲液至原始体积,4000 rpm,4℃离心20-30 min;通过控制离心时间,离心至所需体积及浓度,收集浓缩后蛋白。
1.2.6.3SlCRABP重组蛋白脱脂
由于SlCRABP蛋白能够结合一些游离的疏水性底物,利用原核表达系统表达的重组蛋白SlCRABP可能会结合细菌体内的一些疏水性配基,可能会影响后续的结合实验。因此我们通过萃取反应对SlCRABP重组蛋白进行脱脂处理,除去SlCRABP重组蛋白本底结合的底物,具体的实验操作参考Folli(2005)的方法:加2倍蛋白体积的乙醚到蛋白液中,充分混匀,冰上放置20 min;去除上层乙醚相,加1.5倍蛋白体积的乙醚到蛋白液中,充分混匀,冰上放置20 min;去除上层乙醚相,真空干燥去除剩余乙醚。
1.2.6.4 SlCRABP重组蛋白摩尔浓度的测定
由比尔-朗伯定律(Beer-Lambert law)公式:A=εlC,可以得出:C=A/εl,其中:C表示蛋白的摩尔浓度(M),A表示蛋白在280 nm处的吸光值,ε表示蛋白的摩尔消光系数(M-1.cm-1),l表示光路长度(cm)。ε的值与蛋白中色氨酸(W)、酪氨酸(Y)、半胱氨酸(C)的含量有关;ε的值近似等于蛋白中这三种氨基酸在280 nm处吸光值的总和,可以表示为:ε(280)=(aW×5500)+(bY×1490)+(cC×125),a、b、c表示氨基酸在蛋白中的数量。
如果知道一种蛋白的氨基酸组成,就可以计算出它的W、Y、C的含量,预测它的ε(280)的值;用分光光度计检测其在280 nm处的吸光值A;已知l值,根据公式:C=A/εl,计算出蛋白的摩尔浓度C。
1.2.6.5 SlCRABP重组蛋白与底物的结合取代反应
荧光染料1,8-ANS(8-anilion-1-naphtalenesulfonic acid amm)(Fluka,美国)本身只有很微弱的荧光,可以忽略不计。但当与CRABPs结合形成复合物后,在蓝光的激发下可以产生强烈的荧光。因此,首先固定SlCRABP蛋白浓度,SlCRABP与1,8-ANS充分结合形成复合物后,复合物的荧光强度与1,8-ANS浓度有关,故首先检测了荧光强度随1,8-ANS浓度变化的发射光谱,获得最佳1,8-ANS浓度。在此基础上,再加入不同种类的底物进行竞争结合,通过检测加入不同底物前后荧光强度的变化量,推断出SlCRABP与不同种类底物的亲和力大小,实验流程如下:1)结合荧光检测:定量的SlCRABP与不同浓度梯度的1,8-ANS,在室温黑暗条件下,反应3 min,检测反应物的荧光强度变化,分析整理数据,确定达到饱和时1,8-ANS的浓度;2)竞争结合荧光检测:根据结合反应实验结果,采用合适的SlCRABP与1,8-ANS反应条件,首先在黑暗室温条件下,反应3 min,再加入浓度梯度的底物,竞争反应3 min,检测反应的荧光强度变化情况,从而确定SlCRABP与不同底物的亲和力大小。
1.3 数据分析
使用凝胶成像系统对Western blot结果拍照,用Image Quant TL v2005(Amersham Inc., 美国)分析条带相对亮度值,然后用数值制作成柱状图。所有数值用mean±SEM表示,显著性分析使用一元方差分析(One-way ANOVA)法,采用Tukey检验进行多个样本间的多重比较,P<0.01表示存在统计学上的极显著差异。所有实验重复3次。
2 结果与分析
2.1 目的基因的克隆及序列分析
2.1.1 斜纹夜蛾中肠EST文库Slcrabp基因分析
对实验室的斜纹夜蛾中肠EST文库分析发现,在6龄蜕皮期(L6D0)、进食期(L6D3)和预蛹期(L6D6)三个时期的中肠共有10个SlcrabpcDNA克隆,其中在预蛹期(L6D6)克隆数最多。通过对所有的克隆进行组装拼接,获得了1个全长SlcrabpcDNA序列。SlcrabpcDNA的克隆数在三个不同时期EST文库中的分布如表2。

表2 斜纹夜蛾中肠EST文库Slcrabp克隆数统计Table 2 Clones of Slcrabp in EST library of Spodoptera litura midgut
在斜纹夜蛾基因组数据库,通过检查基因注释及CRABP同源序列比对,发现SWUSl10005904序列编码斜纹夜蛾的CRABP。该基因的结构包括了4个外显子及3个内含子(图1)。
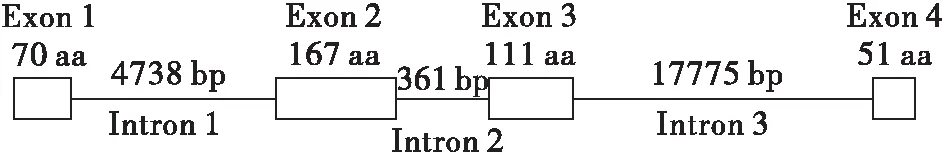
图1 斜纹夜蛾的视黄酸结合蛋白(SlCRABP) 基因结构示意图Fig.1 Diagram of the gene structure of SlCRABP
2.1.2SlCRABPcDNA序列分析
SlCRABP全长的cDNA由595个核苷酸组成,具有一个完整的开放阅读框(ORF),ORF由396个核苷酸组成,编码一个由132个氨基酸组成的蛋白,预测分子量为14.8 kDa,等电点(pI)是6.67(图2)。通过对序列分析发现,SlCRABP含有三个关键氨基酸,分别是Asp73,Lys79,Asp99(图2)。这三个氨基酸被认为是底物结合的关键位点,决定了底物的特异性(Wangetal., 2007)。

图2 Slcrabp cDNA核苷酸及其编码的氨基酸序列Fig.2 Nucleotide and deduced amino acid sequences of Slcrabp cDNA起始密码子(ATG)用加下横线标出,终止密码子(TAA)用星号标出,方框表示三个关键氨基酸,左边的数字是cDNA的核苷酸数,右边的数字是编码的氨基酸数
2.2SlCRABP重组蛋白的表达及抗体检测
2.2.1SlCRABP重组蛋白的表达与纯化
体外诱导pET-28a-Slcrabp重组细菌,采用15% SDS-PAGE蛋白胶检测目的蛋白的表达。从SDS-PAGE(图3)上可以看出,在浓度为0.6 mM的IPTG诱导4 h后,重组蛋白在大肠杆菌中表达。SlCRABP蛋白的理论分子量是14.8 kDa,加上表达载体pET-28a携带的6X His标签蛋白,重组蛋白的表观分子量大小约31.6 kDa。这个分子量与预期分子量大小相同。超声波破碎细菌后,分别收集沉淀和上清液分析,发现该蛋白主要以包涵体形式存在。利用目的蛋白N端带有的6X His标签,使用His-tag柱子对SlCRABP重组蛋白进行分离纯化。目的蛋白SlCRABP能够被纯化出来,并且纯化得到的蛋白条带较单一,可以用于下一步制备多克隆抗体(图3)。
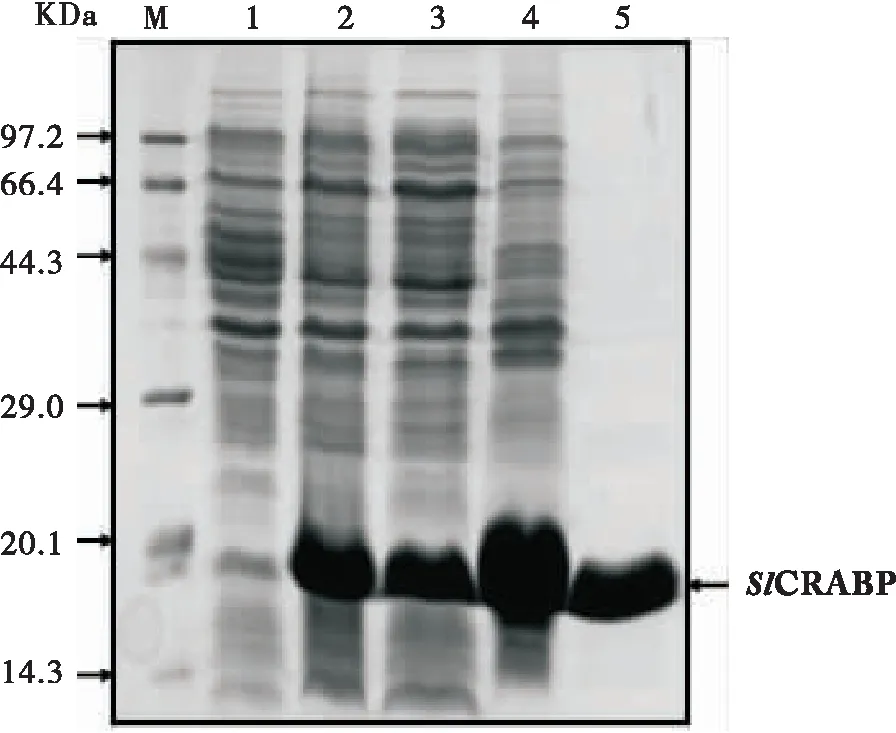
图3 15% SDS-PAGE分析SlCRABP重组蛋白Fig.3 Analysis of SlCRABP recombinant protein by 15% SDS-PAGEM:低分子量蛋白;1:诱导前菌液;2:诱导4 h后菌液;3:诱导4 h后经超声波处理的上清液;4:诱导4 h后经超声波处理的沉淀;5:纯化的SlCRABP蛋白。M:Marker;1:Bacteria before inducation;2:Bacteria after 4 h inducation;3:Supernatant of induced bacteria;4:Precipitation of induced bacteria;5:Purified SlCRABP protein.
2.2.2SlCRABP重组蛋白抗体的制备与检测
用上述重组蛋白免疫新西兰大白兔,三次免疫后,抽取免疫兔子血液,经离心分离获得多克隆抗血清。将制备好的血清储存于-80℃备用。利用Western blot检测制备的SlCRABP多克隆抗体的免疫性与专一性。结果表明,重组菌总蛋白和纯化蛋白,以及中肠组织样品中均出现特异条带,而对照的空载体蛋白样品却没有出现特异条带(图4),蛋白条带的大小与目的蛋白的分子量相符合,表明所制备的抗体的免疫性和专一性较好,可以用于进一步的研究。

图4 Western blot分析重组蛋白多克隆抗体专一性Fig.4 Western blot analysis of specificity of the anti-SlCRABP antibody1:阴性对照样品;2:重组菌体总蛋白样品;3:纯化蛋白样品;4:斜纹夜蛾中肠粗蛋白样。1:Negative sample;2:Total protein from recombinant bacteria;3:Purified SlCRABP protein;4:Total protein from midgut of cutworm.
2.3Slcrabp基因的时空表达分析
2.3.1SlcrabpmRNA表达分析
用RT-PCR(Reverse transcription PCR)的方法分析Slcrabp基因在不同组织和中肠不同时期的表达情况。分离斜纹夜蛾幼虫包括中肠(MG midgut)、表皮(EP epidermis)、脂肪体(FB fat body)和精巢(TE testis)等不同组织,提取总RNA;同时提取中肠不同时期(6龄1 d,2 d,3 d,4 d;预蛹和蛹期)总RNA,再反转录合成cDNA。用RT-PCR分析Slcrabp基因的mRNA表达情况。结果显示,Slcrabp在预蛹期的中肠、表皮、脂肪体和精巢各个组织均有转录,而且其表达量均较高(图5-A)。SlcrabpmRNA在6龄中肠的各个时期均有表达,其表达量在预蛹期有微弱的上升趋势(图5-B)。
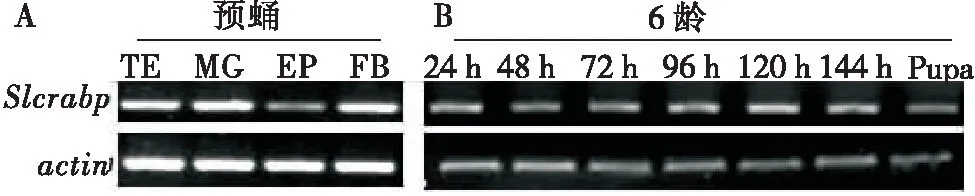
图5 RT-PCR分析Slcrabp基因的表达情况Fig.5 Analysis of expression of Slcrabp gene by RT-PCRA:Slcrabp基因的mRNA在不同组织的表达情况;TE:精巢;MG:中肠;EP:表皮;FB:脂肪体;B:Slcrabp基因的mRNA在6龄不同发育时期在中肠的表达情况。A:Expression of Slcrabp at different tissues;TE:Testis;MG:Midgut;EP:Epidermis;FB:Fat body;B:Expression of Slcrabp in the midgut at different developmental stages for 6th larvae.
2.3.2SlCRABP蛋白质的表达分析
提取斜纹夜蛾预蛹期不同组织(中肠、表皮、脂肪体和精巢)和不同时期(6龄0 h、24 h、48 h、72 h、96 h、120 h和蛹期0 h、24 h、48 h、72 h)的中肠总蛋白,用25 μg的蛋白量进行12%的SDS-PAGE分析,结果发现,SlCRABP的多克隆抗体能够识别出斜纹夜蛾虫体内的SlCRABP蛋白,其大小与预测的SlCRABP蛋白分子量14.8 kDa相一致(图6)。
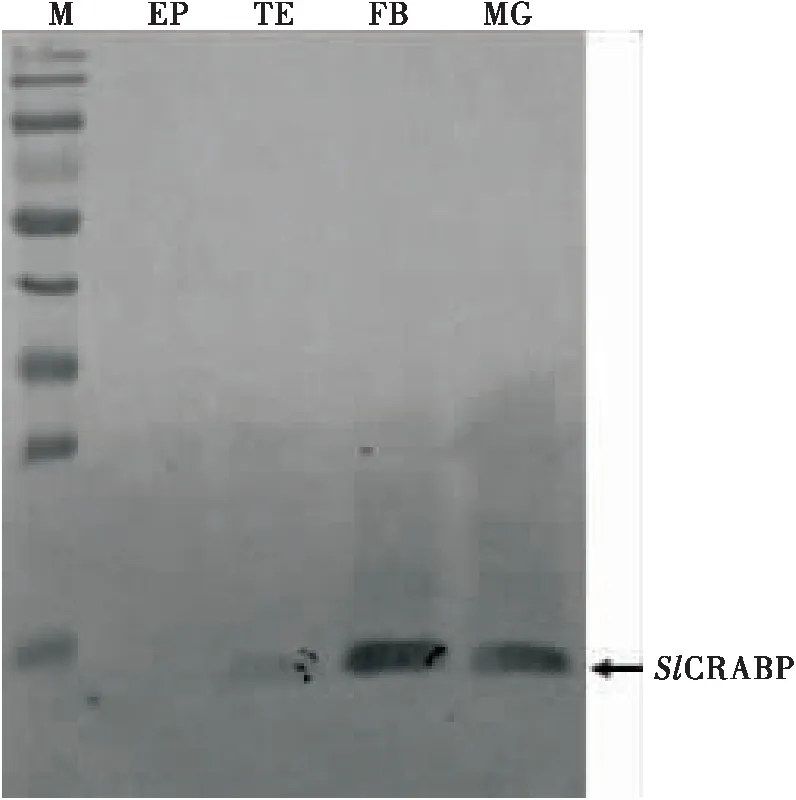
图6 Western blot分析SlCRABP蛋白在预蛹期不同组织的表达情况Fig.6 Analysis of expression of SlCRABP protein in different tissues at prepupal stage by Western blotEP:表皮;TE:精巢;FB:脂肪体;MG:中肠。EP:Epidermis;TE:Testis;FB:Fat body;MG:Midgut.
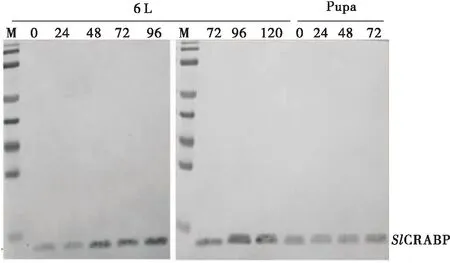
图7 Western blot分析SlCRABP蛋白在中肠不同时期的表达情况Fig.7 Analysis of expression of SlCRABP protein in the midgut at different developmental stages by Western blot6L:6龄幼虫6th instar stage;Pupa: pupal stage
SlCRABP蛋白在虫体预蛹期的脂肪体、精巢和中肠中均有表达,而且表达量较高,但是在表皮中几乎没有表达(图6)。图5结果显示该基因在表皮中有表达,但水平较低。推测Slcrabp基因在表皮中转录后,可能并未翻译成蛋白质或者只有少量被翻译成蛋白质。
SlCRABP蛋白在6龄幼虫不同发育时期的中肠组织中的表达量随着虫体的发育渐渐增加,到预蛹期该蛋白的表达量达到顶峰。但在6龄蜕皮期和蛹期,该蛋白的表达量相对较低(图7)。这个检测结果与斜纹夜蛾中肠EST表达结果相一致,SlCRABP在预蛹期(L6D6)表达量较高(表2)。
2.4SlCRABP蛋白的体外结合取代实验
预蛹期,斜纹夜蛾不再进食,虫体开始变小,并且在形态结构和生理功能上发生了巨大的变化,例如旧的中肠开始萎缩、解体,新的中肠重新形成,由幼虫结构向成虫结构转变。这些活动的发生需要消耗大量的能量。视黄酸结合蛋白是胞内脂质结合蛋白超家族成员之一,有文献报道无脊椎动物中的视黄酸结合蛋白是从脊椎动物的H-FABP进化而来,与H-FABP的亲缘关系更近(Follietal., 2005)。那么,在无脊椎动物中视黄酸结合蛋白是否具有自己独特的生理功能呢?为了进一步研究Slcrabp基因的生理功能,我们进行了SlCRABP蛋白的体外结合取代实验。通过检测SlCRABP蛋白在体外与视黄酸和脂肪酸的结合情况,可以进一步探究与SlCRABP蛋白相互作用的底物。用纯化后的重组SlCRABP蛋白先与荧光染料(1,8-ANS)结合,然后再加入不同的脂肪酸和视黄酸进行竞争结合,通过检测反应前后荧光强度的变化,最终可以确定视黄酸,视黄醇和脂肪酸与SlCRABP蛋白的结合能力及其亲和力大小。
2.4.1SlCRABP与1,8-ANS的结合反应
ANS-CRABP复合物的最佳激发波长Ex(Excitation wavelength)在370 nm左右(Follietal., 2005),为了进一步确定复合物的最佳发射波长Em(Emission wavelength)及在固定SlCRABP蛋白浓度时,复合物的荧光强度与1,8-ANS浓度的关系,检测了荧光强度随1,8-ANS浓度变化的发射光谱。检测的结果显示:ANS-SlCRABP复合物的最佳发射波长Em在466 nm左右;在一定范围内它们发射光谱的峰值会随着1,8-ANS浓度的增加而增加(图8),说明重组SlCRABP可以结合1,8-ANS。
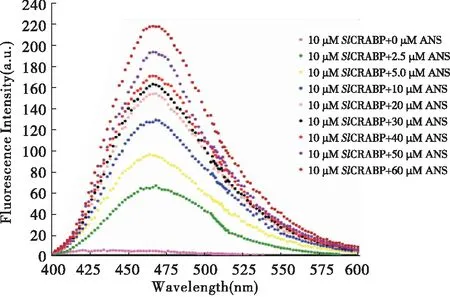
图8 10 μM SlCRABP与不同浓度1,8-ANS结合后的荧光发射光谱Fig.8 Fluorescence emission spectra for 10 μM SlCRABP binding with 1,8-ANS at different concentrations
上述结果显示,SlCRABP蛋白与不同浓度的1,8-ANS结合后,荧光强度随着1,8-ANS浓度的增加而增强。增加到一定的程度后(1,8-ANS浓度为20 μM),荧光强度增加的幅度变小,说明SlCRABP蛋白在此情况下接近结合饱和状态。ANS-SlCRABP复合物的最佳发射波长为466 nm,因此,在后续实验中选取Ex=370 nm,Em=466 nm时的荧光强度,测定1,8-ANS与SlCRABP的荧光强度曲线。

图9 SlCRABP与1,8-ANS的荧光滴定曲线Fig.9 SlCRABP binding curve of 1,8-ANS obtained from the fluorescence titrations
荧光强度接近饱和状态下,1,8-ANS的浓度为20 μM,以此浓度进行后面的取代实验,检测SlCRABP蛋白与1,8-ANS结合的荧光强度在取代反映前后的变化情况,从而测定SlCRABP与不同底物(FAs和RA)的结合能力。
2.4.2SlCRABP蛋白的取代反应
根据前面的荧光滴定实验,选定20 μM 1,8-ANS与10 μMSlCRABP在黑暗室温条件下先进行结合反应3 min,然后再加入不同浓度的脂肪酸、视黄酸和视黄醇进行取代反应3 min,检测条件是:Ex=370 nm,Em=466 nm,激发波狭缝宽度为5 nm,发射波狭缝宽度为10 nm。选用可能与SlCRABP结合的6种脂肪酸和1种视黄酸和视黄醇进行分析,具体种类如表3。结果显示:加入视黄酸、视黄醇和亚油酸后荧光强度没有明显变化或者荧光强度下降幅度比较微弱,说明SlCRABP与视黄酸、视黄醇和亚油酸的结合力很弱或者几乎不结合(图10)。但随着花生四烯酸钠、亚麻酸、油酸钠和油酸浓度的增加,荧光强度急剧下降,说明SlCRABP蛋白更易于结合花生四烯酸钠、亚麻酸、油酸钠和油酸,即与这些不饱和脂肪酸的亲和力较大。而加入软脂酸后,荧光强度下降趋势不大,远远不及花生四烯酸钠、亚麻酸、油酸钠和油酸。这些实验结果预示了SlCRABP蛋白在体外更趋向于结合一些不饱和脂肪酸,但与视黄酸、视黄醇和一些饱和脂肪酸的亲和性不大。
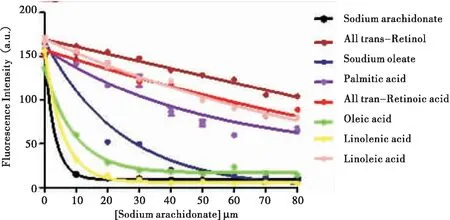
图10 脂肪酸、视黄酸和视黄醇的取代反应Fig.10 Displacement reaction of fatty acids,retinoic acid and retinol to 1, 8-ANS bound to SlCRABP
每种结合底物的Kd值如表3所示。Kd值越小说明SlCRABP蛋白与底物的结合活性越强。SlCRABP蛋白与不饱和的脂肪酸包括花生四烯酸钠、亚麻酸、油酸钠、油酸的Kd值比较小,但是与视黄酸、视黄醇的Kd值比较大,说明SlCRABP蛋白在体外可以结合花生四烯酸钠、亚麻酸、油酸和钠油酸,但可能不结合视黄酸和视黄醇。
2.5SlCRABP蛋白的饥饿诱导表达
为了探究SlCRABP是否参与了脂类代谢的活动,对6龄幼虫进行了饥饿处理实验,探究切断食物,没有脂肪酸补充时,SlCRABP的表达是否会受诱导表达?选取完成蜕皮进入6龄的幼虫分别进行处理:饥饿24 h(Starvation 24)(S24)、喂食24 h(Feeding 24)(F24)、先喂食24 h后再饥饿24 h(F24S24)、先饥饿24 h后再喂食24 h(S24R24)、饥饿48 h(S48)、喂食48 h(F48)(图11)。分别提取各组幼虫的中肠组织总蛋白,利用Western blot检测SlCRABP表达的变化情况。

表3 不同底物及其与SlCRABP的结合常数Table 3 The substrates and the binding constant of the substrates to SlCRABP
图11 饥饿处理方法示意图Fig.11 Schematic diagram to show the way of starvation treatment
结果如图12所示:6龄幼虫经过S24或S48处理后,SlCRABP蛋白质的表达量均有显著上升的趋势。说明饥饿会促进SlCRABP蛋白的表达,结果与前面SlCRABP蛋白在预蛹期(这时幼虫停止进食)高表达,体外与脂肪酸有较高的亲和力的结果一致。ha暗示SlCRABP的生理功能可能与虫体内的脂类的吸收、转运与代谢有关,但可能并不具视黄酸结合蛋白的生理功能。
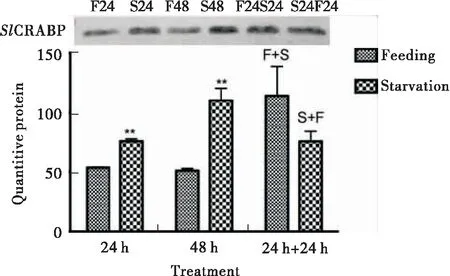
图12 饥饿对中肠SlCRABP蛋白表达的影响Fig.12 Expression profile of SlCRABP in the midgut after starvation treatment
3 结论与讨论
视黄酸是维生素A的中间代谢产物,参与生物体生长、发育的过程,在从鱼到哺乳类的脊椎动物中是生物正常生长发育所必需的成分,在早期胚胎发育及细胞增殖分化、成体组织重建中起着重要的作用。视黄酸结构上是疏水性的,它需要与胞内的脂肪酸结合蛋白形成可溶性的复合物,才能被转运至细胞不同部位发挥其生理作用(Ongetal., 1978)。在脊椎动物中,存在两类的视黄酸结合蛋白(CRABP I和CRABP II)参与视黄酸的的转运;而无脊椎动物中仅报道一种类型的CRABP,但是否参与体内视黄酸的代谢,具体的生理功能尚不明确。关于昆虫CRABP的研究甚少。
分析斜纹夜蛾基因组数据得知:Slcrabp基因结构由3个内含子和4个外显子组成,与脊椎动物斑马鱼Zfcrabp1a和Zfcrabp1b(Liuetal., 2005),小鼠Rtcrabp1和Rtcrabp2,人Hmcrabp1和Hmcrabp2相似。但Slcrabp基因每一个外显子的氨基酸数目与上述脊椎动物不同,后者外显子编码的氨基酸长度极其相似,第一个外显子为23-24 aa;第二个外显子为60 aa;第三个外显子为38 aa;第四个外显子为16 aa(Liuetal., 2005)。
本研究利用荧光染料(1,8-ANS)间接检测了不同底物与SlCRABP蛋白的结合能力,结果显示,SlCRABP重组蛋白更易于结合长链不饱和脂肪酸包括花生四烯酸钠、亚麻酸、油酸钠和油酸,但是与视黄酸、视黄醇的结合力很弱或者几乎不结合,该结果和烟草天蛾CRABP的结合属性是一致的。2005年等发现烟草天蛾CRABP并不能结合和转运视黄酸,反而与脂肪酸有较高的结合活性(Mansfieldetal., 1998, Folli,etal., 2005)。这个结果暗示,SlCRABP可能与虫体内脂类的代谢有关,并不具备结合视黄酸的功能,暗示无脊椎动物CRABP可能并未进化成一个视黄酸结合蛋白,它的存在可能起着补充无脊椎动物FABP的生理功能,但并不参与视黄酸的代谢。而无脊椎动物的视黄酸有可能是通过一些简单的扩散进入细胞核内,发挥它的生理作用(Wangetal., 2007),也可能是iLBPs其它成员可弥补CRABP缺失的功能,参与视黄酸的代谢。所以在无脊椎动物中,CRABP在视黄酸信号代谢途径中并不是不可或缺的,它对于维持细胞内视黄酸合适的浓度也不是唯一需要的(Sharmaetal., 2003)。
我们分析了饥饿状态对SlCRABP蛋白表达的影响。通过对6龄幼虫的不同处理,发现饥饿处理24 h和48 h后,SlCRABP蛋白表达量显著增加。说明了饥饿可诱导SlCRABP蛋白高表达,结果与SlCRABP蛋白在预蛹期高表达相吻合,预蛹期幼虫虽然不再进食,但是这个时期昆虫内主要的脂肪酸,如棕榈酸、油酸和亚油酸等与幼虫期相比并没有明显的变化(待发表测定数据)。基因表达谱分析表明,在预蛹期和蛹期的中肠,脂肪酸合成相关的基因表达都增加了,说明脂肪代谢仍然很活跃(Huangetal., 2012)。这些结果与前面结合取代实验结果相一致:SlCRABP蛋白与不饱和脂肪酸有较高的结合性。这些结果说明SlCRAB的生理功能可能是参与了虫体内脂类的转运与代谢,但没有视黄酸结合蛋白的功能。
References)
Bernlohr DA, Simpson MA, Hertzel AV,etal.Intracellular lipid-binding proteins and their genes [J].AnnualReviewofNutrition, 1997, 17 (1): 277-303.
Dong D, Ruuska SE, Levinthal DJ,etal.Distinct roles for cellular retinoic acid-binding proteins I and II in regulating signaling by retinoic acid [J].JournalofBiologicalChemistry, 1999, 274 (34): 23695-23698.
Donovan M, Olofsson B, Gustafson AL,etal.The cellular retinoic acid binding proteins [J].JournalofSteroidBiochemistryandMolecularBiology, 1995, 53 (1-6): 459-465.
Esteves A and Ehrlich R.Invertebrate intracellular fatty acid binding proteins [J].ComparativeBiochemistryandPhysiologyPartC:Toxicology&Pharmacology, 2006, 142 (4): 262-274.
Folli C, Ramazzina I, Percudani R,etal.Ligand-binding specificity of an invertebrate (Manduca sexta) putative cellular retinoic acid binding protein [J].BiochimicaetBiophysicaActa-biomembranes, 2005, 1747 (2): 229-237.
Goodman DS.Retinoid-binding proteins in plasma and in cells [J].AnnalsoftheNewYorkAcademyofSciences, 1981, 359 (1): 69-78.
Gorry P, Lufkin T, Dierich A,etal.The cellular retinoic acid binding protein I is dispensable [J].ProceedingsoftheNationalAcademyofSciencesoftheUnitedStatesofAmerica, 1994, 91 (19): 9032-9036.
Haunerland NH, Chisholm JM.Fatty acid binding protein in flight muscle of the locust, Schistocerca gregaria [J].BiochimicaetBiophysicaActa, 1990, 1047 (3): 233-238.
Hohoff C, Spener F.Fatty acid binding proteins and mammary-derived growth inhibitor [J].Lipid/Fett, 1998, 100 (6): 252-263.
Huang Z, Zhou D, Gao G,etal.Cloning and characterization of a midgut-specific fatty acid binding protein inSpodopteralitura[J].ArchivesofInsectBiochemistryandPhysiology, 2012, 79 (1): 1-17.
Liu RZ, Sharma MK, Sun Q,etal.Retention of the duplicated cellular retinoic acid-binding protein 1 genes (crabp1a and crabp1b) in the zebrafish genome by subfunctionalization of tissue-specific expression [J].FEBSJournal, 2005, 272 (14): 3561-3571.
Mansfield SG, Cammer S, Alexander SC,etal.Molecular cloning and characterization of an invertebrate cellular retinoic acid binding protein [J].ProceedingsoftheNationalAcademyofSciencesoftheUnitedStatesofAmerica, 1998, 95 (12): 6825-6830.
Niles RM.Signaling pathways in retinoid chemoprevention and treatment of cancer [J].MutationResearch, 2004, 555 (1-2): 81-96.
Noy N, Blaner WS.Interactions of retinol with binding proteins: Studies with rat cellular retinol-binding protein and with rat retinol-binding protein [J].Biochemistry, 1991, 30 (26): 6380-6386.
Ong DE, Chytil F.Cellular retinoic acid-binding protein from rat testis, purification and characterization [J].JournalofBiologicalChemistry, 1978, 253: 4551-4554.
Schaap FG, van der Vusse GJ, Glatz JF.Evolution of the family of intracellular lipid binding proteins in vertebrates [J].MolecularandCellularBiochemistry, 2002, 239 (1): 69-77.
Schug TT, Berry DC, Shaw NS,etal.Opposing effects of retinoic acid on cell growth result from alternate activation of two different nuclear receptors [J].Cell, 2007, 129 (4): 723-733.
Sharma MK, Denovan-Wright EM, Boudreau ME,etal.A cellular retinoic acid-binding protein from zebrafish (Danio rerio): cDNA sequence, phylogenetic analysis, mRNA expression, and gene linkage mapping [J].Gene, 2003, 311 (1): 119-128.
Simpson MA, LiCata VJ, Ribarik CN,etal.Biochemical and biophysical analysis of the intracellular lipid binding proteins of adipocytes [J].MolecularandCellularBiochemistry, 1999, 192 (1): 33-40.
Sundelin J, Das SR, Eriksson U,etal.The primary structure of bovine cellular retinoic acid-binding protein [J].JournalofBiologicalChemistry, 1985, 260 (10): 6494-6499.
Wang L, Li Y, Yan H.Structure-function relationships of cellular retinoic acid-binding proteins.Quantitative analysis of the ligand binding properties of the wild-type proteins and site-directed mutants [J].JournalofBiologicalChemistry, 1997, 272 (3): 1541-1547.
Wang XJ, Chen J, Lv ZB,etal.Expression and functional analysis of the cellular retinoic acid binding protein from silkworm pupae (Bombyxmori) [J].JournalofCellularBiochemistry, 2007, 102 (4): 970-979.
Wu Q, Andolfatto P, Haunerland NH.Cloning and sequence of the gene encoding the muscle fatty acid binding protein from the desert locust,Schistocercagregaria[J].InsectBiochemistryandMolecularBiology, 2001, 31 (6-7): 553-562.
Zhou XM, Huang BQ.Advances in research on drug resistance ofSpodopteralituraand its control strategies [J].Entomology, 2002, 98-102.[周晓梅, 黄炳球.斜纹夜蛾抗药性及其防治对策的研究进展[J].昆虫知识, 2002, 98-102]
The cloning, expression and functional study on cellular retinoic acid binding protein (Slcrabp) inSpodopteralitura
CHEN Ya-Qing*, XIA Ting*, ZHENG Si-Chun, FENG Qi-Li, LIU Lin**
(Guangzhou Key Laboratory of Insect Development Regulation and Applied Research, Institute of Insect Science and Technology, School of Life Sciences, South China Normal University, Guangzhou 510631, China)
Cellular retinoic acid binding protein (CRABP) belongs to a superfamily of intracellular lipid binding proteins.CRABP plays an important role in a wide range of physiological processes, including cell differentiation, tissue reconstruction and signal transduction, but its role in the insect midgut remains to be investigated.A full-length cDNA clone namedSlcrabpwas identified from an Expressed Sequence Tag (EST) library of the midgut ofSpodopteralitura.SlcrabpcDNA is consisted of 396 nucleotides and encodes a polypeptide of 132 amino acids.The predicated spatial structure ofSlCRABP is similar to that of a typical fatty acid binding protein of 10-stranded β-barrel folding and 2 α helixes, which forms a cavity where lipophilic ligand resides.Based on the genomic data ofS.litura,Slcrabpgene contains 4 exons, which is similar to the vertebratecrabpgenes.RT-PCR showed thatSlcrabpkept high expression in the midgut throughout all six larval stages.Western blotting analysis results revealed thatSlCRABP protein had abundant expression in the midgut, fat body, and testis.In the midgutSlCRABP attained the highest expression level at the prepupal stage.Binding affinity ofSlCRABP was assessed by displacement assay of a fluorescent marker, 1-anilinonaphthalene-8-sulfonic acid (1,8-ANS).The results showed thatSlCRABP had higher binding affinity with unsaturated long chain fatty acids, including arachidonic acid, sodium acid, linolenic acid, sodium oleate and oleic acid.However,SlCRABP almost did not bind with retinoic acid or retinol.These results indicate thatSlcrabpmay play a role as a fatty acid binding protein.Larvae at the sixth instar stage were starved for 24 h and 48 h, respectively, and the expression ofSlCRABP protein was detected.The results indicated the significant increase in theSlCRABP level in the midgut.This suggested that starvation induced the expression ofSlCRABP, which may play a role in the transport of fatty acids in the midgut ofS.litura.
Cellular retinoic acid binding protein (CRABP); midgut; fatty acid; retinoic acid;Spodopteralitura
陈亚青,夏亭,郑思春,等.斜纹夜蛾视黄酸结合蛋白(Slcrabp)基因的克隆、表达及功能[J].环境昆虫学报,2017,39(3):493-504.
国家自然科学基金重点项目(31330071)
陈亚青,女,1989年生,博士,研究昆虫变态发育的分子调控,E-mail:ccyaqing@163.com;*共同第一作者:夏亭,女,1987年生,硕士研究生,研究昆虫变态发育的分子调控,E-mail:Xia_ting@dakeue.com
**通讯作者Author for correspondence, E-mail: liul@scnu.edu.cn
Received: 2017-05-15; 接受日期Accepted: 2017-06-01
Q963;S433.4
A
1674-0858(2017)03-0493-12

