甘肃小麦品种主要春化和光周期基因的组成和分布
张 博,白 斌,张雪婷,杨智全,王晓龙,张晓科
(1.西北农林科技大学农学院/国家小麦改良中心杨凌分中心,陕西杨凌 712100;2.甘肃省农业科学院小麦研究所,甘肃兰州 730070)
甘肃小麦品种主要春化和光周期基因的组成和分布
张 博1,白 斌2,张雪婷2,杨智全1,王晓龙1,张晓科1
(1.西北农林科技大学农学院/国家小麦改良中心杨凌分中心,陕西杨凌 712100;2.甘肃省农业科学院小麦研究所,甘肃兰州 730070)
为了明确甘肃小麦春化和光周期基因的分布特点,利用STS标记对96份品种的主要春化基因位点 VRN-A1、 VRN-B1、 VRN-D1、 VRN-B3和光周期基因 PPD-D1位点的等位变异组成进行了检测和分析。结果表明,在甘肃小麦品种中,春化和光周期基因等位变异组合存在11种类型,每种类型的分布频率不同。其中, Ppd-D1a类型频率最高, Vrn-A1/ Vrn-B1/ Ppd-D1a 次之。在春麦生态区存在11种组合类型,其中 Vrn-A1/Vrn-B1/Ppd-D1a频率最高, Ppd-D1a次之。在河西灌溉春麦区、中部干旱春麦区与洮岷高寒春麦区频率最高的组合类型分别为 Vrn-A1/Vrn-B1/Ppd-D1a、Vrn-A1/Vrn-B1和 Ppd-D1a。与春麦生态区相比,冬麦生态区不存在春化基因显性变异 Vrn-A1,且仅存在 Ppd-D1a、Vrn-B1/Ppd-D1a、Vrn-D1/Pp-D1a三种类型的等位变异组合,其中, Ppd-D1a类型频率最高, Vrn-B1/Ppd-D1a次之。在陇南冬麦区、渭河上游冬麦区、泾河上游冬麦区中,基因组合类型 Ppd-D1a均占主导地位,分布频率依次为46.2%、93.6%和100%。
小麦;春化基因;光周期基因;等位变异组合
春化和光周期基因是控制小麦生长发育的重要基因,与小麦对环境的适应性紧密相关,研究春化和光周期基因的组成对小麦品种育种、引种和推广具有重要意义。
小麦春化作用主要受 VRN-1、VRN-2、VRN-3和 VRN-4四个主效基因控制[1-2]。其中,在普通小麦中,春化基因 VRN-1存在3个部分同源基因 VRN-A1、VRN-B1和 VRN-D1,分别位于染色体5A、5B和5D上;而春化基因 VRN-3的部分同源基因 VRN-A3、VRN-B3和 VRN-D3位于7A、7B和7D染色体上[3]。目前,四个主要的春化基因 VRN-A1、VRN-B1、VRN-D1和 VRN-B3已被克隆,相关功能分子标记也被开发,可用于小麦春化基因型检测[4-7]。小麦光周期反应主要受三个部分同源基因 PPD-D1、PPD-B1和 PPD-A1调控,分别定位于2D、2B和2A染色体的短臂上[8-9]。其中, PPD-D1位点对光周期反应起主导作用[10]。Beales等[10]已成功开发了 PPD-D1位点的分子标记,可用于小麦光周期基因型的检测。
甘肃的常年小麦种植总面积大约为133.33万hm2,为一个小麦生态多样化的省份,冬春麦各占一半[15]。根据地理方位、自然气候特征和小麦类型,甘肃省小麦种植区被划分为河西灌溉春麦区(27.33万hm2)、中部干旱春麦区(26.67万hm2)、洮岷高寒春麦区(10.00万hm2)、泾河上游冬麦区(32.00万hm2)、渭河上游冬麦区(20.00万hm2)、陇南冬麦区(17.33万hm2)六大生态区[15-17]。Zhang等[12]和Yang等[13]对甘肃境内河西灌溉春麦区推广的部分小麦品种主要春化和光周期基因的组成进行了分子标记检测,但关于六大生态区绝大部分小麦品种相关基因的组成还不清楚。鉴于此,本研究选取包含六大生态区的96份小麦品种,利用STS标记对其主要的春化和光周期基因进行检测,分析春化和光周期基因组成的分布特点,旨在为甘肃省小麦品种育种、引种和推广提供指导信息。
1 材料与方法
1.1 供试材料
甘肃省春小麦主要种植于河西灌溉春麦区、中部干旱春麦区两个生态区,少部分种植于洮岷高寒春麦区,故选取14份河西灌溉春麦区、11份中部干旱春麦区和7份洮岷高寒春麦区品种作为甘肃春麦的代表;冬小麦主要种植于泾河上游冬麦区与渭河上游冬麦区,少部分种植于陇南冬麦区,故选取24份泾河上游冬麦区、27份渭河上游冬麦区和13份陇南冬麦区的小麦品种来代表甘肃的冬小麦品种,共计96份品种,基本代表了当地小麦育种和生产现状。
1.2 DNA提取
为了确保待测品种检测结果的正确性,每份材料选取能代表该品种特征的三粒种子,采用SDS法提取小麦籽粒的基因组DNA[18]。
1.3 品种基因组成的STS标记检测
本研究选用Yan等[8-9]、Fu等[5]和Beales等[10]设计的特异性引物,进行春化基因(VRN-A1、VRN-B1、VRN-D1、VRN-B3 位点)和光周期基因( PPD-D1位点)检测。引物由上海生工生物工程公司合成。PCR反应体系为20 μL,包括20 mmol·L-1Tris-HCl (pH 8.4)、20 mmol·L-1KCl、0.15 mmol·L-1dNTPs、1.5 mmol·L-1MgCl2、每条引物10 pmol·μL-1、TaqDNA聚合酶1 U、模板DNA 50 ng。PCR反应程序:94 ℃预变性5 min;94 ℃变性45 s,51~63 ℃退火45 s,72 ℃延伸1 min,32个循环;72 ℃延伸8 min。PCR产物用1.5%琼脂糖凝胶电泳检测,缓冲体系为1×TAE溶液,150 V电压电泳30 min至1 h,溴化乙锭染色后用GelDoc XR System扫描成像并存入计算机。依据PCR扩增条带大小,推断品种的基因型。
2 结果与分析
2.1 供试小麦品种春化和光周期基因位点的等位变异组成
2.1.1 春化基因 VRN-A1位点
利用引物对VRN1AF与VRN1-INT1R对 VRN-A1位点进行检测,结果(图1A)表明,陇春10号等13个品种扩增出965 bp和876 bp两条特异性条带,说明这些品种 VRN-A1位点为显性等位变异 Vrn-A1a;甘麦20等5个品种扩增出714 bp特异性条带,说明这些品种 VRN-A1位点为显性等位变异 Vrn-A1b;其余78个品种均扩增出了734 bp的特异性条带,说明这些品种的 VRN-A1位点可能含有显性 Vrn-A1c或隐性 vrn-A1等位变异。再用另外2对引物Intr1/C/F与Intr/AB/R、Intr1/A/F2与Intr/A/R3分别对上述扩增出734 bp特异性条带的78个品种进一步检测,只扩增出1 086 bp特异性条带,而没有1 170 bp特异性条带(图1B),说明这些品种 VRN-A1位点为隐性等位变异 vrn-A1。可以看出,在 VRN-A1位点隐性等位变异 vrn-A1占81.3%;显性等位变异 Vrn-A1占18.8%,其中显性等位变异 Vrn-A1a和 Vrn-A1b分别占13.5%和5.2%。
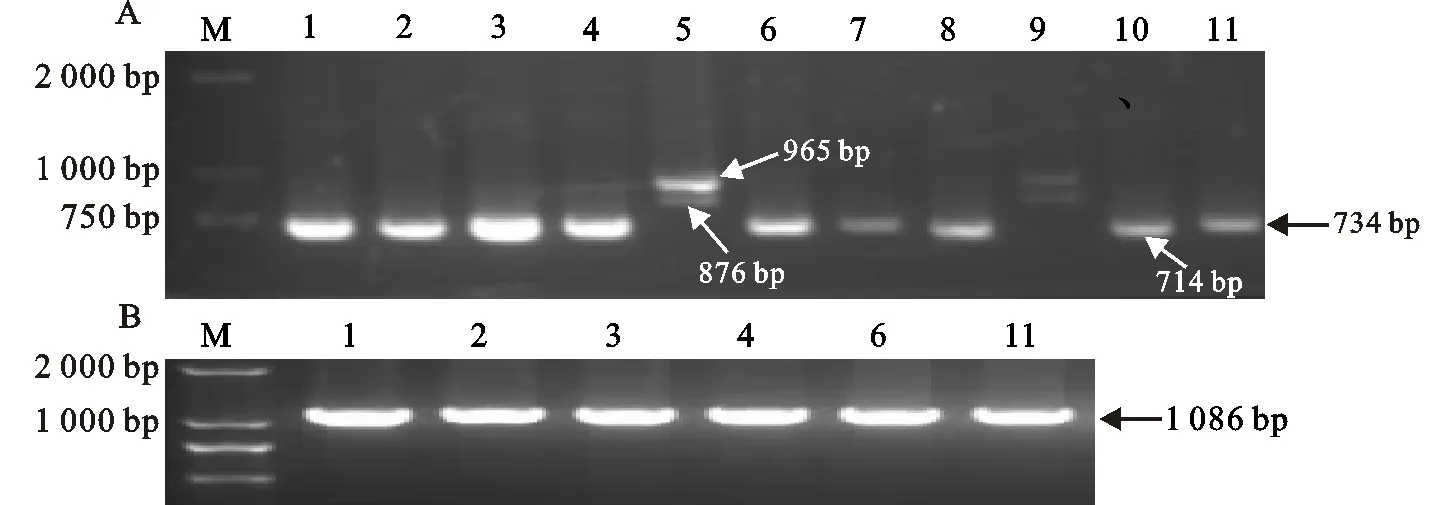
图1A所用引物为VRN1AF与VRN1-INT1R;图1B所用引物为Intrl/C/F与Intr/AB/R;M:DL2000;1:陇春8号;2:陇春23号;3:陇8139;4:定西24;5:陇春10号;6:甘麦8号;7:张春9号;8:甘春20;9:陇春15;10:张春20号;11:张春11。
The primers used in Fig.1A were VRN1AF and VRN1-INT1R;The primers used in Fig.1B were Intrl/C/F and Intr/AB/R;M:DL2000;1:Longchun 8;2:Longchun 23;3:Long 8139;4:Dingxi 24;5:Longchun 10;6:Ganmai 8;7:Zhangchun 9;8:Ganchun 20;9:Longchun 15;10:Zhangchun 20;11:Zhangchun 11.
图1 部分参试小麦品种 VRN-A1位点的扩增结果
Fig.1 PCR fragments amplified at VRN-A1 locus in several wheat cultivars
2.1.2 春化基因 VRN-B1位点
利用Zbyněk等[18]构建的多重PCR,对 VRN-B1位点进行检测,结果(图2)表明,陇8139等13个品种扩增出709 bp的特异性条带,说明这些品种的 VRN-B1位点为显性等位变异 Vrn-B1a;甘麦11号等10个品种扩增出673 bp特异性条带,说明这些品种 VRN-B1位点为显性等位变异 Vrn-B1b;其余73个品种扩增出1 149 bp特异性条带,说明这些品种 VRN-B1位点为隐性等位变异 vrn-B1。可以看出,在 VRN-B1位点隐性等位变异 vrn-B1占76.1%;显性等位变异 Vrn-B1占23.9%,其中显性等位变异 Vrn-B1a和 Vrn-B1b分别占13.5%和10.4%。
2.1.3 春化基因 VRN-D1位点
利用共用上游引物Intr1/D/F与下游引物Intr1/D/R3和Intr1/D/R4的多重体系,对 VRN-D1位点进行检测,结果(图3)表明,陇春23号等13个品种扩增出1 671 bp的特异性条带,说明这些品种 VRN-D1位点为显性等位变异 Vrn-D1;其余83个品种扩增出997 bp的特异性条带,说明这些品种 VRN-D1位点为隐性等位变异 vrn-D1。可以看出,在 VRN-D1位点隐性等位变异 Vrn-D1占87.5%;显性等位变异 Vrn-D1占12.5%。

M:DL2000;1:陇8139;2:陇春20号;3:甘麦11号;4:陇春23号;5:甘春20号;6:甘麦8号;7:张春20号;8:临麦32号。
M:DL2000;1:Long 8139;2:Longchun 20;3:Ganmai 11;4:Longchun 23;5:Ganchun 20;6:Ganmai 8;7:Zhangchun 20;8:Linmai 32.
图2 部分参试小麦品种 VRN-B1位点多重PCR扩增结果
Fig.2` Multiplex PCR fragments amplified at VRN-B1 locus in several wheat cultivars

M:DL2000;1:甘麦11;2:陇春8号;3:陇春23号;4:陇8139;5:张春20号;6:临麦32号。
M:DL2000;1:Ganmai 11;2:Longchun 8;3:Longchun 23;4:Long 8139;5:Zhangchun 20;6:Linmai 32.
图3 部分参试小麦品种 VRN-D1位点的扩增结果
Fig.3 PCR fragments amplified at VRN-D1 locus in several wheat cultivars
2.1.4 春化基因 VRN-B3位点
利用引物对VRN4-B-NOINS-F和VRN4-B-NOINS-R对 VRN-B3位点进行检测,结果(图4)表明,仅陇春30扩增出2 030 bp特异性条带,说明该品种 VRN-B3位点为显性等位变异 Vrn-B3b,其余95个品种扩增出1 140 bp特异性条带,说明其余品种 VRN-B3位点为隐性等位变异 vrn-B3。在 VRN-B3位点,隐性等位变异 vrn-B3占99.0%;显性等位变异 Vrn-B3b占1.0%。
2.1.5 光周期基因 PPD-D1位点
利用Beales等[14]开发的多重PCR体系,对 PPD-D1位点进行检测,结果(图5)表明,仅西旱2号等6个品种扩增出了415 bp的特异性条带,说明这些品种 PPD-D1位点为隐性等位变异 Ppd-D1b,占6.2%;甘麦11等90份材料中扩增出315 bp的特异性条带,说明这些品种 PPD-D1位点为显性等位变异 Ppd-D1a,占93.8%。
在冬小麦品种中,4个春化基因位点均为隐性等位变异;在春小麦品种中,4个春化基因位点至少存在1个显性等位变异,并且显性等位变异的分布频率不同,顺序为 Vrn-B1>Vrn-A1>Vrn-D1>Vrn-B3。在光周期基因 PPD-D1位点,对光反应不敏感的显性光周期等位变异 Ppd-D1a在甘肃小麦中占绝对优势,高达93.7%。

M:DL2000;1:甘春20;2:陇春25;3:平凉43;4:陇春30;5:兰天15;6:兰天17;7:兰天18。
M:DL2000;1:Ganchun 20;2:Longchun 25;3:Pingliang 43;4:Longchun 30;5:Lantian 15;6:Lantian 17;7:Lantian 18.
图4 部分参试小麦品种 VRN-B3位点的扩增结果
Fig.4 PCR fragments amplified at VRN-B3 locus in several wheat cultivars

M:DL2000;1:甘麦11;2:陇春8号;3:陇春10号;4:陇春20号;5:甘春16号;6:定西24。
M:DL2000;1:Ganmai 11;2:Longchun 8;3:Longchun 10;4:Longchun 20;5:Ganchun 16;6:Dingxi 24.
图5 部分参试小麦品种 PPD-D1位点的扩增结果
Fig.5 PCR fragments amplified at PPD-D1 locus in several wheat cultivars
2.2 春化和光周期基因的组合类型和分布
为了简化书写,在表1基因组成类型中略去了携带隐性等位变异的位点,仅列出了携带显性等位变异的位点。在甘肃小麦品种中,春化和光周期基因等位变异组合有11种类型,每种类型的分布频率不同。其中, Ppd-D1a类型频率最高(63.5%), Vrn-A1/Vrn-B1/Ppd-D1a次之(9.4%), Vrn-B1/Vrn-D1、Vrn-A1/Vrn-B1/Vrn-D1/Ppd-D1a、Vrn-B3/Ppd-D1a与 Vrn-A1/Vrn-D1频率较低,均为1.0%。在春麦生态区存在11种组合类型,其中, Vrn-A1/Vrn-B1/Ppd-D1a频率最高(28.1%), Ppd-D1a次之(18.8%)。在河西灌溉春麦区存在7种等位变异组合类型,其中 Vrn-A1/Vrn-B1/Ppd-D1a频率最高(42.9%), Ppd-D1a次之(21.4%)。在中部干旱春麦区存在5种组合类型,其中 Vrn-A1/Vrn-B1频率最高(36.4%), Vrn-A1/Ppd-D1a、 Vrn-A1/Vrn-B1/Ppd-D1a与 Vrn-B1/Vrn-D1/Ppd-D1a次之,均为18.2%。洮岷高寒春麦区存在5种组合类型,其中 Ppd-D1a频率最高(42.8%), Vrn-D1/Ppd-D1a、Vrn-A1/Ppd-D1a、Vrn-A1/Vrn-B1/Ppd-D1a与 Vrn-B1/Vrn-D1次之,均为14.3%。冬麦生态区不存在春化基因显性变异 Vrn-A1,且仅存在3种等位变异组合 Ppd-D1a、Vrn-B1/Ppd-D1a、Vrn-D1/Pp-D1a。其中, Ppd-D1a类型频率最高(85.9%), Vrn-B1/Ppd-D1a次之(7.8%), Vrn-D1/Ppd-D1a频率最低(6.2%)。在陇南冬麦区存在三种组合类型,其中 Ppd-D1a频率最高(46.2%), Vrn-B1/Ppd-D1a次之(38.5%)。在渭河上游冬麦区存在2种组合类型,其中 Ppd-D1a频率最高(93.6%), Vrn-D1/Ppd-D1a次之(7.4%)。在泾河上游冬麦区仅存在 Ppd-D1a类型。

表1 春化和光周期基因显性等位变异组合在甘肃不同生态区的分布Table 1 Distribution of dominant alleles at vernalization and photoperiod gene loci in Gansu ecological regions %
3 讨 论
春化和光周期阶段是小麦抽穗开花之前经历的两个重要的生理发育环节[20-21]。春化基因的显性等位变异可以减少或消除小麦对低温春化作用的需求,其中, VRN-A1位点显性等位变异没有春化作用的需求, VRN-B1与 VRN-D1位点显性等位变异需要一定低温春化作用的需求[19]。光周期基因 PPD-D1位点的显性等位变异 Ppd-D1a使小麦变为对光照不敏感型,即在短光照条件下也可正常抽穗开花[10]。
在三个甘肃冬小麦生态区中,从陇南冬麦区(气温为-0.3~-8.8 ℃,无霜期为215~278 d)到渭河上游冬麦区(气温为-7.5~-10.3 ℃,无霜期为180~230 d),再到泾河上游冬麦区(气温为-9.0~-15.8 ℃,无霜期为135~210 d),一月份平均气温逐渐降低并且无霜期逐渐变短;小麦生育周期在生产上表型为从陇南冬麦区(181~218 d)到渭河上游冬麦区(230~240 d),再到泾河上游冬麦区(270~280 d)逐渐延长[11]。相应种植的小麦品种对低温春化作用的需求量逐渐增大,小麦品种的冬性特性逐渐增强。这表明陇南冬麦区小麦品种冬性最弱,携带 Ppd-D1a/Vrn-B1和 Ppd-D1a/Vrn-D1两种基因组合类型的品种数量增加;渭河上游冬麦区小麦品种冬性次之,多携带 Ppd-D1a/Vrn-D1组合类型;泾河上游冬麦区小麦品种冬性最强,品种不存在春化基因的显性等位变异,仅含有携带对光周期不敏感的单一显性等位变异 Ppd-D1a类型。
河西灌溉春麦区种植品种的基因组合类型 Ppd-D1a/Vrn-A1/Vrn-B1占主导地位,中部干旱春麦区组合类型 Vrn-A1/Vrn-B1占主导地位,洮岷高寒春麦区 Ppd-D1a占主导地位。一方面河西灌溉春麦区与中部干旱春麦区均属于西北春麦区[11],为了避免小麦受早春的霜冻和成熟后期干热风等灾害影响,要求每年三月上旬播种,8月上旬成熟;而洮岷高寒春麦区,为了避免小麦受到高原冻害影响,要求每年三月中旬播种9月中旬成熟,小麦生长周期明显长于另外两个春麦生态区。因此,为了使小麦尽早开花成熟,缩短生育周期,河西灌溉春麦区与中部干旱春麦区的显性春化基因组成均以 Vrn-A1/Vrn-B1占主要地位,而在洮岷高寒春麦区 Vrn-A1/Vrn-B1组合频率明显降低。另一方面,从河西灌溉春麦区(38°56′N)到洮岷高寒春麦区(36°22′N)到中部干旱春麦区(36°06′N),纬度依次降低,小麦生育期年光照时间逐渐增长。因此,在生育期光照时间最长的中部干旱春麦区, Ppd-D1a类型的比重降低,以 Vrn-A1/Vrn-B1组合类型占主要地位。
在我国十大麦区中,黄淮冬麦区与东北春麦区分别为冬春麦的主产区[11]。为了给主产区小麦研究者选择或引进材料是提供参考,对比甘肃地区( Ppd-D1a>Vrn-A1/Vrn-B1/Ppd-D1a>Vrn-D1/Ppd-D1a)与黄淮冬麦区小麦( Ppd-D1a>Vrn-D1/Ppd-D1a>Vrn-B1/Ppd-D1a)[22]在春化与光周期基因型组成的差异,可以发现两个地区均以 Ppd-D1a类型占主导地位且 Vrn-D1/Ppd-D1a类型占较高频率;不同的是在甘肃小麦中 Vrn-A1/Vrn-B1/Ppd-D1a占较高频率,而在黄淮冬麦区小麦中 Vrn-B1/Ppd-D1a占较高频率。同时,对比甘肃地区与东北春麦区( Vrn-A1/Vrn-D1/Ppd-D1b>Vrn-A1/Vrn-B1/Vrn-D1/Ppd-D1b>Vrn-A1/Vrn-B1/Ppd-D1a)在春化与光周期基因组成的差异,可以发现在光周期位点,东北春麦区与甘肃小麦不同,以携带光敏感型 Ppd-D1b为主;在春化位点中,东北春麦区小麦以携带对春化作用最不敏感的 Vrn-A1类型为主,并伴随其他显性春化基因。
从本文研究结果可以看出,在三个甘肃冬麦生态区,种植携带光周期不敏感型基因 Ppd-D1a品种比较适宜。在河西灌溉春麦区,需要推广含 Ppd-D1a/Vrn-A1/Vrn-B1基因组合为主的品种;在中部干旱春麦区,应多种植含 Vrn-A1/Vrn-B1基因组合类型的品种,也可推广含 Vrn-A1/Ppd-D1a、Vrn-A1/Vrn-B1/Ppd-D1a与 Vrn-B1/Vrn-D1/Ppd-D1a基因组合的品种;在洮岷高寒春麦区,应种植以携带 Ppd-D1a类型品种为主,也可种植含 Vrn-D1/Ppd-D1a、Vrn-A1/Ppd-D1a、Vrn-A1/Vrn-B1/Ppd-D1a与 Vrn-B1/Vrn-D1基因组合的品种。本研究利用分子标记,对96份甘肃小麦品种春化和光周期基因进行检测,得到了甘肃六大生态区主要春化与光周期基因组成的分布特点,为甘肃省小麦品种育种、引种和推广提供指导信息。但因其他春化和光周期基因位点还没有有效的分子标记,本文还没有检测;随着其他春化和光周期基因研究深入,可望为甘肃小麦广适性育种改良提供更全面的信息。
[1]FLOOD R G,HALLORAN G M.Geneties and physiology of vernalization response in wheat [J].AdvancesinAgronomy,1986,39:7.
[2]HOOGENDOOR J.The physiology of variation in the time of ear emergence among wheats from different regions of the world [J].Euphytica,1985,34:559.
[3]LAW C N,WORLAND A J,GIORGI B.The genetic control of ear emergence time by chromosome 5A and 5D wheat [J].Heredity,1976,36:49.
[4]YAN L,FU D,LI C,etal.The wheat and barley vernalization gene VRN3 is an orthologue of FT [J].ProceedingoftheNationalAcademyScienceUSA,2006,103(51):19581.
[5]YAN L,HELGUERA M,KATO K,etal.Allelic variation at the VRN-1 promoter region in polyploidy wheat [J].TheoreticalandAppliedGenetics,2004,303:1640.
[6]YAN L,LOUKOIANOV A,TRANQUILLI G,etal.Positional cloning of the wheat vernalization gene VRN1 [J].ProceedingoftheNationalAcademyScienceUSA,2003,100:6263.
[7]FU D,SZCS P,YAN L,etal.Large deletions within the first intron in VRN-1 are associated with spring growth habit in barley and wheat [J].MolecularGeneticsandGenomics, 2005,273:54.
[8]WELSH J R,KEIN D L,PIRASTEH B,etal.Genetic control of photoperiod response in wheat [C].Missouri:Proceeding of the 4th International Wheat Genetic Symposium,1973:879.
[9]LAW C N,SUTKA J,WORLAND A J.A genetic study of day length response in wheat [J].Heredity,1978,41:185.
[10]BEALES J,TURNER A,GRIFFITHS S,etal.A pseudo-response regulator is misexpressed in the photoperiod insensitive Ppd-D1a mutant of wheat (TriticumaestivumL.) [J].TheoreticalandAppliedGenetics,2007,115:721.
[11]ZHUANG Q S.Wheat Improvement and Pedigree Analysis in Chinese Wheat Cultivars [M].Beijing:China Agriculture Press,2003:100-105.
[12]ZHANG X K,XIAO Y G,HANG Y Z,etal.Allelic variation at the vernalization genes Vrn-A1, Vrn-B1, Vrn-D1 and Vrn-B3 in Chinese wheat cultivars and their association with grow habit [J].CropScience,2008,48:458.
[13]YANG F P,ZHANG X K,XIA X C,etal.Distribution of the photoperiod insensitive Ppd-D1a allele in Chinese wheat cultivars [J].Euphytica,2008,165:445.
[14]CHEN F,GAO M,ZHANG J,etal.Molecular characterization of vernalization and response genes in bread wheat from the Yellow and Huai Valley of China [J].BMCPlantBiology,2013,13:199.
[15]SHANG X W,KANG Z Y,CHAI S Y,etal.The ecological region of wheat quality and advice for industrilization of high quality wheat in Gansu [J].2003,5:10.
[16]DONG Y S,ZHENG D S.Wheat Genetic Resources in China [M].Beijing:China Agriculture Press,2000:100-110.
[17]YANG W X.Technical Guidance of Wheat Production in Gansu [M].Beijing:China Agriculture Press,2009:42-55.
[18]MILEC Z,TOMKOV L,SUMKOVT,etal.A new multiplex PCR test for the determination of Vrn-B1 alleles in bread wheat(TriticumaestivumL.) [J].MolecularBreeding,2012,30:317.
[19]LOUKOIANOV A,YAN L,BLECHL A,etal.Regulation of vernalization genes in normal and transgenic polyploidy wheat [J].PlantPhysiology,2005,138(4):2364.
[20]田芳慧,阳 霞,刘路平,等.黄淮麦区小麦品种春化光周期基因型及其与产量性状的相关性[J].麦类作物学报,2013,33(4):647.
TIAN H F,YANG X,LIU L P,etal.Composition of vernalization and photoperiod and correlation with the composition and yield traits in wheat cultivars from Huanghuai Wheat Production Area [J].JournalofTriticeaeCrops,2013,33(4):647.
[21]王宪国,杨 杰,白升升,等.青海和西藏小麦品种主要春化基因的组成分析[J].麦类作物学报,2015,35(10):1341.
WANG X G,YANG J,BAI S S,etal.Composition analysis of vernalization genes in Qinghai and Tibet wheat varieties [J].JournalofTriticeaeCrops,2015,35(10):1341.
[22]张志红,张晓科,孙道杰,等.春化和光周期基因在陕西小麦品种中的分布[J].麦类作物学报,2009,29(3):401.
ZHANG Z H,ZHANG X K,SUN D J,etal.Distribution of vernalization and photoperiod genes in Shaanxi wheat cultivars [J].JournalofTriticeaeCrops,2009,29(3):401.
[23]刘文林,张宏纪,刘东军,等.黑龙江小麦春化和光周期主要基因组成分析[J].植物遗传资源学报,2014,15(6):1352.
LIU W L,ZHANG H J,LIU D J,etal.Disrtibution of allelic variation for vernalization and photoperiod genes in the wheat varieties from Heilongjiang [J].JournalofPlantGeneticResources,2014,15(6):1352.
Combination and Distribution of Vernalization and Photoperiod Genes in Wheat Varieties from Gansu Province
ZHANG Bo1,BAI Bin2,ZHANG Xueting2,YANG Zhiquan1,WANG Xiaolong1,ZHANG Xiaoke1
(1.College of Agronomy,Northwest A&F University,Yangling,Shaanxi 712100,China;2.The Wheat Research Institute,Gansu Academy of Agriculture Science,Lanzhou,Gansu 730070,China)
In order to survey the distribution of vernalization and photoperiod genes in wheat varieties from Gansu province,96 varieties were characterized with STS markers for the vernalization and photoperiod loci VRN-A1,VRN-B1,VRN-D1,VRN-B3 and PPD-D1.There were eleven types of combination of vernalization and photoperiod genes in these varieties. Each region contained different frequencies of each combination type. Ppd-D1a showed highest frequency,followed by Vrn-A1/Vrn-B1/Ppd-D1a. There were eleven types of combination in spring wheat region. Vrn-A1/Vrn-B1/Ppd-D1a type showed the highest frequency,followed by Ppd-D1a. Vrn-A1/Vrn-B1/Ppd-D1a,Vrn-A1/Vrn-B1 and Ppd-D1a showed the highest frequencies in Hexi irrigated spring wheat region,central arid spring wheat region and Taomin cold spring wheat region,respectively. There was no Vrn-A1 allele in winter wheat region,where only three types of combination ( Ppd-D1a,Vrn-B1/Ppd-D1a,Vrn-D1/Pp-D1a) can be detected. Ppd-D1a showed the highest frequency,followed by Vrn-B1/Ppd-D1a type. Ppd-D1a type accounted the highest frequencies in Longnan winter wheat region,Wei river upstream winter region and Jing river upstream winter wheat region for 46.2%,93.6%,and 100%,respectively.
Wheat;Vernalization genes;Photoperiod gene;Combination of allelic variation
时间:2017-07-07
网络出版地址:http://kns.cnki.net/kcms/detail/61.1359.S.20170707.1815.004.html
2017-02-16
2017-06-12
国家重点基础研究发展计划(973计划)项目(2014CB138102);陕西省重点科技创新团队计划项目(2014KCT-25);西北农林科技大学唐仲英育种基金项目
E-mail:13649272692@163.com
张晓科(E-mail:zhangxiaoke66@126.com)
S512.1;S330
A
1009-1041(2017)07-0864-07

