PEG胁迫对不同小麦品种幼苗抗旱生理指标的影响
谢 燕,张庆龙,胡 玲,王法宏,李豪圣,孔令安
(山东省农业科学院作物研究所,山东济南 250100)
PEG胁迫对不同小麦品种幼苗抗旱生理指标的影响
谢 燕,张庆龙,胡 玲,王法宏,李豪圣,孔令安
(山东省农业科学院作物研究所,山东济南 250100)
为给小麦抗旱育种的早期筛选工作提供理论依据,以济麦262(抗旱型)、烟农19(中间型)和临麦2号(水分敏感型)为材料,采用PEG模拟干旱胁迫,探究干旱胁迫对不同小麦品种幼苗生物量、含水量、根系形态特征、抗氧化酶活性和叶绿素荧光参数的影响。结果表明,PEG胁迫下,三个品种中济麦262的生物量最大,地下部含水量显著高于临麦2号和烟农19;其根系的总长、总投影面积、总面积和总体积最大,且受抑制程度最低;其抗氧化酶活性在一定程度上明显增强,尤其是叶片和根系过氧化物酶、根系超氧化物歧化酶及叶片过氧化氢酶活性增强幅度显著高于临麦2号和烟农19;其叶片光化学荧光淬灭系数(qP)和PSⅡ的实际光化学效率与CK相比均呈下降的趋势,其中qP下降程度最低,荧光非光化学淬灭显著增强且高于其他两个品种。综上所述,在PEG胁迫下抗旱品种的生长受抑制程度最小,清除氧自由基能力较强,光能利用率高。
PEG胁迫;冬小麦;根系形态特征;叶绿素荧光参数
干旱影响农作物的生长发育和产量[1-2],是目前农业科学研究的一个世界性问题[3]。我国是一个水资源匮缺、干旱灾害频发的国家[4]。在我国北方小麦生长过程中冬春季节的干旱比较普遍,严重影响小麦分蘖和幼穗分化,进而导致小麦群体数量不足和质量不高,难以为后期产量形成奠定良好基础。因此,开展小麦的抗旱生理机制研究对小麦抗旱育种和旱地栽培有重要指导意义[5]。小麦的抗旱性是一个复杂的生物学性状,是多个因素共同作用的结果[6-8]。前人对小麦抗旱性进行了大量研究。研究表明,在PEG胁迫下,小麦萌发期胚芽鞘的脯氨酸含量升高[9],小麦幼苗相对含水量和可溶性蛋白含量下降[10],超氧化物歧化酶(SOD)活性先降后升,丙二醛含量升高[11]。然而目前对干旱胁迫下冬小麦苗期抗旱性与其根系特征和叶片荧光特性间的关系报道较少。本研究采用PEG模拟干旱胁迫,测定和分析不同品种小麦幼苗含水量、根系形态特征、抗氧化酶活性和叶绿素荧光特性的变化,以期为小麦抗旱育种的早期筛选工作提供理论依据。
1 材料与方法
1.1 实验材料
实验于2014年9月至2016年6月在山东省农业科学院小麦栽培实验室进行。供试小麦品种为济麦262(抗旱型)、烟农19(中间型)和临麦2号(敏感型)。
1.2 实验设计
精选小麦种子,用70%乙醇消毒后,水中浸泡吸胀5 h,于25 ℃恒温培养箱中萌发;5 d后,挑选生长基本一致的幼苗移至装有Hoagland营养液的塑料盒内,置于光照培养箱内培养。培养箱中昼夜温度为24 ℃/18 ℃,相对湿度70%左右,叶面光强约为800 mol·m-2·s-1,光照时间为每天14 h。待幼苗生长至两叶一心期,用含有25% PEG-6000的Hoagland营养液处理,以无PEG胁迫为对照(CK),每个处理设3个重复,处理5 d后取样测定不同生理指标。
1.3 测定指标与方法
1.3.1 幼苗干鲜重和含水量测定
将待测植株冲洗干净,用吸水纸吸干其表面水分,分为地上部和地下部,分别用电子天平称鲜重。再将样品放在105 ℃鼓风干燥箱中杀青30 min,然后放入烘箱,在75 ℃下烘干至恒重,用电子天平称干重,计算植株含水量。含水量=(鲜重-干重)/鲜重×100%
1.3.2 根系形态特征分析
利用Epson Scan(Epson Perfection V800 Photo)对选取的小麦根系进行图像扫描,然后通过WinRHIZO软件进行数据分析。
1.3.3 活性氧(ROS)含量和抗氧化酶活性测定
用DCFH-DA法[12]测定ROS含量,其单位被定义为每分钟每毫克新鲜样本平均增加的DCF荧光量。采用愈创木酚法测定小麦过氧化物酶(POD)活性[13],氮蓝四唑法测定小麦SOD活性[14-15],过氧化氢法测定小麦过氧化氢酶(CAT)活性[16-18],考马斯亮蓝G250染色法测定可溶性蛋白含量[19]。
1.3.4 荧光参数测定
利用FluorCam开放式叶绿素荧光成像系统(Photon System Instruments公司生产)测定叶绿素荧光动力学参数。测定时选取生长一致且受光方向相同的叶片(每处理3叶),先暗适应30 min,依照Nedbal[20]的方法测定,测定参数包括初始荧光(F0)、最大荧光(Fm)、光稳态时的最大荧光(Fm′)、光稳态时的实时荧光(Ft′)、光稳态时的最小荧光(F0′)和稳态荧光产量(Fs),计算光化学荧光淬灭系数(qP)、原初光能转换效率(Fv/Fm)、PSⅡ的实际光化学效率(ФPSⅡ)和荧光非光化学淬灭系数(NPQ)。
qP=(Fm′-Ft′)/(Fm′-F0′);Fv/Fm=(Fm-F0)/Fm;ФPSⅡ=(Fm′-Ft′)/Fm′;NPQ=(Fm-Fm′)/Fm′;Rfd=(Fm-Fs)/Fs。
1.4 数据统计
用WPS软件整理数据,计算均值和标准误差,并绘制图表。采用DPS(Data Processing System v7.05,浙江杭州睿丰信息技术有限公司)数据处理软件进行统计分析,采用Duncan新复极差法分析处理间差异显著性(α=0.05)。
2 结果与分析
2.1 PEG胁迫对不同小麦品种植株生物量和含水量的影响
PEG胁迫后,临麦2号、烟农19和济麦262的叶片均出现萎蔫和干枯状。PEG胁迫下,三个品种中济麦262地上部鲜重最大,烟农19次之,临麦2号最低,三个品种较CK分别下降了41.03%、59.03%和49.16%;济麦262地上部干重显著高于临麦2号和烟农19,且较CK略有升高,而临麦2号和烟农19较CK分别下降了2.06%和36.95%;济麦262、临麦2号和烟农19间地上部含水量差异不显著,但均较CK显著下降,降幅分别为8.44%、10.33%和6.51%(表1)。说明在PEG胁迫下,济麦262地上部生长受影响较小,临麦2号和烟农19明显受到抑制。
PEG胁迫下,济麦262地下部的鲜重最大,临麦2号次之,烟农19最低,三个品种较CK分别下降了3.60%、3.61%和50.28%;济麦262地下部的干重最高,临麦2号和烟农19差异不显著,三个品种较CK分别升高了55.07%、47.57%和0.25%;济麦262地下部的含水量最高,临麦2号次之,烟农19最低,三者之间差异显著,且较CK分别降低了6.86%、7.71%和13.74%。说明干旱对济麦262和临麦2号根系造成的伤害较小,对烟农19影响较大。

表1 PEG胁迫对不同小麦品种植株生物量积累和含水量的影响Table 1 Effects of PEG treatment on the biomass accumulation and the relative water content of different wheat cultivars
同列数值后的不同字母表示品种间在0.05水平上差异显著。
Different letters following the values within the same column are significantly different among the varieties at the 0.05 probability level.
2.2 PEG胁迫对不同小麦品种根系形态特征的影响
PEG胁迫对临麦2号、烟农19和济麦262幼苗根系的形态特征影响显著(图1)。PEG胁迫后三个品种的根系总长、总投影面积、总表面积和总体积显著低于CK。PEG胁迫5 d后,济麦262的总根长最大,临麦2号次之,烟农19最低,且三个品种较CK分别下降了53.73%、64.22%和63.78%(图1A);济麦262的根系总投影面积最大,烟农19其次,临麦2号最小,且较CK分别下降了46.98%、53.14%和60.47%(图1B);PEG胁迫下,济麦262根系的总表面积最大,烟农19次之,临麦2号最小,且三个品种较CK分别减少了46.98%、49.65%和62.09%(图1C);济麦262的根系总体积高于临麦2号和烟农19,且三个品种较CK分别下降了36.12%、55.11%和35.08%(图1D)。由此可知,三个品种中济麦262根系适应干旱胁迫能力最强,烟农19次之,临麦2号最弱。
2.3 PEG胁迫对不同小麦品种活性氧(ROS)含量及抗氧化酶活性的影响
PEG胁迫下,济麦262的ROS含量最低,烟农19次之,临麦2号最高,且济麦262较CK降低了9.01%,而临麦2号和烟农19较CK分别升高了3.74%和30.81%(图2),说明干旱胁迫下济麦262的ROS积累较少,细胞受伤害的程度低于临麦2号和烟农19。
从图3来看,PEG胁迫下,三个品种中济麦262的叶片POD活性最大,烟农19次之,临麦2号最低,且济麦262和烟农19较CK分别升高了25.86%和11.92%,而临麦2号较CK降低了16.09%;济麦262的根系POD活性高于临麦2号和烟农19,且济麦262较CK升高了47.07%,而临麦2号和烟农19较CK分别下降了9.66%和15.63%。PEG胁迫下,济麦262的叶片SOD活性高于临麦2号和烟农19,但差异均不显著,三个品种较CK分别升高了63.21%、88.33%和48.45%;济麦262的根系SOD活性显著高于临麦2号和烟农19,与CK相比三个品种分别升高了43.57%、15.61%和8.81%。PEG胁迫下,济麦262的叶片CAT活性显著高于临麦2号和烟农19,济麦26和临麦2号较CK分别升高了63.92%和42.13%,而烟农19 较CK降低了0.53%;三个品种中烟农19的根系CAT活性最大,显著高于临麦2号和济麦262,较CK升高了12.97%,而临麦2号和济麦262与CK相比分别下降了55.43%和32.92%。由上述结果可知,济麦262在受到干旱胁迫后体内抗氧化酶活性显著增强,尤其是叶片和根系POD、根系SOD及叶片CAT活性增强幅度显著高于临麦2号和烟农19,这对有效地清除体内产生的多余的氧自由基、防止膜脂过氧化、保持植株正常的生长状况具有重要作用。

图柱上的不同字母表示品种间在0.05水平上差异显著。下图同。
Different letters after the values on the columns are significantly different among the varieties at the 0.05 probability level. The same in other figures
图1 PEG胁迫对不同小麦品种总根长、根系总投影面积、根系总表面积和根系总体积的影响
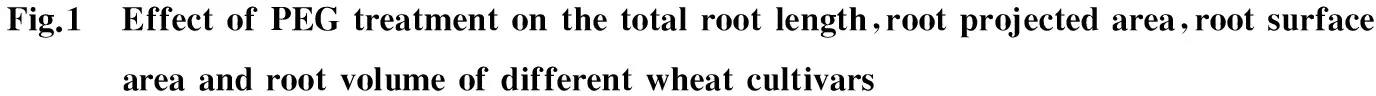

图2 PEG胁迫对不同小麦品种ROS含量的影响Fig.2 Effect of PEG treatment on ROS content of different wheat cultivars
2.4 PEG胁迫对不同小麦品种叶片荧光特性的影响
测定结果(图4)表明,PEG胁迫对临麦2号、烟农19和济麦262叶片荧光特性影响显著。PEG胁迫下,济麦262的叶片qP最高,烟农19次之,临麦2号最低,且济麦262较CK下降程度低于临麦2号和烟农19,三个品种分别较CK下降了4.82%、18.29%和8.64%。PEG胁迫下,三个品种中济麦262叶片的Rfd高于临麦2号和烟农19,与CK相比升高了174.29 %,而临麦2号和烟农19 分别升高了33.11 %和4.24 %。PEG胁迫后,济麦262的叶片ΦPSⅡ高于临麦2号和烟农19,三个品种较CK分别下降了18.74%、24.64%和17.25%。PEG胁迫下,济麦262的NPQ最高,较CK升高了176.71%,临麦2号升高了21.19%,烟农19降低了5.62%。济麦262的叶绿素荧光参数均高于临麦2号和烟农19,济麦262的qP下降程度较小,电子传递效率高,Rfd升高最多,潜在量子转化效率大,能将多余的能量散失出去,有利于减少植株所受伤害。

图3 PEG胁迫对不同品种小麦植株POD、SOD和CAT活性的影响Fig.3 Effects of PEG treatment on the POD,SOD and CAT activity in different wheat cultivars
3 讨 论
干旱直接抑制作物的生长。植株生物量和含水量是评价作物抗旱性的重要指标,反映了植株生长发育的状况[21]。本研究中,PEG胁迫下济麦262植株鲜重和干重均显著高于临麦2号和烟农19,且相对于CK的比例最大;地下部含水量最高,而烟农19地上部含水量表现最好,较CK下降程度最低,临麦2号表现较差,说明PEG胁迫后济麦262生长受抑制的程度最低。
在土壤-植物-大气系统中,土壤水分直接被作物根系吸收利用,当土壤干旱缺水时作物根系首先感应并合成大量ABA,这些ABA随蒸腾作用转运到地上部分,引起整个植株对水分胁迫做出响应,此时根系形态结构也发生相应变化[22-23]。研究表明,水分胁迫下,根系在土壤剖面的可调节性分布对根系吸水功能和作物生产力具有重要作用[24]。小麦等作物通过调整根系的形态特征和生长速度来适应干旱胁迫[25],根长、根表面积、根体积等会影响植株抵抗干旱的能力,与植株正常的生理功能具有密切的联系[26-27]。本研究中,PEG胁迫5 d 后,济麦262根系的总长度、总投影面积、总表面积和总体积均最高,烟农19次之,临麦2号最低,且济麦262较CK下降程度最低。由于根部形态特征的变化反映了根的生长和水分状况,因而这种变化程度越小,说明根受干旱胁迫的伤害越少,抗旱性越强,这是植物适应缺水条件的一种机制[28]。三个品种中济麦262通过促进根系伸长,增加表面积,使得深层根相对增加,从而更加充分地利用土壤水分,具有更强的抗旱能力,这与前人研究的干旱响应机制一致[29]。

图4 PEG胁迫对不同小麦品种叶片叶绿素荧光参数(qP,Rfd,ΦPSⅡ 和NPQ)的影响
干旱胁迫下,如果保护酶系统不能及时有效地清除体内多余的自由基,植物体内的活性氧(ROS)就会大量积累,造成脂膜过氧化,抑制植株正常的生长发育[30]。POD、SOD和CAT是自由基的清除剂,其活性的大小与作物抗旱性密切相关[31]。本实验结果表明,PEG胁迫下,济麦262叶片中ROS含量均低于临麦2号和烟农19,其整株的POD、根中的SOD和叶片中的CAT活性显著高于临麦2号和烟农19,说明其清除氧自由基的能力较强,具有更强的细胞膜稳定性。
植物叶绿素荧光淬灭由光化学淬灭和非光化学淬灭两个过程构成,以耗散过剩的光能。非光化学淬灭是一种自我保护机制,对光合机构起保护作用,因此叶绿素荧光参数可作为判断小麦是否抗旱的重要指标。有研究证明,植物体内有效的热耗散可以防止光抑制的发生[32]。qP反映了ΦPSⅡ天线色素吸收的光能用于光化学电子传递的份额,还可以反映电子光合链的电子传递速率及其参与CO2固定的效率[33-34]。荧光下降比值可反映叶片光合作用活力即叶片潜在的光合作用量子转化效率[35]。PEG胁迫下,济麦262的qP最高,烟农19次之,临麦2号最低,且济麦262较CK下降程度最低,电子传递效率高。济麦262的荧光下降比值高于其他两个品种,且较CK升高程度最大,潜在量子转化效率大。植物叶片不能把所捕获的光能都用于光合作用,多余能量须以热量形式散失掉,以有效保护地光合机构[36]。PEG胁迫下济麦262叶片的NPQ显著高临麦2号和烟农19,且济麦262较CK升高程度较大,说明济麦262叶片受到PEG胁迫后能更有效地将多余的能量散失出去,以减少植株所受伤害。
综上所述,PEG胁迫下,三个品种中济麦262的生物量和地下部含水量高于临麦2号和烟农19,其根系生长发育受抑制的程度最低,抗氧化酶活性显著增强,叶片的光合特性受影响最小,表明济麦262的抗旱能力高于临麦2号和烟农19。
[1]周宜君,冯金朝,马文文,等.植物抗逆分子机制研究进展[J].中央民族大学学报(自然科学版),2006,15(2):169.
ZHOU Y J,FENG J C,MA W W,etal.Progress of molecular mechanism of stress resistance in plants [J].JournaloftheCentralUniversityforNationalities(NaturalSciencesEdition),2006,15(2):169.
[2]KANNANGARA R,BRANIGAN C,LIU Y,etal.The transcription factor WIN1/SHN1 regulates cutin biosynthesis inArabidopsisthaliana[J].PlantCell,2007,19(4):1278.
[3]丁声俊.干旱灾害与粮食安全 [J].中国食物与营养,2009(4):4.
DING S J.Drought disaster and food security [J].FoodandNutritioninChina,2009(4):4.
[4]王贺正,马 均,刘慧远.水稻抗旱性研究现状与展望[J].中国农学通报,2005,21(1):110.
WANG H Z,MA J,LIU H Y.Present situations and prospects of study on rice drought resistance [J].ChineseAgriculturalScienceBulletin,2005,21(1):110.
[5]许 兴,郑国琦,邓西平,等.水分和盐分胁迫下春小麦幼苗渗透调节物质积累的比较研究[J].干旱地区农业研究,2002,20(1):52.
XU X,ZHENG G Q,DENG X P,etal.Comparison study on osmotic adjustment of accumulation of spring wheat seedlings in water and salt stress [J].AgriculturalResearchintheAridAreas,2002,20(1):52.
[6]郑桂萍,李金峰,钱永德,等.农作物综合抗旱性指标的评价分析[J].中国农学通报,2005,21(10):109.
ZHENG G P,LI J F,QIAN Y D,etal.Evaluation on comprehensive drought resistant index of crops [J].ChineseAgriculturalScienceBulletin,2005,21(10):109.
[7]栗雨勤,张文英,王有增,等.作物抗旱性鉴定指标研究及进展[J].河北农业科学,2004,8(1):58.
LI Y Q,ZHANG W Y,WANG Y Z,etal.Advances of studies on crop drought resistance identification [J].JournalofHebeiAgriculturalSciences,2004,8(1):58.
[8]冀天会,张灿军,杨子光,等.小麦抗旱性鉴定方法及评价指标研究Ⅲ.合评价指标的比较研究[J].中国农学通报,2007,23(10):422.
JI T H,ZHANG C J,YANG Z G,etal.Study on resistance drought identify method and evaluation index of wheat Ⅲ.The comparative study on synthesis evaluation index [J].ChineseAgriculturalScienceBulletin,2007,23(10):422.
[9]张玉梅,林 琪,姜 雯,等.渗透胁迫条件下不同抗旱性小麦品种萌发期生理生化指标的变化[J].麦类作物学报,2006,26(6):125.
ZHANG Y M,LIN Q,JIANG W,etal.Effect of osmotic stress on physiological and biochemical indices at germination stage of different drought resistant wheat [J].JournalofTriticeaeCrops,2006,26(6):125.
[10]唐玉婧,马 猛,邓西平,等.干旱胁迫下小麦抗旱能力与其根系特征间的关系[J].西北农林科技大学学报(自然科学版),2014,42(4):48.
TANG Y J,MA M,DENG X P,etal.Relationship between drought resistance and root characteristics of wheat under drought stress [J].JournalofNorthwestA&FUniversity(NaturalScienceEdition),2014,42(4):48.
[11]孟健男,于 晶,苍 晶,等.PEG胁迫对两种冬小麦苗期抗旱生理特性的影响[J].东北农业大学学报,2011,42(1):40.
MENG J N,YU J,CANG J,etal.Effect of PEG stress on drought resistance physiological indices of two winter wheats at seedling stage [J].JournalofNortheastAgriculturalUniversity,2011,42(1):40.
[12]KONG L A,SUN M Z,XIE Y,etal.Photochemical and antioxidative responses of the glume and flag leaf to seasonal senescence in wheat [J].FrontiersinPlantScience,2015,6:358.
[13]TATIANA Z,YAMASHITA K,MATSUMOTO H.Iron deficiency induced changes in ascorbate content and enzyme activities related to ascorbate metabolism in cucumber roots [J].PlantCellPhysiology,1999,40:273.
[14]MISRA H P,FRIDOVICH I.The role of superoxide anion in the autoxidation of epinephrine and a simple assay for superoxide dismutase [J].JournalofBiologicalChemistry,1972,247(10):3170.
[15]DHINDSA R S,PLUMP-DHINDSA P,THORPE T A.Leaf senescence correlated with increased levels of membrane permeability a lipid peroxidation,and decreased levels of superoxide dismutase and catalase [J].JournalofExperimentalBotany,1981,32(126):93.
[16]SAIRAM R K,SRIVASTAVA G C.Water stress tolerance of wheat(TriticumaestivumL.):variations in hydrogen peroxide accumulation and antioxidant activity in tolerant and susceptible genotypes [J].JournalofAgronomy&CropScience,2001,186:63.
[17]MISHRA N P,MISHRA R K,SINGHAL G S.Changes of antioxidant enzymes in the activities of antioxidant enzyme during exposure of intact wheat leaves to strong visible light at different temperatures in the presence of protein synthesis inhibitors [J].PlantPhysiology,1993,102(3):903.
[18]KANG H M,SALVEIT M E.Effect of chilling on antioxidant enzymes and DPPH-radical scavenging activity of high- and low-vigour cucumber seedling radicles [J].PlantCell&Environment,2002,25:1233.
[19]高俊凤.植物生理学实验指导[M].北京:高等教育出版社,2006:142.
GAO J F.Experimental instruction of plant physiology [M].Beijing:Higher Education Press,2006:142.
[20]NEDBAL L,SOUKUPOVJ,KAFTAN D,etal.Kinetic imaging of chlorophyll fluorescence using modulated light [J].PhotosynthesisResearch,2000,66(1):3.
[21]REYNOLDS M P,SINGH R P,IBRAHIM A,etal.Evaluating physiological traits to complement empirical selection for wheat in warm environments [J].Euphytica,1998,100:85.
[22]张岁岐,周小平,慕自新,等.不同灌溉制度对玉米根系生长及水分利用效率的影响[J].农业工程学报,2009,25(10):1.
ZHANG S Q,ZHOU X P,MU Z X,etal.Effects of different irrigation patterns on root growth and water use efficiency of maize [J].TransactionsoftheChineseSocietyofAgriculturalEngineer,2009,25(10):1.
[23]王家顺,李志友.干旱胁迫对茶树根系形态特征的影响[J].河南农业科学,2011,40(9):55.
WANG J S,LI Z Y.Effects of drought stress on root morphology of tea [J].JournalofHenanAgricultural,2011,40(9):55.
[24]刘金祥,谭杏婵,刘家琼.高温胁迫对香根草含水量、膜透性、脯氨酸和叶绿素含量的影响[J].草原与草坪,2005(6):58.
LIU J X,TAN X C,LIU J Q.Effects on relative water content,membrane permeability,proline content and chlorophyll content ofVetiveriazizanioidesunder high temperature stress [J].GrasslandandTurf,2005(6):58.
[25]徐 飞,郭卫华,徐伟红,等.刺槐幼苗形态、生物量分配和光合特性对水分胁迫的响应[J].北京林业大学学报,2010,32(1):24.
XU F,GUO W H,XU W H,etal.Effects of water stress on morphology,biomass allocation and photosynthesis inRobiniapseudoacaciasseedlings [J].JournalofBeijingForestryUniversity,2010,32(1):24.
[26]李鲁华,李世清,翟军海,等.小麦根系与土壤水分胁迫关系的研究进展[J].西北植物学报,2001,21(1):1.
LI L H,LI S Q,ZHAI J H,etal.Review of the relationship between wheat roots and water stress [J].ActaBotanicaBoreali-OccidentaliaSinica,2001,21(1):1.
[27]王 静.不同品种春小麦种子根的解剖结构和抗旱性的初步研究[J].西北植物学报,1995,15(8):159.
WANG J.Preliminary study on anatomical structure and drought resistance of different varieties of spring wheat seed root [J].ActaBotanicaBoreali-OccidentaliaSinica,1995,15(8):159.
[28]SHARP R E,POROYKO V,HEJLEK L G.Root growth maintenance during water deffcits:physiology to functional genomics [J].JournalofExperimentalBotany,2004,55(407):2343.
[29]HO M D,ROSAS J C,BROWN K M,etal.Root architectural tradeoffs for water and phosphorus acquisition [J].unctionalPlantBiology,2005,32:737.
[30]王晨阳.干旱胁迫对根的活性氧代谢的影响[J].华北农学报,1997,12(增刊):31.
WANG C Y.Effect of drought stress on root metabolism of reactive oxygen species [J].ActaAgriculturalBoreali-Sinica,1997,12(S):31.
[31]洪法水,董振吉,马成仓,等.Ca2+PEG预处理对干旱胁迫下小麦幼苗某些酶活性的影响[J].作物学报,1996,22(1):101.
HONG F S,DONG Z J,MA C C,etal.Effect of Ca2+or PEG pretreatment on some enzymes of wheat seedlings under drought stress [J].ActaAgronomicaSinica,1996,22(1):101.
[32]郭培国,李荣华.夜间高温胁迫对水稻叶片光合机构的影响[J].植物学报,2000,42(7):673.
GUO P P,LI R H.Effects of high nocturnal temperature on photosynthetic organization in rice leaves [J].ActaBotanicaSinica,2000,42(7):673.
[33]邵瑞鑫,上官周平.外源NO调控小麦幼苗生长与生理的含量效应[J].生态学报,2008,28(1):302.
SHAOR X,SHANGGUAN Z P.Effects of exogenous nitric oxide at different concentrations on the growth and physiology of winter wheat seedlings [J].ActaEcologicaSinica,2008,28(1):302.
[34]杨华庚,林位夫.低温胁迫对油棕幼苗光合作用及叶绿素荧光特性的影响[J].中国农学通报,2009,25(24):506.
YANG H G,LIN W F.The effect of low temperature stress on photosynthesis and chlorophyll fluorescence characteristics in oil palm seedlings [J].ChineseAgriculturalScienceBulletin,2009,25(24):506.
[35]李 晓,冯 伟,曾晓春.叶绿素荧光分析技术及应用进展[J].西北植物学报,2006,26(10):2186.
LI X,FENG W,ZENG X C.Advances in chlorophyll fluorescence analysis and its uses [J].ActaBotanicaBoreali-OccidentaliaSinica,2006,26(10):2186.
[36]齐 华,白向历,孙世贤,等.水分胁迫对玉米叶绿素荧光特性的影响[J].华北农学报,2009,24(3):102.
QIH,BAI X L,SUN S X,etal.Effects of water stress on chlorophyll fluorescence parameters of maize [J].ActaAgriculturalBoreali-Sinica,2009,24(3):102.
Physiological Responses of Different Wheat Cultivars to PEG Stress
XIE Yan,ZHANG Qinglong,HU Ling,WANG Fahong,LI Haosheng,KONG Ling’an
(Crop Research Institute,Shandong Academy of Agricultural Sciences,Jinan,Shandong 250100,China)
In order to provide theoretical basis for drought resistance wheat breeding,wheat varieties,Linmai 2,Yannong 19 and Jimai 262,were hydroponically cultivated in Hoagland solution(control) or solution containing 25% PEG(water stress) to investigate the effects of water stress on plant biomass,water content,root morphology,antioxidant enzyme activity and chlorophyll fluorescence parameters in seedlings. The results showed that under water stress,Jimai 262 showed the largest biomass among the three wheat varieties,and its root water content was significantly higher than that of Linmai 2 and Yannong 19. Root assessment using a WinRHIZO scanner showed that the total root length,total projected area,total area and total volume under PEG treatment were less affected in Jimai 262 compared with Linmai 2 and Yannong 19. Activity of antioxidant enzymes of Jimai 262 was greatly increased,especially the activities of POD,SOD in roots and CAT in leaves were significantly increased,compared to that of Linmai 2 and Yannong 19. Compared with control,bothqPandΦPSⅡin leaves of examined cultivars were decreased andqPof Jimai 262 had a slight reduction. NPQ of Jimai 262 was significantly increased under water stress,compared with control,and higher than that of the other two varieties. In conclusion,under PEG treatment,Jimai 262 showed the smallest degree of inhibition on growth,stronger ability of scavenging oxygen free radical,higher light utilization efficiency and higher resistance to water stress,compared to Linmai 2 and Yannong 19.
PEG stress; Wheat; Root morphology; Chlorophyll fluorescence parameters
时间:2017-07-07
网络出版地址:http://kns.cnki.net/kcms/detail/61.1359.S.20170707.1816.024.html
2016-01-17
2016-02-14
山东省现代农业产业技术体系项目(SDAIT-01-06);国家小麦现代农业产业技术体系项目(CARS-3-1-21);山东省自然科学基金项目(ZR2016CM39);国家公益性行业(农业)科研专项(201303109-07)
E-mail:xieyanwell@163.com
孔令安(E-mail:kongling-an@163.com)
S512.1;S311
A
1009-1041(2017)07-0947-08

