玉米InDel标记20重PCR检测体系的建立
冯 博许理文王凤格薛宁宁刘文彬,2易红梅
田红丽1吕远大3赵 涵3金石桥4张力科4蔚荣海2赵久然1
1北京市农林科学院玉米研究中心 /玉米DNA指纹及分子育种北京市重点实验室,北京100097;2吉林农业大学农学院, 吉林长春130118;3江苏省农业科学院农业生物技术研究所,江苏南京210014;4全国农业技术推广服务中心,北京100125
玉米InDel标记20重PCR检测体系的建立
冯 博1,2,**许理文1,**王凤格1,*薛宁宁1刘文彬1,2易红梅1
田红丽1吕远大3赵 涵3金石桥4张力科4蔚荣海2赵久然1
1北京市农林科学院玉米研究中心 /玉米DNA指纹及分子育种北京市重点实验室,北京100097;2吉林农业大学农学院, 吉林长春130118;3江苏省农业科学院农业生物技术研究所,江苏南京210014;4全国农业技术推广服务中心,北京100125
为构建玉米多重PCR检测体系,提高分子标记检测效率,利用10份代表性玉米材料对238对InDel引物进行单重PCR评估,共得到192对扩增效率高、稳定性好的引物。根据软件评估结果、扩增质量、产物范围、染色体均匀分布原则从192对引物中优选出30对综合表现较好的引物形成扩增产物范围在80~200 bp和200~400 bp的两组核心引物组合,每套组合中有10对引物分布在不同染色体上。在核心引物组合的基础上综合考虑染色体分布、碱基片段范围、引物荧光颜色,逐一添加引物,最终形成两组玉米20重PCR体系,一组40重荧光标记毛细管电泳。
玉米;InDel;多重PCR
多重PCR(multiplex PCR)是在常规PCR的基础上改进的,在同一个PCR反应体系中加入多对引物,对多个DNA模板或同一模板的不同区域同时扩增多个目的片段的技术,这个概念由Chambercian等和Mullis等[1-2]率先提出。多重PCR技术可以同时扩增多个目的基因,具有节省珍贵的试验样品、节省时间提高效率、降低成本的优点,所以自从多重PCR技术报道以来,受到众多研究者的重视,并且迅速发展至多个研究领域,多重PCR技术己经成为生命科学各个领域一种重要的检测手段[3]。
目前,在动物和人类上得到了较广泛深入的研究及应用。以前的多重体系较多基于SSR引物,人类STR[4](short tandem repeat)中已经地成功组建了26重PCR体系[5],玉米中成功组建了10重PCR体系[6]。随着InDel[7-8]新型标记的开发,人们首先在动物及人类上构建多重PCR复合扩增体系[9-10],已在人类上成功组建3组16重PCR,48重荧光毛细管电泳[11]。在玉米等植物上的研究较少,主要原因是在玉米上开发的InDel标记较少,本实验室基于玉米核心种质自交系的重测序数据,全面挖掘玉米基因组上的InDel位点,并评估其多态性,分析位点两侧序列的保守性,获得一批InDel引物(未发表)。本试验准备借鉴多重PCR在动物及人类上的研究成果探索以InDel标记构建玉米多重PCR体系的方案。该体系的建立具有现实意义,既可为大规模、高通量玉米指纹库构建创造有利条件又可提高玉米遗传研究和标记辅助育种的效率[12-13]。
1 材料与方法
1.1 材料
共10份(表1),涵盖普通玉米、甜玉米、糯玉米,具广泛代表性。其中包括2份玉米自交系和8份常用玉米杂交种。
1.2 试验方法
1.2.1 DNA提取 采用王凤格等的改良CTAB法[14]。
1.2.2 PCR扩增 单重PCR反应体系:200µmol L–1DNA模板2µL、2×Taq Plus Master Mix 10µL、0.25µmol L–1引物2µL,总体积20µL。PCR程序为95℃预变性5 min;94℃变性40 s,60℃退火35 s, 72℃延伸45 s,35个循环;72℃延伸10 min;4℃保存。在多重PCR体系中将单重PCR体系引物浓度调整为0.5µmol L–1,引物用量为0.2µL,在体系优化过程中调整部分引物浓度,其余与单重PCR相同。

表1 供试材料Table 1 Test materials in this study
1.2.3 荧光标记毛细管电泳 对于单重PCR,在96孔板的各孔中分别加入9µL去离子甲酰胺、0.2 µL GS3730-500分子量内标和2µL稀释10倍的PCR产物。95℃变性5 min,于4℃保存10 min,2000 r min–1离心1 min,于ABI3730XL DNA分析仪上进行荧光毛细管电泳。对于多重PCR,采用产物原液,其余与单重PCR电泳一致。
1.2.4 数据收集与分析 采用Date Collection软件收集原始数据,用本单位自主研发的SSR Analyser(V1.2.4)指纹分析器统计与分析数据。
1.2.5 InDel引物开发设计与评估 引物位点开发阶段的筛选条件为InDel长度在3~10 bp、两侧序列保守性高、染色体上均匀分布。引物设计标准是利用Primer3设计引物,为有效构建多重PCR,所有引物设计时采用统一设置参数,主要参数包括Tm值(60±2℃)、扩增产物片段范围(80~400 bp)、GC含量(40%~60%)。引物扩增质量筛选原则是荧光标记毛细管电泳图谱中峰值高于1000、无非特异峰、多态性高、稳定性好。
1.2.6 InDel引物多重组合 多重PCR核心引物组的筛选:在192对候选引物中,将扩增产物片段分为80~200 bp和200~400 bp两组,每组引物按染色体均匀分布、片段范围平均差异20 bp左右选择一对引物,挑选出10对引物,形成核心引物组合。扩增产物片段范围在80~200 bp的引物按四色(ABI合成)或二色荧光(国内合成)分别挑选出一套核心引物组合。对核心引物组合及候选引物进行软件评估,并对所评估的引物按与核心引物组合相互作用的大小排序。试验评估在核心引物组合的基础上进行逐一添加引物,优先选择引物之间干扰弱的引物。
2 结果与分析
2.1 引物筛选与确定
根据引物扩增质量筛选原则,对于单重PCR扩增,从238对荧光引物中筛选出192对,其在染色体上的分布情况(表2),大多数引物在染色体上均匀分布,平均相差20 bp有1对引物。第1染色体上引物分布最多,共30对;第4和第7染色体上分布最少,共13对。扩增产物片段范围在80~300 bp的引物分布均匀,350 bp以上的分布较少。表2左侧数列为扩增产物片段范围,引物的荧光颜色可根据需要及组合方式自行标记。可由表2信息根据染色体分布和扩增产物片段大小自由组建多重引物组合。

表2 192对候选引物名单Table 2 List of 192 candidate primers

(续表2)

(续表2)
2.2 10重核心引物组合
10重核心引物组合经软件评估引物间无干扰。10重PCR电泳结果表明10对引物可以同时成功扩增(图1)。10份材料验证多重组合稳定性较高,又在实验室选取200份材料对多重组合进行验证,均取得了较好的试验结果。10重PCR的扩增片段大小与单重PCR扩增出的片段大小一致、没有非特异峰、同色荧光引物扩增片段无交叉;虽然10对引物的扩增效率差异较大,但随后扩增体系优化的过程中各引物浓度有所调整。10重核心引物组合名单详见表3。
2.3 20重引物组合的确定
2.3.1 80~200 bp四色荧光引物组合 在10重核心引物组合的基础上添加至20重引物组合,20对引物均成功扩增。用10份材料验证多重组合稳定性较高,又在实验室选取200份材料对多重组合进行验证,均取得较好的试验结果。在染色体上分布均匀、多重PCR的扩增片段大小与单重PCR扩增出的片段大小一致、引物扩增片段无交叉、扩增效率较高、扩增效果较稳定。由于引物扩增片段大小以及引物自身扩增效率的原因采用相同引物浓度无法实现等效扩增,根据引物扩增效率对扩增体系进行优化,即对各引物扩增浓度进行调整,调整浓度后各引物扩增效率与调整前有明显改善(图2)。
2.3.2 二色荧光组合 借鉴组建80~200 bp 20重引物组合的经验,利用FAM和ROX二色荧光组建了扩增片段范围在80~200 bp、200~400 bp的20重PCR组合,所有引物均成功扩增(图3)。
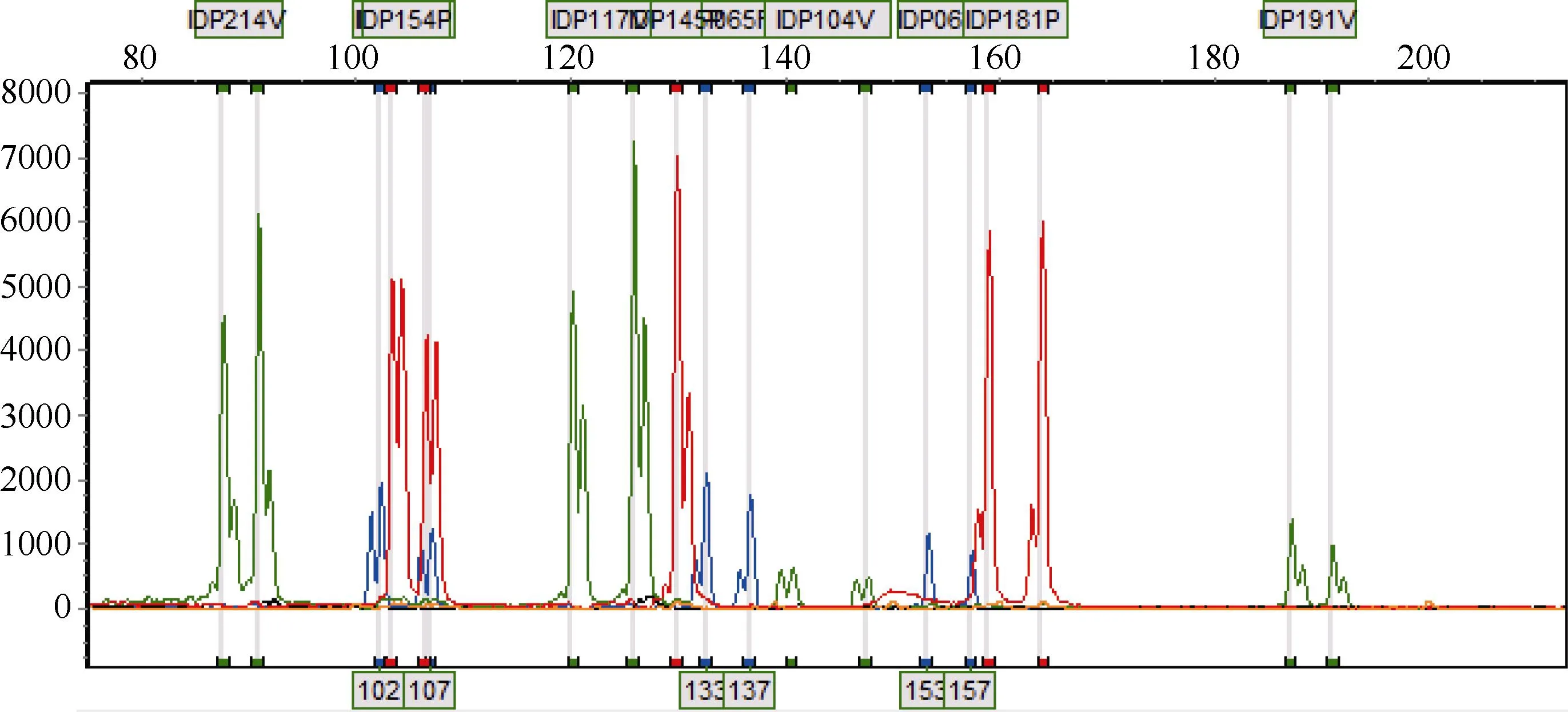
图1 郑单958的10重核心引物扩增结果图

图2 郑单958的80~200 bp 20重引物PCR效果图

图3 郑单958的80~200 bp及200~400 bp 20重引物PCR效果图
2.4 40重电泳
将采用FAM和ROX二色荧光标记的80~200 bp、200~400 bp的2个20重PCR组合电泳,获得了二色荧光标记40重电泳组合(图4)。10份材料验证多重组合稳定性较高。又在实验室选取200份材料对多重组合进行验证,均取得了较好的试验结果。ABI3730XL DNA分析仪为五色荧光毛细管电泳仪,一色为内标,四色可以标记引物,因此理论上可以做到80重荧光标记毛细管电泳组合,将极大地提高InDel基因型分型的效率。40对引物基本信息见表4。
3 讨论
InDel遍布于真核生物整个基因组的频率仅次于SNP,位居第二,在玉米基因组也是如此,平均126 bp,大约是SNP(60.8)的2倍。InDel在玉米基因组上分布不均,在非编码区平均85 bp一个,在编
码区平均每2500 bp一个[15-16]。InDel引物在组建多重PCR时自身二态性标记的特点有明显优势,每个引物只有2个等位基因、不会出现新的等位基因、目标产物片段大小确定,所以在组建多重PCR时能够避免引物片段大小有交叉、能够保证引物充分扩增易于实现多重PCR以及多重电泳。所用InDel引物设计时均采用相同的退火温度,多个引物可采用同一程序同时扩增。InDel引物通用性强、稳定性高,应用目前SSR引物的扩增程序即可成功扩增,不涉及到扩增程序上的优化,为组建多重PCR提供了更大的可能性。InDel引物没有连续多峰和三峰的现象,便于数据的统计与分析;兼容荧光毛细管电泳平台、芯片平台、KASP平台,易于数据的整合。

表3 20对引物基本信息Table 3 Basic information of 20 primers

图4 40重荧光标记毛细管电泳效果图

表4 40对引物基本信息(按图中引物出现的先后顺序,先蓝色后红色)Table 4 Basic information of 40 primers(the sequence ranking of primers from blue to red)

(续表4)

(续表4)
利用InDel标记将候选引物按扩增产物片段范围、染色体分布进行分类,构建10对核心引物组合后逐一添加引物的方案使本试验最终成功地组建了两组20重PCR,一组40重荧光标记毛细管电泳。本试验成功组建20重PCR的试验方法、试验程序以及试验流程,为今后多重PCR体系的构建提供了丰富的经验。后续试验进一步研究的空间还很大,可以继续组建20重以上的多重复合体系,理论上可以实现80重荧光标记毛细管电泳,在标记上具有较高的通量。理论上的80重荧光毛细管电泳,在一个孔中即可实现对80个位点的基因型分型分析,一块96孔板就可以实现7680个位点的基因型分型分析、一块384板则可实现30 720个位点的基因型分型分析。20个引物同时扩增提高了试验的准确性;减少了繁琐的试验操作、节省了试验样本、试验耗材、试验时间,工作效率提高了20倍。本研究获得的20重PCR组合以及40重荧光标记毛细管电泳将在较大范围内具有应用价值,今后可以应用到更多有关玉米品种真实性和纯度鉴定中,同时也可以为分子植物育种[17]提供技术支撑。
4 结论
利用10份玉米材料结合InDel标记,成功组建了两组20重PCR体系、一组40重荧光毛细管电泳,以及一套组建PCR复合体系的试验方案,为今后利用InDel及其他分子标记组建多重PCR复合体系,分子标记辅助育种的背景选择以及将多重PCR复合体系应用于玉米品种鉴定提供了重要的思路和研究方法。
[1]Chambercian J S,Gibbs R A,Ranier J E,Nguyen P N,Caskey C T.Detection screening of the duchenne muscular dystrophy locus via mutiplex DNA amplification.Nucl Acids Res,1988,16: 11141–11156
[2]Mullis K,Faloona F,Scharf S,Saiki R,Horn G,Erlich H. Specific amplification of DNA in vitro:the polymerase chain reaction.Cold Spring HaborSymp Quant Biol,1986,51:263–273
[3]王稳,屈武斌,申志勇,任长虹,刘虎岐,张成岗.利用MP primer设计引物并优化扩增条件以提高多重PCR效率的实验研究.生物化学与生物物理进展,2010,37:342–346
Wang W,Qu W B,Shen Z Y,Ren C H,Liu H Q,Zhang C G. Using MP primerto design primers and optimize the amplification conditions in order to improve the efficiency of multiple PCR.Prog Biochem Biophy,2010,37:342–346(in Chinese with English abstract)
[4]蔡颖,周广彪,赵书民,陈文婉,陈其生,许如苏,梁希扬.中国人群亲权鉴定常用STR基因座平均突变率的估计.中国司法鉴定,2010,(5):56–59
Cai Y,Zhou G B,Zhao S M,Chen W W,Chen Q S,Xu R S, Liang X Y.Estimation of average mutation rates of routine STR loci in Parentage testing.Chin J Forensic Sci,2010,(5):56–59 (in Chinese with English abstract)
[5]Hill C R,Butler J M,Vallone P M.A 26plex autosomal STR assay to aid human identity testing.Forensic Sci,2009,54: 1008–1015
[6]王凤格,赵久然,戴景瑞,易红梅,匡猛,孙艳美,于新艳,郭景伦,王璐.玉米通用SSR核心引物筛选及高通量多重PCR复合扩增体系建立.科学通报,2006,51:2738–2746
Wang F G,Zhao J R,Dai J R,Yi H M,Kuang M,Sun Y M,Yu X Y,Guo J L,Wang L.Screening of core SSR primers and establishment of high throughput multiplex PCR amplification system in maize.Chin Sci Bull,2006,51:2738–2746(in Chinese)
[7]张体付,葛敏,韦玉才,赵涵.玉米功能性Insertion/Deletion (InDel)分子标记的挖掘及其在杂交种纯度鉴定中的应用.玉米科学,2012,20(2):64–68
Zhang T F,Ge M,Wei Y C,Zhao H.Molecular marker of functional Insertion/Deletion(InDel)in maize and its application in hybrid seed purity identification.Maize Sci,2012,20(2): 64–68(in Chinese with English abstract)
[8]Pereira R,Phillips C,Alves C,Amorim A,Carracedo A,Gusmão L.A new multiplex for human identification using insertion/ deletion polymorphisms.Electrophoresis,2009,30:3682–3690
[9]孙宽,张素华,朱如心,赵书民,李成涛.新一代遗传标记——InDel研究进展.法医学杂志,2013,29:134–143
Sun K,Zhang S H,Zhao S M,Li C T.Progress in InDel as a new generation of genetic marker.J Forensic Med,2013,29:134–143 (in Chinese with English abstract)
[10]Pimenta J R,Pena S D J.Efficient human paternity testing with a panel of 40 short insertion-deletion polymorphisms.Genet Mol Res,2010,9:601–607
[11]Santos N P C,Ribeiro-Rodrigues E M,Ribeiro-dos-SantosA K C, Pereira R,Gusmão L,Amorim A,Guerreiro J F,Zago M A,Matte C,Hutz M H,Santos S E B.Assessing individual interethnic admixture and population substructure using a 48-Insertion-Deletion(INSEL)ancestry-informative marker(AIM)panel. Human Mutation,2010,31:184–190
[12]王凤格,赵久然,郭景伦,陈刚,廖琴,孙世贤,陈如明.中国玉米新品种DNA指纹库建立系列研究:III.多重PCR技术在玉米SSR引物扩增中的应用.玉米科学,2003,11(4):3–6
Wang F G,Zhao J R,Guo J L,Chen G,Liao Q,Sun S X,Chen R M.A series of studies on the establishment of DNA fingerprinting database of new maize varieties in China:III.The application of multiplex PCR technique in the amplification of maize SSR primers.Maize Sci,2003,11(4):3–6(in Chinese with English abstract)
[13]Liu J,Qu J T,Yang C,Tang D G,Li J W,Lan H,Rong T Z. Development of genome-wide insertion and deletion markers for maize,based on next-generation sequencing data.BMC Genomics,2015,16:601
[14]王凤格,赵久然.玉米品种DNA指纹鉴定技术——SSR标记的研究与应用.北京:中国农业科学技术出版社,2011.pp 136–145
Wang F G,Zhao J R.Research and Application of SSR Fingerprint Identification Technology of Maize Variety DNA. Beijing:China Agricultural Science and Technology Press,2011. pp 136–145(in Chinese)
[15]Ching A,Caldwell K S,Jung M,Dolan M,Smith O S,Tingey S, Morgante M,Rafalski A J.SNP frequency haplotype structure and linkage disequilibrium in elite maize inbred lines.BMC Genet,2002,3:19
[16]Bhangale T R,Rieder M J,Livingston R J,Nickerson D A. Comprehensive identification and characterization of diallelic insertion-deletion polymorphisms in 330 human candidate genes. Hum Mol Genet,2005,14:59–69
[17]王建康,李慧慧,张学才,尹长斌,黎裕,马有志,李新海,邱丽娟,万建民.中国作物分子设计育种.作物学报,2011,37: 191–201
Wang J K,Li H H,Zhang X C,Yin C B,Li Y,Ma Y Z,Li X H, Qiu L J,Wan J M.Crop molecular design breeding in China. Acta Agron Sin,2011,37:191–201(in Chinese with English abstract)
Establishment of Multiplex PCR System with 20 Pairs of InDel Markers in Maize
FENG Bo1,2,**,XU Li-Wen1,**,WANG Feng-Ge1,*,XUE Ning-Ning1,LIU Wen-Bin1,2,YI Hong-Mei1,TIAN Hong-Li1,LYU Yuan-Da3,ZHAO Han3,JIN Shi-Qiao4,ZHANG Li-Ke4,YU Rong-Hai2,and ZHAO Jiu-Ran1
1Maize Research Center,Beijing Academy of Agriculture&Forestry Sciences/Beijing Key Laboratory of Maize DNA Fingerprinting and Molecular Breeding,Beijing 100097,China;2Faculty of Agronomy,Jilin Agricultural University,Changchun 130118,China;3Provincial Key Laboratory of Agrobiology,Jiangsu Academy of Agricultural Sciences,Nanjing 210014,China;4National Agricultural Technical Extension and Service Center, Beijing 100125,China
In order to improve the detection efficiency with molecular marker,the multiple PCR detection system was constructed.
In this study,10 major materials were used to evaluate the single pair PCR with 238 pairs of InDel primers.According to the
software quality evaluation results,product range,and the principle of chromosome uniform distribution,30 pairs of primers were
selected from 192 primers with better performance to form two groups of core primer combinations with amplified products in the
range of 80-200 bp and 200-400 bp,There were 10 pairs of primers distributing in different chromosomes for each primer
combination.Based on core primer combination and comprehensive consideration on chromosome distribution,base fragment,
and primers fluorescent color,we established two groups of corn test 20 PCR system and a group of 40 fluorescent capillary
electrophoresis.
Maize;InDel;Multiplex PCR
(
):2016-12-11;Accepted(接受日期):2017-04-20;Published online(网络出版日期):2017-04-27.
10.3724/SP.J.1006.2017.01139
本研究由国家科技支撑计划项目(2015BAD02B02)和北京市农林科学院科技创新能力建设专项(KJCX20161501)资助。
This study was supported by the National Science and Technology Project from the Ministry of Science and Technology of China (2015BAD02B02),and the Science and Technology Innovation Special Project of Beijing Academy of Agriculture and Forestry Sciences (KJCX20161501).
*通讯作者(Corresponding author):王凤格,E-mail:gege0106@163.com**同等贡献(Contributed equally to this work)
联系方式:冯博,E-mail:fengbo02220108@163.com;许理文,E-mail:xulw0408@126.com
URL:http://kns.cnki.net/kcms/detail/11.1809.S.20170427.0948.002.html

