胰岛素抵抗及脂联素缺乏对小鼠心肌重构的影响
徐璐,刘雅娟,张青,秦毅,张娜,任永康,杨锐英
胰岛素抵抗及脂联素缺乏对小鼠心肌重构的影响
徐璐,刘雅娟,张青,秦毅,张娜,任永康,杨锐英
目的:研究胰岛素抵抗(IR)及脂联素(APN)缺乏对小鼠心肌重构的影响。
方法:选择16只野生C57小鼠随机分为对照组和IR组,每组8只;16只APN基因敲除(APNKO)C57小鼠随机分为APNKO组和APNKO+IR组,每组各8只。对照组和APNKO组给予普通饲料,IR组和APNKO+IR组给予高脂饲料诱导产生IR。喂养12周后取血测定总胆固醇、甘油三酯、空腹血糖和空腹胰岛素水平,取心脏测量心脏重量和左心室重量。取左心室心肌做苏木素伊红(HE)染色和马松(Masson)染色,观察各组心肌结构改变及纤维化的程度;用免疫组化法和蛋白免疫印迹法检测心肌中基质金属蛋白酶-9(MMP-9)和APN表达量的差异。
结果:与对照组比较,IR组、APNKO组和APNKO+IR组中小鼠的总胆固醇、甘油三酯、空腹血糖和空腹胰岛素、心脏重量和左心室重量均有增加(P<0.05);HE染色及Masson染色结果显示:与对照组比较,IR组、APNKO组和APNKO+IR组中小鼠的心肌肥大程度更高;免疫组化及蛋白免疫印迹结果显示:与对照组相比,IR组、APNKO组和APNKO+IR组中小鼠心肌APN表达明显减低,心肌MMP-9表达明显增加(P<0.05)。
结论: APN缺乏和IR导致心肌重构,且两者起协同促进作用。
胰岛素抗药性;脂联素;心室重构
(Chinese Circulation Journal, 2017,32:808.)
心肌重构是指心脏功能受损,心腔扩大,心肌肥厚的代偿过程中,心肌细胞和细胞外基质发生结构性的变化,是心力衰竭发生、发展的基本病理机制[1,2]。早期干预和针对诱因的预防是治疗心肌重构的关键。以往研究显示,低脂联素(APN)血症及胰岛素抵抗(IR)有可能是参与左心室心肌重构的重要因素[3,4]。体内低表达APN并伴IR时是否会进一步加重心肌重构,此类研究鲜有报道。为此,本研究采用野生C57小鼠和同品系APN基因敲除(APNKO)C57小鼠为观察对象,用高脂饲料诱导IR,通过析因分析,探讨IR与APNKO对心肌重构的影响。
1 材料与方法
实验动物与试剂:野生雄性C57小鼠32只以及同品系APNKO纯合子雄性小鼠均购自上海南方模式生物研究中心,合格证书为SCXK(沪)2009-0023;蛋白免疫印迹(Western blot)法相关试剂均购自南京生物科技发展有限公司;酶联免疫吸附剂测定(ELISA)试剂盒购自美国R&D公司;普通饲料购自宁夏医科大学动物实验中心;高脂饲料购自美国Research Diets公司,脂肪供能比占60%。
实验分组:(1)对照组:普通饲料喂养的野生小鼠;(2)IR组:高脂饲料喂养的野生小鼠,诱导IR模型[5];(3)APNKO组:普通饲料喂养的APNKO小鼠;(4)APNKO+IR组:高脂饲料喂养的APNKO小鼠。每组各8只。
标本采集:喂养12周后测体重,禁食8 h后测空腹血糖,4%水合氯醛腹腔麻醉后,眼球取血,用生化分析仪检测血清总胆固醇、甘油三酯,用ELISA试剂盒测空腹胰岛素。解剖分离心脏后称取心脏重量,分离左心室后称取左心室重量。
标本处理:将左心室心肌标本脱水、浸蜡,用石蜡包埋切片,分别进行苏木素伊红(HE)染色和马松(Masson)染色。用计算机软件Image-Pro plus 6.0测定HE染色中心肌细胞横切面的横截面积以观察心肌细胞肥大的程度,并且测定Masson染色中心肌胶原容积分数和血管周围胶原面积的含量以评价血管周围纤维化程度[6]。免疫组化测定基质金属蛋白酶-9(MMP-9)及APN的分布及表达,对阳性表达进行光密度半定量分析。Western blot检测MMP-9及APN的表达。将心肌组织置于加有蛋白酶抑制剂的细胞裂解液中,研磨至匀浆,提取总蛋白。用BCA蛋白检测试剂盒测定蛋白浓度。取50μg蛋白匀浆进行凝胶电泳(SDS-PAGE),转至聚偏二氟乙烯膜上,对膜敷育一抗MMP-9、APN及内参蛋白甘油醛-3-磷酸脱氢酶(GAPDH),4℃过夜后,常温孵育二抗,并用化学发光成像系统(BIORAD ChemiDoc XRS+)进行化学曝光,对目的蛋白及GAPDH条带进行灰度值半定量分析。
指标计算:胰岛素抵抗指数[空腹血糖(mmol/L)×空腹胰岛素(mmol/L)/22.5];心肌肥厚指标包括心脏重量指数(心脏重量/体重)和左心室重量指数(左心室重量/体重)、心肌细胞胶原容积分数(心肌细胞胶原面积/视野总面积)、心肌细胞胶原面积(不包括血管周围胶原面积)、血管周围胶原面积与管腔面积的比值(心肌内小动脉管腔周围胶原面积/动脉管腔面积)。
统计学处理:采用SPSS19.0统计软件分析,计量资料以均数±标准差(±s)表示,多组间比较采用单因素方差分析。P<0.05为差异有统计学意义。
2 结果
四组小鼠观察指标的比较(表1):与对照组比,IR组所有观察指标均增加,除左心室重量指数外差异均有统计学意义(P<0.05);APNKO组总胆固醇、甘油三酯、空腹血糖、空腹胰岛素、心脏重量、心脏重量指数明显增加,差异均有统计学意义(P<0.05);APNKO+IR组所有观察指标均增加,除总胆固醇外差异均有统计学意义(P<0.05)。与IR组比,APNKO组甘油三酯增加,体重、空腹血糖、空腹胰岛素、胰岛素抵抗指数、心脏重量明显减少(P<0.05);APNKO+IR组甘油三酯、空腹血糖、空腹胰岛素、胰岛素抵抗指数、左心室重量指数明显增加(P<0.05)。与APNKO组相比,APNKO+IR组体重、空腹血糖、空腹胰岛素、胰岛素抵抗指数、心脏重量、左心室重量、左心室重量指数进一步增加,差异均有统计学意义(P<0.05)。
HE染色结果(图1):对照组小鼠可观察到排列整齐、形态正常、界限清晰的心肌细胞及胞间结构。IR组和APNKO组小鼠心肌细胞胞间结构界限模糊,排列紊乱,心肌细胞肥大。而APNKO+IR组心肌细胞核固缩、碎裂、溶解、消失,胞间界限更加模糊,心肌细胞排列更加紊乱,心肌细胞进一步肥大,并出现炎性细胞浸润。
Masson染色结果(图1):心肌胶原纤维和血管显示蓝色,心肌细胞显示粉红色,红细胞显示紫色。与对照组比较,蓝色心肌纤维在APNKO组增加;与IR组和APNKO组比较,蓝色心肌纤维在APNKO+IR组进一步增加。

表1 四组小鼠观察指标的比较(n=8,±s)

图1 四组小鼠心肌HE染色纵切面(×400)和Masson染色(×400)
四组小鼠心肌组织病理分析比较(表2):与对照组比,IR组、APNKO组、APNKO+IR组横截面积、心肌细胞胶原容积分数、血管周围胶原面积与管腔面积的比值逐渐增加,差异均有统计学意义(P<0.05)。
免疫组化检测(图2):与对照组比,IR组、APNKO组和APNKO+IR组心肌APN表达明显减低,心肌MMP-9表达明显增加,差异均有统计学意义(P<0.05);与IR组相比,APNKO组和APNKO+IR组心肌APN表达明显减低,心肌MMP-9表达明显增加,差异均有统计学意义(P<0.05);与APNKO组相比,APNKO+IR组心肌APN表达进一步减低,心肌MMP-9表达进一步增加,差异均有统计意义(P<0.05)。
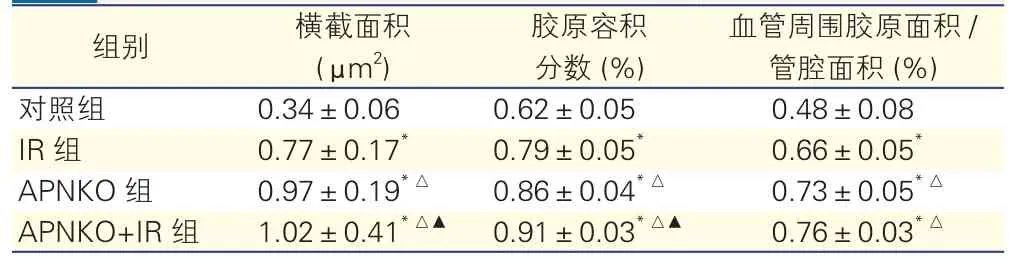
表2 四组小鼠心肌组织病理分析比较(n=8,±s)

图2 四组小鼠心肌脂联素和基质金属蛋白酶-9免疫组化检测结果(×400)
四组小鼠心肌脂联素和基质金属蛋白酶-9蛋白表达的比较(表3):免疫组化和Western blot检测可见,与对照组比IR组、APNKO组和APNKO+IR组的APN光密度和灰度值依次递减,而MMP-9 光密度和灰度值依次递增,差异均有统计差异(P<0.05)。

表3 四组小鼠心肌脂联素和基质金属蛋白酶-9蛋白表达比较(n=8,±s)
3 讨论
IR是正常剂量的胰岛素产生低于正常生物学效应的一种状态,主要表现为外周组织对葡萄糖的利用障碍和对胰岛素敏感性下降,尤其是肌肉、肝脏、脂肪组织和下丘脑。IR又是2型糖尿病重要病理基础,当大量分泌的胰岛素不能克服血糖的升高时,血糖开始升高,最终成为2型糖尿病。APN在机体内主要由白色和棕色脂肪细胞合成,并通过自分泌、旁分泌等多种方式作用于靶器官,是一种具有胰岛素增敏、抗动脉粥样硬化及抗炎等作用的特异性细胞因子[7]。MMP-9是反应心肌重构程度的因子之一,参与心肌梗死后心肌重构、慢性心力衰竭进展等心血管疾病的发生、发展过程[8]。相关研究表明:高血压患者心肌纤维化,并存在低APN血症[9]。而心肌重构是糖尿病主要的晚期严重并发症之一,心肌重构患者空腹胰岛素水平增高[10],有研究也发现糖尿病心肌病大鼠左心室心肌组织胶原含量明显高于正常大鼠,心肌间质发生了纤维化,左心室发生重构[11]。
目前的研究中,IR和APN缺乏均是心肌重构的重要影响因子,但关于IR和APN对心肌重构的协同作用,少见报道。本次研究主要通过高脂饲料诱导APN基因敲除小鼠的糖脂代谢紊乱,探讨IR对APN基因敲除小鼠心肌重构的影响。其结果显示:APN基因敲除和IR均增加心脏重量、左心室重量、心脏重量指数和左心室重量指数的大小。APN基因敲除和IR对总胆固醇、甘油三酯、空腹血糖和空腹胰岛素及心肌重构相关指标有交互效应,且均为正效应,APN基因敲除和IR对心肌APN有交互效应,但为负效应。产生这一现象的机制可能与APN的抗炎及胰岛素增敏作用有关。APN水平降低,引起脂肪细胞、内皮细胞、巨噬细胞分泌大量的白细胞介素-1β、白细胞介素-6、肿瘤坏死因子-α等炎性细胞因子,APN的抗炎作用不能抗衡体内炎症时,进一步促进炎性细胞因子的释放,降低胰岛素的敏感性,加重IR的程度。低水平APN抑制腺苷酸活化蛋白激酶AMPK的激活,促进成纤维细胞向心肌中迁移,增加细胞外基质,从而促进心肌纤维化[12]。另外低水平的APN可以激活外周血管紧张素,增加心脏负荷,抑制核转录因子-κB的表达,进而促进心肌与间质细胞的代偿性肥大及增生[13]。低水平APN降低胰岛素敏感性,发生IR时,出现一系列糖脂代谢紊乱,表现为过氧化物激活增值受体被激活,游离脂肪酸增多,心肌细胞过度依赖脂肪酸β氧化,葡萄糖利用功能减低,脂肪酸供能增多,心肌能量转换率下降,耗氧量增加,心肌负荷增加,从而导致心肌细胞凋亡[14]。同时,IR使磷酸化丝氨酸胰岛素受体底物-1增加,蛋白激酶B激活,最终导致心肌细胞凋亡并发生心肌结构和功能的改变[15]。
综上所述,APN缺乏及IR均可以导致心肌重构,并且二者在心肌重构的发生过程中起协同促进作用。体内低水平APN伴IR是心肌重构发生的高危因素。增加体内外源性APN的摄入的同时控制IR的进展将是延缓心肌重构进程的重要方法。
[1] 中华医学会心血管病学分会, 中华心血管病杂志编辑委员会. 慢性心力衰竭诊断治疗指南. 中华心血管病杂志, 2007, 12: 1076-1095.
[2] 罗涛, 赵达君, 孙阳. 衰老影响心肌梗死后心室重塑机制研究进展.心脏杂志, 2014, 5: 618-621.
[3] 孙蕊, 薛万里, 秦毅, 等. 福辛普利对自发性高血压大鼠心室重塑及血清脂联素、心肌脂联素受体1表达的影响. 临床心血管病杂志, 2014, 9: 766-769.
[4] Harmancey R, Lam TN, Lubrano GM, et al. Insulin resistance improves metabolic and contractile efficiency in stressed rat heart. FASEB J, 2012, 26: 3118-3126.
[5] Sumiyoshi M, Sakanaka M, Kimura Y. Chronic intake of high-fat and high-sucrose diets differentially affects glucose intolerance in mice. J Nutrit, 2006, 136: 538-587.
[6] 张海啸, 史载祥, 贾海忠, 等. 大蒜素通过部分阻抑TGF-β1介导的Smads信号改善压力超负荷大鼠心肌反应性纤维化. 中国中西医结合杂志, 2012, 32: 666-670.
[7] Kuo JZ, Guo X, Klein R, et al. Adiponectin, insulin sensitivity and diabetic retinopathy in latinoswith type 2 diabetes. J Clin Endocrinol Metab, 2015, 100: 3348-3355.
[8] 徐立松, 刘志跃. 基质金属蛋白酶-9与心血管疾病. 内蒙古医学杂志, 2009, 9: 1089-1092.
[9] 孟秋云, 李秀昌, 孙红, 等. 血清脂联素水平与高血压及心肌纤维化的关系. 中国循环杂志, 2010, 2: 111-113.
[10] 武力勇, 王先梅, 杨丽霞, 等. 心室重塑患者瘦素抵抗与胰岛素抵抗及其相关性研究. 中国循环杂志, 2011, 1: 30-33.
[11] Huang ZG, Jin Q, Fan M, et al. Myocardial remodeling in diabetic cardiomyopathy associated with cardiac mast cell activation. PLoS One, 2013, 8: e60827.
[12] Essick EE, Ouchi N, Wilson RM, et al. Adiponectin mediates cardioprotection in oxidative stress-induced cardiac myocyte remodeling. Am J Physiol Heart Circ Physiol, 2011, 301: H984-H993.
[13] Dadson K, Turdi S, Boo S, et al. Temporal and molecular analyses of cardiac extracellular matrixRemodeling following pressure overload in adiponectin deficient mice. PLoS One, 2015, 10: e0121049.
[14] Wang HJ, Wang W, Cornish KG, et al. Cardiac sympathetic afferent denervation attenuates cardiac remodeling and improves cardiovascular dysfunction in rats with heart failure. Hypertension, 2014, 64: 745-755.
[15] Li CB, Li XX, Chen YG, et al. Myocardial remodeling in rats with metabolic syndrome: role of Rho-kinase mediated insulin resistance. Acta Biochim Pol, 2012, 59: 249-254.
Impact of Insulin Resistance and Adiponectin Lacking on Myocardial Remodeling in Experimental Mice
XU Lu, LIU Ya-juan, ZHANG Qing, QIN Yi, ZHANG Na, REN Yong-kang, YANG Rui-ying.
Department of Cardiology, Ningxia Medical University, Yinchuan (750004), Ningxia, China
YANG Rui-ying, Email: yangruiying@medmail.com
Objective: To explore the impact of insulin resistance (IR) and adiponectin (APN) lacking on myocardial remodeling in experimental mice.
Methods:16 normal C57 mice were divided into 2 groups: Control group and IR group; in addition, 16 APN gene knockout(APNKO) mice were divided into another 2 groups: APNKO group and APNKO+IR group. n=8 in each group. The mice in Control group and APNKO group were fed with normal diet, in IR group and APNKO+IR group were fed with high fat diet to create the IR model. All animals were treated for 12 weeks. Blood levels of total cholesterol(TC), triglycerides(TG),fasting plasma glucose(FPG) and fasting insulin(FINS) were examined; heart weight and left ventricular weight were measured; left ventricular myocardial morphological changes and the degree of fibrosis were assessed by HE staining and Masson staining; protein expressions of myocardial matrix metalloproteinase-9 (MMP-9) and APN were detected by immunehistochemistry and Western blot analysis.
Results: Compared with Control group, IR group, APNKO group and APNKO+IR group showed elevated blood levels of TC, TG, FPG and FINS; increased heart weight and left ventricular weight, all P<0.05; IR group, APNKO group and APNKO+IR group presented more myocardial hypertrophy, decreased protein expression of APN and increased protein expression of MMP-9, all P<0.05.
Conclusion: IR and APN lacking could incur myocardial remodeling in experimental mice and they had synergistically facilitated effect.
Insulin resistance;Adiponectin; Ventricular remodeling
book=808,ebook=84
2016-08-25)
(编辑:漆利萍)
国家自然科学基金资助项目(81360026)
750004 宁夏回族自治区银川市,宁夏医科大学 心血管内科(徐璐、张青、张娜、任永康);宁夏医科大学总医院 心脏中心干部病房(刘雅娟、杨锐英);宁夏医科大学 基础医学院(秦毅)
徐璐 硕士研究生 主要从事冠心病与代谢综合征的研究 Email:3051406099@qq.com 通讯作者:杨锐英 Email:yangruiying@medmail.com.cn
R54
A
1000-3614(2017)08-0808-05
10.3969/j.issn.1000-3614.2017.08.018

