石杉碱甲对帕金森病模型大鼠乙酰胆碱酯酶及ATP酶活性的影响
杨 彭,黄 健,韩 敏,莫颖敏,黄振兴,刘 波
(1.广西壮族自治区人民医院神经内科干部病区老年神经内科,南宁 530021;2.广西医科大学第一附属医院检验科,南宁 530021;3.广西医科大学药学院,南宁 530021)
·经验交流·
石杉碱甲对帕金森病模型大鼠乙酰胆碱酯酶及ATP酶活性的影响
杨 彭1,黄 健2△,韩 敏1,莫颖敏1,黄振兴3,刘 波1
(1.广西壮族自治区人民医院神经内科干部病区老年神经内科,南宁 530021;2.广西医科大学第一附属医院检验科,南宁 530021;3.广西医科大学药学院,南宁 530021)
目的 探讨石杉碱甲对帕金森模型病大鼠乙酰胆碱酯酶(AchE)及ATP酶活性的影响。方法 选择45只雄性SD大鼠为研究对象,采用随机数字表法分为空白对照组、模型组、石杉碱甲组各15只。模型组、石杉碱甲组采用6-羟基多巴胺脑立体定向单侧纹状体双靶点微量注射法制备帕金森大鼠模型,石杉碱甲组给予0.1 mg·kg-1·d-1石杉碱甲灌胃,空白对照组和模型组灌入等容量蒸馏水。比较3组大鼠空间记忆能力、纹状体多巴胺(DA)水平及AchE水平、脑内黑质Ca2+-ATPase、Na+- K+-ATPase、Ca2+-Mg2+-ATPase活性。结果 模型组信息游泳时间、选择游泳时间明显长于空白对照组(t=6.907、6.966,P<0.05),石杉碱甲组大鼠信息游泳时间、选择游泳时间明显短于模型组(t=4.572、3.444,P<0.05),且石杉碱甲组大鼠且明显短于模型组(t=2.421、3.912,P<0.05);模型组大鼠脑组织多巴胺明显低于空白对照组,AchE明显高于空白对照组(t=12.517,6.834,P<0.05),石杉碱甲组大鼠脑组织多巴胺明显高于模型组,AchE明显低于模型组(t=6.388、4.719,P<0.05),且石杉碱组大鼠脑组织多巴胺明显低于空白对照组,AchE明显高于空白对照组(t=6.055、2.024,P<0.05);模型组大鼠脑黑质中Ca2+-ATPase、Na+-K+-ATPase、Ca2+-Mg2+-ATPase水平均明显低于空白对照组(t=20.326、15.2225、12.517,P<0.05),石杉碱甲组大鼠脑黑质中Ca2+-ATPase、Na+-K+-ATPase、Ca2+-Mg2+-ATPase水平均高于模型组(t=16.771、9.516、7.480,P<0.05),且大鼠脑黑质中Ca2+-ATPase、Na+-K+-ATPase、Ca2+-Mg2+-ATPase水平均低于模型组(t=3.901、5.844、5.848,P<0.05)。结论 石杉碱甲有助于提高帕金森大鼠空间记忆能力,可能与抑制AchE表达、提高脑组织中多巴胺及ATP酶的活性有关。
帕金森病;乙酰胆碱酯酶;石杉碱甲;ATP酶;空间记忆能力
帕金森病是一种锥体外系疾病,临床主要特征为静止性震颤、肌强直、肌张力增高及运动困难(运动迟缓、姿势步态不稳)[1]。帕金森病常见于中老年人,发病率约占65岁以上老龄人群的1.00%~2.00%。研究表明,帕金森病患者除了运动功能受损外,10.00%~30.00%患者存在明显的记忆、智能、情绪障碍及痴呆等高级神经活动受损症状[2],严重影响患者的生活质量。帕金森病因尚不明确,脑纹状体多巴胺(dopamine,DA)、乙酰胆碱酯酶(acetylcholinesterase,AGhE)表达失衡可能是导致帕金森病的主要原因[3]。石杉碱甲(huperzine A)能抑制AchE活性,通过抗氧化应激和抗细胞凋亡途径来保护神经元继续损伤[4]。也有学者研究表明,石杉碱甲能显著改善PD患者大脑认知功能[5],但具体作用机制尚少见文献报道。本研究拟通过观察石杉碱甲对帕金森病大鼠AchE及ATP酶活性的影响,初步探讨石杉碱甲治疗帕金森的可能作用机制,为下一步临床治疗提供相关的理论依据。
1 材料与方法
1.1 实验动物与分组 健康清洁级成年SD大鼠45只,雄性,体质量200~300 g,平均(238.36±22.45)g,4~8周龄,平均(6.75±0.72)周龄。购自广西医科大学实验中心(许可证号151210),采用随机数字表法分为空白对照组、模型组、石杉碱甲组各15只,本次研究经广西医科大学实验中心动物伦理委员会批准。
1.2 药品、试剂与主要仪器 石杉碱甲片:上海复旦复华药业有限公司,批准文号:H10960133,规格50μg×40 s;水合氯醛:青岛宇龙海藻有限公司,批准文号:国药准字H37022673;6-羟基多巴胺(6-OH多巴胺)、AchE活性试剂盒购自南京建成生物工程研究所;Ca2+-ATPase、Na+-K+-ATPase及Ca2+-Mg2+-ATPase 试剂盒购自天津市科密欧化学试剂中心);HPLC高效液相色谱系统(Varian 公司)、电子分析天平:美国METTLERTOLEDO公司XS205型;分光光度计:上海精密科学仪器有限公司722型;高速冷冻离心机:北京医用离心机厂LD5.2A型;脑立体定位仪:美国Stoelting公司51700型;Morris水迷宫:上海吉量电子公司。
1.3 模型制作 45只大鼠适应性饲养1周后,除空白组,其余组大鼠采用单侧绞状体双靶点注射法建立帕金森模型[6]。用6-OH多巴胺行脑内立体定向注射,10%水合氯醛(0.35 g/kg)麻醉,俯卧位固定于脑立体定位仪上,根据paxson《The Rat Brain》图谱, 将6-OH多巴胺分2点分别注入右中脑腹侧被盖部和黑质致密部,每点注射每5微升10 μg,留针10~15 min,术后每只大鼠腹腔注射青霉素20 MU/d预防感染,连用7 d。2周后腹腔注射盐酸阿朴吗啡(0.5 mg/kg)诱导出模,以平均旋转大于7 r/min 为建模成功。
1.4 分组干预 造模成功后7 d,石杉碱甲组按0.1 mg·kg-1·d-1灌胃给药,空白对照组和模型组灌入等容量蒸馏水,1次/天,连续4周[7]。治疗结束后,采用Markowska设计延缓位置非匹配作业进行训练[8]。将一T型隔板放入水迷宫内,分割成开始部A与开放部B、C,在开放部B放一平台。参照高怀云等[9]文献资料计算信息游泳时间与选择游泳时间。
1.5 观察指标
1.5.1 空间记忆能力 水迷宫训练5 d,统计分析3组大鼠信息游泳时间、选择游泳时间。
1.5.2 脑组织中多巴胺和AchE水平 水迷宫训练5 d后,断头处理大鼠取脑组织,在冰台上迅速分离纹状体,于液氮中保存。经匀浆、3 000 r/min离心10 min后,用高效液相色谱法(HPLC)测定纹状体多巴胺(dopamine,DA)水平;取下丘脑中部脑组织匀浆、4℃离心后取上清液测定AchE(Acetyl cholinesterase,AchE)活性。
1.5.3 ATP酶活性检测 水迷宫训练5 d后,选用升主动脉灌注固定脑组织,参照白妍等[10]文献资料,采用分光光度法测定各组大鼠脑内黑质Ca2+-ATPase、Na+-K+-ATPase、Ca2+-Mg2+-ATPase活性。
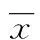
2 结 果
2.1 3组大鼠空间记忆能力比较 模型组信息游泳时间、选择游泳时间明显长于空白对照组(P<0.05);石杉碱甲组大鼠信息游泳时间、选择游泳时间明显长于空白对照组,且明显短于模型组(P<0.05),见表1。

表1 三组大鼠信息游泳时间与选择游泳时间比较±s)
a:t=6.907、6.966,P<0.05,与空白对照组比较;b:t=4.572、3.444,P<0.05,与模型组比较;c:t=2.421、3.912,P<0.05,与空白对照组比较
2.2 3组大鼠脑组织多巴胺、AchE水平比较 模型组大鼠脑组织多巴胺明显低于空白对照组,AchE明显高于空白对照组(P<0.05);石杉碱甲组大鼠脑组织多巴胺明显高于模型组,AchE明显低于模型组(P<0.05);且石杉碱组大鼠脑组织多巴胺明显低于空白对照组,AchE明显高于空白对照组(P<0.05),见表2。

表2 三组大鼠脑组织中多巴胺、AchE水平比较±s)
a:t=12.517、6.834,P<0.05,与空白对照组比较;b:t=6.388、4.719,P<0.05,与模型组比较;c:t=6.055、2.024,P<0.05,与空白对照组比较
2.3 3组大鼠脑内黑质ATPase 活性比较 模型组大鼠脑黑质中Ca2+-ATPase、N2+- K+-ATPase、Ca2+-Mg2+-ATPase水平均明显低于空白对照组(P<0.05);石杉碱甲组大鼠脑黑质中Ca2+-ATPase、Na+- K+-ATPase、Ca2+-Mg2+-ATPase水平均高于模型组(P<0.05),且大鼠脑黑质中Ca2+-ATPase、Na+- K+-ATPase、Ca2+-Mg2+-ATPase水平均低于模型组(P<0.05)。见表3。

表3 三组大鼠脑内黑质中ATP酶活性测定结果比较
a:t=20.326、15.2225、12.517,P<0.05,与空白对照组比较;b:t=16.771、9.516、7.480,P<0.05,与模型组比较;c:t=3.901、5.844、5.848,P<0.05,与空白对照组比较
3 讨 论
帕金森病是一种常见的慢性神经系统退行性疾病,其病理机制与患者中脑黑质多巴胺能神经元和乙酰胆碱神经递质的缺失密切相关。多巴胺合成减少,导致黑质纹状体通路多巴胺通路多巴胺能神经功能减弱,乙酰胆碱系统功能相对亢奋,而钙超载参与帕金森的多巴胺能神经元损伤的发生发展[11]。
石杉碱甲是从我国传统中草药蛇足石杉分离提取到的一种新型石松类生物碱,具有高效、可逆选择性AchE抑制的作用,脂溶性高,分子量小,易透过血脑屏障,能增加突触间隙内乙酰胆碱含量,促进乙酰胆碱神经递质的升高[12-13]。乙酰胆碱是形成记忆的神经递质,主要由胆碱酯酶分解而成。帕金森患者大脑中枢胆碱能神经元受损,使ACh递质减少[14]。多巴胺属于神经递质,是负责传递大脑情欲、感觉的是一种脑内分泌物[15],使用石杉碱甲抑制AchE活性后,能改善胆碱能神经元受损症状[16]。本文研究中,石杉碱甲组大鼠信息游泳时间、选择游泳时间明显短于模型组,这也可以从两组大鼠脑组织中多巴胺、AchE含量比较中得到证实,与刘忠锦等[17]文献报道基本相似,提示石杉碱甲可通过调节多巴胺、AchE发挥神经保护作用。
脑组织对缺血缺氧非常敏感,细胞内Ca2+是神经元凋亡的触发者。当钙离子大量内流时可加强缺氧症状,导致一氧化氮合酶(NOS)的激活与释放,进而增加一氧化氮(NO)含量[18]。二者均促进氧化应激反应、加重线粒体损伤,线粒体损伤又加深钙超载程度,进一步加重神经元细胞损伤及凋亡,因此拮抗Ca2+的作用可起到抗凋亡和神经细胞保护作用[19]。Ca2+-ATPase、Na+-K+-ATPase、Ca2+-Mg2+-ATPase是细胞能量转换的重要系统[20],当上述3种ATP酶活性下降时,会引起Ca2+超载,所产生的细胞毒性作用则导致神经元活性下降甚至死亡。有研究显示,帕金森大鼠大脑纹状体中多巴胺神经元丢失与多巴胺含量下降、黑质的Caspase-3表达增多有关[21]。白妍等[10]指出,提高帕金森病大鼠脑黑质中Ca2+-ATPase、Na+-K+-ATPase、Ca2+-Mg2+-ATPase酶活性能减少钙超载。本文研究中,石杉碱甲组大鼠脑黑质中3种ATPase活性均高于模型组,说明石杉碱甲有助于调节ATP酶活性。本研究结果表明,石杉碱甲有助于提高帕金森模型大鼠空间记忆能力,可能与抑制AchE表达、提高脑组织中多巴胺及ATP酶活性有关。需要提出的是,由于可供参考文献较少,本文对石杉碱甲对乙酰胆碱酶、ATP酶活性影响可能作用机制分析不够,这也是研究的局限性之一。而且由于人体与动物对药物反应能力的差异性,石杉碱甲用于治疗帕金森病还有待于更多的临床研究去证实。
[1]Aygun D,Kocabicak E,Yildiz MO,et al.Effect of age and disease duration on the levodopa response in patients with advanced parkinson′s disease for deep brain stimulation of the subthalamic nucleus[J].Front Neurol,2016,7:97.
[2]李知莲,吴慧芳,马兰.老年帕金森病患者血浆同型半胱氨酸水平与认知障碍的相关性分析[J].海南医学院学报,2014,20(5):642-646.
[3]Aflaki E,Borger DK,Moaven N,et al.A new glucocerebrosidase chaperone reduces alpha-Synuclein and glycolipid levels in iPSC-Derived dopaminergic neurons from patients with gaucher disease and parkinsonism[J].J Neurosci,2016,36(28):7441-7452.
[4]李雯妮,虞华英.石杉碱甲治疗轻中度阿尔茨海默病老年患者的疗效[J].中国老年学杂志,2011,31(11):2096-2097.
[5]张彩霞,余晓峰.石杉碱甲及尼莫地平联合多奈哌齐治疗轻中度老年血管性痴呆的疗效[J].中国老年学杂志,2015,35(12):3298-3299.
[6]牛朝诗,杨艳艳.双靶点注射6-OH DA建立帕金森病大鼠模型并提高成功率[J].立体定向和功能性神经外科杂志,2008,21(5):257-262.
[7]王楠,梁战华,齐中华.EGCG对帕金森病大鼠行为、学习记忆能力的影响及机制[J].山东医药,2016,56(20):28-30.
[8]Markowska AK.VE selective effects of nerve growth factor on spatial recent memory as assessed by a delayed nonmatching-position task in the water maze[J].J Neurosci,1996,16(10):3541-3548.
[9]高怀云,熊晶晶,胡卡明.电针对老年阿尔茨海默病大鼠空间记忆能力的影响[J].针灸临床杂志,2012,28(7):54-56.
[10]白妍,卢金荣,胡丙成,等.不同电针头穴透刺对帕金森病大鼠脑内黑质钙稳态相关3种ATP酶活性的影响[J].中国中医药科技,2016,23(1):4-5.
[11]Wiemerslage L,Ismael S,Lee D.Early alterations of mitochondrial morphology in dopaminergic neurons from Parkinson′s disease-like pathology and time-dependent neuroprotection with D2 receptor activation[J].Mitochondrion,2016,30(16):138-147.
[12]刘忠锦,张海燕,刘佳俊,等.石杉碱甲对血管性痴呆大鼠胶质细胞源性神经营养因子的表达及氧化应激水平的影响[J].中国生化药物杂志,2014,34(6):13.
[13]陈娟,夏燕,孟祥武,等.石杉碱甲治疗阿尔茨海默病认知功能的疗效观察[J].神经损伤与功能重建,2016,11(1):80-81.
[14]李敏,杨明会,刘毅,等.基于脑内神经递质探讨补肾活血中药对帕金森病的影响[J].中药材,2013,36(3):505-507
[15]刘嘉琳,郑芳,龙彦,等.钙结合蛋白S1003B对多巴胺受体及神经递质多巴胺、5-羟色胺生成和代谢的影响[J].中华神经科杂志,2016,49(9):697-702.
[16]刘莉,刘畅,钟源波,等.七氟烷吸入麻醉对大鼠认知功能影响的钙内流机制研究[J].海南医学院学报,2015,21(5):611-613.
[17]刘忠锦,张海燕,刘佳俊,等.石杉碱甲对血管性痴呆大鼠胶质细胞源性神经营养因子的表达及氧化应激水平的影响[J].中国生化药物杂志,2014,35(6):44-46,50.
[18]任蕾,杜井波,翁秋霖.等[J].不同剂量石杉碱甲对血管性痴呆患者的疗效评价[J].中国临床神经科学,2010,18(6):644-646.
[19]Timmermann L,Jain R,Chen L,et al.134 VANTAGE Trial:three-year outcomes of a prospective,multicenter trial evaluating deep brain stimulation with a new multiple-source,constant-current rechargeable system in parkinson disease[J].Neurosurgery,2016,63(Suppl 1):155.
[20]岳康异,杨甜,李新,等.Preso 调控nNOS在神经元机械性损伤中的作用[J].中华神经外科疾病研究杂志,2016,15(6):510-513.
[21]Gaballah HH,Zakaria SS,Elbatsh MM,et al.Modulatory effects of resveratrol on endoplasmic reticulum stress-associated apoptosis and oxido-inflammatory markers in a rat model of rotenone-induced Parkinson′s disease[J].Chem Biol Interact,2016,251(1):10-16.
杨彭(1980-),主治医师,硕士, 主要从事脑血管疾病、帕金森病、痴呆的研究。△
,E-mail:yp198003@163.com。
10.3969/j.issn.1671-8348.2017.22.036
R322.81
A
1671-8348(2017)22-3132-04
2017-01-31
2017-03-12)

