昆虫卵子发生及其研究进展
彭晨星 吴松原 童晓玲 代方银
(家蚕基因组生物学国家重点实验室,农业部蚕桑生物学与遗传育种重点实验室,西南大学生物技术学院,重庆400716)
昆虫卵子发生及其研究进展
彭晨星 吴松原 童晓玲 代方银
(家蚕基因组生物学国家重点实验室,农业部蚕桑生物学与遗传育种重点实验室,西南大学生物技术学院,重庆400716)
强大的生殖能力是昆虫繁衍生息的重要基础,卵子发生作为昆虫生殖的重要环节,一直是发育生物学研究的热点之一。卵子发生不仅为后期胚胎发育提供重要基础,同时伴随着复杂的细胞活动,被作为研究细胞生物学等过程的模型。本文概述了昆虫卵子发生过程、功能及卵子发生的调控因素,这能为进一步理解昆虫生殖及胚胎发育提供参考,也对经济昆虫的繁衍或害虫的防治研究具有参考价值。
昆虫;卵子发生;发育;调控因素
强大的繁殖能力和多样的生殖方式是昆虫能发展成为动物界种类最多、数量最大类群的重要因素之一。两性卵生作为昆虫最为常见的生殖方式,其生殖生理过程的调控机制受到研究者的广泛关注。两性卵生昆虫生殖生理过程包括性别分化形成雌雄各异的性腺与生殖系统、精子与卵子的发生、进行交配受精等复杂的生物学过程。而其中卵子发生尤为受到人们的密切关注,这一方面是由于卵子发生能产生大量的配子为种群延续提供重要的基础,另一方面是由于卵子发生过程中复杂的细胞形态的变化能被广泛用于各类细胞生物学的研究。
昆虫卵子形成发生于卵巢中,其过程为:首先,卵巢中的原始生殖细胞进行增殖并分化形成卵母细胞与滋养细胞,而后体细胞形成的滤泡细胞包裹卵母细胞和滋养细胞形成卵室;卵室在生长过程中滤泡细胞进行增殖与分化形成多种细胞类型,它们进一步经历增殖与分化、形态改变、位置迁移、信息和能量交流等过程后,卵室最终发育成为成熟的卵子。
卵子发生是一个复杂的生物学过程,随着现代生物学的飞速发展,基因组学、蛋白组学、生物信息学和细胞生物学等领域的长足进步,卵子发生过程中越来越多的调控因子被解析,卵子发生的研究取得了显著的进步。本文系统阐述了昆虫卵子发生过程以及近几年来对卵子发生的调控研究所取得的进展,这能为进一步理解昆虫生殖及胚胎发育提供参考,同时也能为促进经济昆虫的繁衍或害虫的防治提供线索。
1 卵子发生
卵子发生过程起始于幼虫阶段,在胚胎晚期性腺分化之后,原始生殖细胞(Primordial germ cells, PGC)和体细胞性腺前体细胞(Somatic gonadal precursors, SGPs)首先会经历几轮细胞分裂进而发育形成卵巢[1-3]。卵巢由多个卵巢管组成(果蝇中通常为15-20个,家蚕通常由8个组成),每个卵巢管从尖端到远端被分为三个部分,分别为端丝(Terminal filament, TF)、原卵区(Germarium, GE)和卵黄区(Vitellarium)。端丝和原卵区是最先形成的部位,最前部体细胞群形成卵巢管的端丝,原卵区的帽细胞(Cap cells)紧靠着端丝与其构成了生殖干细胞(Germline stem cell, GSC)的微环境[4]。
1.1卵室的形成
卵室的形成起始于卵巢管中的原卵区。原卵区中还包括了帽细胞、柄细胞(Stalk cells)、护送细胞(Escort cells, EC)、生殖干细胞和其后期分化形成的各类型细胞。与帽细胞黏着连接(E-cadherin)的生殖干细胞被体细胞形成的护送细胞包围着,处于微环境中的生殖干细胞会分化形成包囊干细胞(Cystoblast, CYB),并经由不完全胞质分裂同步分裂四次形成16个连通的包囊细胞复合体(16-cell cyst),其中一个细胞会发育成卵母细胞进行减数分裂,而其他15个细胞成为滋养细胞(Nurse cells, NC),供给卵母细胞营养。此时,体细胞滤泡干细胞(Somatic stem cells, SSC)进行分化增殖形成滤泡细胞(Follicle cells, FC)包围从原卵区出芽的16-cell cyst,形成卵室并移动到卵黄区,而卵室之间通过滤泡细胞分化形成的柄细胞进行连接(图1)[4]。
CC,帽细胞;CYB,胞囊干细胞;CYC,胞囊细胞;DPGC,生殖干细胞的分化前体;EC,护送细胞;FC,滤泡细胞;GE,原卵区;GSC,生殖干细胞;NC,滋养细胞;OO,卵母细胞;SSC,体细胞干细胞;TF,端丝。
图1果蝇卵巢端丝和原卵区[4]
1.2卵室的成熟发育
双翅目的黑腹果蝇(Drosophilamelanogaster)是重要的模式昆虫,其被广泛用以研究昆虫的各种生物学问题。果蝇卵子发生的研究亦较为成熟,在此我们以果蝇为例对卵子发生进行介绍。
果蝇卵室的发育按照滤泡细胞的形态特征被分为14个时期,在原卵区形成第1时期的卵室。从第1时期到第6时期,滋养细胞都进行核内周期(Endocycle)以增加其多倍体数,而滤泡细胞进行有丝分裂增殖以包围不断生长的卵母细胞。至第7时期,Notch信号通路触发上皮层的滤泡细胞开始进行核内周期增殖,分化形成四种不同形态的滤泡细胞(Stretched、Centripetal、Posterior和Main body follicle cells)、边界细胞(Border cell, BC)和极细胞(Polar cell, PC)[5],这几种细胞在成熟卵的形态构建(背呼吸器、卵孔等结构)、卵的极性和胚胎形成等过程中起到非常关键的作用(图2)。
滤泡细胞在第8时期形成立方上皮细胞,等到了第9时期开始进行一系列的迁移,其中约6-10个最前端的滤泡细胞形成边界细胞,穿过滋养细胞到达卵母细胞的前端,并在第14时期退化形成卵的卵孔(Micropyle)结构;其他约50个前端细胞,被称作Stretched细胞,形成扁平的滤泡细胞覆盖在滋养细胞上;大多数的滤泡细胞变形为柱状围绕在卵室,在第10B时期,滤泡细胞像中心移动覆盖住了处于前端的卵母细胞。当滋养细胞在第10B到14时期通过环管(Ring canals)将mRNA、蛋白质和脂质等物质完全转移给卵母细胞后进行细胞凋亡,滤泡细胞也在第14时期完成卵壳构建并形成背附属物(Dorsal appendages)和鳃盖(Operculum)等结构后进行细胞凋亡(图3)[5-7]。
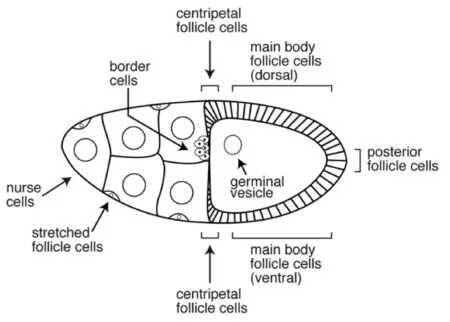
图2 第10B时期的卵室中不同类型细胞示意图[5]
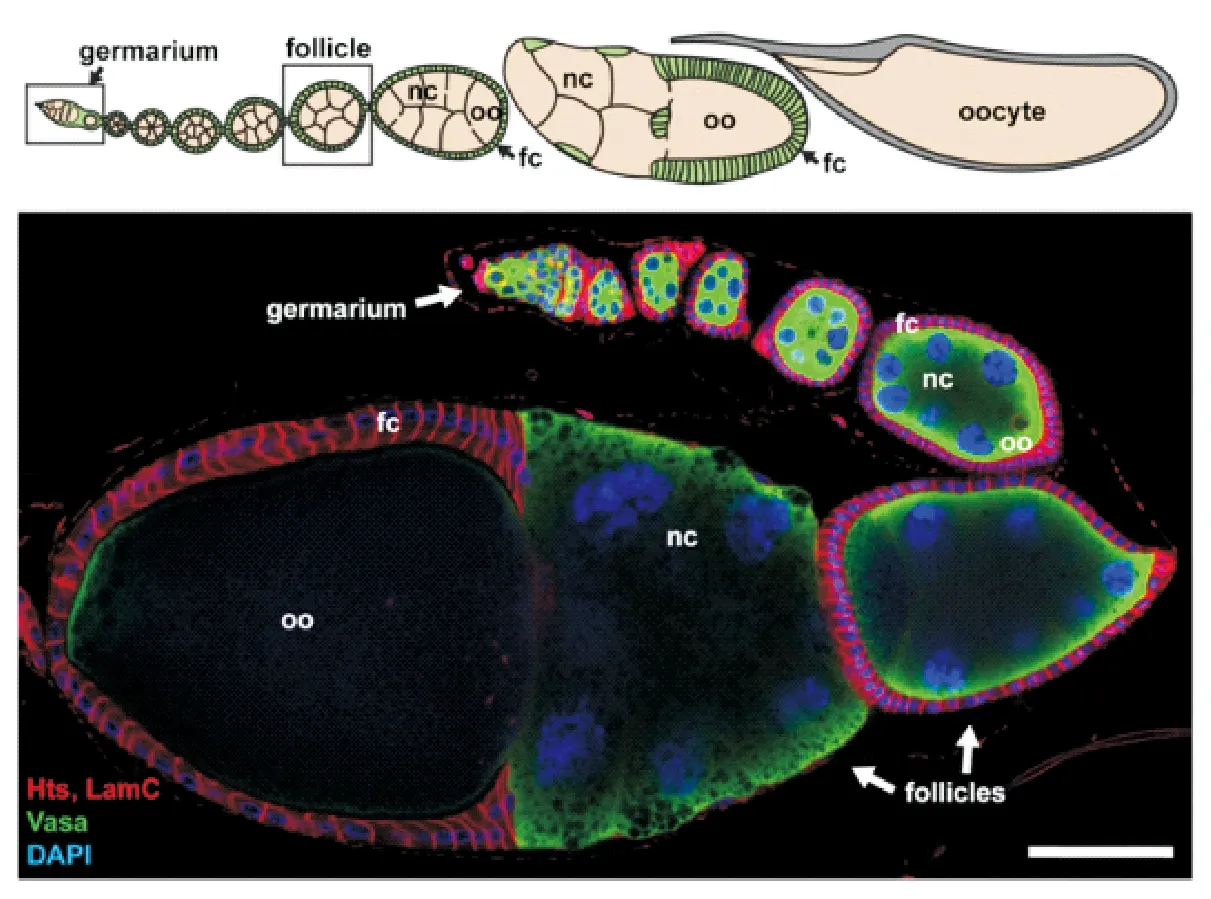
生殖细胞(绿色)用anticasa抗体染色;微环境和滤泡细胞膜(红色)用anti-Hts和anti-LamC染色;细胞核使用DAPI进行染色。fc,滤泡细胞;nc,滋养细胞;oo,卵母细胞。
图3卵室发育时期图[8]
卵的极性是由滤泡细胞中特化形成的一类极细胞所调控的,其处于卵室的两端,在细胞迁移过程中随着边界细胞迁移至滋养细胞与卵母细胞的交界处,对胚胎前后轴Anterior/posterior axis(A/P axis)的形成至关重要[7]。
2 卵子发生的重要功能
卵子发生为后期的胚胎发育提供了重要基础,其主要具有以下三个方面的功能:其一,卵室进行形态构建形成的卵子为胚胎发育提供了场所[9-10];其二,卵母细胞吸收并储存的卵黄蛋白(Yolk protein, YP)为受精后胚胎发育提供营养物质;其三,卵母细胞进行减数分裂形成雌原核为受精提供了配子。
昆虫卵室在构建过程中不仅形成了坚固的卵壳以保护胚胎的发育,同时也形成了用于呼吸作用背附属物或气孔、用于幼虫孵化出口的鳃盖和用于精子进入的卵孔等结构[9,11]。卵子在发生过程中卵室构建形成了,已经鉴定了JAK/STAT、Notch、Gurken-EGFR、Insulin、Hippo和Wnt/Wingless等信号通路能独立或共同的调控卵室内各细胞的形成或迁移等过程,调控卵室形态的构建过程[12-15]。
昆虫卵成熟的过程也是卵母细胞吸收卵黄原蛋白(Vitellogenin, Vg)合成卵黄蛋白储存营养物质的过程,故亦可将卵子发生过程分为卵黄形成前期(Previtellogenesis)、卵黄形成(Vitellogenesis)和绒毛膜形成/卵壳形成(Choriogenesis)这三个过程。卵黄原蛋白是昆虫体内最为丰富的卵黄蛋白前体,其主要是在激素的调控下在脂肪体中合成,释放至血淋巴中,分别通过卵黄原蛋白受体(Vitellogenin receptor, VgR)和卵黄蛋白受体(Yolk protein receptor, YPR)介导的胞吞作用与内吞作用被卵母细胞所吸收[16-17]。卵黄原蛋白及卵黄蛋白的合成与转运对于卵巢激活、卵黄发生和卵子形成密切相关,研究者们相继鉴定了飞蝗(Locustamigratoria)[18]、埃及伊蚊(Aedesaegypti)[19]、红火蚁(Solenopsisinvicta)[20]、家蚕(Bombyxmori)[21]和褐飞虱(Nilaparvatalugens)[22]等30多个物种的卵黄原蛋白受体蛋白VgR。
卵子发生另一重要的功能就是产生功能性的配子。卵子发生早期,同源染色体进行联会(Synaptonemal complex,SC)并发生减数分裂重组形成核小体,处于减数分裂第一时期的卵母细胞会一直延续这个状态到卵子成熟。待产卵后,卵母细胞减数分裂重新被启动形成一个雌核和三个极体(Polar-body)[23]。
3 昆虫卵子发生的调控因素
昆虫卵子发生过程是一个复杂的发育过程,其受到了蜕皮激素、保幼激素、各类信号通路和转录因子等一系列因素的共同调控。
3.1激素与卵子的发生
蜕皮激素信号调控卵子发生的过程分为两个阶段:第一阶段,在卵子发生早期的原卵区对于Niche细胞的形成、滤泡细胞的分化、生殖干细胞(GSC)的维持和包囊细胞复合体(Cyst)细胞分化中起到作用。由蜕皮激素受体EcR/Usp传导的蜕皮激素信号通路会在果蝇幼虫3龄早期和3龄晚期分别抑制和激活下游的转录因子Broad-Complex(BR-C)的表达,进而在3龄早期先抑制,而在3龄晚期激活Niche的形成和原始生殖细胞(PGC)的分化,促使原卵区形成足够的Niche和干细胞前体(DPGC)。进一步,蜕皮激素信号能通过调控E78(Ecdysone-inducedprotein78)和BR-C影响GSC的数量。第二阶段,在卵子发生中期,蜕皮激素对于卵子发育关键时期滤泡细胞的命运、卵黄原蛋白的累积和边界细胞的迁移至关重要。蜕皮激素信号中BR-C能响应营养信号从而调控蜕皮激素响应基因E75A和E75B的表达从而调控卵子发育第8时期滤泡细胞是进行凋亡还是继续发育进行卵黄生成和卵成熟的过程。在营养充足的情况下蜕皮激素信号调控E75B进行表达,促进第8时期的滤泡细胞进行卵黄生成和卵成熟;反之,在饥饿的条件下蜕皮激素会诱导E75A的表达,从而诱导滤泡细胞凋亡。蜕皮激素影响边界细胞迁移的过程需要Taiman(辅助激活剂,蜕皮激素受体复合物)和Abrupt(BTB/ZF转录因子,作为蜕皮激素信号抑制因子在滤泡细胞中表达)、E74、E75或BR-C等因子的共同参与。极细胞中JAK/STAT信号和蜕皮激素信号均能降低Abrupt的含量,低浓度的Abrupt又进一步激活蜕皮激素的表达丰度上调,高浓度的蜕皮激素信号又会激活边界细胞迁移起始(图4)[4,24]。
保幼激素影响卵子发生过程主要是与蜕皮激素协同起作用调控卵黄原生成(Vitellogenin, Vg)过程。根据现有的研究来看,由咽侧体分泌的保幼激素会刺激滤泡细胞中合成蜕皮激素和Vg,而滤泡细胞中产生的蜕皮激素会进一步刺激脂肪体中Vg的合成,脂肪体中合成的Vg会经过血淋巴进而被卵母细胞吸收[25]。但是保幼激素与蜕皮激素如何协同影响卵子发生的过程还有待进一步的研究。

图4 蜕皮激素在卵子发生过程中不同调控作用示意图[24]
3.2卵子发生过程中主要的信号通路
果蝇卵子发生除受到激素调控以外,还涉及许多信号通路的调节。目前较为明确参与果蝇卵子发生过程的信号通路包括JAK/STAT、Notch、Gurken-EGFR、Insulin、Hippo和Wnt/Wingless信号通路等。
JAK/STAT信号通路由受体Domeless(Dome)、Hopscotch(Hop)、转录因子STAT92E(STAT)和配体Unpaired(Upd)这些基本的元件构成,其相关蛋白和基本功能在生物体中相对保守。JAK/STAT参与生殖过程在不同性别间存在差异,其要与体细胞中TGFβ、Hedgehog、Notch、 EGF和PDGF等信号通路共同作用。在卵巢中,JAK/STAT信号通路主要有以下几个方面的作用:① JAK/STAT通过Decapentaplegic(Dpp)影响柄细胞和极细胞的数量;②卵前部极细胞中的Upd信号会调控组织附近的滤泡细胞形成边界细胞;③而hop和STAT会影响边界细胞的迁移。已经鉴定了slowbordercells(slbo)基因(编码果蝇的CCAAT/enhancer-binding protein(C/EBP)同源蛋白)作为STAT的靶基因会调控下游的FAK、DE-cadherin、TheFGFreceptorBreathless和编码核受体的jing和yan基因,从而影响边界细胞的迁移[12-15]。
Notch信号通路是通过Notch受体与Delta配体相互作用传导细胞信号,从而调控下游靶基因的表达。在生殖细胞中表达的Delta调控滤泡细胞的发育具有时期性,其主要通过调控卵室形成的两个不同的时期,分别为:①在卵子发生早期,Notch信号通路能与JAK/STAT共同调控柄细胞和极细胞的形成[26];②在卵子发育第6到8时期,Notch信号通路激活上皮层的滤泡细胞由有丝分裂转化而进行核内周期增殖,并通过FasIII的表达诱导滤泡细胞的分化,最终形成主体滤泡细胞和两端滤泡细胞两种类型[27]。
随着对卵子发生的研究不断深入,越来越多信号通路涉及到该过程,例如EGF信号在卵子发生过程中能通过与配体转化生长因子TGFα-like分子Gurken(Grk)结合,从而激活卵室后端的滤泡细胞表面的EGF受体,使卵母细胞后腹部的滤泡细胞获得特异性的命运,影响卵母细胞微观组织结构的重建和卵母细胞极性[28];Insulin信号通路在卵子发生中卵黄成熟过程,即使在保幼激素、蜕皮激素和一些其他因子存在的情况下,缺乏胰岛素底物蛋白(CHICO)的果蝇也不能正常经历卵黄生成[29];Hippo信号通路能通过主要的抑制因子yorkie抑制Notch信号通路从而影响极细胞特化参与卵子发生[30];Hedgehog信号通路能通过调控体细胞和生殖细胞间相互作用而影响卵巢形态的构建[31];TOR信号通路在对于维持成虫期Niche-GSC单元的功能从而影响生殖细胞和其他类型细胞形成具有最基本的作用[32-33];Wnt/Wingless会参与调控滤泡干细胞的增殖与分化[34];Pdgf/Vegf受体能引导边界细胞到达恰当的位置[35]。
4 卵子发生过程中的生物学研究
卵子发生中涉及复杂的生物学过程,被广泛用于各类生物过程研究的模型。包括细胞凋亡、干细胞功能、生殖细胞发育、减数分裂、细胞迁移、形态发生、细胞间信号传导和转录调控等过程[36]。
4.1卵子发生与细胞凋亡
细胞凋亡是发育过程中最基本的生命现象,其亦是多细胞生物体中一种重要的自我稳定机制。在卵子发生过程中,生殖细胞、滤泡细胞和滋养细胞都会经历细胞凋亡。生殖细胞在卵子发生过程中进行有丝分裂产生大量的卵原细胞,卵巢中的凋亡检验点能控制卵原细胞的数量,从而保持体细胞和生殖细胞的数量的平衡[37-39];滋养细胞的凋亡是其将细胞质中的物质如mRNA、蛋白质和脂质等完全转移给卵母细胞后[40-41];滤泡细胞凋亡主要发生在其行使完功能之后[42]。已经鉴定了Caspases蛋白家族,跨膜蛋白Spomster(与人类Hspin1同源),daughterless(da)、dmos、chico和midway等基因通过促进或抑制的作用参与卵子发生过程中各细胞类型的凋亡[37-39,43-46]。
4.2卵子发生与减数分裂
果蝇全基因组测序及注释的基础、丰富的遗传学操作手段是将果蝇卵子发生作为研究减数分裂过程的模型最基本的因素之一。果蝇卵子发生在减数分裂研究方面具有以下几个优势:①随着人们对于果蝇遗传学的解析,依据重组频率构建了减数分裂图谱,对于减数分裂过程的解析提供了重要的基础;②果蝇中具有大量自然及人工突变体,在果蝇中广泛得到应用的基因编辑手段也为探究减数分裂过程中相关的基因功能提供了有力基础;③果蝇卵子发生机制简单而有序是其作为研究减数分裂过程的又一因素[23]。
5 小结
尽管随着生物学手段的长足发展,人们对卵子发生的机制及调控有了较为清晰的认识,但是卵子发生的认知仍然存在局限性。主要有以下几点因素:①目前对于卵子发生的研究主要集中在双翅目的果蝇。果蝇作为模式昆虫具有着较大的优势,果蝇中通过大量的由P转座因子插入(P-element insertion)导致的不育突变体鉴定了大量的因子参与调控卵子发生。但是其调控机制是否在昆虫中普遍存在,这还需进一步对已鉴定的调控因子在不同物种中进行鉴定。②调控卵子发生的分子机制网络并不明朗。目前已鉴定了JAK/STAT、Notch、Gurken-EGFR、Insulin、Hippo和Wnt/Wingless等信号通路,转录因子或调节基因,蜕皮激素和保幼激素信号等,能独立的或相互作用的参与调控卵子的发生,但是各信号通路间的相互作用还未完全解析。
对卵子发生调控的研究一方面还要依赖于不同物种中的一些新的突变体的鉴定,以鉴定得到新的调控因子,另一方面还要依赖于现有的分子生物学手段对其调控机制进行进一步解析。我们有理由相信随着现代生物学的飞速发展,卵子发生调控机制会越来越明朗。
[1] DEFALCO TJ,VERNEY G,JENKINS AB,et al. Sex-specific apoptosis regulates sexual dimorphism in theDrosophilaembryonic gonad. Developmental cell[J]. 2003,5:205-216.
[2] LE BRAS S,VAN DOREN M. Development of the male germline stem cell niche inDrosophila. Developmental biology[J]. 2006,294:92-103.
[3] JEMC JC. Somatic Gonadal Cells: The Supporting Cast for the Germline[J]. Genesis,2011,49:753-775.
[4] BELLES X,PIULACHS MD. Ecdysone signalling and ovarian development in insects: from stem cells to ovarian follicle formation. Biochimica et Biophysica Acta[J]. 2015,1849:181-186.
[5] CAVALIERE V,BERNARDI F,ROMANI P,et al. Building up theDrosophilaeggshell: first of all the eggshell genes must be transcribed[J]. Developmental dynamics,2008,237:2061-2072.
[6] WU XD,TANWAR PS,RAFTERY LA.Drosophilafollicle cells: Morphogenesis in an eggshell[J]. Seminars in cell & developmental biology,2008,19:271-282.
[7] GATES J.Drosophilaegg chamber elongation: insights into how tissues and organs are shaped[J]. Fly,2011,6:213-227.
[8] ABLES ET.Drosophilaoocytes as a model for understanding meiosis: an educational primer to accompany “corolla is a novel protein that contributes to the architecture of the synaptonemal complex ofDrosophila”[J]. Genetics,2015,199:17-23.
[9] CAVALIERE V,BERNARDI F,ROMANI P,et al. Building up theDrosophilaeggshell: first of all the eggshell genes must be transcribed[J]. Developmental Dynamics An Official Publication of the American Association of Anatomists,2008,237:2061.
[10]WU X,TANWAR PS,RAFTERY LA.Drosophilafollicle cells: morphogenesis in an eggshell[J]. Seminars in cell & developmental biology,2008,19:271-282.
[11]LECANIDOU R,PAPANTONIS A. Silkmoth chorion gene regulation revisited: promoter architecture as a key player[J]. Insect molecular biology,2010,19:141-151.
[12]MCGREGOR JR,XI R,HARRISON DA. JAK signaling is somatically required for follicle cell differentiation inDrosophila[J]. Development,2002,129:705.
[13]HOMBRIA JC,BROWN S. The fertile field ofDrosophilaJak/STAT signalling[J]. Current biology,2002,12:R569-575.
[14]BECCARI S,TEIXEIRA L,RØRTH P. The JAK/STAT pathway is required for border cell migration duringDrosophilaoogenesis[J]. Mechanisms of development,2002,111:115-123.
[15]SILVER DL,GEISBRECHT ER,MONTELL DJ. Requirement for JAK/STAT signaling throughout border cell migration inDrosophila[J]. Development,2005,132:3483.
[16]MARIN MG,MATOZZO V. Vitellogenin induction as a biomarker of exposure to estrogenic compounds in aquatic environments[J]. Marine Pollution Bulletin,2004,48:835-839.
[17]TUFAIL M,TAKEDA M. Insect vitellogenin/lipophorin receptors: molecular structures,role in oogenesis,and regulatory mechanisms[J]. Journal of insect physiology,2009,55:88-104.
[18]FERENZ H-J. Yolk protein accumulation inLocustamigratoria(R. & F.) (Orthoptera:Acrididae) oocytes[J]. Int J Insect Morphol,1993,22:295-314.
[19]CHO KH,RAIKHEL AS. Organization and developmental expression of the mosquito vitellogenin receptorgene[J]. Insect molecular biology,2001,10:465-474.
[20]CHEN ME,LEWIS DK,KEELEY LL,et al. cDNA cloning and transcriptional regulation of the vitellogenin receptor from the imported fire ant,SolenopsisinvictaBuren(Hymenoptera:Formicidae)[J]. Insect molecular biology,2004,13:195-204.
[21]LIN Y,MENG Y,WANG YX,et al. Vitellogenin Receptor Mutation Leads to the Oogenesis Mutant Phenotype “scanty vitellin” of the Silkworm,Bombyxmori[J].Journal of Biological Chemistry,2013,288:13345-13355.
[22]LU K,SHU Y,ZHOU J,et al.Molecular characterization and RNA interference analysis of vitellogenin receptor from Nilaparvatalugens (Stal)[J]. Journal of insect physiology,2015,73:20.
[23]ABLES ET. Drosophila Oocytes as a Model for Understanding Meiosis: An Educational Primer to Accompany “Corolla Is a Novel Protein That Contributes to the Architecture of the Synaptonemal Complex ofDrosophila”[J]. Genetics,2015,199:17-23.
[24]URYU O,AMEKU T,NIWA R. Recent progress in understanding the role of ecdysteroids in adult insects: Germline development and circadian clock in the fruit flyDrosophilamelanogaster[J]. Zoological letters,2015,1:32.
[25]GRUNTENKO NE,RAUSCHENBACH IY. Interplay of JH,20E and biogenic amines under normal and stress conditions and its effect on reproduction[J]. Journal of insect physiology,2008,54:902.
[26]ASSA-KUNIK E,TORRES IL,SCHEJTER ED,et al.Drosophilafollicle cells are patterned by multiple levels of Notch signaling and antagonism between the Notch and JAK/STAT pathways[J]. Development,2007,134:1161-1169.
[27]ROTH S.Drosophilaoogenesis: coordinating germ line and soma[J]. Current biology,2001,11:R779-781.
[28]NILSON LA,SCH?PBACH T. EGF receptor signaling inDrosophilaoogenesis[J]. Current Topics in Developmental Biology,1999,44:203-243.
[29]RICHARD DS,RYBCZYNSKI R,WILSON TG,et al. Insulin signaling is necessary for vitellogenesis inDrosophilamelanogasterindependent of the roles of juvenile hormone and ecdysteroids: female sterility of the chico1 insulin signaling mutation is autonomous to the ovary[J]. Journal of insect physiology,2005,51:455.
[30]CHEN HJ,WANG CM,WANG TW,et al. The Hippo pathway controls polar cell fate through Notch signaling duringDrosophilaoogenesis[J]. Developmental biology,2011,357:370.
[31]BESSE F,BUSSON D,PRET AM. Hedgehog signaling controls Soma-Germen interactions duringDrosophilaovarian morphogenesis[J]. Developmental dynamics,2005,234:422-431.
[32]LAFEVER L. Specific roles of target of rapamycin in the control of stem cells and their progeny in theDrosophilaovary[J]. Development,2010,137:2117-2126.
[33]LAFEVER L,DRUMMOND-BARBOSA D. Direct control of germline stem cell division and cyst growth by neural insulin inDrosophila[J]. Science,2005,309:1071-1073.
[34]SONG X,XIE T. Wingless signaling regulates the maintenance of ovarian somatic stem cells inDrosophila[J]. Development,2003,130:3259-3268.
[35]DUCHEK P,SOMOGYI K,JÉKELY G,et al. Guidance of cell migration by theDrosophilaPDGF/VEGF receptor[J]. Cell,2001,107:17-26.
[36]MCLAUGHLIN JM,BRATU DP.DrosophilamelanogasterOogenesis: An Overview[M].Springer New York,2015,1-20
[37]BAUM JS,ST GEORGE JP,MCCALL K. Programmed cell death in the germline[J]. Seminars in cell & developmental biology,2005,16:245-259.
[38]DRUMMOND-BARBOSA D,SPRADLING AC. Stem Cells and Their Progeny Respond to Nutritional Changes duringDrosophilaOogenesis[J]. Developmental biology,2001,231:265-278.
[39]RD SJ,CUMMINGS CA,CRONMILLER C. Daughterless coordinates somatic cell proliferation,differentiation and germline cyst survival during follicle formation inDrosophila[J]. Development,2002,129:3255-3267.
[40]NEZIS IP,STRAVOPODIS DJ,PAPASSIDERI I,et al. Stage-specific apoptotic patterns duringDrosophilaoogenesis[J]. European Journal of Cell Biology,2000,79:610-620.
[41]FOLEY K,COOLEY L. Apoptosis in late stageDrosophilanurse cells does not require genes within the H99 deficiency[J]. Development,1998,125:1075.
[42]REGINATO RD,DA CLC. Morphological characterization of cell death during the ovary differentiation in worker honey bee[J].Cell Biology International,2002,26:243-251.
[43]LAUNDRIE B,PETERSON JS,BAUM JS,et al.Germline cell death is inhibited by P-element insertions disrupting the dcp-1/pita nested gene pair inDrosophila[J]. Genetics,2003,165:1881.
[44]PETERSON JS,BARKETT M,MCCALL K. Stage-specific regulation of caspase activity inDrosophilaoogenesis[J]. Developmental biology,2003,260:113-123.
[45]BUSZCZAK M,LU X,SEGRAVES WA,et al. Mutations in the midway gene disrupt aDrosophilaacyl coenzyme A: diacylglycerolacyltransferase[J]. Genetics,2002,160:1511-1518.
[46]ROYZMAN I,HAYASHI-HAGIHARA A,DEJ KJ,et al.The E2F cell cycle regulator is required forDrosophilanurse cell DNA replication and apoptosis[J]. Mechanisms of development,2002,119:225-237.
OnInsectOogenesisandaReviewoftheProgressofItsResearch
PENG Chen-xing WU Song-yuan TONG Xiao-ling DAI Fang-yin
(StateKeyLaboratoryofSilkwormGenomeBiology,LaboratoryofSericulturalBiology,GeneticsandBreeding(MinistryofAgriculture),CollegeofBiotechnology,SouthwestUniversity,Chongqing400716,China)
A strong reproductive capacity is an important basis for insects to survive. Oogenesis, as an important part of insect reproduction, has been a hot spot in developmental biology. Not only does oogenesis provide an important basis for later embryonic development, it also is accompanied by complex cell activities, which is often used as a model for studying cell biology and other processes. In this paper, a review is given of the process of insect egg generation, its functions and its regulatory factors, which can provide reference for a better understanding of insect reproduction and embryo development, and also provide clues to promote the breeding of economic insects or the prevention and control of pests.
insect; oogenesis; development; regulatory factor
863计划项目(No. 2013AA102507);国家自然科学基金项目(No.31472153, No. 31372379);国家现代农业产业技术体系建设项目(CARS-18)。
彭晨星(1992-),女,硕士。研究方向:家蚕分子遗传。
代方银,教授,博士生导师。E-mail: fydai@swu.edu.cn

