茶小绿叶蝉代谢解毒基因CYP303A1的克隆及生物信息学分析
李良德,王定锋,李慧玲,张 辉,曾明森,吴光远
茶小绿叶蝉代谢解毒基因CYP303A1的克隆及生物信息学分析
李良德,王定锋,李慧玲,张 辉,曾明森,吴光远*
(福建省农业科学院茶叶研究所,福建 福安 355015)
CYP303A1基因是细胞色素P450(简称P450)家族成员之一,它在昆虫药物代谢解毒过程中发挥重要作用。本研究通过RT-PCR方法克隆了茶小绿叶蝉Empoasca flavescens CYP303A1基因编码区ORF,并通过生物信息学软件和在线网站对该基因编码蛋白的理化性质、系统进化树、氨基酸多重序列比对、三级结构及功能域进行了分析。结果表明,CYP303A1基因含有1503 bp开放阅读框,编码500个氨基酸,分子量为57.42 k Da,理论等电点为8.56。系统进化树分析结果表明,CYP303A1基因与同翅目的烟粉虱Bemisia tabaci亲缘关系最近,与膜翅目的榕小蜂Ceratosolen solmsi亲缘关系最远。氨基酸系列比对结果表明,CYP303A1基因与其他物种昆虫CYP303A1的保守性较差。三级结构及功能域分析结果表明,该蛋白以β折叠为主,功能域由一信号肽和p450蛋白域(Pfam:p450)组成。该研究明确了茶小绿叶蝉CYP303A1的核苷酸序列及编码蛋白特征。
茶小绿叶蝉;CYP303A1基因;克隆;生物信息学;杀虫剂
福建省现有茶园370万亩,茶树害虫种类繁多。茶小绿叶蝉Empoasca flavescens,隶属同翅目(Homoptera)叶蝉科(Cicadellidae),是茶树上的头号害虫,也是茶树病虫害防治工作的首要对象[1]。目前,可供选择防治该虫的药剂极少,导致了茶农长期单一使用同一类杀虫剂,从而导致茶小绿叶蝉抗药性增强,防效显著下降,虫害连年暴发。如2000年初,王念武等发现寿宁茶场的小绿叶蝉对阿克泰、莫比朗、吡虫啉等农药产生了不同程度的抗性,特别是阿克泰的抗性达到了13.3倍[2];2009年,庄家祥等发现在武夷山茶场和福安茶场茶小绿叶蝉对啶虫脒的抗性倍数达到了52.3和97.4倍,抗性水平进一步提升[3];最近,李建宇等发现福州、南平、泉州和宁德主产茶区的茶小绿叶蝉对联苯菊酯和啶虫脒已达到高抗水平[4]。由此可见,茶小绿叶蝉的抗药性出现了逐年加重的现象。
害虫具有较为复杂的抗药性机制,导致害虫抗性产生的主要原因有:杀虫剂对表皮的穿透力降低,昆虫对杀虫剂的解毒代谢增强和杀虫剂对作用靶标的敏感性降低。其中昆虫细胞色素P450酶(Cytochrome P450 enzyme,简称P450)对杀虫剂的解毒代谢作用增强,是导致昆虫对靶标农药产生抗性的主要原因[5]。1958年最早发现P450蛋白是一类含有亚铁血红素和硫醇盐的蛋白酶,它能与CO结合并在450 nm处有较强吸收峰,因此而得名[6,7]。到目前为止,已在数十种昆虫中发现多种P450家族成员(如CYP3,CYP4和CYP6等),且每个家族又具有多个亚族基因,其中CYP3家族与农药的解毒代谢及昆虫免疫密切相关。
研究表明,CYP3主要通过相应的酶活性的增加或其酶表达量的增加,导致害虫产生抗药性[8,9]。例如,棉铃虫Helicoverpa armigera CYP337B3具有催化氰戊菊酯的羟基化作用,最终导致棉铃虫对氰戊菊酯产生抗药性[5]。又如对拟除虫菊酯产生抗性的棉铃虫与CYP337B3的上调表达密切相关[10]。因此,开发基于以茶小绿叶蝉CYP303A1为靶标的新杀虫剂对解决茶小绿叶蝉抗药性具有重要的意义。本研究采用RT-PCR技术从茶小绿叶蝉中克隆得到CYP303A1基因的编码区ORF全长,并对该基因编码的蛋白序列进行了分子量、等电点和疏水性分析;同时构建了该基因的系统进化树并比对了氨基酸序列图谱;最后,对其特殊的三级结构及蛋白功能域进行了分析模拟。
1 材料与方法
1.1 供试昆虫及取样
试验昆虫茶小绿叶蝉,采自福建省农业科学院茶叶研究所试验茶园(福建省福安市社口镇,北纬27°8′~27°13′,东经119°32′~119°38′)。采用捕虫网来回S型路线绕茶园将茶小绿叶蝉收集于捕虫网中,并收集3~4龄茶小绿叶蝉若虫于1.5 m L离心管中(每管150头),保存于-80℃中备用。
1.2 主要试剂
总RNA提取(E.Z.N.A.TMTotal RNA Kit)及反转试剂盒(Revert AidTMFirst Strand cDNA Synthesis Kit)、DNA回收凝胶试剂盒购自Sigma公司;琼脂糖凝胶、d NTPs(浓度2.5 mmol·L-1)、Taq DNA聚合酶、DNA Marker(DL2000)、载体p MD20-T和大肠杆菌感受态细胞(DH5α)均为Ta KaRa公司购买。本试验所用引物的合成和菌样的测序均由上海英潍捷基贸易有限公司完成。
1.3 总RNA提取及cDNA模板的合成
将预先备好的3~4龄茶小绿叶蝉若虫(每管150头)液氮冷冻后,参照总RNA提取试剂盒说明书,研磨提取总RNA,并用电泳检测(2%琼脂糖凝胶)所提取RNA的完整性。参照总RNA反转试剂盒说明书,于20μL混合体系中加入1μg总RNA反转构建cDNA模板。
1.4 茶小绿叶蝉CYP303A1基因RT-PCR扩增
根据已获得的茶小绿叶蝉转录组数据库,从中挑选出茶小绿叶蝉CYP303A1的基因片段,分析得知该片段包含完整编码区ORF。为验证获得的碱基序列,首先在ORF的起始密码子两端设计一对兼并引物CAGGCTATATCCTGCAAA/TGAC ATCGTCTTGCGACC进行RT-PCR扩增。进而在终止密码子的两端设计另一交叉兼并引物ACGAGTGTATCAAGGAGAT/CAACATCTTT ATTGCTATA,RT-PCR扩增获得茶小绿叶蝉CYP303A1的ORF全序列。扩增反应程序为:95℃3 min;95℃30 s,62℃1 min,72℃45 s,40个循环;72℃6 min;4℃,保存备用。最后,将所克隆的目的条带用琼脂糖凝胶回收并与p MD20-T载体进行重组,导进DH5α感受态细胞中培养,挑取阳性白斑进行序列测序。
1.5 茶小绿叶蝉CYP303A1基因生物信息学分析
茶小绿叶蝉CYP303A1序列由DNAstar软件去除重复序列拼接获得;蛋白质理化信息通过ProtParam在线网站分析获得;氨基酸多重序列比对由Multalin 5.4.1在线网站比对获得;系统进化树由MEGA 7.0采用1000次重复分析制作获得(比对方法:neighbor-joining,NJ);三级结构由Swiss Model在线网站模拟获得;蛋白功能域由SMART在线网站分析获得。
2 结果与分析
2.1 茶小绿叶蝉CYP303A1基因的克隆
通过设计的两对简并引物,分别扩增获得大小为465 bp(图1:泳道2)和1884 bp(图1:泳道1)的前后两个条带,再将所获得的前后条带去除重复序列,拼接得到2161 bp的全序列。
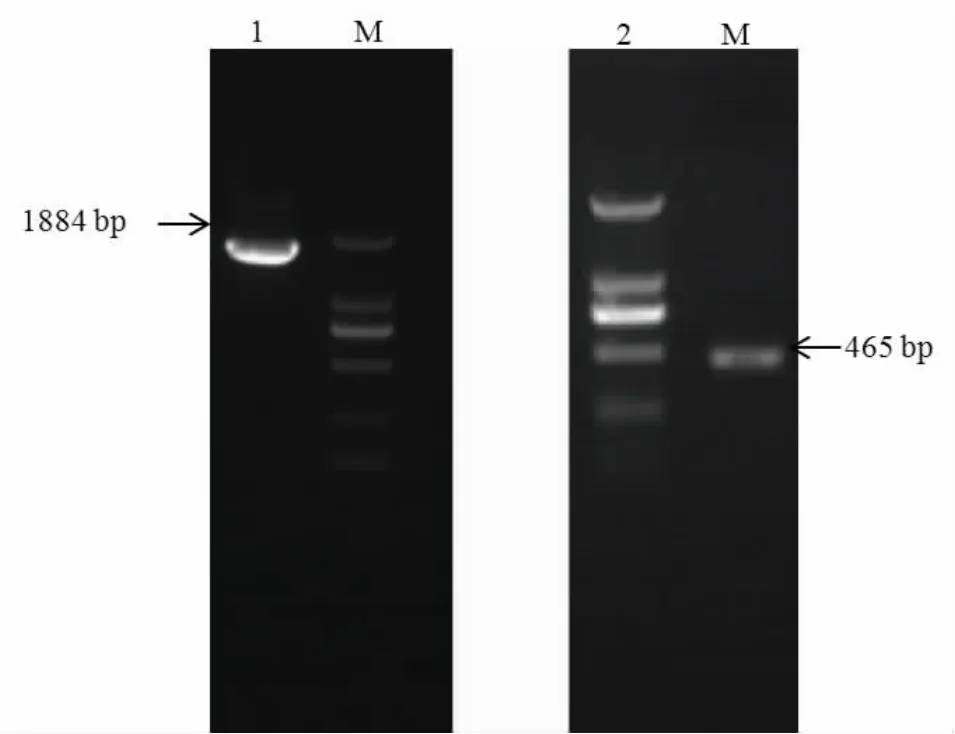
图1 茶小绿叶蝉CYP303A1基因的克隆Fig.1 Cloning of CYP303A1 cDNA from Empoasca flavescens
采用DNAstar软件对该基因进行拼接,结果表明CYP303A1基因含有1503 bp开放阅读框,编码500个氨基酸(图2)。采用ProtParam在线网站对编码蛋白的理化性质进行分析,结果表明该蛋白分子式为C2608H4062N682O720S29,总平均疏水性为-0.219,理论等电点为8.56,分子量为57.42 kDa。

图2 茶小绿叶蝉CYP303A1编码的氨基酸序列Fig.2 Aminoacid sequence of CYP303A1 from E.flavescens
2.2 茶小绿叶蝉CYP303A1系统进化树分析
通过NCBI Blast比对后发现,茶小绿叶蝉CYP303A1基因与烟粉虱Bemisia tabaci(XM_ 019040732.1)、温带臭虫Cimex lectularius(XM_014391468.1)、茶翅蝽Halyomorpha halys(XM_014430413.1)、柑橘木虱Diaphorina citri(XM_017445374.1)、红火蚁Orussus abietinus(KM217008.1)、豌豆长管蚜Acyrthosiphon pisum(XM_001951058.4)、白背飞虱Sogatella furcifera(KX660712.1)、小菜蛾Plutella xylostella(XM_011554832.1)、蝇蛹金小蜂Nasonia vitripennis(NM_001167774.1)、芜菁叶蜂Athalia rosae(XM_012401354.2)、灰飞虱Laodelphax striatell a(JX462969.1)、短管赤眼蜂Trichogramma pretiosum(XM_014366947.1)、榕小蜂Ceratosolen solmsi(XM_011496884.1)基因的亲缘关系依次降低。将以上序列下载并制成fasta格式文档,由MEGA 7.0软件制作获得系统进化树(图3)。由图中可知,该基因与同翅目的烟粉虱Bemisia tabaci亲缘关系最近,与膜翅目的榕小蜂Ceratosolen solmsi亲缘关系最远。
2.3 茶小绿叶蝉CYP303A1氨基酸多重序列比对
通过NCBI比对发现,茶小绿叶蝉CYP303A1基因与其他物种昆虫CYP303A1的保守性较差,其中与同翅目烟粉虱Bemisia tabaci(XM_019040732.1)和白背飞虱Sogatella furcifera(KX660712.1)保守性最高,为67%,与半翅目茶翅蝽Halyomorpha halys(XM_014430413.1)、温带臭虫Cimex lectularius(XM_014391468.1)、豌豆蚜Acyrthosiphon pisum(XM_001951058.4)和褐飞虱Nilaparvata lugens(KM217008.1)的保守性为66%、与鳞翅目小菜蛾Plutella xylostella(XM_011554832.1)的保守性为65%。将以上保守氨基酸下载制成fasta格式文档,通过Multalin 5.4.1在线网站比对获得了茶小绿叶蝉CYP303A1的氨基酸多重序列比对图(图4)。从图4中分析得出,8个物种CYP303A1蛋白除个别氨基酸保所外(如308~319),其余部分基本不相同,表明茶小绿叶蝉CYP303A1与其他昆虫较不保守。
2.4 茶小绿叶蝉CYP303A1三级结构与功能域分析
将茶小绿叶蝉CYP303A1编码蛋白导入Swiss Model在线网站进行三级结构模拟,结果表明该蛋白主要以β折叠为主,中间以部分α螺旋进行连接(图5)。
采用Smart网站对该编码序列进行功能域预测,发现该蛋白功能域结构单一,分别由1~20位氨基酸编码的信号肽(signal peptide)和27~494位氨基酸编码的p450蛋白域(Pfam:p450)组成(图6)。
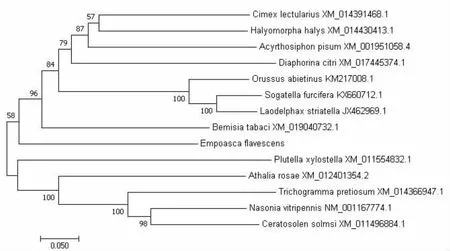
图3 茶小绿叶蝉CYP303A1基因的进化树Fig.3 Phylogenetic tree of CYP303A1 gene from E.flavescens注:数字的大小表示不同物种亲缘关系的远近。

图4 茶小绿叶蝉CYP303A1多重序列比对Fig.4 Multiple sequence alignment of CYP303A1 from E.flavescens注:保守性由红色、蓝色和黑色逐步降低。
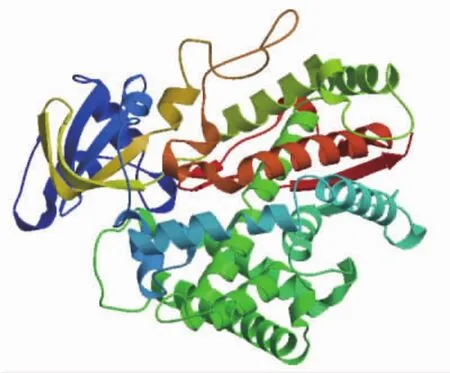
图5 茶小绿叶蝉CYP303A1蛋白三级结构Fig.5 Tertiary structure of CYP303A1 from E.flavescens
3 结论与讨论
本研究首次克隆了茶小绿叶蝉CYP303A1基因的全编码区ORF,该序列全长2161 bp,含有1503 bp开放阅读框,编码500个氨基酸,分子量为57.42 k Da,理论等电点为8.56,这与其他物种昆虫,如烟粉虱Bemisia tabaci、白背飞虱Sogatella furcifera、茶翅蝽Halyomorpha halys、豌豆蚜Acyrthosiphon pisum等的CYP303A1基因基本类似,明确了获得的序列为茶小绿叶蝉CYP303A1基因。系统进化树比对表明,茶小绿叶蝉CYP303A1基因与同翅目昆虫烟粉虱Bemisia tabaci亲缘关系最近,这与茶小绿叶蝉隶属同翅目昆虫结果相符;但其氨基酸多重序列比对结果发现,茶小绿叶蝉CYP303A1蛋白氨基酸序列除个别位点保守外,其余部分基本不相同,可能暗示茶小绿叶蝉CYP303A1基因在长期参与药物解毒或免疫过程中受外来物质的诱导,导致多处碱基发生突变。这种现象在抗性昆虫中也有存在,如棉铃虫Helicoverpa armigera抗氰戊菊酯品系的CYP687基因编码区共有14个碱基发生突变,并最终引起3个氨基酸发生改变[11]。抗溴氰菊酯的淡色库蚊Culex pipiens pallens的P450 CYP4家族(CYP4C、CYP4D、CYP4 H)亦存在多基因位点突变[12]。本研究中茶小绿叶蝉多处碱基发生突变,可能因为该虫采集于常规试验茶园,推测其CYP303A1基因可能受长年施药的诱导,导致保守性降低。
另外,信号肽具有引导新合成的蛋白质向分泌通路转移的功能,它能引导靶标蛋白质向内质网腔内转移,随即被腔内表面的信号肽酶水解脱离,最终被分泌到胞外。本研究对茶小绿叶蝉CYP303A1蛋白功能域分析发现,该蛋白具有由20位氨基酸组成的一短信号肽,暗示茶小绿叶蝉CYP303A1信号肽在参与有毒物质解毒、排毒过程中发挥了重要作用,但具体功能有待后续做进一步研究。
[1]李慧玲,林乃铨,郭剑雄,等.茶园间作绿肥对假眼小绿叶蝉及其天敌缨小蜂的影响[J].中国生物防治学报,2016,32(1):50-54.
[2]王念武,徐金汉,陈峥.不同茶园假眼小绿叶蝉抗药性比较[J].福建农林大学学报,2004,33(2):169-173.
[3]庄家祥,傅建炜,苏庆泉.福建省茶小绿叶蝉抗药性的地区差异[J].茶叶科学,2009,29(2):154-158.
[4]李建宇,史梦竹,傅建炜,等.茶假眼小绿叶蝉的抗性监测及不同地区的敏感性差异[J].福建农业学报,2015,30(10):989-992.
[5]邱星辉.细胞色素P450介导的昆虫抗药性的分子机制[J].昆虫学报,2014,57(4):477-482.
[6]Klingenberg M.Pigments of rat liver microsomes[J].Archives of biochemistry and biophysics,1958,75(2):376-386.
[7]Omura T,Sato R.A new cytochrome in liver microsomes[J].Journal of Biological Chemistry,1962,237(4):1375-1376.
[8]Misra J R,Lam G,Thummel C S.Constitutive activation of the Nrf2/Keap1 pathway in insecticide-resistant strains of drosophila[J].Insect biochemistry and molecular biology,2013,43(12):1116-1124.
[9]Zhu F,Parthasarathy R,Bai H,et al.A brain-specific cytochrome P450 responsible for the majority of deltamethrin resistance in the QTC279 strain of Tribolium castaneum[J].PNAS,2010,107(19):8557-8562.
[10]Yang Y,Yue L,Chen S,et al.Functional expression of Helicoverpa armigera CYP9A12 and CYP9A14 in Saccharomyces cerevisiae[J].Pesticide biochemistry and physiology,2008,92(2):101-105.
[11]张衡.抗性和敏感棉铃虫CYP6B7基因的克隆及不同发育阶段的表达研究[D].北京:中国农业大学,2007.
[12]朱昌亮,李建民,田海生,等.淡色库蚊细胞色素P450抗性相关基因克隆与初步鉴定[J].中国寄生虫学与寄生虫病杂志,2000,18(5):263-268.
Cloning and Bioinformatics of Metabolic Detoxication Gene,CYP303A1,in Empoasca flavescens(Hemoptera:cicadas)
LI Liang-de,WANG Ding-feng,LI Hui-ling,ZHANG Hui,ZENG Ming-sen,WU Guang-yuan*
(Tea Research Institute,Fujian Academy of Agricultural Sciences,Fu’an,Fujian 355015,China)
CYP303A1 gene belongs to the cytochrome P450 family.It plays an important role in metabolic detoxification of insecticides for insects.This study cloned the complete open reading frame(ORF)of CYP303A1 from Empoasca flavescens using RT-PCR.The physicochemical properties,phylogenetic tree,amino acid sequence,tertiary structure and functional domain of the gene were analyzed with the bioinformatics software and information from online sources.The results showed that the gene had a 1,503 bp ORF encoding 500 amino acids with a molecular weight of 57.42 kDa and a theoretical isoelectric point of 8.56.The phylogenetic tree analysis on the gene indicated that it had the highest genetic relationship with Bemisia tabaci(Homoptera)and the lowest with Ceratosolen solmsi(Hymenoptera).The amino acid sequence of the gene poorly conserved with those of other insects,and the structure was primaryβ-sheet with its functional domain consisting of a signal peptide and pfam:p450.This study unveiled the nucleotide sequence and encoded amino acid characteristics of CYP303A1 from E.flavescens which would lead to the designing of a target insecticide for better control of E.flavescens on tea plants.
Empoasca flavescens;CYP303A1 gene;clone;bioinformatics;insecticide
S435.711
A
2096-0220(2017)02-0041-05
2017-03-21初稿;2017-04-29修改稿
福建省属公益类科研院所基本科研专项(2017R1102、2014R1012-5);国家茶叶产业技术体系建设专项(CARS-23);福建省现代农业茶叶产业技术体系(2014NK04)。
李良德(1988-),男,助理研究员,主要从事昆虫生理学和毒理学研究。E-mail:787834208@qq.com
*通讯作者:吴光远(1962-),男,研究员,主要从事茶树植保与害虫生物防治研究。E-mail:gywupt@163.com

