茶叶多糖制备新技术研究进展
杨军国,王丽丽,陈 林
茶叶多糖制备新技术研究进展
杨军国,王丽丽,陈 林*
(福建省农业科学院茶叶研究所,福建 福安 355015)
从超声波辅助浸提、微波辅助浸提、酶法浸提、乙醇辅助浸提、反胶束萃取、超临界流体萃取、协同浸提等提取技术,及膜分离法、吸附树脂法、柱色谱法等纯化技术,阐述近年来茶叶多糖提取制备的研究进展。
茶多糖;超声波辅助浸提;微波辅助浸提;酶法浸提;膜分离法;吸附树脂法
茶叶多糖,是茶叶(Camellia sinensis)中由大量单糖通过糖苷键连接而成的天然大分子活性物质。现代药理研究表明,茶叶多糖具有多种保健功效,如降血糖、抗氧化、免疫调节、抗肿瘤、抗凝血、抗疲劳、抑菌杀毒、减肥等,尤以降血糖活性、防治糖尿病成为众多学者关注的焦点[1-2]。茶叶多糖是一类杂多糖,因其单糖组分、分子量、连接位置、糖苷键构型和糖环类型的不同,以及聚糖体与配体蛋白之间的N-糖肽键或O-糖肽键连接,导致构象十分繁杂,所以茶叶多糖的提取和分离纯化尚难以稳定开展。随着植物提取产业现代化进程的加快,传统的提取方法诸如酸碱法、热水浸提法由于存在提取率低、时间长、污染环境等不足,难以满足产业发展的需求。具有绿色环保、条件稳定、提出率高、生物活性强等优点的新型提取纯化技术,为茶叶多糖的应用开展注入了新的活力。本文结合近年来茶叶多糖提取纯化研究的相关文献报道,主要对其新型提取纯化技术应用进展进行综述。
1 茶叶多糖提取新技术
1.1 超声波浸提
超声波浸提是利用超声波具有的机械效应、空化效应和热效应,通过增大介质分子的运动速度和穿透力,高效、快速提取茶叶有效成分的一项新技术。表1为不同学者开展的超声波辅助浸提茶叶多糖的工艺研究,表中可见,原料、评价靶标及最优工艺参数不尽相同[3-11]。相较于热水浸提,超声波辅助浸提法可明显提高茶叶多糖的得率。然而,超声波具有较强的剪切作用,使茶叶多糖产生降解,相对分子量变小,生物学活性发生改变[4-5,9-10,12]。张忠等[5]研究发现,超声波辅助法浸提的茶籽多糖清除羟基活性基本未见变化,而清除超氧阴离子的能力有较好的增强作用。苗爱清等[12]也研究比较了超声波辅助法与传统常规法绿茶提取多糖的抗氧化活性变化,结果表明超声波辅助法提取的绿茶多糖DPPH自由基清除能力略有提高,ABTS自由基清除活性差异不大,而亚铁离子络合能力降低,分析认为超声波辅助法提取改变了茶叶多糖的结构与生物学活性。张丽美等[9]研究发现,超声波辅助法提取的茶籽多糖对羟基及DPPH自由基具有较高的清除活性,却几乎没有还原能力。李星科等[10]研究表明,与热水浸提法相比,超声波辅助提取的信阳红茶多糖对DPPH自由基和羟基自由基的清除活性明显降低,而对超氧阴离子自由基清除率差异不大。
综上所述,超声波辅助浸提法简单、快速、高效,然而一定程度上使得茶叶多糖的生物学活性发生了改变。目前来看,超声波辅助法浸提的茶叶多糖抗氧化活性,尤其是清除自由基活性变化表达不一。在不同的茶叶多糖提取原料、自由基种类等因素下,茶叶多糖清除自由基活性表达不尽相同。由此来看,超声波辅助浸提茶叶多糖的进程中,其结构与生物学活性发生了改变。

表1 超声波辅助浸提茶叶多糖的工艺研究Table 1 Ultrasound-assisted extraction of tea polysaccharides
1.2 微波浸提
微波技术因其内加热特性、速率快、得率高、能耗低等优点,现已广泛应用于天然植物有效成分的提取。聂少平等[13]采用单因素试验和正交试验,对微波辅助提取茶多糖条件进行分析,得到最佳的微波提取工艺:微波强度100%的条件下,按料液比1∶15提取75 s,茶多糖得率达4.73%。研究还发现,微波辅助提取对茶叶多糖抑制α-淀粉酶活性并无影响,且在提取率及经济实用等方面较超声波辅助提取,显得更加优越。之后,众多学者针对微波辅助提取茶叶多糖做了进一步探讨,与超声波辅助浸提变化趋势相同,原料、评价靶标及最优工艺参数不尽相同,微波功率是首要的影响因素(表2)[14-22]。微波加热主要使得细胞内部温度迅速上升,其液态水分汽化产生压力致使细胞膜及细胞壁极具破裂,形成微小的孔洞后可溶性物质快速溶出。与超声波辅助浸提类似,微波浸提过程中茶叶多糖的生物学活性亦发生了一定程度的变化[14,22]。由此,微波过程中茶叶多糖的构效变化仍需进一步探讨。
1.3 酶法浸提
酶法浸提是利用酶选择性地破坏细胞壁,减少胞内成分向浸提介质溶解和扩散的传质阻力,从而应用于植物靶标成分有效提取的新技术。目前,用于茶叶多糖提取研究较多的是纤维素酶、胰蛋白酶、水解酶、果胶酶及复合酶[23-30]。针对酶法辅助浸提茶叶多糖的相关研究,酶处理方式显得至关重要,综合来看主要有4种,见图1。酶是一类具有生物催化功能的高分子物质,其活性易受温度、pH值、底物浓度等诸多因素所影响。研究表明,酶法浸提茶叶的最优参数为温度40℃~55℃,pH值4.0~5.5,酶添加量在0.5%左右,而胰酶相对来说有较高的pH值反应环境,约在8.0左右[23-30]。
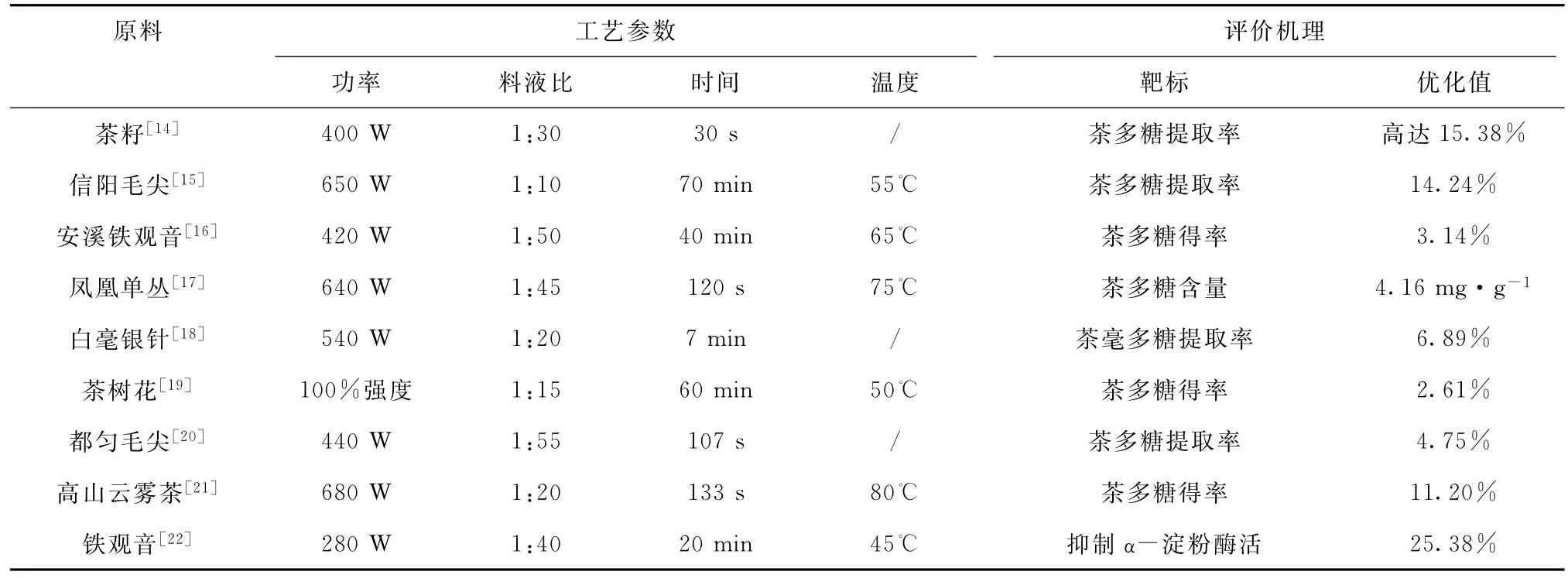
表2 微波辅助浸提茶叶多糖的工艺研究Table 2 Microwave-assisted extraction of tea polysaccharides
相较于超声波浸提、微波浸提和热水浸提,酶法浸提茶叶多糖反应条件温和(反应温度35~60℃),浸出率较高。然而,鉴于酶种类及添加方式的不同,茶叶多糖的提取率,组成结构及活性皆有所不同。周小玲等[23]研究比较果胶酶、胰蛋白酶、复合酶及水浸提法浸提崂山绿茶多糖的组成变化,结果发现,果胶酶法制得茶叶多糖含量最高,糖醛酸含量最低;4种方法制得的多糖氨基酸组成种类未见变化,氨基酸含量较水浸提法显著减少。贾亮亮等[31]研究发现,纤维素酶法制得的鄂产绿茶多糖对α-淀粉酶及蔗糖酶抑制活性强于热水浸提法和冷水提取法所得绿茶多糖。Baik等[30]研究也认为,果胶酶可通过水解反应改变茶叶多糖组成,并显著提高巨噬细胞白细胞介素IL-6的表达水平。茶叶细胞内存在着一定量的蛋白质、纤维素、半纤维素、果胶质等成分,成为胞内多糖溶出的主要屏障。茶叶多糖提取过程中,选用合适酶类可使细胞壁软化、膨胀和崩溃,从而改变细胞壁的通透性,提高了茶叶多糖的浸提率。同时,酶法浸提可提高中性多糖的含量,而酸性多糖含量变低,表明酶解过程中酸性多糖结构遭到破坏,酸性多聚体结构变成低聚体,导致生物学活性的表达变化。

图1 茶叶多糖的酶法辅助提取工艺Fig.1 Enzymatic extraction of tea polysaccharides
1.4 乙醇辅助浸提
乙醇可用于茶叶多糖的沉淀分级纯化[32-35]。高浓度乙醇可沉淀析出蛋白质、鞣质、大分子色素、多糖等大分子物质,且不同浓度时各物质沉淀特性有所不同。前期本课题组开展了乙醇沉淀分级茶多糖特性的研究,发现70%乙醇浓度沉淀分级效果最优,且可溶性蛋白含量低[35]。因此,选取合适高浓度乙醇先辅助提取茶叶中的茶多酚、氨基酸、蛋白质等化学物质,再进一步通过水相浸提可实现茶叶多糖的富集制备。通过单因素试验和正交试验研究表明,乙醇辅助提取茶叶最优工艺参数为乙醇浓度65%、料液比1:25、温度55℃、提取时间20 min,该工艺实施后再通过水提可制得含量达15%以上的茶叶多糖,且可溶性蛋白质含量低[36-37]。茶叶中多糖含量较低,导致单独提取分离制备运行成本过高,尚难实现工业化生产,而乙醇预提取茶叶可兼具制备茶多酚和茶叶多糖,降低成本,呈现出良好的工业化前景。
1.6 反胶束萃取
反胶束技术,作为一种选择性高、操作步骤简单,并易于大规模萃取的液-液萃取技术,具有很好的应用前景。Li和Cao[38]研究考察了丁二酸二异辛酯磺酸钠(AOT)/正庚烷体系在茶叶多糖大分子物质的萃取及反萃取工艺上的应用,结果表明,前萃中低剂量促溶剂盐酸胍在AOT/正庚烷体系中可抑制茶叶多糖的聚合效应,并促使其溶于极性核内部的水相。进一步研究得出反胶束萃取茶叶多糖的前萃最优条件为AOT浓度0.04 mol·L-1、pH值4.6、NaCl为0.05 mol·L-1、7%浓度甲醇和0.06 mol·L-1的盐酸胍,此条件下茶叶多糖前萃率可达34%;反萃中添加盐酸胍和尿素,茶叶多糖反萃率均超过100%,这为反胶束萃取技术在萃取茶多糖领域应用奠定了良好的基础。
1.7 超临界流体萃取
超临界流体萃取是20世纪60年代初发展起来的新型萃取分离技术,常用流体溶剂为CO2。李博等[39]采用响应面优化超临界CO2萃取茶籽多糖最佳工艺参数为:时间150 min、压力45 MPa、温度60℃、夹带剂乙醇浓度为65%,此条件下茶籽多糖得率为13.23%。Chen和Xiong[40]研究确立超临界CO2萃取茶叶多糖的最佳工艺参数,在茶粉颗粒度380μm、20%无水乙醇夹带剂、萃取压力35 MPa、萃取温度45℃和萃取时间2 h试验条件下,茶叶多糖萃取率可达92.5%。此法具有能耗小、效率高、无污染、条件温和等优点,然而鉴于昂贵的设备和较长的提取时间,目前多用于贵重植物有效成分的提取制备。
1.8 协同浸提
茶叶多糖近年来引入了超声波辅助浸提、微波辅助浸提、酶法浸提等新型提取技术,不同方法之间各有利弊,其进一步的相互结合可实现茶叶多糖更高效的提取制备。陈义勇等[41]采用超声-微波协同辅助提取茶叶多糖,50 W超声波功率下,最佳工艺条件为提取时间23 min、料液比1:30、微波功率90 W,该条件下茶叶多糖得率从2.95%提高至4.19%,纯度从70.15%提高至86.08%。高仁金和李天霖[42]采用超声波辅助纤维素酶提取茶叶废料中的茶叶多糖,超声波提取时间20 min、pH值7、料液比1:30、酶用量60 mg·g-1等工艺条件下,茶叶多糖得率为11.85%。韩艳丽等[43]研究果胶酶-微波法对浸提茶树花多糖的影响,结果表明,最佳酶解工艺参数为酶用量1.0%、pH值5.5、酶解时间2.5 h、酶解温度50℃,此条件下茶树花多糖提取率最高,进一步微波处理(功率700 W、时间60 s)后,茶树花多糖提取率达4.82%,茶叶多糖提取率显著提高。因此,茶叶多糖新型浸提方法之间的协同提取,可充分利用超声波振动的空化效应、微波的内加热特性及酶的选择特性,具绿色环保、条件温和、浸提率高等优点,在茶叶多糖提取中具有广阔的应用前景。
2 茶叶多糖纯化新技术
茶叶多糖通常是一类复合物,经提取后,常含有部分蛋白质、茶多酚、茶色素等物质,其纯度不高,仍需进一步分离纯化。目前,较为常用的传统方法是乙醇沉淀法、H2O2脱色、Sevag法去蛋白,然而制得的茶叶多糖仍有纯度低、损失大、有机溶剂残留、多糖结构降解破坏及活性降低等不足。因此,众多学者结合当前产业的发展趋势,对茶叶多糖的分离纯化做了进一步有益的探讨。
2.1 膜分离技术
膜分离是20世纪60年代迅速发展起来的一门分离新技术,通过借助外界能量或化学位差的推动实现不同组分气体或液体的分离、分级和富集,具有高效、节能、工艺简单、污染少且不发生相变等优点,在医药、食品、环保、水处理等领域得到了广泛的应用,成为当今分离学科中最重要的手段之一。
陈海霞和谢笔均[44]对醇沉法、超滤法和CTAB法制备的粗茶多糖进行分析比较,发现超滤法(截留分子量10000)所得多糖纯度最高,且清除羟基活性最强。刘军海[45]采用截留分子量为30 k D的超滤膜,使得大分子多糖与小分子茶多酚、咖啡碱等活性物质全面分离。寇小红等[46]以炒青绿茶为原料,经水提取和0.2μm孔径膜过滤后,滤液依次经过150 k D、20 k D和6 k D的膜组件进行分级和浓缩,结果表明,茶汤中50%以上的干物质能够透过20 k D孔径膜。就茶叶多糖来说,20 k D孔径膜截留液中含量最高,占干物质比重的36.86%,而150 k D和6 k D膜截留液中多糖含量分别为27.13%和21.16%,6 k D膜透析液中含量仅为1.09%,揭示膜分离对于茶叶多糖的分离纯化效果明显。张艳和杜先锋[47]进一步研究确立膜集成联用技术对粗制茶多糖纯化的最佳工艺条件为:以0.05μm的膜孔径、0.2 MPa的操作压力、pH值为8.0、1%的料液浓度为工艺条件微滤后,再经30 k D超滤膜二次纯化,多糖含量从原有的50%提高至81%。综上所述,采用膜分离技术可对多糖进行分级和富集,无有机溶剂污染、能耗低,工艺简单易行,适宜于工业化生产。
2.2 吸附树脂技术
吸附树脂法是以大孔吸附树脂、离子交换树脂和聚酰胺等作为载体,利用其对不同成分的选择性吸附及筛选作用分离纯化植物的天然成分,具有能耗低、易再生、无环境污染等优点,现已广泛应用于环境保护、合成化学及生物医药等领域。王元凤和金征宇[48]对大孔弱碱性阴离子交换树脂D315分离纯化茶多糖的工艺进行了研究,结果表明,上样液pH值6.0~7.0、温度30℃、糖醛酸浓度2.5 mg·m L-1时,可收集上柱吸附的流出液和去离子水洗脱液得到中性糖为主的茶多糖NTPS,该多糖总糖质量分数为82.7%,糖醛酸质量分数为7.9%;而后采用0.5 mol·L-1的NaCl溶液洗脱,得到酸性糖ATPS,该多糖总糖质量分数为85.5%,糖醛酸质量分数为35.2%,揭示吸附树脂法实现了茶叶多糖的分级富集。黄永春等[49-50]也进一步研究表明,860021大孔树脂和D941大孔树脂适吸附茶多糖符合Freundlich模型,具有较好的吸附效果。Yang等[51]分析比较AB-8、NKA-9、XDA-6、D4020等4种大孔吸附树脂对茶籽多糖和皂甙的吸附分离效果,研究发现,AB-8树脂吸附后可用去离子水洗脱得到茶籽多糖,得率为18.7%,纯度89.2%;进一步用0.25%的NaOH溶液洗脱除去色素,再用90%乙醇洗脱得到茶籽皂甙,从而达到茶籽多糖与皂甙的综合分离制备,且易规模化生产。
吸附树脂技术可较好去除茶叶多糖中的色素和蛋白质,这为多糖分离纯化提供了另一种新的思路。针对吸附树脂对茶叶多糖的脱色脱蛋白研究,多以脱色率、脱蛋白率和多糖保留率为评价指标。研究表明,大孔弱碱性阴离子交换树脂D315在pH值4.5、温度55℃下,茶叶多糖溶液的脱色率可达89.82%,蛋白质去除率93.95%,多糖保留率64.86%[52]。张芸等[53]则研究表明,乌龙茶多糖(OTPS)聚酰胺柱层析法脱色脱蛋白的最佳工艺条件为4 mg OTPS·m L-1聚酰胺、2/5倍柱体积去离子水溶解上样,吸附平衡20 min,3 m L·min-1速率洗脱,脱色率达91.78%,脱蛋白率72.61%,总糖保留率74.38%。普洱茶属于后发酵茶,茶色素含量高,极性很大且存在部分与多糖及蛋白质结合的特点,传统方法脱除十分困难。杨新河等[54]研究发现D101树脂适合对普洱茶多糖同时脱色和蛋白质去除,当普洱茶多糖溶液体积为50 m L时,在pH值4.0、温度50℃、料液质量浓度3.8 mg·m L-1、树脂用量11 m L的条件下,普洱茶多糖的脱色率为82.33%,蛋白质去除率为70.89%,远高于过氧化氢的脱色率45.20%和Sevage法5次蛋白质去除率36.83%。可见,与传统的脱色脱蛋白方法相比,吸附树脂法工序少、周期短,且能极大的保留多糖原有的生物学活性,符合绿色化学的发展要求。
2.3 柱色谱法
柱色谱法,又称柱层析法,不同物质上柱吸附后经等度或梯度洗脱从而得到纯度较高的分级组分,其关键是柱填料与洗脱剂的选择。茶叶多糖国内外报道的柱填料主要是分配层析的纤维素和凝胶柱层析的Sephadex及Sepharose,然而限于成本和得率,该部分工作现阶段仅在实验室用于制备不同纯度的茶叶多糖,以进行其结构及生物学活性的研究。
倪德江等[55]以脱蛋白乌龙茶多糖为原料,先采用DEAE-52纤维素柱层析分级,用双蒸水及不同浓度的NaCl溶液进行梯度洗脱,制得乌龙茶多糖分级样品OTPS1、OTPS2、OTPS3和OTPS4;以主要组分OTPS2上层析柱Sephadex G-150吸附分离,用0.1 mol·L-1的NaCl溶液洗脱得到主要部分OTPS2-1,葡聚糖凝胶柱层析和琼脂糖凝胶电泳检测表明该样品为均一多糖组分。Wang等[56]以粗茶籽多糖溶于0.02 mol·L-1的磷酸盐缓冲液,经DEAE-52纤维素阴离子交换柱吸附,用0.1~0.6 mol·L-1的NaCl溶液梯度洗脱得到NTSPS、ATSPS1和ATSPS2;ATSPS1进一步经Sephadex G-200吸附分离,0.1 mol·L-1的NaCl溶液洗脱得到ATSPS1-1和ATSPS1-2,研究表明所得分级多糖皆能显著抑制人白血病细胞株K562的增殖。Cai等[57]将粗茶多糖磷酸盐溶液经离子层析柱DEAE sepharose CL-6B吸附,用不同浓度的NaCl溶液洗脱得到多糖分级样品TPS-1、TPS-2、TPS-3和TPS-4,研究发现TPS-4具有显著的抗凝血活性。Wang等[58]以粗富硒茶多糖为原料,高速离子琼脂糖凝胶柱吸附,NaCl溶液洗脱,制得分级富硒茶多糖Se-NTPS、Se-TPS1、Se-TPS2和Se-TPS3,结果表明不同分级多糖样品之间单糖组成及种类有所不同,都具有较强的清除自由基活性。
3 小结
近年来,超声波辅助浸提、微波辅助浸提、酶法浸提、乙醇辅助浸提、超临界流体萃取、膜分离技术、吸附树脂技术、柱色谱法等茶叶多糖制备新技术可替代传统工艺方法,实现高效、节能、环保式提取制备,且有效地保留茶叶多糖原有的生物学活性,体现出广阔的发展前景。然而,仍有诸多问题需进一步研究:
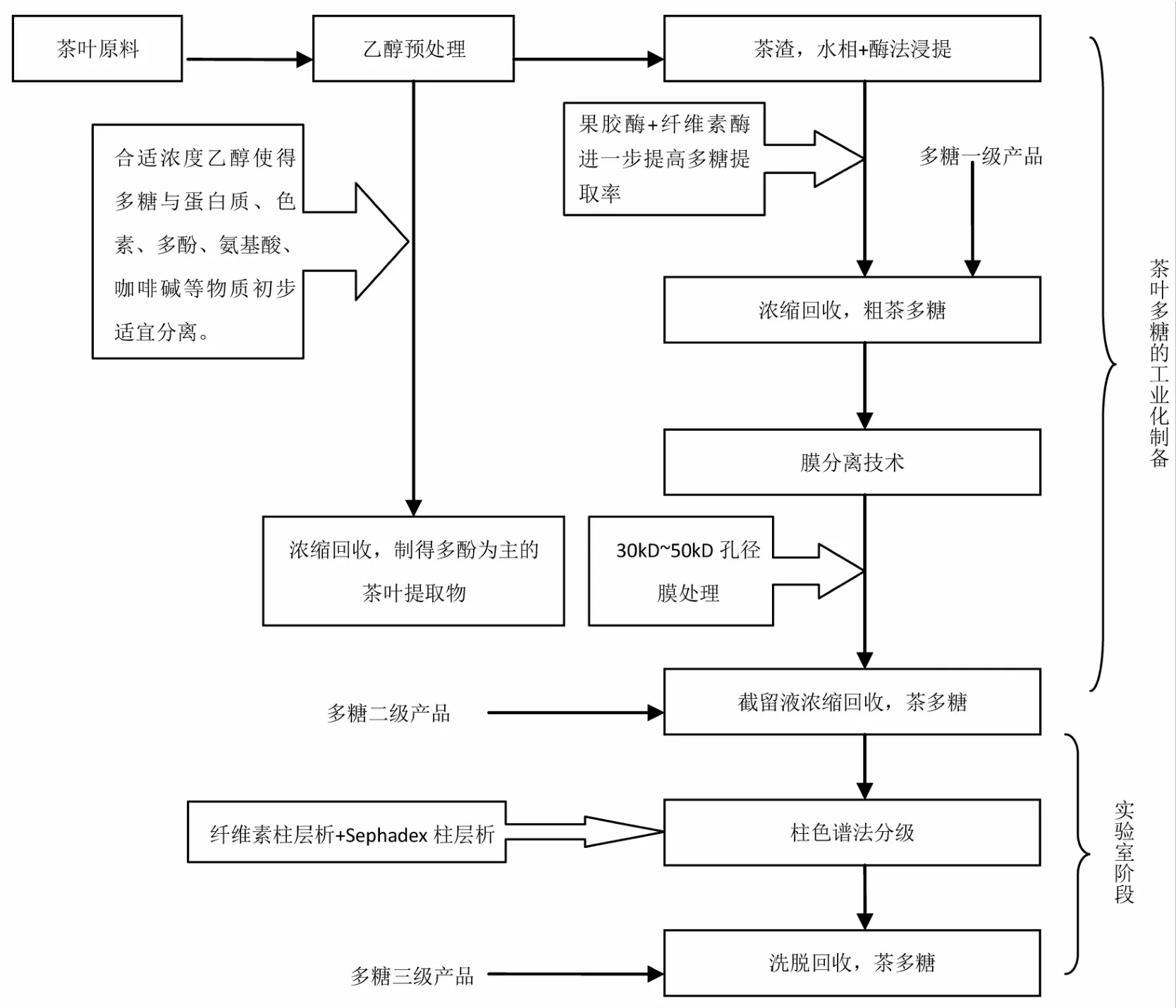
图2 茶叶多糖的工业化制备工艺Fig.2 Industrialized extraction process of tea polysaccharides
(1)茶叶多糖工业化制备的可行性探讨。茶叶多糖在茶叶中含量较低,单独提取制备相当困难,与茶叶其他活性成分(如茶多酚)的综合提取分离可作为行之有效的手段。因此,笔者在综合茶叶多糖提取纯化技术的基础上,提出一条具有可行性的工业化生产工艺路径,见图2。该工艺采用乙醇辅助浸提实现茶叶多糖与茶多酚的综合提取制备,从而降低了茶叶多糖的加工成本,同时,采用酶法结合水相浸提进一步提高茶叶多糖的制取率,制得一级的粗茶多糖产品;然后在该产品的基础上,采用膜分离技术进一步提高茶叶多糖的纯度,制得纯度较高的二级多糖产品;最后,为了满足对其生物学活性及其结构的研究,可在实验室阶段采用柱色谱法制得纯度高且均一的三级多糖产品。总体来看,工艺简单可行、成本低、不涉及任何有机溶剂的使用,符合当前茶产业绿色环保的发展趋势。
(2)茶叶多糖制备的新技术与其生物学活性表达及构效变化的关系研究。茶叶多糖是一类杂多糖,糖链庞大,构象繁杂,生物学活性表现不一。其活性表达受诸多因素制约,倪德江等[59]比较绿茶、乌龙茶、红茶的茶叶多糖含量、组成、体外清除自由基以及降血糖效果,研究发现不同产地、品种、加工工艺对茶叶多糖的结构组成及生物学活性都有显著影响。也有学者研究表明,不同原料(西湖龙井)[60]、热水浸提[61]、真空干燥[62]等因素对茶叶多糖抑制α-葡萄糖苷酶和α-淀粉酶的活性影响较大。因此,茶叶多糖制备新技术应用与多糖的生物学活性表达,构效变化的影响,仍需进一步研究。研究表明,茶叶多糖的生物学活性表达可以实现优化,原料筛选、提取方式、干燥方式、化学修饰(硫酸化、乙酰化、羧甲基化)[63-64]、酶法修饰[65]及与其他成分协同作用[66]皆可使茶叶多糖的生物学活性进一步增强,表明茶叶多糖必然存在活性中心和片段。随着茶叶多糖构象及药理活性研究的广泛开展,高活性或专一活性茶叶多糖的分离纯化及构效关系的确立,对茶叶多糖今后的研究显得尤为重要。
[1]Cao H.Polysaccharides from Chinese tea:recent advance on bioactivity and function[J].International Journal of Biological Macromolecules,2013,62(11):76-79.
[2]Chen G J,Yuan Q X,Saeeduddin M,et al.Recent advances in tea polysaccharides:Extraction,purification,physicochemical characterization and bioactivities[J].Carbohydrate Polymers,2016,(153):663-678.
[3]巩发永,齐桂年,李静,等.超声波辅助提取边茶中茶多糖工艺条件研究[J].江西农业科学,2006,(5):139-140,166.
[4]黄永春,马月飞,谢清若,等.超声波辅助提取茶多糖及其分子量变化的研究[J].食品科学,2007,28(7):170-173.
[5]张忠,李静,李正涛,等.超声波辅助提取茶籽多糖工艺条件的研究[J].安徽农学通报,2007,13(10):49-50.
[6]安卫征,王一飞,赵晓华.超声波法提取普洱茶多糖的工艺[J].食品研究与开发,2008,29(4):119-122.
[7]周晓晴,余飞,邓丹雯,等.超声波辅助提取茶鲜叶中茶多糖实验研究[J].江西食品工业,2008,(4):39-41.
[8]李粉玲,蔡汉权,林杰.超声波法提取凤凰茶多糖的研究[J].中国酿造,2011,30(10):104-107.
[9]张丽美,杨婷婷,胡蒋宁,等.超声波辅助提取茶粕多糖及其抗氧化活性[J].食品科学,2013,34(18):36-40.
[10]李星科,刘芳丽,李素云,等.信阳红茶多糖的超声波提取工艺及抗氧化活性研究[J].食品工业,2014,(12):162-164.
[11]王晓琴,余岚岚.超声波技术提取乌龙茶多糖工艺研究及其降血糖活性研究[J].中国农学通报,2010,26(20):102-105.
[12]苗爱清,孙世利,曾琼,等.超声波辅助提取绿茶多糖的体外抗氧化活性研究[J].广东茶业,2010,(1):40-42.
[13]聂少平,谢明勇,罗珍.微波技术提取茶多糖的研究[J].食品科学,2005,26(11):103-107.
[14]张忠,李静,花旭斌,等.微波辅助提取茶籽多糖工艺条件的研究[J].食品与发酵科技,2007,43(1):23-25.
[15]孙慕芳,袁丁,王在群,等.信阳毛尖茶多糖微波提取工艺的优化[J].安徽农业科学,2007,35(17):5188-5189.
[16]王晓琴,范文斌.微波技术辅助浸提乌龙茶多糖工艺的研究[J].热带农业科学,2010,30(7):40-43.
[17]李粉玲,蔡汉权,朱梓文.凤凰茶多糖微波辅助提取工艺[J].食品与发酵工业,2011,37(11):235-238.
[18]林志銮,王欢,郑小珍,等.白毫银针茶毫中茶多糖工艺优化及其抗氧化研究[J].湖北农业科学,2015,54(3):665-668.
[19]韩艳丽,凡军民,李静,等.茶树花多糖微波辅助提取工艺[J].江苏农业科学,2015,43(2):273-275.
[20]陈仕学,田艺,卢忠英,等.响应面法优化都匀毛尖茶多糖的提取及抗氧化性研究[J].食品工业,2015,(9):83-88.
[21]李继伟,龚伟发,穆素芳,等.微波辅助提取绿茶多糖条件的响应面优化[J].应用化工,2016,45(11):2009-2012.
[22]王晓琴,耿頔,李林宴.微波技术提取乌龙茶多糖工艺研究[J].热带作物学报,2010,31(12):2277-2280.
[23]周小玲,汪东风,李素臻,等.不同酶法提取工艺对茶多糖组成的影响[J].茶叶科学,2007,27(1):27-32.
[24]张元,林强,崔玉梅,等.乌龙茶多糖的酶法提取及降血糖活性初步研究[J].中国现代应用药学杂志,2008,25(4):286-288.
[25]Baik J H,Shin K S,Park Y,et al.Biotransformation of catechin and extraction of active polysaccharide from green tea leaves via simultaneous treatment with tannase and pectinase[J].Journal of the Science of Food and Agriculture,2015,95(11):2337-2344.
[26]傅博强,谢明勇,周鹏,等.纤维素酶法提取茶多糖[J].无锡轻工大学学报,2002,21(4):362-366.
[27]王元凤,金征宇.酶法提取茶多糖工艺的研究[J].江苏农业科学,2005,(3):122-124.
[28]郭艳红,魏新林,王元凤,等.酶法提取茶多糖工艺条件的研究[J].农产品加工:学刊,2009,(4):4-7.
[29]何传波,吴兰兰,汤凤霞,等.铁观音茶多糖的酶法提取及脱蛋白工艺研究[J].云南民族大学学报(自然科学版),2009,18(1):41-44.
[30]李星科,彭星星,李素云,等.酶法提取信阳红茶多糖的工艺研究[J].食品工业科技,2012,33(20):168-170.
[31]贾亮亮,奚炜,彭官良,等.不同提取工艺对鄂产绿茶多糖体外降糖活性的影响[J].医药导报,2015,34(1):7-10.
[32]许旋,骆晓枫,陈兆星,等.正交试验优化绿茶中茶多糖醇析水提法的实验研究[J].中药材,2005,28(4):327-329.
[33]江新凤,高其璋,杨普香,等.乙醇沉淀法提取茶花多糖的研究[J].蚕桑茶叶通讯,2013,(5):31-33.
[34]杨军国,陈键,王丽丽,等.乙醇法沉淀茶多糖的抗氧化活性评价[J].福建农业学报,2016,31(2):199-204.
[35]杨军国,陈键,王丽丽,等.醇沉分级粗茶多糖的抗氧化活性比较及变化机制[J].食品工业科技,2016,37(17):96-100,105.
[36]杨军国,王丽丽,陈键,等.乙醇在茶叶多糖提取中的应用研究[J].茶叶学报,2016,57(4):192-199.
[37]杨军国,宋振硕,王丽丽,等.高抗氧化活性茶叶粗多糖提取工艺研究[J].食品研究与开发,2017,38(6):60-64.
[38]Li S L,Cao X J.Extraction of tea polysaccharides(TPS)using anionic reverse micellar system[J].Separation&Purification Technology,2014,122(122):306-314.
[39]李博,屠幼英,梅鑫,等.响应面法优化超临界CO2提取茶籽多糖的工艺研究[J].高校化学工程学报,2010,24(5):897-902.
[40]Chen M,Xiong L Y.Supercritical extraction technology in tea polysaccharide extracting application[J].Advanced Materials Research,2012,(347-353):1683-1688.
[41]陈义勇,窦祥龙,黄友如,等.响应面法优化超声-微波协同辅助提取茶多糖工艺[J].食品科学,2012,33(4):100-103.
[42]高仁金,李天霖.超声波辅助酶法从茶叶废料中提取茶多糖的研究[J].化学工程与装备,2015,(12):20-22.
[43]韩艳丽,凡军民,李静,等.果胶酶-微波法提取茶树花多糖的工艺[J].江苏农业科学,2017,45(2):166-168.
[44]陈海霞,谢笔均.茶多糖不同提取工艺的比较研究[J].食品工业科技,2001,22(2):18-19.
[45]刘军海.超滤法提取茶多糖研究[J].食品工业科技,2007,28(9):124-126,129.
[46]寇小红,江和源,张建勇,等.系列膜超滤处理在茶多糖分离纯化中的应用研究[J].食品科技,2008,(8):152-155.
[47]张艳,杜先锋.膜技术分离纯化茶多糖的工艺研究[J].安徽农业大学学报,2015,42(1):12-17.
[48]王元凤,金征宇.D315树脂分离茶多糖工艺的研究[J].农业工程学报,2005,21(10):147-150.
[49]黄永春,杨锋,马月飞,等.860021大孔树脂吸附茶多糖的研究[J].现代化工,2007,27(S2):220-224.
[50]黄永春,杨锋,马月飞,等.D941大孔树脂吸附茶多糖的热力学研究[J].食品科学,2008,29(11):274-277.
[51]Yang P J,Zhou M D,Zhou C Y,et al.Separation and purification of both tea seed polysaccharide and saponin from camellia cake extract using macroporous resin[J].Journal of Separation Science,2015,38(4):656-662.
[52]王元凤,金征宇.茶多糖脱色研究[J].食品与发酵工业,2004,30(12):60-65.
[53]张芸,倪德江,余志,等.乌龙茶多糖的聚酰胺柱层析法纯化工艺[J].食品科学,2014,35(14):1-4.
[54]杨新河,黄建安,刘仲华,等.树脂对普洱茶多糖的纯化与分离[J].食品科学,2015,36(2):19-24.
[55]倪德江,陈玉琼,谢笔钧,等.乌龙茶多糖OTPS 2-1的光谱特性、形貌特征及热特性研究[J].高等学校化学学报,2004,25(12):2263-2268.
[56]Wang Y F,Liu Y Y,Mao F F,et al.Purification,characterization and biological activities in vitro of polysaccharides extracted from tea seeds[J].International Journal of Biological Macromolecules,2013,62(10):508-513.
[57]Cai W R,Xie L L,Chen Y,et al.Purification,characterization and anticoagulant activity of the polysaccharides from green tea[J].Carbohydrate Polymers,2013,92(2):1086-1090.
[58]Wang Y F,Li Y F,Liu Y Y,et al.Extraction,characterization and antioxidant activities of Se-enriched tea polysaccharides[J].International Journal of Biological Macromolecules,2015,77(6182):76-84.
[59]倪德江,陈玉琼,谢笔均,等.绿茶、乌龙茶、红茶的茶多糖组成、抗氧化及降血糖作用研究[J].营养学报,2004,26(1):57-60.
[60]Xiao J B,Huo J L,Jiang H X,et al.Chemical compositions and bioactivities of crude polysaccharides from tea leaves beyond their useful date[J].International Journal of Biological Macromolecules,2011,49(5):1143-1151.
[61]Wei X L,Chen M A,Xiao J B,et al.Composition and bioactivity of tea flower polysaccharides obtained by different methods[J].Carbohydrate Polymers,2010,79(2):418-422.
[62]Wang Y F,Liu Y Y,Huo J L,et al.Effect of different drying methods on chemical composition and bioactivity of tea polysaccharides[J].International Journal of Biological Macromolecules,2013,62(11):714-719.
[63]Wang Y F,Peng Y H,Wei X L,et al.Sulfation of tea polysaccharides:synthesis,characterization and hypoglycemic activity[J].International Journal of Biological Macromolecules,2010,46(2):270-274.
[64]梁进,张剑韵,崔莹莹,等.茶多糖的化学修饰及体外抗凝血作用研究[J].茶叶科学,2008,28(3):166-171.
[65]余志,石玉涛,倪德江.酶法修饰绿茶多糖对免疫低下模型小鼠免疫活性的影响[J].茶叶科学,2010,30(S1):567-572.
[66]Yuan C F,Li Z H,Peng F,et al.Combination of seleniumenriched green tea polysaccharides and Huo-ji polysaccharides synergistically enhances antioxidant and immune activity in mice[J].Journal of the Science of Food and Agriculture,2015,95(15):3211-3217.
Research Progress on Processing Technologies for Polysaccharide Extraction from Tea(Camellia sinensis)
YANG Jun-guo,WANG Li-li,CHEN Lin*
(Tea Research Institute,Fujian Academy of Agricultural Sciences,Fu’an,Fujian 355015,China)
This article summarizes recent research progress on processing technologies of polysaccharide extraction and purification from tea(Camellia sinensis).Various methods,including ultrasound-assisted extraction,microwave-assisted extraction,enzymatic extraction,ethanol-and-water extraction,reverse micellar extraction,and supercritical fluid extraction,as well as separation by using membranes,absorption resins,or column chromatography are described.
tea polysaccharides;ultrasound-assisted extraction;microwave-assisted extraction;enzymatic extraction;membrane separation;absorption resin
Q538
A
2096-0220(2017)02-0063-08
2017-03-05初稿;2017-04-28修改稿
福建省自然科学基金项目(2015J05057);福建省农业科学院“青年科技英才百人计划”项目(YC2015-8);福建省农业科学院茶叶研究所重点项目(2014-cys-03)。
杨军国(1980-),男,博士,助理研究员,主要从事茶叶生物化学与综合利用。E-mail:95711139@qq.com
*通讯作者:陈林(1975-),男,博士,副研究员,主要从事茶叶加工、茶叶生物化学与综合利用。E-mail:82785676@qq.com

