酿酒酵母枸杞发酵物抗氧化性能研究
宋明辉,桑娜,乔长晟,3,*
(1.天津科技大学生物工程学院,工业发酵微生物教育部重点实验室,天津300457;2.代谢控制发酵技术国家地方联合工程实验室,天津300457;3.天津北洋百川生物技术有限公司,天津300457)
酿酒酵母枸杞发酵物抗氧化性能研究
宋明辉1,2,桑娜1,2,乔长晟1,2,3,*
(1.天津科技大学生物工程学院,工业发酵微生物教育部重点实验室,天津300457;2.代谢控制发酵技术国家地方联合工程实验室,天津300457;3.天津北洋百川生物技术有限公司,天津300457)
以编号为TJKD01~TJKD21的酿酒酵母和宁夏枸杞为原料,以多糖为主要指标,筛选获得了一株能够提高多糖含量的酿酒酵母。检测发酵前后主要成分多糖、多酚、黄酮、类胡萝卜素的含量变化,并用DPPH自由基清除法、邻二氮菲-Fe2+氧化法和邻苯三酚自氧化法考察枸杞发酵物的抗氧化性能变化。试验结果表明,编号为TJKD08的酿酒酵母发酵可以提高多糖和多酚含量。发酵后多糖和多酚含量分别提高了27.6%和77.8%。发酵后DPPH自由基IC50由0.78 g/L变为0.43 g/L,羟自由基IC50由14.1 g/L变为8.2 g/L,超氧阴离子自由基IC50由7.7 g/L变为5.4 g/L,抗氧化能力得到提高。
枸杞;发酵;抗氧化性能
Abstract:Using Saccharomyces cerevisiae (TJKD01-TJKD21)and Ningxia wolfberry as raw materials,polysaccharides was selected as the main index to obtain a strain ofSaccharomyces cerevisiaewhich could increase the polysaccharides content.The contents of polysaccharides,polyphenols,flavonoids and carotenoids were determined before and after fermentation.The antioxidant activities of the fermented products ofLycium barbarumL.were studied by DPPH radical scavenging method,phenanthroline-Fe2+oxidation method and pyrogallolautoxidation method.The results showed that fermentation with TJKD08 could enhance the content of polysaccharides and polyphenls.After fermentation the polysaccharides and polyphenols content increased by 27.6%and 77.8%,respectively.After fermentation DPPH free radicals IC50changed from 0.78 g/L to 0.43 g/L,hydroxyl free radical IC50changed from 14.1 g/L to 8.2 g/L,IC50on superoxide anion free radical changed from 7.7 g/L to 5.4 g/L,antioxidant capacity has been improved.
Key words:Lycium barbarumL.;fermentation;antioxidant properties
枸杞(Lycium barbarumL.)为茄科枸杞属(Lycium Linn.)植物,是我国传统名贵药材,其果实是一种“药食同源”的功能保健性食品。现代药理学研究认为枸杞具有提高机体免疫、抗氧化、抗衰老、抗肿瘤、抗疲劳、明目以及保肝护肝等功能[1-4]。目前关于枸杞的研究集中于枸杞多糖(Lycium barbarumpolysaccharides,LBP)功能和枸杞饮料开发两个方面。Zhang等[5]研究表明,LPB-d由8种单糖组成,LBP-e由6种单糖组成。LPB-d和LBP-e能使SMCC-7721细胞系分别停滞于G0/G1期和S期,其抑制率分别为26.7%和45.13%。两个多糖组分都能提高细胞质的Ca2+浓度,促进癌细胞凋亡。Maria Vittoria Varoni等[6]研究表明小鼠口服枸杞多糖可以保护肝脏,减轻由镉中毒对肝脏造成的损伤。目前,枸杞保健食品的研究侧重于饮料产品的开发。田海娟[7]等以人参、枸杞为原料,以开菲尔为发酵剂研制人参枸杞复配发酵饮品,通过正交试验优化出最佳发酵工艺,开发出一种口味良好,风味独特的复合发酵饮品。冯霖等[8]以枸杞、大米为原料,通过根霉、酵母的糖化发酵,制成一种营养丰富、酒味鲜美的具有保健作用的低度枸杞米酒。
中药发酵是借助于酶和微生物的作用,在一定的环境条件下(如温度、湿度、空气、水分等),使药物通过发酵过程,改变其原有性能,增强或产生新的功效,扩大用药品种,以适应临床用药的需要[9]。微生物在生长过程中可以分泌多种胞外酶于培养基中,这些酶可以促进胞内物质的释放;同时,在这些酶的作用下一些前体物质也有可能转化为有效成分,从而提高有效物质的含量。微生物次生代谢产物很丰富,这些次生代谢物与药物成分发生协同作用可增强药效,从而获得药效更强的药物。因此中药发酵炮制具有十分广阔的前景。目前酿酒酵母发酵枸杞侧重于酿酒工艺的研究,鲜有关于成分、功能变化的报道。
本文以宁夏枸杞和酿酒酵母为原料,通过使用酿酒酵母发酵枸杞,检测发酵前后有效成分和抗氧化性能的变化,以期为枸杞保健食品开发提供参考。
1 材料与方法
1.1 材料和试剂
编号为TJKD01~TJKD21的酿酒酵母:天津科技大学生化工程研究室保藏。
种子培养基:将10 g酵母粉、20 g蛋白胨、20 g葡萄糖溶于水,定容至1 L,115℃灭菌20 min;发酵培养基:将枸杞粉碎后过40目筛,以料水比1∶5(g/mL)混匀,115℃灭菌20 min。
1.2 仪器与设备
打浆机:美的集团有限公司;HYG-WI型摇床:上海欣蕊自动化设备有限公司;YXQ-LS-75SⅡ型灭菌锅:上海东亚压力容器制造有限公司;UVmini-1240型紫外可见分光光度计:日本岛津公司;TGL-16B高速离心机:上海安亭科学仪器厂。
1.3 方法
1.3.1 培养方法
取一环菌种接种至种子培养基28℃,200 r/min振荡过夜培养,再按2%的接种量接种至发酵培养基,相同条件下培养3 d。
1.3.2 枸杞有效成分测定方法
将发酵液100℃煮沸20 min,促进有效物质释放到发酵液中。5 000 r/min离心10 min后,上清液用于测定多糖、多酚、黄酮含量,沉淀烘干后用于测定类胡萝卜素含量。
1.3.2.1 多糖含量测定
取20 mL上清液和80 mL无水乙醇混匀,4℃静置过夜,5 000 r/min离心10 min后弃上清,用等体积蒸馏水将沉淀溶解,稀释后以葡萄糖作为标准品,使用硫酸-苯酚法[10]测定多糖含量。
1.3.2.2 多酚含量测定
将上清液稀释,以没食子酸作为标准品,使用酒石酸亚铁比色法[11]测定多酚含量。
问题解决第三课时的教学我主要采用四人小组合作模式,让学生自己去探索讨论,体会如何按比例分配,从而掌握知识。我的设计流程如下:
1.3.2.3 黄酮含量测定
取上清液,以芦丁作为标准品,使用张艳荣等[12]NaNO2-Al(NO3)3-NaOH体系分光光度法,测定黄酮含量。
1.3.2.4 类胡萝卜素含量测定
将沉淀烘干测干重,加入石油醚超声提取30 min,提取两次,合并提取液,参考曹有龙等[13]的方法测定类胡萝卜素含量。
1.3.3 抗氧化能力测定
将1.3.2得到的上清液真空干燥,计算溶解物的浓度。将样品稀释不同的倍数,参考Brand-Williams等[14]的方法测定DPPH自由基清除率。参考Qiu等[15]的邻二氮菲-Fe2+氧化法和邻苯三酚自氧化法测定羟自由基清除率和超氧阴离子自由基清除率。
2 结果与分析
2.1 菌株的筛选
各菌株发酵后多糖含量见表1。

表1 各菌株发酵后多糖含量Table 1 Polysaccharides content of each strain after fermentation

续表1 各菌株发酵后多糖含量Continue table 1 Polysaccharides content of each strain after fermentation
使用不同的酿酒酵母对枸杞发酵,检测发酵前后多糖含量变化。由表1可知,在21株不同来源的酿酒酵母中,大部分菌株发酵后多糖含量不变或下降。编号为TJKD08和TJKD09的酿酒酵母发酵后多糖含量分别由4.72 g/L提高至5.95 g/L和5.24 g/L,分别提高了26%和11%,编号为TJKD08的酿酒酵母发酵后多糖含量提高幅度最大,因此确定以其作为试验菌株。
2.2 发酵对枸杞有效成分的影响
2.2.1 发酵对多糖、多酚含量的影响
发酵时间对多糖、多酚含量的影响见图1。

图1 发酵时间对多糖、多酚含量的影响Fig.1 Effects of fermentation time on polysaccharides and polyphenols content
在发酵过程中不同时间点取样,检测多糖和多酚含量。由图1可知,使用编号为TJKD08的酿酒酵母发酵过程中,0~48 h多糖和多酚含量逐渐增多,多糖含量由4.7 g/L升高至6 g/L,多酚含量由0.18 g/L DW升高至0.32 g/L DW,分别提高了27.6%和77.8%,随后两者含量都略有下降,这可能是因为随着时间的增加酿酒酵母开始分解、利用多糖和多酚。在48 h多糖和多酚含量最高,因此确定发酵时间为48 h。酿酒酵母在发酵过程中所分泌的酶和枸杞中的成分作用,促进了物质转化,提高了多糖和多酚含量。
2.2.2 发酵对黄酮、类胡萝卜素含量的影响
发酵时间对黄酮、类胡萝卜素含量的影响见图2。
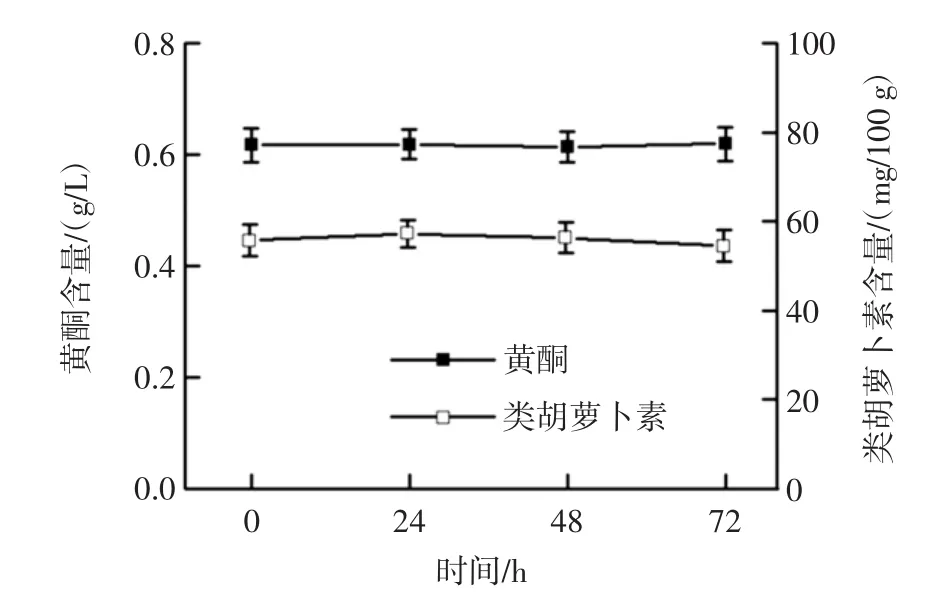
图2 发酵时间对黄酮、类胡萝卜素含量的影响Fig.2 Effects of fermentation time on flavonoids and carotenoids contents
枸杞中含有丰富的黄酮类化合物和类胡萝卜素,具有抗氧化、抗肿瘤、明目等生理活性。如图2所示,发酵过程中黄酮、类胡萝卜素含量不变。在酿酒酵母发酵过程中黄酮、类胡萝卜素并未发生转化。
2.3 发酵对抗氧化性能的影响
2.3.1 发酵对DPPH自由基清除能力的影响
DPPH自由基是一种很稳定的以氮为中心的自由基,其孤对电子在517 nm波长附近有强吸收;当有自由基清除剂存在时,孤对电子被配对,吸收消失或减弱。因此通过测定吸收减弱的程度来评价抗氧化剂的抗氧化活性[16]。枸杞发酵物对DPPH自由基的清除作用如图3所示。
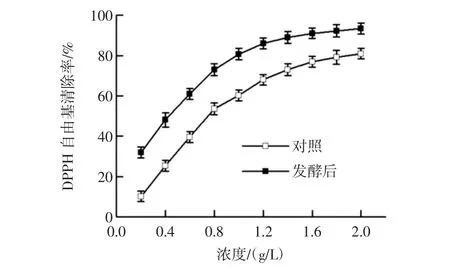
图3 枸杞发酵物对DPPH自由基的清除率曲线Fig.3 Scavenging effect ofLycium barbarumfermented product on DPPH radicals
由图3可见,不同浓度的枸杞发酵物对DPPH自由基均有一定的清除作用。在试验浓度范围内,枸杞发酵物对DPPH自由基的清除率随着浓度的增大而增大,当浓度大于1.2 g/L后,对DPPH自由基的清除作用增加变慢。IC50是DPPH自由基浓度减少一半的浓度。发酵前IC50为0.78 g/L,发酵后变为0.43 g/L,由此可以看出,发酵后的DPPH自由基清除能力明显增强。
2.3.2 发酵对羟自由基清除能力的影响
枸杞发酵物对羟自由基的清除作用见图4。

图4 枸杞发酵物对羟自由基的清除率曲线Fig.4 Scavenging effect ofLycium barbarumfermented product on hydroxyl radicals
羟自由基是一种非常活跃、进攻性极强的活性氧自由基,其对生物体危害极大。由图4可知,不同浓度的枸杞发酵物均对羟自由基具有良好的清除能力。在试验范围内,羟自由基清除率随着发酵物浓度的增加而增加。在枸杞发酵物浓度小于15 g/L时羟自由基清除率增加较快;当浓度大于15 g/L后,对羟基自由基的清除率增加变慢。相同浓度的样品,发酵后的羟自由基清除率始终大于发酵前。发酵前IC50为14.1 g/L,发酵后变为8.2 g/L,经过编号为TJKD08的酿酒酵母发酵,增强了对羟自由基的清除能力。
2.3.3 发酵对超氧阴离子自由基清除能力的影响
枸杞发酵物对超氧阴离子自由基的清除作用见图5。

图5 枸杞发酵物对超氧阴离子自由基的清除率曲线Fig.5 Scavenging effect ofLycium barbarumfermented product on superoxide radicals
超氧阴离子自由基可以作为多种活性氧的前体,虽然其本身氧化性较弱,但它在一定条件下会分解成氧化性很强的单线态氧自由基或羟自由基,具有更大的危害性。由图5可以看出,发酵物浓度越大,超氧阴离子自由基清除率越大。在枸杞发酵物浓度小于14 g/L时,对超氧阴离子自由基的清除率增加较快;当浓度大于14 g/L后,对超氧阴离子自由基的清除率增加变慢,在浓度大于18 g/L后清除率趋于不变。发酵前IC50为7.7 g/L,发酵后变为5.4 g/L。经过编号为TJKD08的酿酒酵母发酵,枸杞发酵物的超氧阴离子自由基清除率变大,抗氧化能力增强。
3 结论
通过对酿酒酵母筛选,找到了一株可以发酵枸杞提高多糖含量的酿酒酵母,经过其发酵后,有效成分发生了较大变化。多糖和多酚含量分别提高了27.6%和77.8%,黄酮和类胡萝卜素含量不变。发酵后的DPPH自由基清除率、羟自由基清除率、超氧阴离子自由基清除率和发酵前相比均大幅度提高,抗氧化能力得到强化。枸杞经编号为TJKD08的酿酒酵母发酵后实现了物质转化,提高了有效成分含量,从而提高了抗氧化能力。本试验通过微生物发酵提高枸杞的抗氧化性能,为枸杞资源的开发利用提供了一定参考。
[1]Ying Miao,Bingxiu Xiao,Zhen Jiang,et al.Growth inhibition and cell-cycle arrest of human gastric cancer cells byLycium barbarumpolysaccharide[J].Medical Oncology,2010,27:785-790
[2]Meejung Ahn,Jong Sang Park,Sungwook Chae,et al.Hepatoprotective effects ofLycium chinenseMiller fruit and its constituent betaine in CCl4-induced hepatic damage in rats[J].Acta Histochemica,2014,116:1104-1112
[3]X M Li,Y L Ma,X J Liu.Effect of theLycium barbarumpolysaccharides on age-related oxidative stress in aged mice[J].Journal of Ethnopharmacology,2007,111:504-511
[4]Qiong Luo,Zhuoneng Li,Xiaolan Huang,et al.Lycium barbarumpolysaccharides:Protective effects against heat-induced damage of rat testes and H2O2-induced DNA damage in mouse testicular cells and beneficial effect on sexual behavior and reproductive function of hemicastrated rats[J].Life Sciences,2006,79:613-621
[5]Qian Zhang,Xiaoling Lv,Tao Wu,et al.Composition ofLycium barbarum polysaccharides and theirapoptosis-inducing effect on human hepatoma SMMC-7721 cells[J].Food and Nutrition,2015,59:28696
[6]Maria Vittoria Varoni,Valeria Pasciu,Sergio Domenico Gadau,et al.Possible antioxidant effect ofLycium barbarumpolysaccharides on hepatic cadmium-induced oxidative stress in rats[J].Environmental Science and Pollution Research,2017,24(3):2946-2955
[7]田海娟,王蕾,朴春红,等.人参枸杞复配发酵饮品的研制[J].食品研究与开发,2015,36(18):87-90
[8]冯霖,刘芳竹.低度枸杞米酒的研制[J].食品工业科技,2005,26(3):143-144
[9]丁安伟.中药炮制学[M].北京:高等教育出版社,2007:318
[10]赵晓蕾,王小瑜,李恃圻,等.庄河产薏苡仁中多糖含量的测定[J].安徽农业科学,2011,39(27):17026-17029
[11]刘雪红,陈云国,刘慧,等.超声铺助提取红景天多酚类物质的工艺条件研究[J].江西食品工业,2011(1):38-40
[12]张艳荣,辛红阳,刘婷婷,等.红景天黄酮提取技术的研究[J].食品科学,2007,28(9):292-295
[13]曹有龙,刘兰英,李晓莺,等.枸杞鲜果类胡萝卜素超声提取工艺优化及光稳定性[J].食品研究与开发,2014,35(5):20-22
[14]W Brand-Williams,M E Cuvelier,C Berset.Use of a free radical method to evaluate antioxidant activity[J].Lebensm WissTechnol,1995,28:25-30
[15]Shulei Qiu,Jin Chen,Xi Chen,et al.Optimization of selenylation conditions forlycium barbarumpolysaccharide based on antioxidant activity[J].Carbohydrate Polymers,2014,103:148-153
[16]Perumal Siddhuraju,Klaus Becker.The antioxidant and free radical scavenging activities of processed cowpea (Vigna unguiculata(L.)Walp.)seed extracts[J].Food Chemistry,2007,101(1):10-19
Study on the Antioxidant Activity of the Wolfberry Fermentation by Saccharomyces cerevisiae
SONG Ming-hui1,2,SANG Na1,2,QIAO Chang-sheng1,2,3,*
(1.College of Biotechnology,Tianjin University of Science&Technology,Key Laboratory of Industrial Fermentation Microbiology,Ministry of Education,Tianjin 300457,China;2.National and Local United Engineering Lab of Metabolic Control Fermentation Technology,Tianjin 300457,China;3.Tianjin Peiyang Biotrans Co.,Ltd.,Tianjin 300457,China)
2017-02-22
10.3969/j.issn.1005-6521.2017.19.004
宋明辉(1991—),男(汉),在读硕士研究生,轻工技术与工程专业。
*通信作者:乔长晟(1969—),男(汉),教授,博士,主要从事生物高分子及食品生物技术方向研究。

