茶多酚EGCG抑制大肠杆菌O157:H7生物膜研究
肖 洁,张秀琴,杜文芳,段合波,李 睿
(1.武汉轻工大学 生物与制药工程学院,湖北 武汉 430023;2.神农架林区检验检测中心,湖北 神农架 442400)
茶多酚EGCG抑制大肠杆菌O157:H7生物膜研究
肖 洁1,张秀琴2,杜文芳1,段合波1,李 睿1
(1.武汉轻工大学 生物与制药工程学院,湖北 武汉 430023;2.神农架林区检验检测中心,湖北 神农架 442400)
研究低于抑菌浓度的茶多酚EGCG对大肠杆菌O157:H7 EDL933生物膜形成和泳动性能的影响。在培养基中添加不同浓度的EGCG加入到玻璃试管,接种大肠杆菌O157:H7 EDL933,30 ℃下静置培养5 d。结晶紫法测定生物膜量。结果表明亚抑菌浓度(0.125 mg/mL,0.25 mg/mL,0.5 mg/mL)的EGCG可以显著抑制大肠杆菌O157:H7 EDL933的生物膜形成。0.3% LB软琼脂加入亚抑菌浓度(0.125 mg/mL、0.25 mg/mL、0.5 mg/mL)的EGCG,37 ℃培养大肠杆菌O157:H7 EDL933 24 h,结果证实大肠杆菌O157:H7 EDL933泳动能力显著减小。结果证实EGCG具有很强的抑制细菌生物膜的能力,有望用于食品工业控制细菌污染。
茶多酚EGCG; 大肠杆菌O157:H7;生物膜;泳动性
Abstract:The effects of Epigallocatechin gallate (EGCG) on the biofilm formation and swimming motility ofEscherichiacoliO157:H7 were studied. The mediums supplemented with different concentrations of EGCG were added into glass tubes, thenEscherichiacoliO157:H7 EDL933 was innoculated and statically incubated at 30℃ for 5days. Biofilm biomass was measured by crystal violet assay. The results indicated that sub-MIC (0.125mg/mL,0.25mg/mL and 0.5mg/mL) of EGCG significantly inhibited the biofilm formation byEscherichiacoliO157:H7. Soft LB agar (0.3%) containing EGCG (0.125mg/mL,0.25mg/mL and 0.5mg/mL) was used in swimming inhibitory assay. The results showed that EGCG significantly suppressed swimming motility ofEscherichiacoliO157:H7 at 37℃. These results suggested the feasibility of using EGCG in food industry to controlEscherichiacoliO157:H7 growth and biofilm formation.
Key words:Epigallocatechin gallate;EscherichiacoliO157:H7; biofilm; swimming motility
1 引言
肠出血性大肠杆菌(EnterohemorrhageEscherichiacoli,EHEC)是一类重要的食源性致病菌,可严重威胁人类健康。EHEC具有多种血清型,大肠杆菌O157:H7是其中最典型的一种血清型,其发病率最高、致病性最强、流行性最广[1]。
细菌生物膜是指细菌为了适应外界环境附着于其他表面上,分泌胞外多糖、脂蛋白等胞外聚合物,通过细胞彼此粘附并被自身产生的胞外聚合物包围形成的大量膜样物质[2]。生物膜形成的三要素为:细菌、细菌附着的表面及胞外基质[2]。细菌生物膜被认为是细菌为适应不利生存条件而产生的,生物膜中的细胞通常比浮游状态的细胞具有更顽强的生命力,对不利的生存环境(例如干燥失水、极端温度、抗生素、消毒剂等)的适应能力增强[3]。生物膜促使细菌对抗生素产生耐药性[3]。现有研究表明,细菌生物膜形成除受到环境因素包括温度、PH值、渗透压、离子浓度等的影响外,也与细菌自身的运动性密切相关[4]。细菌的运动性包括群集运动(Swarm motility)和浮泳运动(Swim motility)两种方式[4]。
茶多酚是茶叶提取物中多酚类物质的总称。研究表明茶多酚具有抗菌、抗病毒、抗过敏、抗炎、抗癌、抗氧化等多种活性作用[5]。茶多酚对单增李斯特菌、大肠杆菌O157:H7、鼠伤寒沙门氏菌、金黄色葡萄球菌等多种致病菌的生长具有明显的抑制作用[6]。在茶多酚中,发挥抑菌活性的主要有以下4种儿茶素:表没食子儿茶素没食子酸酯(E-epigallocatechin-3-gallate,EGCG),表儿茶素(E-epicatechin,EC),表儿茶素没食子酸酯(E-epicatechin-3-gallate,ECG)和表没食子儿茶素(E-epigallocatechin,EGC)[7]。EGCG在所有儿茶素中含量最高,约占其总含量的50-80%,抗菌活性最强[8],其分子结构如图1所示。
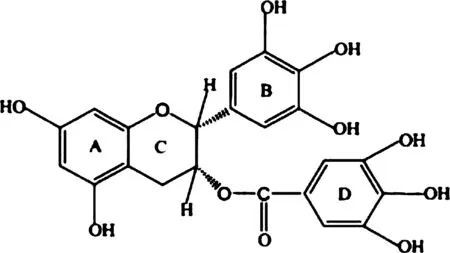
图1 EGCG的分子结构
目前有很多化学类食品添加剂应用于食品保鲜中,这些添加剂都有比较好的抑菌效果,但是化学类食品添加剂因副作用大备受争议[9]。茶多酚等天然提取物因而受到消费者欢迎。茶多酚在食品保鲜中的应用已成为一大研究热点[10]。但茶多酚的抑菌机理目前并未阐释清楚。笔者以茶多酚EGCG单体为研究对象,考察其对大肠杆菌O157:H7生物膜的抑制作用,为茶多酚在食品工业中的应用提供理论参考。
2 材料与方法
2.1 材料
2.1.1 实验菌株
大肠杆菌O157:H7 EDL933由中国检验检疫科学研究院赠送。
2.1.2 主要试剂
EGCG(99.8%)购自南京广润生物制品有限公司;LB、MH肉汤购自青岛高科园海博生物技术有限公司; 结晶紫购自美国Amresco公司;6孔细胞培养板购自武汉华顺生物技术公司。
2.2 方法
2.2.1 EGCG对大肠杆菌O157:H7EDL933 最低抑菌浓度的测定
最低抑菌浓度(minimal inhibitory concentration, MIC) 测定参考美国临床和实验室标准协会(Clinical and Laboratory Standards Institute,CLSI)2012版[11]进行。即 接种大肠杆菌O157:H7 EDL933于MH平板上,划线分离, 待长出单菌落。挑取3—4个单菌落接种至含5 mL MH肉汤的试管中,37℃摇床培养4h至菌液OD600为0.4左右,此时细菌浊度约0.5麦氏单位。 用MH肉汤将菌液稀释100倍。将预先配制好的EGCG 母液用MH肉汤稀释成设定的浓度,稀释方法参考文献[11]进行。向96孔板中加入对应样品,实验组为不同浓度的EGCG,每孔加50 μL,然后加入稀释100倍的菌液50 μL;阳性对照为50 μL MH肉汤加50 μL稀释菌液;阴性对照为100 μL MH肉汤(无菌液)和含相应浓度EGCG的MH肉汤(无菌液),每个样品做4个平行孔。加入板中的菌液终浓度约为5×105CFU/mL。将96孔板置于生化培养箱中,37 ℃静置培养20 h。MIC终点判读:用肉眼在96孔板中所见能完全抑制细菌生长的最低抗菌药物浓度为最小抑菌浓度。若肉眼无法准确判断,可将96孔板置于酶标仪下测定OD600帮助判定MIC。
2.2.2 EGCG对大肠杆菌O157:H7 EDL933生物膜形成的影响
接种大肠杆菌O157:H7 EDL933于LB液体培养基中,150 r/min 37 ℃摇床过夜培养,用LB液体培养基调节细菌浓度,使细菌OD600接近于1。将预先配制好的EGCG 母液用1/2 LB肉汤(2倍稀释的LB)稀释成设定的浓度,即0.125 mg/mL、0.25 mg/mL、0.5 mg/mL。将菌液分别用含不同浓度EGCG的1/2 LB肉汤培养基稀释100倍。设定阳性和阴性对照。菌液直接用1/2 L B肉汤稀释,不加EGCG设定为阳性对照 ; 阴性对照为无菌液的1/2 LB肉汤。将各组菌液加入到灭菌小试管中,每管加2mL菌液。将试管置于生化培养箱中,30 ℃下静置培养5 d。培养完成后,将试管内菌液小心吸出,沿管壁缓慢加入3 mL无菌PBS轻轻润洗试管1次,于37 ℃下风干。每管加入3 mL 0.5%结晶紫染液,于37 ℃下染色30 min。弃染色液,3 mL无菌PBS(pH7.4)洗涤3次,直到阴性对照管无过量染色。 37 ℃下风干, 取3 mL 95%乙醇过夜脱色,酶标仪测定OD595吸光度值。每一实验组和对照组设置至少三个平行对照管,取平均值,样品最终OD值=样品平均OD值-阴性对照OD平均值。
2.2.3 EGCG对大肠杆菌O157:H7 EDL933泳动能力的影响
接种大肠杆菌O157:H7 EDL933于LB肉汤中培养至对数期,OD600为0.4左右。制备0.3% LB软琼脂,高压蒸汽灭菌后保温于50—60 ℃待用,防止凝固。0.3% LB软琼脂中加入不同浓度的EGCG,混匀,使软琼脂中EGCG终浓度分别为0.125 mg/mL、0.25 mg/mL、0.5 mg/mL。 将含不同浓度EGCG的LB软琼脂加入6孔细胞培养板中,每孔加入3mL,将6孔板置于超净工作台中4 h,待LB软琼脂凝固后,分别取1 μL菌液点在每个LB软琼脂孔中央。将6孔细胞培养板正置于生化培养箱中,37 ℃培养24 h,观察菌落形态并拍照,同时测定细菌泳动直径大小。
2.2.4 统计学分析
本文中所有实验均进行3次生物学重复,实验数据以“m±SD”来表示,使用SPSS 22.0软件进行统计分析,采用t检验进行组间两两比较,并认为p<0.05具有统计学意义且存在显著差异(用*表示),p<0.01为差异极显著(**表示)。
3 结果与分析
3.1 EGCG对大肠杆菌0157:H7 EDL933的MIC测定
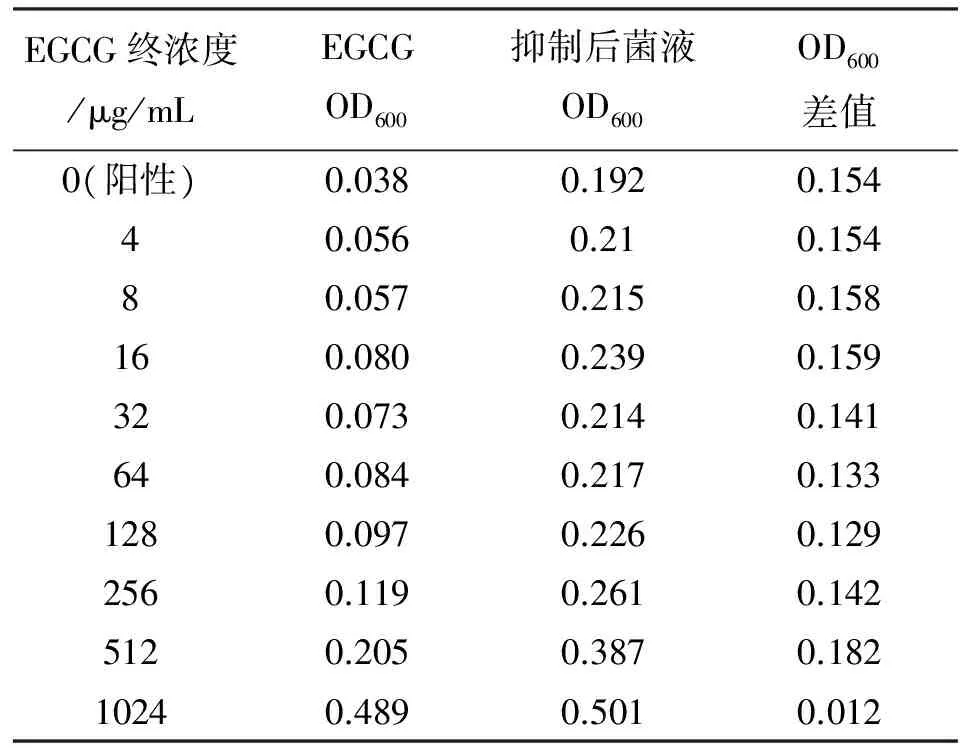
根据CLSI报道的方法[11]进行一定改良,测定EGCG和柠檬酸对大肠杆菌O157:H7 EDL933的MIC。由于不同浓度的EGCG自身带有一定颜色,颜色变化会对吸光度值带来一定干扰,故采用自身对照法检测其对大肠杆菌O157:H7 EDL933的MIC。随着EGCG浓度增大,EGCG本身的吸光度值增大。加入菌液培养20 h后,排除EGCG本身吸光值的干扰(表1),可看到随着EGCG浓度增大,测得的吸光度差值减小。当EGCG浓度达到1.024 mg/mL时,吸光度差值迅速减少,说明菌体生长被抑制(表1),所以EGCG对大肠杆菌O157:H7 EDL933的MIC确定为1.024 mg/mL。
表1 EGCG对大肠杆菌O157:H7 EDL933 MIC测定的OD600值
EGCG终浓度/μg/mLEGCGOD600抑制后菌液OD600OD600差值0(阳性)0.0380.1920.15440.0560.210.15480.0570.2150.158160.0800.2390.159320.0730.2140.141640.0840.2170.1331280.0970.2260.1292560.1190.2610.1425120.2050.3870.18210240.4890.5010.012
3.2 生物膜形成实验
将大肠杆菌O157:H7 EDL933分别接种于含不同浓度 EGCG的1/2 LB 液体培养基中,30 ℃下静置培养5 d,结晶紫染色观察。大肠杆菌O157:H7 EDL933的生物膜在培养基与空气气液交界面处形成,结晶紫与生物膜结合后,附着于玻璃试管内壁,形成蓝紫色的生物膜环。脱色后测定OD595。由图2可知, 阳性对照组形成生物膜量最多,OD595最大 ; 加入EGCG后,生物膜量减少,EGCG浓度越高,测得的OD595越小。
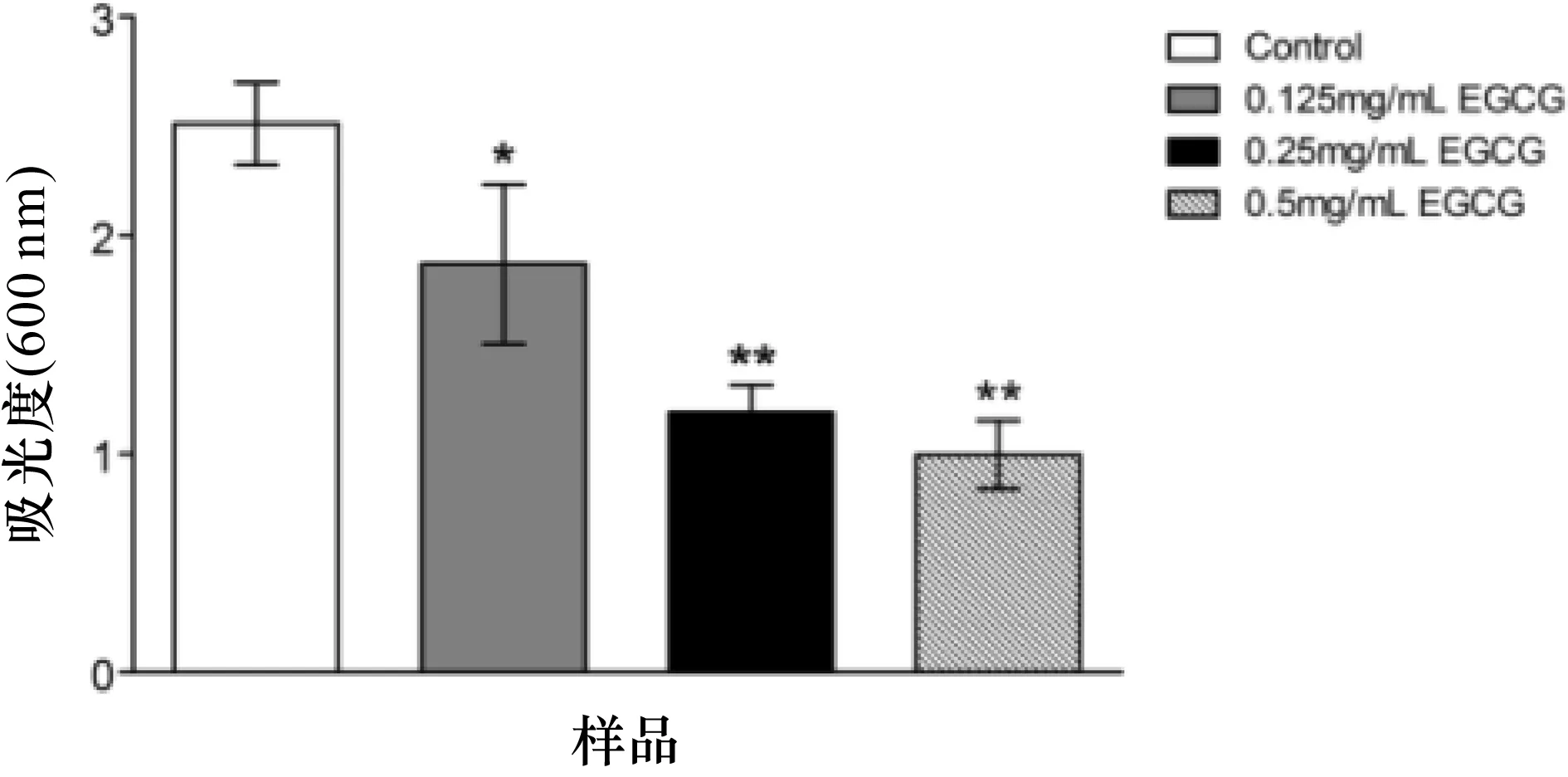
图2 EGCG对大肠杆菌O157:H7 EDL933生物膜形成的影响
3.3 细菌泳动能力检测结果
培养24 h后观察菌落形态,各组细菌在软琼脂表面生长良好,形成圆形或近似圆形的大小不一的菌落。各组菌落直径比较结果见图3,含EGCG的实验组细菌菌落直径均极显著小于PBS对照组(p<0.01)。大肠杆菌O157:H7 EDL933在含EGCG的软琼脂上的泳动能力弱于PBS对照组,表明低于MIC的EGCG对该菌泳动能力有抑制作用。
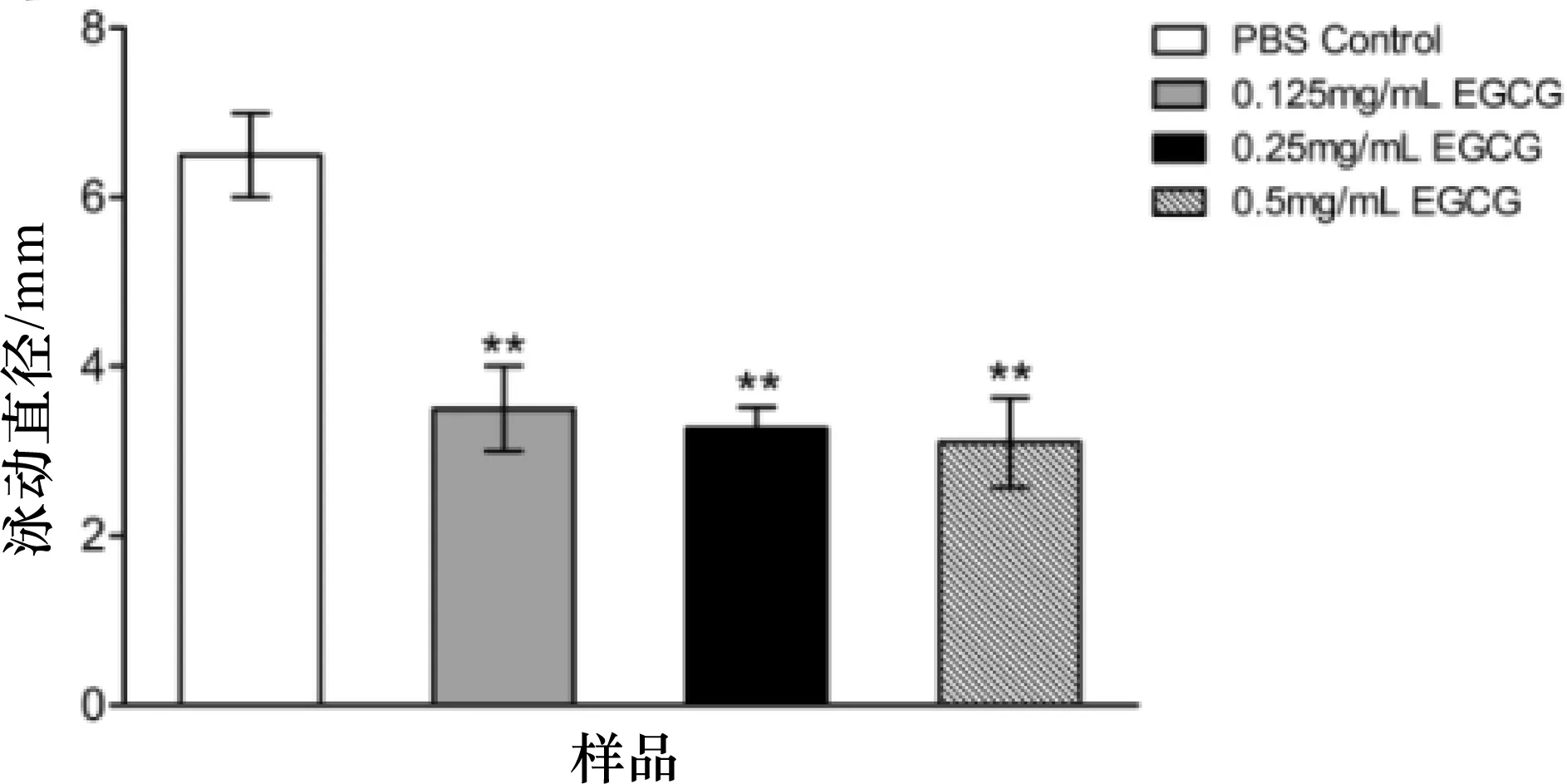
图3 细菌泳动实验结果
4 结论
EGCG属于天然提取物,具有诸多保健功效,可以应用于食品保鲜中。大肠杆菌O157:H7是一种对人类健康危害极大的食源性致病菌。本文结果表明,低于MIC浓度的EGCG可以显著抑制大肠杆菌O157:H7 EDL933生物膜的形成,抑制作用随着EGCG浓度增大而增强。低于MIC浓度的EGCG可以显著抑制大肠杆菌O157:H7 EDL933的泳动能力,EGCG的抑制作用随浓度的增大而增强。
目前亚抑菌浓度的EGCG抑制细菌生物膜的相关报道较少。 Castillo等人 发现EGCG在亚抑菌浓度下可以显著降低空肠弯曲杆菌的运动性,减少其生物膜的形成[12]。Blanco等人也报道了亚抑菌浓度的EGCG可抑制金黄色葡萄球菌的生物膜形成[13]。我们推断,在亚抑菌浓度下,EGCG不能杀死细菌,因此EGCG抑制细菌生物膜形成主要是通过干扰细菌代谢、降低细菌运动性,减少细菌粘附到固体载体表面,从而减少生物膜形成。
本文证实亚抑菌浓度的EGCG 可显著抑制大肠杆菌O157:H7 EDL933生物膜的形成,因此EGCG可用于食品工业中控制致病菌生长和生物膜的产生。本文结果为茶多酚开发做为天然食品保鲜剂提供了理论依据。
[1] Karmali M A, Mascarenhas M, Shen S, et al. Association of genomic O island 122 ofEscherichiacoliepidemic and/or serious disease[J]. Journal of Clinical Microbiology, 2003, 41(11): 4930-4940.
[2] Wu H, Moser C, Wang H Z, et al. Strategies for combating bacterial biofilm infections[J]. International Journal of Oral Science, 2015, 7(1): 1-7.
[3] Dewanti R, Wong A C L. Influence of culture conditions on biofilm formation byEscherichiacoliO157:H7[J]. International Journal of Food Microbiology, 1995, 26(2): 147-164.
[4] 丁莉莎, 王瑶. 鞭毛介导的运动性与细菌生物膜的相互关系[J]. 微生物学报, 2009, 49(4): 417-422.
[5] 董璐,代增英, 韩晴,冯建岭, 李迎秋. 茶多酚的抑菌作用研究进展[J]. 山东食品发酵, 2014, (3) :42-44.
[6] Lee K M, Kim W S, Lim J, et al. Antipathogenic properties of green tea polyphenol epigallocatechin gallate at concentrations below the MIC against enterohemorrhagicEscherichiacoliO157:H7[J]. Journal of Food Protection, 2009, 72(2): 325-331.
[7] Noormandi A, Dabaghzadeh F. Effects of green tea onEscherichiacolias a uropathogen[J]. Journal of Traditional and Complementary Medicine, 2015, 5(1): 15-20.
[8] Bansal S, Syan N, Mathur P, et al. Pharmacological profile of green tea and its polyphenols: a review[J]. Medicinal Chemistry Research, 2012, 21(11): 3347-3360.
[9] 边策. 防腐剂的安全性及鉴别方法[J].价值工程, 2013, (24):320-321.
[10] 张海霞.天然抗氧化剂茶多酚在食品贮藏保鲜中的应用[J].食品安全导刊, 2015,(30):137-138.
[11] CLSI C. Performance standards for antimicrobial susceptibility testing: twenty-second informational supplement[J]. CLSI/NCCLS Document M100-S22. Clinical and Laboratory Standards Institute, Wayne, PA, 2012.
[12] Castillo S, Heredia N, García S. 2(5H)-Furanone, epigallocatechin gallate, and a citric-based disinfectant disturb quorum-sensing activity and reduce motility and biofilm formation ofCampylobacterjejuni[J]. Folia Microbiologica, 2015, 60(1): 89-95.
[13] Blanco A R, Roccaro A S, Spoto G S, et al. Epigallocatechin Gallate Inhibits Biofilm Formation by Ocular Staphylococcal Isolates[J]. Antimicrobial Agents and Chemotherapy, 2005, 49(10): 4339-4343.
Inhibition effects of Epigallocatechin gallate on the biofilm formation ofEscherichiacoliO157:H7
XIAOJie1,ZHANGXiu-qin2,DUWen-fang1,DUANHe-bo1,LIRui1
(1.School of Biology and Pharmaceutical Engineering,Wuhan Polytechnic University,Wuhan 430023,China; 2.Center for Detection and Inspection,Shennongjia Forestry District,Shennongjia 442400,China)
2017-08-01.
肖洁(1991) ,女,硕士研究生,E-mail:15827061924@163.com.
李睿(1972),女,教授,博士,E-mail:liruiwuhan@163.com.
湖北省教育厅重点科研计划项目(D20151702).
2095-7386(2017)03-0033-04
10.3969/j.issn.2095-7386.2017.03.006
R 155.5
A

