FeCl3溶液引起葡萄白藜芦醇积累与Halliwell-Asada途径的偶联关系
董锦蕾,李月荣,王晓琴,2,张 波,2
(1.石河子大学药学院,新疆石河子 832002;2.省部共建新疆特种资源植物药重点实验室,新疆石河子 832002)
FeCl3溶液引起葡萄白藜芦醇积累与Halliwell-Asada途径的偶联关系
董锦蕾1,李月荣1,王晓琴1,2,张 波1,2
(1.石河子大学药学院,新疆石河子 832002;2.省部共建新疆特种资源植物药重点实验室,新疆石河子 832002)
目的FeCl3溶液可导致葡萄白藜芦醇积累但机制不明,研究Halliwell-Asada(H-A)途径与白藜芦醇积累的关系在损伤保护角度。方法FeCl3溶液处理葡萄叶片后,检测细胞损伤程度和活性氧水平,分析白藜芦醇与H-A途径相关基因表达变化规律。结果FeCl3溶液造成叶片活性氧积累与叶片损伤正相关,且伴随白藜芦醇呈量效关系积累,峰值36.83 μg/g;白藜芦醇合成途径以及H-A途径下相关酶PAL、C4H、4CL、STS、APX和MDAR的基因表达量除DHAR基因外均明显上调;H2O2协同处理增加白藜芦醇含量,抗氧化剂NAC和GSH-EE协同则相反。结论FeCl3溶液降低葡萄叶片H-A途径对活性氧的清除能力,造成氧化胁迫并引起白藜芦醇积累,提示白藜芦醇合成与H-A途径存在偶联。
白藜芦醇;细胞损伤;H-A途径;ROS积累;美国红地球葡萄
0 引 言
【研究意义】白藜芦醇是一种具有抗真菌活性的植保素。虽然铝剂、铁剂[1]以及H2O2[2]均能够诱导白藜芦醇的积累,但能够诱导白藜芦醇积累的核心因素尚不明确,因此FeCl3特异性的阻断H-A途径致使白藜芦醇积累与植物抗氧化H-A途径的关系成为研究焦点。【前人研究进展】研究表明,使用非生物或生物诱导因子均可使叶片中白藜芦醇含量显著升高[3],研究发现,使用三氯化铁[1]和过氧化氢[2]处理葡萄叶片时白藜芦醇的积累与H-A途径有关,其原因与葡萄叶片发生氧化胁迫密切相关。【本研究切入点】氧化性的非生物诱导剂会对葡萄造成氧化胁迫,继而使其白藜芦醇含量显著升高。FeCl3也是H-A途径抗坏血酸循环中DHAR的酶抑制剂[4],当FeCl3浓度过高时则会引起组织中ROS水平升高造成氧化胁迫[5],当合成白藜芦醇的苯丙氨酸途径的STS在受到胁迫刺激后才会启动白藜芦醇的合成[6]。通过检测细胞损伤程度和ROS水平、分析相关基因的表达规律,来确定H-A途径抗坏血酸循环与葡萄白藜芦醇积累的关系。【拟解决的关键问题】以离体红地球葡萄叶片为材料,探讨用氧化剂FeCl3处理后葡萄叶片中白藜芦醇与H-A途径抗坏血酸循环的因果关系,为研究FeCl3诱导葡萄叶片中白藜芦醇的积累机制提供理论依据。
1 材料与方法
1.1 材 料
1.1.1 红地球葡萄
3年生红地球葡萄苗(VitisviniferaL. cv. Red Globe)购自新疆石河子葡萄研究所,于石河子大学药园日光温室中培育(25℃);试验选取7月龄葡萄茎上距顶尖第4或第5叶摘取后避光保存(含叶柄)[7]。
1.1.2 试剂
白藜芦醇标准品(色谱纯,美国Sigma-Aldrich公司);甲醇(AR,天津市富宇精细化工有限公司)、乙腈(色谱纯,美国Fisher公司);FeCl3(AR,天津盛奥化学试剂有限公司);3,3'-二氨基联苯胺(3,3'- diaminobenzidine,缩写DAB,北京索莱宝公司);谷胱甘肽乙酯(GSH-EE,美国Sigma公司)、N -乙酰- L-半胱氨酸(美国Sigma公司);其余试剂均为分析纯,稀释及空白处理中的水为实验室制备双蒸水。
1.2 方 法
1.2.1 FeCl3处理葡萄叶片
葡萄叶片:选用0(空白)、1、10和100 mM的FeCl3于100 mL三角瓶中,将离体葡萄叶片的叶柄浸泡处理并置于暗室中处理18 h,方法参考Adrian等[7]。NAC的浓度为1 mM[8],GSH-EE的浓度为2 mM。表1
表1 酶抑制剂和抗氧化剂处理
Table 1 Inhibitors and Antioxidants treatment
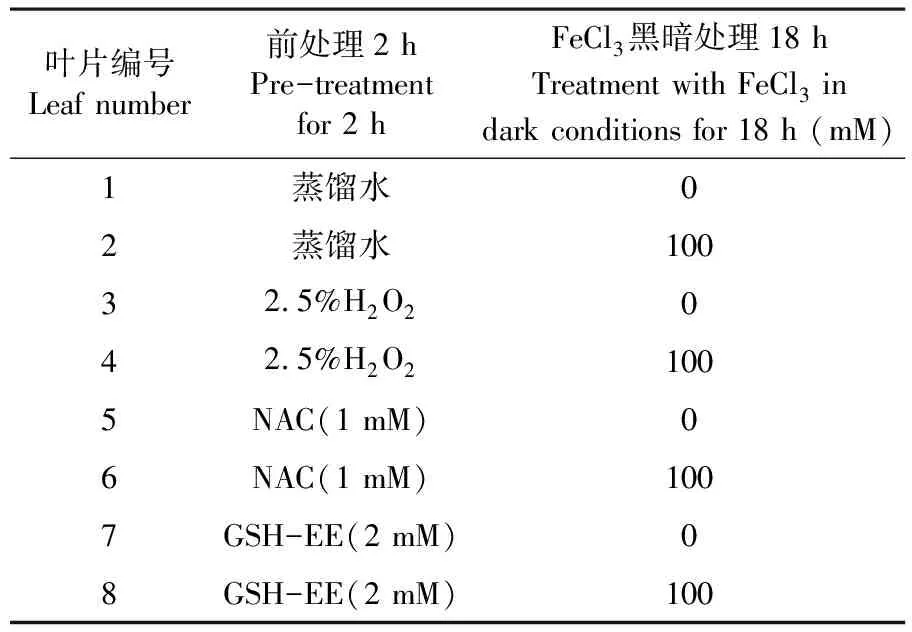
叶片编号Leafnumber前处理2hPre-treatmentfor2hFeCl3黑暗处理18hTreatmentwithFeCl3indarkconditionsfor18h(mM)1蒸馏水02蒸馏水10032 5%H2O2042 5%H2O21005NAC(1mM)06NAC(1mM)1007GSH-EE(2mM)08GSH-EE(2mM)100
1.2.2 叶片细胞死亡
将处理好的葡萄叶片置于伊文思蓝染液中染色10 min,用蒸馏水洗涤三次后进行脱色,并采集照片。具体方法参考Faoro等[9]。
1.2.3 MDA活性检测
过氧化脂质降解产物中的丙二醛(MDA)可与硫代巴比妥酸(TBA)缩合,形成红色产物。测定532 nm处的吸光度值,参照南京建成所提供的丙二醛(MDA)试剂盒说明书。
1.2.4 叶片组织中ROS积累测定
使用DAB染色方法定性检测ROS:将FeCl3溶液处理好的葡萄叶片置于DAB溶液中染色8 h后进行脱色,并采集照片。具体方法参考Meißlitzer-Ruppitsch等[10];定量检测叶片组织中H2O2:提取叶片细胞间隙液,提取方法参考Sutherland等[11],测定560 nm(或595 nm)处吸光度值。参照上海生工生物工程股份有限公司过氧化氢定量分析试剂盒推荐方法。
1.2.5 白藜芦醇的提取和检测
将FeCl3溶液处理好的葡萄叶片称重后加适量甲醇,研磨,超声提取20 min,振荡离心,提取后的上清液收集蒸干并用甲醇溶解,定容至10 mL容量瓶中。通过HPLC法对葡萄叶片中的白藜芦醇进行定量分析,参照文献[12]。白藜芦醇含量采用(μg/g 鲜重)表示。
1.2.6 白藜芦醇茋合酶基因以及H-A途径中脱氢抗坏血酸循环关键酶基因的RT-PCR检测
选取0、0.1、1.0、10和100 mM的FeCl3溶液处理叶片18 h,用RNAprep Pure 多糖多酚植物总RNA提取试剂盒提取RNA(天根生化科技有限公司,北京),参考方法[13];cDNA第一条链合成根据(PrimeScriptR RT reagent Kit Perfect Real Time,TaKaRa)推荐方法进行;根据参考文献设计葡萄白藜芦醇合成途径关键酶的引物:苯丙氨酸解氨酶(PAL)、肉桂酸-4-羟化酶(C4H)和4-肉桂酸辅酶A连接酶(4CL)及白藜芦醇合成酶(STS)[14];根据参考文献设计葡萄H-A途径脱氢抗坏血酸循环关键酶基因的引物;抗坏血酸过氧化物酶(APX)[15]、单脱氢抗坏血酸还原酶(MDAR)和脱氢抗坏血酸还原酶(DHAR)[16],内参18S rRNA[17]。RT-PCR反应及电泳相关步骤参考文献[17],列出引物序列。表2
1.3 数据处理
所有实验设3个平行组或重复3次,结果以平均值±标准偏差(Mean values±S)表示,以t检验进行组间统计学差异比较。
表2 引物序列
Table 2 Primer sequences table

基因Gene引物序列SequenceofReverse(R)andForward(F)Primers分子量(KD)Molecularweight(KD)18S5’-TGGCCTTCGGGATCGGAGTAA-3’5’-ATCCCTGGTCGGCATCGTTTAT-3’201STS5’-CGAAGCAACTAGGCATGTGT-3’5’-CTCCCCAATCCAATCCTTCA-3’134PAL5’-CCGAACCGAATCAAGGACTG-3’5’-GTTCCAGCCACTGAGACAAT-3’183C4H5’-AAAGGGTGGGCAGTTCAGTT-3’5’-GGGGGGTGAAAGGAAGATAT-3’1094CL5’-CTGATGCCGCTGTTGTTTCG-3’5’-GCAGGATTTTACCCGATGGA-3’198APX5’-AAATGGGTCTCAGCGACAAG-3’5’-CAGGGTCCTTCAAATCCAGA-3’94MDAR5’-GACAGGTGGAAGAGGAGAAA-3’5’-CTACAACGATGAAAGGGTGAC-3’101DHAR5’-CCTACAAGATGCATCTGATCAA-3’5’-GACTGAGACTACAGTAATGACC-3’127

图1 用10 mM FeCl3+2.5%H2O2的混合液处理葡萄叶片并进行伊文思蓝染色
2 结果与分析
2.1 FeCl3对葡萄叶片损伤作用
伊文思蓝染色法可以检测叶片损伤程度。根据染色结果,可以看出在氧化剂FeCl3和H2O2的双重胁迫下叶片损伤程度加重,抗氧化剂NAC和GSH-EE的共处理组叶片损伤有所改善。单用氧化剂组较空白叶片有损伤增加现象。图1
2.2 FeCl3溶液引起葡萄叶片MDA积累
植物中逆境下遭受伤害与ROS积累诱发的膜脂过氧化作用密切相关,其中丙二醛是膜脂过氧化最重要的产物之一,可通过MDA含量了解膜脂过氧化的程度,间接测定膜系统受损程度以及植物抗逆性。研究表明,随着FeCl3溶液浓度的增加,葡萄叶片中MDA含量明显升高,在100 mM FeCl3处理组其含量达到0.71 nmol/mg,是空白组的2.36倍,并呈量效依赖关系。图2

注:与空白相比**P< 0.01
Note:**P< 0.01, vs vehicle control
图2 FeCl3溶液下葡萄叶片中MDA活性变化
Fig.2TheeffectofFeCl3solutiononactivityofMDAingrapeleaves
2.3 FeCl3溶液处理引起细胞ROS水平的升高
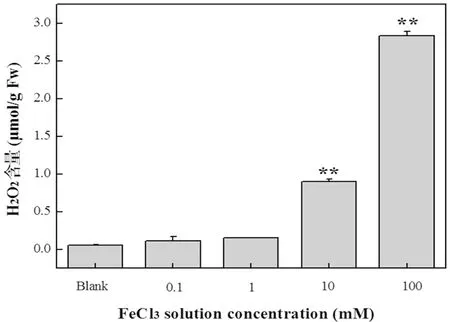
随着FeCl3溶液处理浓度的增加,叶片的氧化胁迫程度也越加严重,葡萄叶片代谢产生的对其有毒害作用的ROS。DAB染色法可以定性检测细胞内ROS水平,而H2O2含量则可以定量表现出叶片组织内ROS含量。DAB的染色结果可以发现FeCl3和H2O2共处理后叶片中ROS的水平升高,抗氧化剂NAC和GSH-EE的共处理组叶片ROS水平有所降低;而H2O2含量也显著上升。低剂量处理组较空白对照组H2O2含量无显著性差异,但10和100 mM处理组中H2O2含量显著上升,100 mM处理组葡萄叶片产生的内源性的H2O2含量达到最大值2.84 μmol/g,是空白组的48倍。图3,图4,图5

图3 用10 mM FeCl3+5%H2O2的混合液处理葡萄叶片并进行DAB染色
注:与空白相比**P< 0.01
**P< 0.01, vs vehicle control
图4氧化胁迫条件下葡萄叶片细胞间隙液H2O2含量
Fig.4ChangesofH2O2contentsinintercellularfluidofgrapeleavestotheoxidativestress
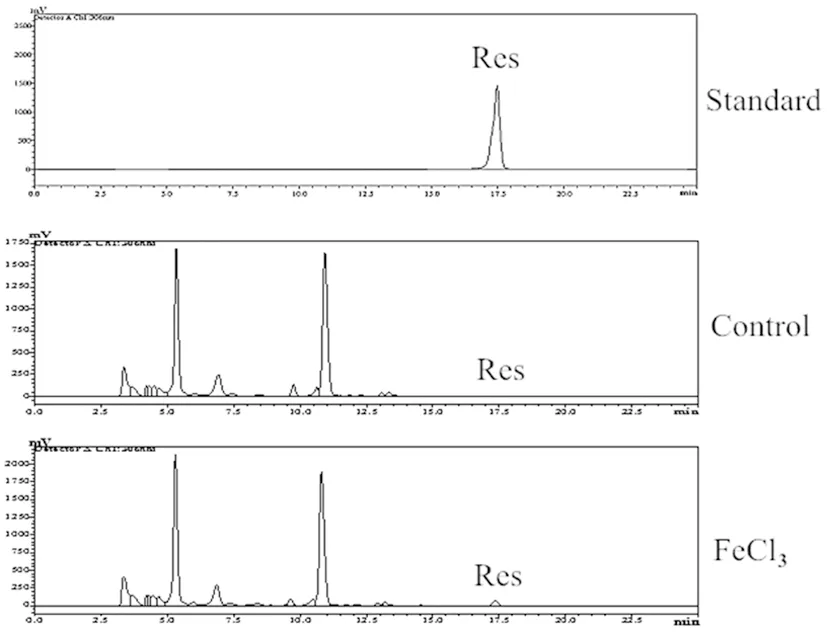
图5 100 mM FeCl3溶液处理葡萄叶片18 h后HPLC分析
Fig.5TheHPLCanalysisofgrapeseedlingswith100mMFeCl3solutiontreatmentfor18h
2.4 FeCl3溶液处理浓度与白藜芦醇积累水平
研究表明,随着FeCl3处理浓度的增加叶片中的白藜芦醇含量明显升高,FeCI3溶液处理浓度与白藜芦醇积累水平呈正相羊关。在100 mM FeCl3处理组其含量达到36.83 μg/g,是空白组的44.87倍,并呈量效依赖关系。白藜芦醇的含量相比较于FeCl3单独处理组来说,加了助氧化剂H2O2处理组的白藜芦醇含量有所增加,而加了抗氧化剂NAC和GSH-EE的处理组白藜芦醇的含量则有所减少。图6,图7

注: 与空白相比**P< 0.01
Note:**P< 0.01, vs vehicle control
图6 FeCl3溶液对葡萄叶片白藜芦醇诱导量效关系(18 h)
Fig.6Thedose-effectofFeCl3solutiononresveratrolcontentingrapeseedlingsfor18hourstreatment
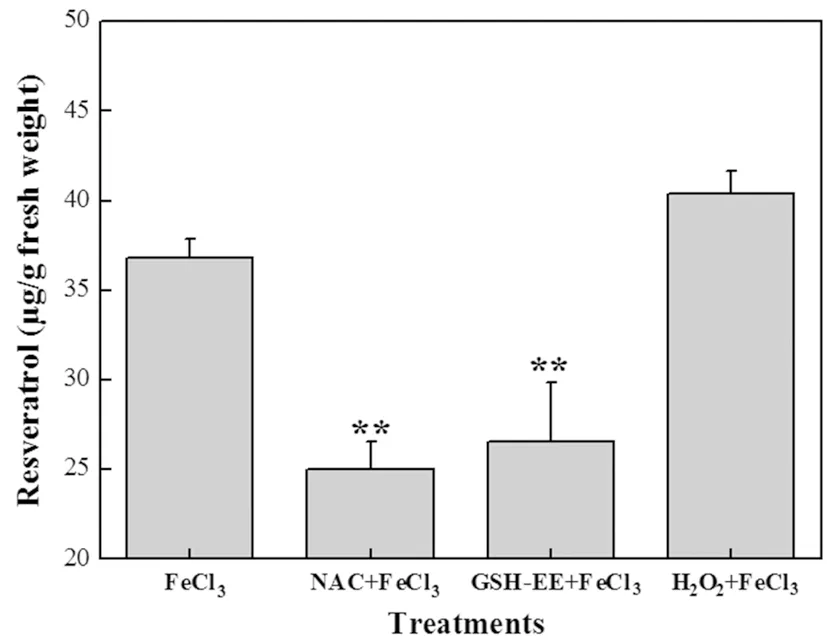
注:与空白相比**P< 0.01
Note:**P< 0.01, vs vehicle control
图7 FeCl3溶液在不同前处理条件下对葡萄叶片白藜芦醇诱导量效关系(18 h)
Fig.7Thedose-effectofFeCl3solutiononresveratrolcontentingrapeseedlingsunderdifferentpretreatmentconditionsfor18hourstreatment
2.5 FeCl3溶液处理上调了葡萄茋类物质合成途径相关基因表达
茋类物质合成途径RT-PCR凝胶电泳图显示,随着FeCl3浓度的增加,苯丙氨酸代谢公共途径相关分子表达有明显的变化。公共途径中苯丙氨酸解氨酶(PAL)、肉桂酸-4-羟化酶(C4H)、4-肉桂酸辅酶A连接酶(4CL)以及茋合酶(STS)基因表达随着FeCl3浓度的增加而上调,具有明显的量效关系。图8
2.6 FeCl3溶液抑制了H-A途径脱氢抗坏血酸还原酶基因表达
FeCl3能诱导植物体ROS过氧化氢大量积累,引发氧化胁迫。当植物遭受逆境胁迫时抗氧化系统——H-A途径的适度调整可以有效阻止ROS的积累。为了控制ROS水平,植物体内ROS清除系统H-A途径中脱氢抗坏血酸循环中关键酶APX、MDAR活性都有所升高,而DHAR酶的表达量则随着FeCl3溶液浓度的升高而下调。图9
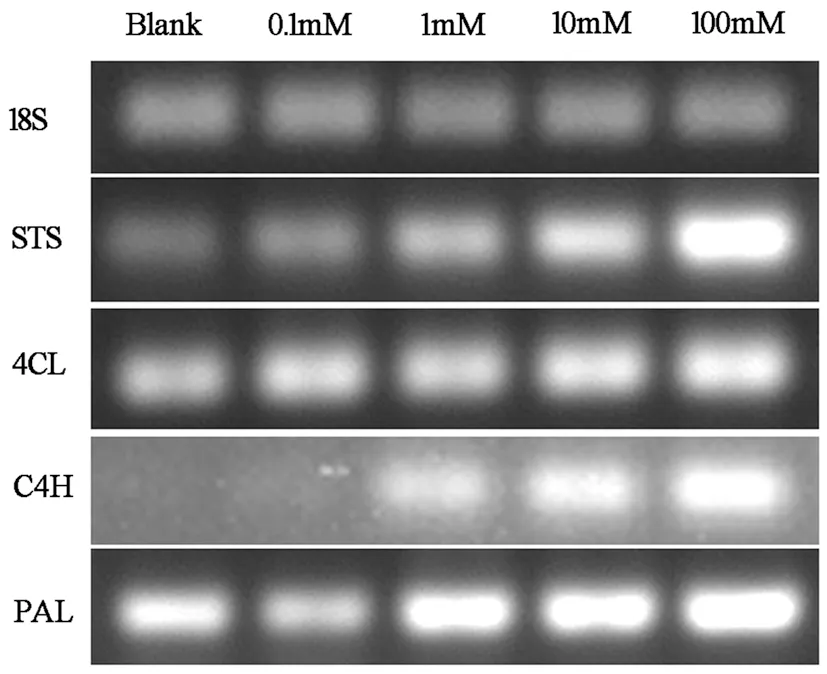
注:内参基因为18S rRNA,下同
Note: internal reference gene 18S rRNA, the same as below
图8 FeCl3胁迫下红地球葡萄叶片中茋类物质合成限速酶基因表达
Fig.8TheeffectofFeCl3treatmentonstilbenematerialsynthesisrate-limitingenzymesgeneexpressioningrapeleaf
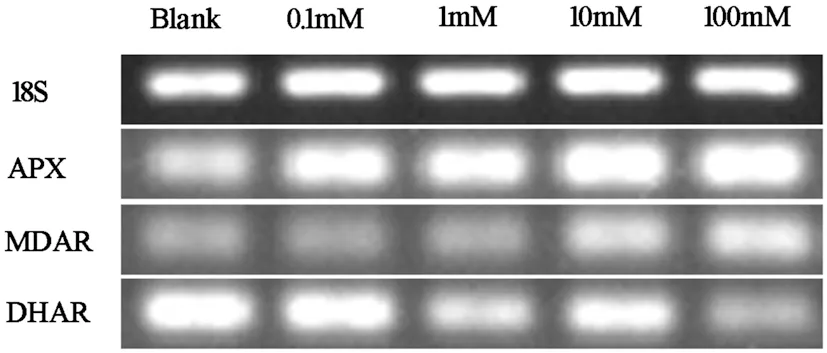
图9 RT-PCR测定FeCl3下红地球葡萄叶片Halliwell-Asada途径中相关酶基因表达(18 h)
Fig.9TheeffectofFeCl3onHalliwell-AsadapathwayenzymegeneexpressioninleavesofVitisviniferaL.cv.RedGlobefor18hourstreatmentbyRT-PCRanalysis
3 讨 论
铁是自然界分布最广泛的金属元素之一,在地壳中的质量约占5%左右,主要以氧化铁的形式存在,在环境中的单质铁很容易被自然氧化形成三价铁,三价铁容易在植物中间被吸收和转移。过高的铁会抑制植物的生长,并且带来一定的胁迫效应,这种胁迫效应会对植物细胞造成损伤。课题组前期研究发现,环境中氧化剂如过氧化氢、Al3+均能引起葡萄叶片白藜芦醇的积累,Fe3+也遵循这个规律[1]。通过Evans染色可以直观的看出FeCl3对葡萄叶片具有氧化损伤,这与王庆文等[18]结果相似。在逆境下,植物发生不同程度的膜脂过氧化,生成对细胞有毒的醛物质和大量的ROS,造成膜脂过氧化,对植物造成伤害。MDA是膜脂过氧化的产物,其含量可以代表损伤程度的大小[19],实验中MDA的含量随着FeCl3处理浓度的增加而升高,这与Evans染色结果一致。葡萄叶片中的ROS大量富集,由DAB染色定性研究ROS可以看出,FeCl3处理葡萄叶片后出现坏死斑,坏死斑所在区域积累过氧化氢,从而介导细胞程序性死亡以阻断生物或非生物因素的伤害,这与白权子等[20]的研究类似;定量检测葡萄叶片代谢所产生H2O2含量,发现它随着三氯化铁的处理浓度的增加而增加,说明其对叶片造成的氧化胁迫也越加严重。白藜芦醇(茋类物质)是一种植保素,它与植物抗病性具有密切的关系[21],李月荣等[1]发现氧化剂FeCl3溶液对葡萄愈伤组织茋类物质具有显著的诱导作用,白藜芦醇的诱导量先增加后降低,在18 h时达到最高 ,表现出一定的时效依赖关系。实验在此基础上用FeCl3溶液不同浓度处理红地球葡萄叶片后,白藜芦醇的积累在100 mmol/L时达到最高36.83 μg/g并且呈现显著的量效关系。这种结果可能的原因一方面是由于FeCl3本身就是氧化剂,能够对植物造成氧化胁迫;另一方面,有研究表明FeCl3是H-A途径抗坏血酸循环中DHAR的酶抑制剂,在一定范围内随着FeCl3浓度的增加,组织中ROS的水平升高引起氧化胁迫从而影响白藜芦醇的积累。研究则通过分析白藜芦醇合成途径相关基因、H-A途径脱氢抗坏血酸循环相关酶基因的表达规律确定H-A途径脱氢抗坏血酸循环与葡萄白藜芦醇积累可能具有偶联关系。
当植物体内ROS的动态平衡被打破时,植物体可自身提高抗氧化系统活力来平衡ROS代谢[22]。在FeCl3胁迫下植物抗氧化酶APX、MDAR和MDA的活性都有所升高,只有DHAR酶的表达量有所降低,原因和FeCl3是DHAR的酶抑制剂有关。白藜芦醇的合成来源于苯丙氨酸代谢途径,即在一般条件下合成途径是关闭的,只有当受到病原菌或各种诱发因子诱导后合成才被激活,茋类物质在受激部位含量显著增加。白藜芦醇通过植物苯丙氨酸代谢途径合成,需要PAL、C4H、4CL以及STS酶的催化[14]。FeCl3作用下该途径的关键酶PAL、C4H、4CL以及STS的基因表达量均明显上调,解释了白藜芦醇积累与H-A的关联。为了明晰这一系列现象的内在联系,实验加入抗氧化剂NAC、GSH-EE和助氧化剂H2O2加以针对FeCl3与ROS的积累正反验证。NAC是半胱氨酸的前体[23],能增加谷胱甘肽(GSH)含量;GSH-EE谷胱甘肽乙酯是谷胱甘肽酯化物,进入细胞后直接转换成为谷胱甘肽(GSH),能阻止细胞内总ROS的产生。研究表明,相比较用助氧化剂H2O2预处理后葡萄叶片损伤程度加重,白藜芦醇含量升高的结果,NAC和GSH-EE预处理组的损伤程度比单独用FeCl3处理的低。分别用NAC和GSH-EE做预处理后,白藜芦醇的含量积累也明显减少,说明NAC和GSH-EE有效的抑制了FeCl3对叶片造成的损伤,确认了白藜芦醇积累与H-A途径密切关联。
4 结 论
FeCl3单独处理葡萄叶片时会导致白藜芦醇的积累,在100 mM 时其含量达到36.83 μg/g,是空白组的44.87倍。加助氧化剂H2O2共处理组的白藜芦醇含量有所提高,是单独处理组的1.09倍;而加了抗氧化剂NAC和GSH-EE的共处理组白藜芦醇的含量则有所减少,分别为单独处理组的0.67和0.72倍。FeCl3溶液降低葡萄叶片H-A途径对ROS的清除能力,造成氧化胁迫并引起白藜芦醇积累。
References)
[1] 李月荣,李荣飞,张波, 等. FeCl3溶液诱导葡萄愈伤组织白藜芦醇积累及其与氧化应激的关系[J]. 新疆农业科学,2016,52(1):149-155.
LI Yue-rong, LI Rong-fei, ZHANG Bo, et al. (2016). The relationship between FeCl3-induced resveratrol accumulation and oxidative stress in grapevine callus [J].XinjiangAgriculturalScience, 52(1):149-155. (in Chinese)
[2] 李月荣,颜欢,张波, 等. 过氧化氢诱导不同色素水平葡萄愈伤组织白藜芦醇及白藜芦醇苷含量差异[J]. 北方园艺, 2015,(8):114-116.
LI Yue-rong, YAN Huan, ZHANG Bo, et al. (2015). The differences between resveratrol and piceid in grapevine callus responsed to the hydrogen peroxide treatment [J].NorthrenHorticulture, (8):114-116. (in Chinese )
[3] 韩晶晶,刘炜,毕玉平. 白藜芦醇的研究进展[J]. 生物工程学报,2008,(11):1 851-1 859.
HAN Jing-jing, LIU Wei, BI Yu-ping, (2008). Advances in resveratrol studies [J].ChineseJournalofBiotechnology, (11):1,851-1,859. (in Chinese )
[4] Hossain, M. A., & Asada, K. (1984). Purification of dehydroascorbate reductase from spinach and its characterization as a thiol enzyme.Plant&CellPhysiology, 39(1): 113.
[5] 朱启红,夏红霞. FeCl3对滴水观音抗氧化性的影响[J].山西农业科学,2012,40(2):110-112.
ZHU Qi-hong, XIA Hong-xia. (2012). Influence of FeCl3to oxidative stability of Alocasia macrorrhiza [J].JournalofShanxiAgriculturalSciences, 40(2): 110-112. (in Chinese )
[6] 郭景南,刘崇怀,潘兴,等.葡萄属植物白藜芦醇研究进展[J].果树学报,2002,(3):199-204.
GUO Jing-nan, LIU Chong-huai, PAN Xin, et al. (2002). Advances in research on resveratrol in Vitis spp. [J].JournalofFruitScience, (3):199-204. (in Chinese )
[7] Adrian, M., Jeandet, P., Bessis, R., & Joubert, J. M. (1996). Induction of phytoalexin (resveratrol) synthesis in grapevine leaves treated with aluminum chloride (alcl3).J.agric.foodChem, 44(8):1,979-1,981.
[8] Liu, J., Wang, X., Hu, Y., Hu, W., & Bi, Y. (2013). Glucose-6-phosphate dehydrogenase plays a pivotal role in tolerance to drought stress in soybean roots.PlantCellReports, 32(3): 415-429.
[9] Faoro, F., & Iriti, M. (2005). Cell death behind invisible symptoms: early diagnosis of ozone injury.BiologiaPlantarum, 49(4): 585-592.
[10] Meilitzerruppitsch, C., Vetterlein, M., Stangl, H., Maier, S., Neumüller, J., & Freissmuth, M., et al. (2008). Electron microscopic visualization of fluorescent signals in cellular compartments and organelles by means of dab-photoconversion.HistochemistryandCellBiology, 130(2): 407-419.
[11] Sutherland, M. W., & Deverall, B. J. (2010). The ubiquity of non-specific eliciting activity in intercellular washing fluids from rust-infected wheat leaves.PlantPathology, 39(1): 50-57.
[12] 田春芳,张波,刘景磊, 等. HPLC法测定离体葡萄叶中茋化物的含量[J]. 湖北农业科学, 2013, (10): 2 411-2 413, 2 419.
TIAN Chun-fang, ZHANG Bo, LIU Jing-lei, et al. (2013). Determination of the main stilbenes composition in detached grape leaves by HPLC [J].HubeiAgriculturalSciences, (10):2,411-2,413, 2,419. (in Chinese )
[13] 杨晓燕,张波,黄方爱,等.葡萄叶片中提取总RNA的三种方法比较[J].北方园艺,2013,281(2): 87-90.
YANG Xiao-yan, ZHANG Bo, HUANG Fang-ai, et al. (2013). Comparative study on three methods for the extraction of total RNA from grape leaves [J].NorthernHorticulture, 281(2): 87-90. (in Chinese )
[14]Lijavetzky D, Almagro L, Belchi-Navarro S, et al. (2008). Synergistic effect of methyliasmonate and cyclodextrin on stilbene biosynthesis pathway gene expression and resveratrol production in Monastrell grapevine cell cultures [J].BMCResearch.Notes, (1): 132-135.
[15] Ricardo, V., Francisca, P., Sebastián, R., & Pérez, F. J. (2012). Hypoxia induces h2o2production and activates antioxidant defence system in grapevine buds through mediation of h2o2and ethylene.JournalofExperimentalBotany, 63(11):4,123-4,131.
[16] Melino, V. J., Soole, K. L., & Ford, C. M. (2009). Ascorbate metabolism and the developmental demand for tartaric and oxalic acids in ripening grape berries.BMCPlantBiology, 9(1):145.
[17] 赵晓,马会勤,陈尚武, 等. 葡萄果实发育后期半定量RT-PCR内参基因的优选[J]. 中国农业大学学报,2010,(3):7-14.
ZHAO Xiao, MA Hui-qin, CHEN Shang-wu, et al. (2010). Internal reference gene selection for semi quantitative RT-PCR of genes in the second half of grape berry development [J].JournalofChinaAgriculturalUniversity, 15(3): 7-14. (in Chinese )
[18] 王庆文,冯汉青,戎富虎,等. 交替氧化酶对AlCl3胁迫下烟草BY-2悬浮细胞死亡发生的影响[J]. 兰州大学学报(自然科学版),2015,(4):564-568.
WANG Qing-wen, FENG Han-qing, RONG Fu-hu, et al. (2015). The effect of the alternative oxidase on cell death of the BY-2 tobacco suspension cells under AlCl3stress [J].JournalofLanzhouUniversity(NaturalSciences) , (4):564-568. (in Chinese )
[19] Wang, C., & Wang, X. (2000). Involvement of phospholipase d in wound-induced accumulation of jasmonic acid in arabidopsis.PlantCell, 12(11): 2,237-2,246.
[20] 白权子. OsBBM1重新沉默的表观机制探究和OsPIE1基因的功能探究[D]. 武汉:华中农业大学硕士学位论文,2015.
BAI Quan-zi. (2015).StudyofepigeneticmechanismsofOsBBM1resilienceandfunctionalanalysisofOsPIE1gene[D]. Master Thesis. Huazhong Agricultural University, Wuhan. (in Chinese )
[21] Pool, R. M., Creasy, L. L, & Frackelton, A. S. (1981). Resveratrol and the viniferins, their application to screening for disease resistance in grape breeding programs.Vitis, (20): 136-145.
[22] Mallick, S., Sinam, G., Kumar, M. R., & Sinha, S. (2010). Interactive effects of cr and fe treatments on plants growth, nutrition and oxidative status in zea mays L.Ecotoxicology&EnvironmentalSafety, 73(5): 987-995.
[23] Zafarullah, M., Li, W. Q., Sylvester, J., & Ahmad, M. (2003). Molecular mechanisms of n-acetylcysteine actions.Cellular&MolecularLifeSciences, 60(1): 6-20.
Abstract:【Objective】 FeCl3solution causes the accumulation of resveratrol, but the mechanism is not clear. Here we aim to study the relationship between the Halliwell-Asada (H-A) pathway and resveratrol accumulation from the perspective of damage protection.【Method】After FeCl3solution treatment of grape leaves, the degree of cell damage and the level of reactive oxygen species were detected, and the expression of resveratrol and H-A pathway related genes were analyzed.【Result】The results showed that the oxidative stress level of leaves treated with FeCl3solution were positively correlated with the damage of foliar tissue. A significant resveratrol accumulation was also observed. In addition, the maximum content of resveratrol reached 36.83 μg/g after treatment in a dose-dependant manner. The gene expression levels of resveratrol metabolic enzymes and key enzymes in H-A pathway were increased in FeCl3treatment, such as PAL, C4H, 4CL, STS, APX and MDAR except DHAR. Resveratrol contents in H2O2co-treatment were raised, contrary to co-treatments of antioxidant reagents NAC and GSH-EE.【Conclusion】FeCl3solution decreased ROS scavenging capability of H-A pathway, thus causing oxidative stress and leading to resveratrol accumulation in grapevine samples, which underlines a correlation between resveratrol metabolism and H-A pathway.
Keywords: resveratrol; foliar injury; H-A pathway; ROS accumulation;VitisviniferaL. cv. Red Globe
CouplingMechanismbetween-ResveratrolAccumulationInducedbyFeCl3SolutionandHalliwell-AsadaPathwayinGrapevine
DONG Jin-lei1, LI Yue-rong1, WANG Xiao-qin1,2, ZHANG Bo1,2
(1.CollegeofPharmacy,ShiheziUniversity.ShiheziXinjiang832002,China;2.KeyLaboratoryofXinjiangEndemicPhytomedicineResources,MinistryofEducation,CollegeofPharmacy,ShiheziUniversity,ShiheziXinjiang832002,China)
10.6048/j.issn.1001-4330.2017.09.018
S663
A
1001-4330(2017)09-1713-08
2017-02-21
国家自然科学基金项目“葡萄茋类物质积累与氧应激反应偶联机制研究”(31160058),新疆兵团重点领域科技攻关项目“葡萄废弃物中芪多酚的富集及抗肿瘤研究”(2014BA029)
董锦蕾(1990-),河南周口人,硕士研究生,研究方向为生物技术制药,(E-mail)1173057890@qq.com
张波(1978-),男,陕西宝鸡人,教授,研究方向为肿瘤药理及生物技术制药,(E-mail)Bozhang_lzu@126.com
Supported by: NSFC“Study on the reaction mechanism of coupling stilbene accumulation and oxidative stress in grape” ( 31160058),science and technology research projects in key fields of XPCC“Enrichment along with anti-tumor study of stilbene polyphenols in grape waste” ( 2014BA029)
Corresponding author:Zhang Bo (1978-), male, Shanxi Baoji, Professor, Research direction are tumor pharmacology and biotechnology pharmaceutical, (E-mail) Bozhang_lzu@126.com

