新疆部分地区牛源空肠弯曲菌分离鉴定及耐药性分析
代 婧,彭 斌,雷程红,阿热阿依·海依拉提
(新疆农业大学动物医学学院,乌鲁木齐 830052)
新疆部分地区牛源空肠弯曲菌分离鉴定及耐药性分析
代 婧,彭 斌,雷程红,阿热阿依·海依拉提
(新疆农业大学动物医学学院,乌鲁木齐 830052)
目的研究新疆部分地区牛空肠弯曲菌污染及耐药性。方法从乌鲁木齐、昌吉、石河子3个地区共采集牛肛拭子171份。用布氏肉汤初步增菌后,用改良CCD琼脂基础和哥伦比亚血平板2种选择培养基培养,用聚合酶链式反应(PCR)鉴定,最后参照2010年美国临床实验室标准化研究所(CLSI)推荐使用的琼脂扩散法进行药敏试验。结果从乌鲁木齐牛场肛拭子分离鉴定到1株空肠弯曲菌(编号为N22),检出率为1.11%(1/90);昌吉牛场肛拭子分离鉴定到1株空肠弯曲菌(编号为C25),检出率为3.33%(1/30)。石河子牛场肛拭子没有分离到空肠弯曲菌。2株空肠弯曲菌对单环β内酰胺类、氨基糖苷类抗生素高度敏感;对喹诺酮类抗菌药物、大环内酯类和大部分头孢菌素类抗生素产生了不同程度的耐药。结论新疆牛群存在空肠弯曲菌的感染,感染菌株可用单环β-内酰胺类、氨基糖苷类抗生素进行防治。研究结果可为评价新疆牛群空肠弯曲菌的流行状况和制定防控措施提供科学依据。
空肠弯曲菌;PCR;分离鉴定;耐药性检测
0 引 言
【研究意义】空肠弯曲菌(Campylobacter jejuni)是一种重要病原菌,是可以引起细菌性腹泻的革兰氏阴性菌,通常为弧形、螺旋形、海鸥展翅形或S形[1-2],是世界范围内一种重要的人畜共患病性病原细菌[3],该菌不仅可引起人畜腹泻、还可引起发烧和腹部绞痛、急性肠炎[4],严重时可引发肝炎等严重的并发症。对新疆地区牛源空肠弯曲菌流行情况和耐药性进行调研,为及时监测和防治该病的爆发以及用药方案提供依据。【前人研究进展】我国目前没有将空肠弯曲菌列入监测范围,虽然将此病列为法定丙类传染病之一,但是对空肠弯曲菌的研究也没有发达国家深入[5]。虽然在牛、猪等家畜体内可分离到此菌,但是该菌主要存在于家禽、野禽空肠内,因此,鸡源空肠弯曲菌的分离率最高可达100%[6]。该菌通过带菌动物或患病者的粪便进入环境中,也可通过分娩或排泄物污染食物和饮水,在外环境中以一种“活的非可培养状态”状态(viable but non-culturable)生存,即VBNC 状态。处于此状态的空肠弯曲菌在一定的条件下可以复苏并使人畜患病。人感染空肠弯曲菌的原因主要是食入被污染的肉制品、奶制品,或与宠物的接触[7]。发展中国家的空肠弯曲菌流行情况与国外不同。在发展中国家,此前导致腹泻的常见病原菌是沙门氏菌和志贺菌,但近年来空肠弯曲菌的感染率已超过这两种病原菌,因此,空肠弯曲菌被认为是主要的食源性致病菌之一[8]。在发达国家中,空肠弯曲菌的感染率仅低于这两种病原菌。空肠弯曲菌的培养条件苛刻,需在微需氧环境下(N2:85%,CO2:10%,O2:5%),42℃培养48 h。其在25℃时不能生长。42℃生长良好[9]。【本研究切入点】现有文献资料尚无新疆牛源空肠弯曲菌的分离鉴定。对新疆部分地区牛源肛拭子进行空肠弯曲菌的分离鉴定和耐药性分析,研究其流行传播规律及制定用药方案。【拟解决的关键问题】研究调查新疆部分地区牛源空肠弯曲菌流行情况,为相关部门对该病的监测及用药提供科学依据。
1 材料与方法
1.1 材 料
1.1.1 主要试剂
布氏肉汤,改良CCD琼脂基础(CCDA)、弯曲菌分离琼脂添加剂(头孢哌酮、两性霉素B、利福平)、哥伦比亚血平板均购自青岛日水生物技术有限公司网络销售分公司;P-49头孢哌酮、Cary-Blair氏运送培养基均购自北京陆桥技术有限责任公司;MH(B)培养基、琼脂粉购自北京奥博星生物技术有限责任公司。革兰氏染色及PCR相关试剂(mix、灭菌dd H2O、2000Marker)均购自北京鼎国昌盛生物技术有限责任公司;引物购自生工生物工程(上海)股份有限公司;空肠弯曲菌标准菌株(ATCC33291)购自上海复祥生物科技有限公司。
1.1.2 主要仪器
超净工作台;Mastercycler nexus X1 PCR仪(Eppendorf);GelDoc XR System凝胶成像系统(Bio-rad伯乐公司)。DYY-6C型电泳仪(北京市六一仪器厂)。
1.2 方 法
1.2.1 样品采集
从乌鲁木齐市、昌吉市、石河子市共采集牛肛拭子171份,放入Cary-Blair氏运送培养基,24 h内对其进行分离培养。其中乌鲁木齐采集了90份(N1~N90)、昌吉市采集了30份(C1~C30)、石河子采集了51份(S1~S51)。
1.2.2 引物设计
根据参考文献[10]选用16S rDNA片段,引物序列见表1。
表1 引物序列
Table 1 Primer sequences

基因Genes引物序列(5’→3’)Primersequences退火温度(℃)Annealingtemperature片段长度(bp)Fragmentsize16SrDNAF:AATCACTGGGCGTAAAGGR:CGGTATTGCGTCTCATTGTAT59711
1.2.3 细菌培养
每个EP管分装500 μL灭菌生理盐水,将牛肛拭子从运送培养基中取出,放入EP管中。浸透20 min,每隔5 min震荡一次,将浸液加至含 9.5 mL布氏肉汤的摇菌管中,置微需氧培养罐中,42℃培养4 h后每个摇菌管添加20 μL 30 mg/L头孢哌酮溶液,置微需氧培养罐中,42℃培养48 h±4 h。
1.2.4 选择性培养
用接种环蘸取布氏肉汤增菌液并用划线法接种于改良CCD琼脂基础(每100 mL CCD琼脂基础添加一支弯曲菌分离琼脂添加剂),置微需氧培养罐中,42℃培养48 h。
挑取改良CCD琼脂基础上灰白色,扁平,湿润,沿划线生长的可疑单菌落接种于哥伦比亚血平板,微需氧环境下,42℃培养48 h。
1.2.5 PCR鉴定
模板的制备:每个摇菌管分装10 mL布氏肉汤,挑取哥伦比亚血平板上可疑单菌落接种至摇菌管中,微需氧条件下42℃培养48 h,吸取500 μL布氏肉汤增菌液至1.5 mL EP管中,8 000 r/min 离心5 min,弃上清,加100 μL灭菌dd H2O震荡重悬,隔水煮沸10 min后立即置于冰盒。10 min后8 000 r/min离心3 min,取上清PCR或者置-20℃保存。PCR反应体系为25 μL:11 μL Mix,10 μL灭菌ddH20,上下游引物各1 μL,模板2 μL) 。循环参数为:95 ℃预变性5 min,95℃变性30 s,59℃退火45 s,72℃延伸45 s,35个循环后72 ℃延伸10 min。1%琼脂糖凝胶,7 μL PCR产物加样,130 V电压电泳20 min,凝胶成像系统拍照。并将PCR产物送于生工生物工程(上海)股份有限公司测序。
1.2.6 药敏试验
试验对分离的2株牛源空肠弯曲菌进行了6大类17 种药物进行耐药性检测。参照2010年美国临床实验室标准化研究所(CLSI)推荐使用的琼脂扩散法进行药敏试验[11]。青霉素类:氨苄西林(AMP)、哌拉西林(PIP);头孢菌素类:头孢呋辛(FRX)、头孢噻吩(CEP)、头孢哌酮(CFP)、头孢他啶(CAZ)、头孢曲松(CTRX)、头孢西叮(FOX)、头孢唑啉(CZO)、头孢吡肟(FEP)、头孢噻肟(CTX);单环β内酰胺类:氨曲南(AZT);氨基糖苷类:链霉素(STR)、妥布霉素(TOB)、卡那霉素(KAN);喹诺酮类:氧氟沙星(OFLX);大环内酯类:麦迪霉素(MID)。配制MH培养基,高压蒸汽灭菌锅高压20 min(121℃,100 kPa)。放置60℃水浴锅20 min,在超净台内倒板,将100 μL在625 nm处吸光度值为0.08~0.10的弯曲菌培养液均匀涂布于MH琼脂平板上,取药敏片贴到培养基表面。将培养皿放入微需氧培养罐,42℃温箱培养24 h后观察结果。
2 结果与分析
2.1 PCR鉴定结果
经过改良CCD琼脂基础和哥伦比亚血琼脂的鉴别培养,对得到的可疑菌进行16S rDNA的特异性PCR扩增,在711 bp得到两条单一条带,PCR产物测序结果经NCBI (National Center for Biotechnology Information)比对,表明2株分离菌与空肠弯曲菌YH002(ID: CP020776.1)同源性达到100%,确定2株分离菌为空肠弯曲菌。从乌鲁木齐牛场肛拭子分离鉴定到1株空肠弯曲菌(编号为N22)检出率为1.11%;从昌吉市牛场肛拭子中分离鉴定到1株空肠弯曲菌(编号为C25),检出率为3.33%,从石河子市牛源肛拭子中没有分离到空肠弯曲菌。图1~3

图1 空肠弯曲菌在改良CCD琼脂基础菌落形态
Fig.1 Colonies of Campylobacter jejuni on improved CCD agar base
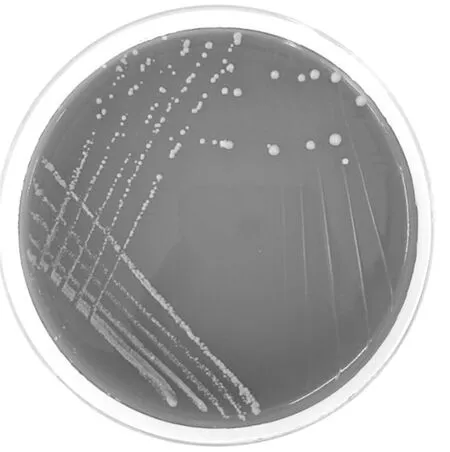
图2 空肠弯曲菌在哥伦比亚血平菌落形态
Fig.2 Colonies of Campylobacter jejuni on Colombian blood plate
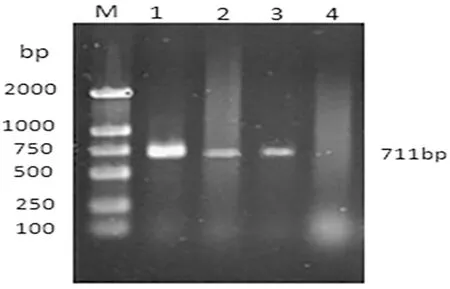
注:M,DL2000 DNA Marker;1,标准阳性菌株;2,N22;3,C25,4,阴性对照
Note: M,DL2000 DNA Marker;1,Positive control strain;2,N22;3,C25;4,Negative control
图3 16S rDNA基因扩增部分结果
Fig.3 The part of PCR amplification results of 16S rDNA gene
2.2 药敏试验结果
分别测量各纸片抑菌环直径(mm)(如图4),按照CLSI判定标准分别判为耐药(R)、中敏(I)或高敏(S)。
从乌鲁木齐牛场肛拭子分离到的1株空肠弯曲菌对氨基糖苷类的链霉素、妥布霉素及小部分头孢哌酮抗生素较为敏感;对青霉素类、单环β内酰胺类、氨基糖苷类的卡那霉素高度敏感;对喹诺酮类抗菌药物、大环内酯类和大部分头孢菌素类抗生素产生了不同程度的耐药。从昌吉牛场肛拭子分离到的1株空肠弯曲菌对青霉素类、氨基糖苷类的妥布霉素和卡那霉素及小部分头孢哌酮抗生素较为敏感;对单环β内酰胺类、氨基糖苷类的链霉素高度敏感;对喹诺酮类抗菌药物、大环内酯类和大部分头孢菌素类抗生素产生了不同程度的耐药。结果显示,两个地区分离到2株空肠弯曲菌对单环β内酰胺类、氨基糖苷类抗生素高度敏感;对喹诺酮类抗菌药物、大环内酯类和大部分头孢菌素类抗生素产生了不同程度的耐药。表2
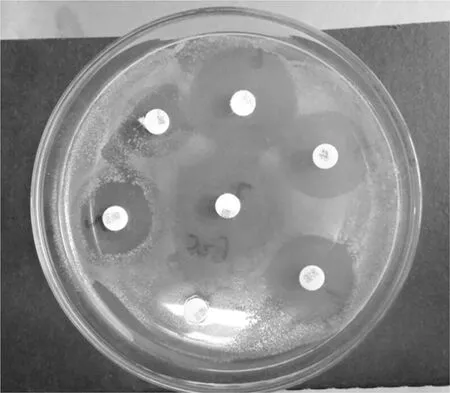
图4 药敏试验抑菌圈直径
Fig.4 The diameter of inhibition zone in drug susceptibility test
表2 药敏试验结果
Table 2 The results ofdrug susceptibility test
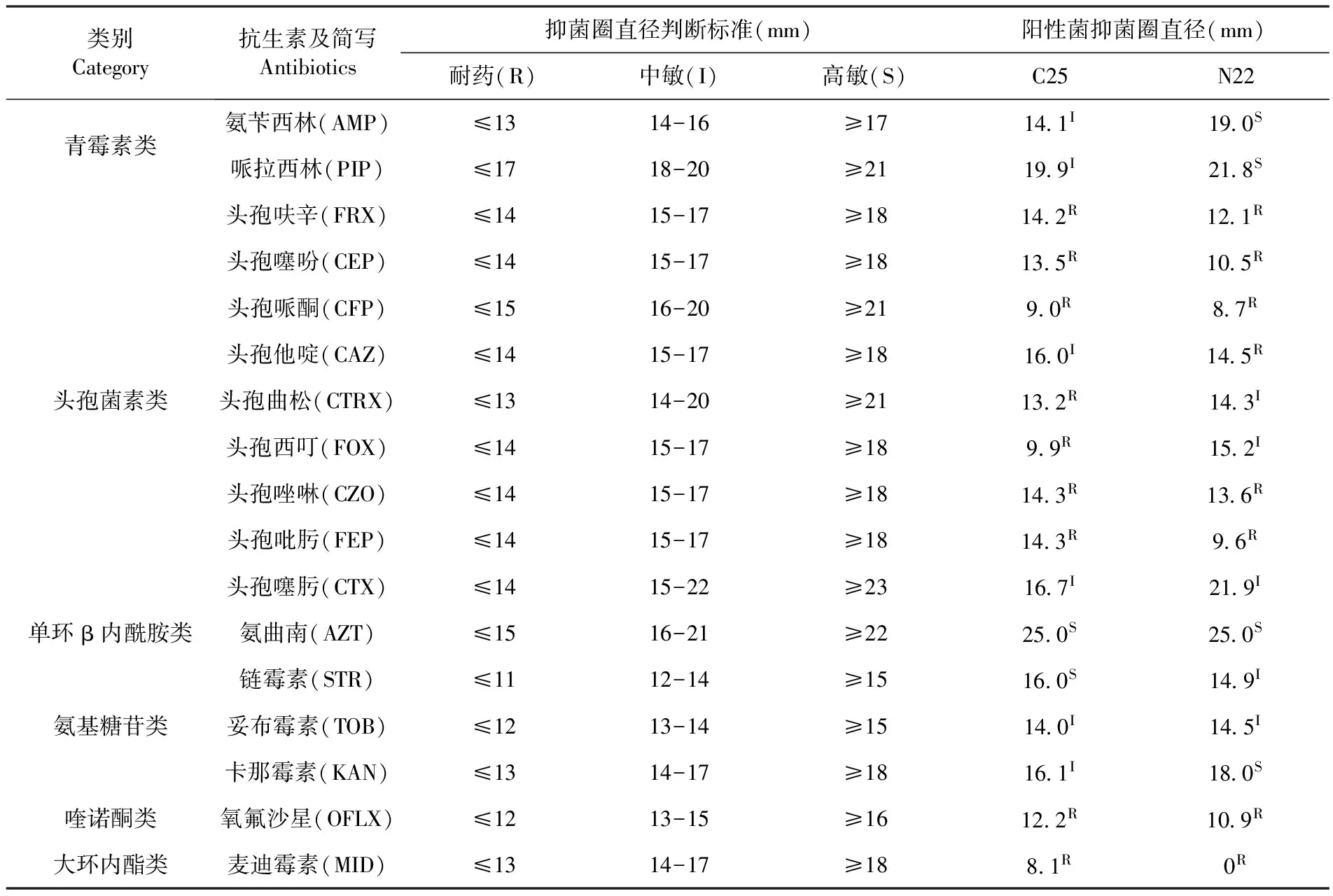
类别Category抗生素及简写Antibiotics抑菌圈直径判断标准(mm)阳性菌抑菌圈直径(mm)耐药(R)中敏(I)高敏(S)C25N22青霉素类氨苄西林(AMP)≤1314-16≥1714 1I19 0S哌拉西林(PIP)≤1718-20≥2119 9I21 8S头孢菌素类头孢呋辛(FRX)≤1415-17≥1814 2R12 1R头孢噻吩(CEP)≤1415-17≥1813 5R10 5R头孢哌酮(CFP)≤1516-20≥219 0R8 7R头孢他啶(CAZ)≤1415-17≥1816 0I14 5R头孢曲松(CTRX)≤1314-20≥2113 2R14 3I头孢西叮(FOX)≤1415-17≥189 9R15 2I头孢唑啉(CZO)≤1415-17≥1814 3R13 6R头孢吡肟(FEP)≤1415-17≥1814 3R9 6R头孢噻肟(CTX)≤1415-22≥2316 7I21 9I单环β内酰胺类氨曲南(AZT)≤1516-21≥2225 0S25 0S氨基糖苷类链霉素(STR)≤1112-14≥1516 0S14 9I妥布霉素(TOB)≤1213-14≥1514 0I14 5I卡那霉素(KAN)≤1314-17≥1816 1I18 0S喹诺酮类氧氟沙星(OFLX)≤1213-15≥1612 2R10 9R大环内酯类麦迪霉素(MID)≤1314-17≥188 1R0R
3 讨 论
牛肉是我国居民消费量比较大的肉类,在西方发达国家,常有因为食用未彻底灭菌的牛奶和牛肉而引起空肠弯曲菌感染的案例,美国威斯康辛州在2001年爆发空肠弯曲病,原因是人们认为生牛奶及未全熟的牛肉的口感和营养价值更高。我国居民饮用生牛奶及牛肉的很少,因此,空肠弯曲菌的发病率很低[12]。但是近年来,发展中国家的感染率呈上升趋势,如尼日利亚,1984年到1994年10年间,腹泻儿童中弯曲菌感染率为从5.2%增至16.5%[13]。国内报道幼儿园健康儿童空肠弯曲菌带菌率为2.92%~3.8%[14]。
实验中,乌鲁木齐牛源肛拭子的采集时间在10月,空肠弯曲菌的检出率为1.11%;昌吉牛场肛拭子的采集时间在6~7月,空肠弯曲菌的检出率为3.33%。石河子牛场肛拭子的采集时间在12月,没有分离到空肠弯曲菌。黄金林等[15]检测了不同地区30个鸡群空肠弯曲杆菌流行情况,结果表明,鸡群中普遍感染空肠弯曲菌,但不同地区的鸡场感染率差别较大。该病流行的季节性不一,有研究表明温暖季节阳性率较寒冷季节高,倾向于 7~9月最高。吴光先(1990)于不同季节宰杀鸡时采取其盲肠内容物分离该菌,其中春季检出率最高达到63.9%,冬季为检出率低至54.8%[16]。因此,乌鲁木齐牛场与昌吉牛场不同的空肠弯曲菌检出率可能是由于空肠弯曲菌感染率春夏季高、秋冬季低[14]与地区不同两方面因素导致。
张弓等[17]对从鹅体内分离到的54 株空肠弯曲菌及从鸭子体内分离到的36 株空肠弯曲菌进行8大类20种抗生素药敏试验,结果表明,鹅源与鸭源空肠弯曲菌分离株对青霉素G、部分头孢菌素类、喹诺酮类、磺胺类和四环素类抗生素产生了较强的耐药性。吴忠亮[18]对133 株不同来源的空肠弯曲菌药敏实验结果表明,空肠弯曲菌对氨基糖苷类、大环内脂类抗生素较为敏感,对喹诺酮类、磺胺类、四环素类和大部分头孢菌素类抗生素产生了耐药性。谢永强等[19]对广州地区2010~2014年4年间2 088例腹泻患儿粪便标本中共检出154株空肠弯曲菌,该地区儿童感染空肠弯曲菌对氨基糖苷类药物敏感。侯凤琴等[20]对200株空肠弯曲菌检测30种抗生素敏感性,研究结果显示该菌对氨基糖苷类、氯霉素尚没有耐药菌株。研究结果表明,两个地区分离到的空肠弯曲菌对单环β内酰胺类、氨基糖苷类抗生素高度敏感,对喹诺酮类抗菌药物、大环内酯类、大部分头孢菌素类抗生素产生了耐药,与大量研究结果基本一致。
4 结 论
从乌鲁木齐牛源肛拭子中分离鉴定到1株阳性菌(编号为N22),检出率为1.11%;从昌吉牛场分离鉴定到1株阳性菌(编号为C25),检出率为3.33%,石河子牛场没有分离到空肠弯曲菌。两个地区分离到的空肠弯曲菌对单环β内酰胺类、氨基糖苷类抗生素高度敏感;对喹诺酮类、大环内酯类和大部分头孢菌素类抗生素产生了不同程度的耐药。需做好空肠弯曲菌污染情况的调查,并合理指导各地防治空肠弯曲菌病用药方案,提高公共卫生安全。
References)
[1] 翟海华. 青岛地区鸡源空肠弯曲菌流行病学、ERIC-PCR分型及毒力基因研究[D].泰安:山东农业大学硕士学位论文,2014.
ZHAI Hai-hua. (2014).Epidemiology,ERIC-PCRtypingandvirulencegenesofCampylobacterjejuniinchickenfarmsinQingdao[D]. Master Thesis. Shandong Agricultural University, Taian. (in Chinese)
[2]翟海华,王娟,王君伟,等. 空肠弯曲菌的致病性及致病机制研究进展[J]. 动物医学进展,2013,(12):164-169.
ZHAI Hai-hua, WANG Juan, WANG Jun-wei, et al. (2013). Pathogenicity and Pathogenesis of Campylobacter jejuni [J].AdvancesinAnimalMedicine, (12): 164-169. (in Chinese)
[3]Altekruse, S. F., Stern, N. J., Fields, P. I., & Swerdlow, D. L. (1999). Campylobacter jejuni-an emerging foodborne pathogen.EmergingInfectiousDiseases, 5(1): 28-35.
[4]Allos, B. M. (2001). Campylobacter jejuni infections: update on emerging issues and trends.ClinicalInfectiousDiseases, 32(8): 1,201.
[5]许紫建. 猪、鸡弯曲菌的分离鉴定和耐药性分析及空肠弯曲菌LAMP检测方法的研究[D].保定:河北农业大学硕士学位论文,2013.
XU Zi-jian. (2013).AnalysisofIsolationandIdentificationofCandidaspp.AndAnalysisofDrugResistanceandLAMPDetectionMethodofCampylobacterjejuni[D]. Master Thesis. Hebei Agricultural University,Baoding. (in Chinese)
[6]朱冬梅.肉鸡屠宰过程中弯曲菌的分离鉴定、耐药性及PFGE分析[D].成都:四川农业大学硕士学位论文,2014.
ZHU Dong-mei. (2014).Isolation,identificationanddrugresistanceofPFMinbroilerslaughteringprocess[D]. Master Thesis. Sichuan Agricultural University,Chengdu. (in Chinese)
[7]郑扬云.食品中空肠弯曲菌的污染分布规律及遗传多样性研究[D].广州:广东工业大学硕士学位论文,2013.
ZHENG Yang-yun.(2013).StudyontheDistributionLawandGeneticDiversityofCampylobacterjejuniinFood[D]. Master Thesis. Guangdong University of Technology, Guangzhou. (in Chinese)
[8]刘夏阳.弯曲菌的分离培养及分型分析[D].北京:中国疾病预防控制中心硕士学位论文,2014.
LIU Xia-yang. (2014).IsolationandcultureofCampylobacteranditstypinganalysis[D]. Master Thesis.China Center for Disease Control and Prevention, Beijing. (in Chinese)
[9]Vanniasinkam, T., Lanser, J. A., & Barton, M. D. (1999). Pcr for the detection of campylobacter spp. in clinical specimens.LettersinAppliedMicrobiology, 28(1): 52-56.
[10]韩新锋,刘书亮,张晓利,等.鸡肉空肠弯曲杆菌的分离鉴定及耐药性分析[J]. 中国人兽共患病学报,2012,(1):31-36.
HAN Xin-feng, LIU Shu-liang, ZHANG Xiao-li, et al. (2012). Isolation and identification of Campylobacter jejuni in chicken and analysis of drug resistance [J].ChineseJournalofZoology, (1):31-36. (in Chinese)
[11]Cockerill, F. R. (2010).Performancestandardsforantimicrobialsusceptibilitytesting:twentiethinformationalsupplement.Performancestandardsforantimicrobialsusceptibilitytesting:twenty-thirdinformationalsupplement. Clinical and Laboratory Standards Institute.
[12]Headrick ML, Korancy S, Bean NH, et al. (1998). Profile of raw milk-associated food borne disease outbreaks reported in the United States, 1973 through 1992.Americanjournalofpublichealth, 88(8):1,219-1,221.
[13]吴蜀豫,张立实,冉陆. 弯曲菌及弯曲菌病的流行现状[J]. 中国食品卫生杂志,2004,(1):58-61.
WU Shu-yu, ZHANG Li-shi, RAN Lu. (2004). The prevalence of Campylobacter and Campylobacter disease [J].ChineseJournalofFoodHygiene, (1):58-61. (in Chinese)
[14]陈志新,吕德生,万绍平, 等. 儿童空肠弯曲菌感染的流行病学研究[J]. 中华预防医学杂志,1995,(3):144-146.
CHEN Zhi-xin, LÜ De-sheng,WAN Shao-ping, et al.(1995). Epidemiological study of Campylobacter jejuni infection in children [J].ChineseJournalofPreventiveMedicine, (3):144-146. (in Chinese)
[15]黄金林,许海燕,郑国军,等. 部分省市鸡群空肠弯曲菌和结肠弯曲菌的流行状况分析[J]. 中国预防兽医学报,2008,(1):72-75.
HUANG Jin-lin, XU Hai-yan, ZHENG Guo-jun, et al.(2008). Analysis of epidemic situation of Campylobacter jejuni and Campylobacter jejuni in some provinces and cities [J].JournalofPreventiveVeterinaryMedicine, (1):72-75. (in Chinese)
[16]吴光先. 不同季节鸡、猪肠道中嗜热弯曲菌群携带状况的调查[J]. 中国人兽共患病杂志,1990,(3):44.
WU Guang-xian.(1990) Investigation on the carrying status of thermophilic benthic strains in chickens and pigs in different seasons [J] .ChineseJournalofZoonoses, (3):44. (in Chinese)
[17]张弓. 水禽空肠弯曲菌流行病学及分离株的多位点序列分型分析[D]. 扬州: 扬州大学硕士学位论文,2010.
ZHANG Gong. (2010).EpidemiologyofCampylobacterjejuniinwaterfowlandanalysisofmulti-locussequenceofisolates[D]. Master Thesis. Yangzhou University,Yangzhou. (in Chinese)
[18]吴忠亮. 空肠弯曲杆菌感染分布研究[D]. 上海:上海交通大学硕士学位论文,2007.
WU Zhong-liang. (2007).DistributionofCampylobacterjejuniinfection[D]. Master Thesis. Shanghai Jiaotong University, Shjanghai. (in Chinese)
[19]谢永强,钟华敏,虢艳,等.广州地区儿童空肠弯曲菌感染的检测与分析[J]. 国际检验医学杂志,2016,(17):2 448-2 450.
XIE Yong-qiang, ZHONG Hua-min, GUO Yan, et al. (2016). Detection and analysis of Campylobacter jejuni infection in children in Guangzhou [J].JournalofInternationalJournalofLaboratoryMedicine, (17):2,448-2,450. (in Chinese)
[20]侯凤琴,沈宝铨,孙新婷. 200株空肠弯曲菌对30种抗生素敏感性研究[J]. 医师进修杂志,2001,(3):39-40.
HOU Feng-qin, SHEN Bao-quan, SUN Xin-ting. (2001). Study on the susceptibility of 200 strains of Campylobacter jejuni to 30 antibiotics [J].JournalofPhysicianTraining, (3):39-40.(in Chinese)
Abstract:【Objective】 To study the prevalence of campylobacter jejuni from cattle in partial areas of Xinjiang and its drug resistance.【Method】In this experiment, 171 fecal samples were collected from cattle in Urumqi, Changji and Shihezi. After the initial enrichment of Brucella broth, the culture medium was cultured with two improved media, namely, the improved CCD agar base and the Columbia blood plate, and finally identified by polymerase chain reaction (PCR). Finally, the agar diffusion method recommended by the United States Clinical Laboratory Standardization Institute (CLSI) in 2010 was used for drug susceptibility test.【Result】A strain of Campylobacter jejuni (No. N22) was isolated from the Urumqi cattle farm and the detection rate was 1.11%(1/90). A strain of Campylobacter jejuni (No.C25) was identified from Changji cattle farmand the detection rate was 3.33%(1/30).There were no strains of Campylobacter jejuni isolated from Shihezi cattle farm. 2 strains of Campylobacter jejuni were highly sensitive to monocyclic beta lactam and aminoglycoside antibiotics,and showing different degrees ofresistenceto quinolones, macrolides and most of the cephalosporins antibiotics.【Conclusion】The infection of campylobacter jejuni was found from cattle in Xinjiang, and the infection strains could be used to prevent and cure with monobactam and aminoglycoside antibiotics. The results can provide a scientific basis for the evaluation of the prevalence of campylobacter jejuni and the prevention and control measures in Xinjiang cattle herds.
Keywords: campylobacter jejuni; PCR; isolation and identification; drug resistance test
Isolation,IdentificationandDrugResistanceDetectionofCampylobacterJejunifromCattleinPartialAreasofXinjiang
DAI Jing, PENG Bin, LEI Chen-hong, Aray Hayrat
(CollegeofVeterinaryMedicine,XinjiangAgriculturalUniversity,Urumqi830052,China)
10.6048/j.issn.1001-4330.2017.09.020
S85
A
1001-4330(2017)09-1730-07
2017-04-25
新疆维吾尔自治区自然科学基金项目“新疆牛源弯曲菌污染分布规律及分离株遗传多样性研究”(2015211A021)
代婧(1993-),女,新疆石河子人,硕士研究生,研究方向为畜产品质量安全,(E-mail)1730220547@qq.com
彭斌(1976-),男,四川资中人,讲师,硕士,研究方向为畜产品质量安全,(E-mail)pengbinwho@163.com 雷程红(1967-),女,安徽六安人,副教授,博士,研究方向为兽医免疫学,(E-mail)leichxjnd@aliyun.com
Supported by: Natural Science Foundation of Xinjiang "Study of the Distribution Regularity and Genetic Diversity of Campylobacter from Cattle in Xinjiang"(2015211A021)
Corresponding author:PENG Bin (1976-), male, native place: Zizhong, Sichuan, lecturer, master's degree, research field: Quality and safety of animal products. (E-mail) pengbinwho@163.com LEI Chen-hong (1967-), female, native place: Liuan, Anhui, Associate Professor, Ph.D., research field: Veterinary immunology, (E-mail) leichxjnd@aliyun.com

