山仙颗粒对Lewis肺癌荷瘤小鼠抗肿瘤免疫力及外周血中IFN-γ、TNF-β、IL-10的影响①
方 艳 张朝玉 应小平 潘艳芳 焦佩娟
(陕西中医药大学,咸阳 712046)
·中医中药与免疫·
山仙颗粒对Lewis肺癌荷瘤小鼠抗肿瘤免疫力及外周血中IFN-γ、TNF-β、IL-10的影响①
方 艳 张朝玉 应小平 潘艳芳 焦佩娟
(陕西中医药大学,咸阳 712046)
目的观察山仙颗粒对Lewis肺癌细胞增殖的影响及对Lewis肺癌荷瘤小鼠抗肿瘤免疫力及免疫微环境的影响,以探究山仙颗粒抑瘤及提高机体抗肿瘤免疫力的分子机制,为其临床应用提供深层次的理论依据。方法腋下皮肤移植Lewis肺癌细胞建立小鼠荷瘤模型,分为空白组、模型组、化疗组和山仙颗粒组;通过对Lewis肺癌荷瘤小鼠肿瘤组织称重并计算抑瘤率,采用免疫组织化学法检测脾脏组织中淋巴细胞CD、CD8表达情况,采用CCK-8法检测淋巴细胞对Lewis肺癌细胞增殖的影响,采用ELISA 法检测外周血中IFN-γ、TNF -β与IL-10的变化。结果①山仙颗粒组对Lewis肺癌的抑瘤率为45.99%,显著高于化疗组(P<0.05);②小鼠淋巴细胞可抑制Lewis肺癌细胞的增殖,并与淋巴细胞浓度和作用时间呈正相关;且脾脏组织中CD4+T细胞、CD4+/CD8+比值及淋巴细胞对Lewis肺癌细胞的抑制率,模型组和化疗组显著低于空白组(P<0.05),山仙颗粒组显著高于模型组和化疗组(P<0.05),而山仙颗粒组与空白组比较无显著差异(P>0.05);③模型组和化疗组小鼠外周血中的IFN-γ和TNF-β显著低于空白组(P<0.05)、而IL-10显著高于空白组(P<0.05),山仙颗粒组小鼠外周血中的IFN-γ、TNF-β显著高于模型组和化疗组(P<0.05),而IL-10显著低于模型组与化疗组(P<0.05);山仙颗粒组小鼠外周血中的IFN-γ、TNF-β、IL-10与空白组比较无明显差异(P>0.05)。结论山仙颗粒能明显抑制Lewis肺癌荷瘤小鼠肿瘤组织的生长,并具有提高小鼠脾脏指数、增强T淋巴细胞活性、使外周血中的IFN-γ、TNF-β上调而IL-10下调,提示山仙颗粒的抗肿瘤作用可能通过调节CD4+T 淋巴细胞含量、CD4+/CD8+、Th1/Th2比值,恢复肿瘤患者免疫功能稳态,提高机体免疫力、加强免疫监视功能有关。
山仙颗粒;Lewis肺癌细胞;T淋巴细胞;IFN-γ;TNF-β;IL-10
1 材料与方法
1.1材料
1.1.1实验动物及瘤细胞株 健康SPF级昆明小鼠48只,雌雄各半,4~5周龄,体重18~22 g(西安交通大学实验动物中心提供,SCXK-2015-005)。Lewis肺癌细胞株(LLC),购于赛齐(上海)生物工程有限公司。
1.1.2药品与试剂 山仙颗粒(SXG),陕西中医药大学附属医院制剂中心(生产批号150328),顺铂注射液。主要试剂:Hyclone DMEM 糖培养液,CD4、CD8、兔抗鼠多克隆抗体(武汉博士德生物工程有限公司);ELISA 试剂盒(武汉新启迪生物科技有限公司);CCK-8细胞增殖-细胞毒性检测试剂盒(上海 BestBio 贝博生物)。
1.1.3主要仪器 二氧化碳培养箱(德国BindCD-150),超净工作台(苏州净化),倒置显微镜(奥特 BDS-200),普通石蜡切片机(A0-800型,上海医疗器械厂),全自动酶标仪(美国Bio-Tek ELX808IU)等。
1.2方法
1.2.1制备LLC细胞悬液 将LLC细胞体外培养扩增,取对数生长期的肿瘤细胞,制备1×108个/ml的瘤细胞混悬液。
1.2.2小鼠荷瘤模型的建立及分组 选取健康BALB/c小鼠48只,雌雄各半,4~5周龄,体重18~22 g,适应性饲养一周后,编号,按体重指数随机、雌雄各半,选取12只,为空白组,于小鼠右前肢腋窝皮下注射0.4 ml生理盐水。其余36只进行造模,将制备的LLC细胞悬液0.2 ml(约2×107个瘤细胞)接种于小鼠右前肢腋窝皮下,三天后检查成瘤情况并测量,待肿瘤直径约为5 mm时(约第5天),然后按肿瘤大小指数、雌雄各半平均分为三组,每组12只,分别为模型组、化疗组、山仙颗粒组。
1.2.3药液制备 根据人、鼠体重计量换算法计算,将SXG用生理盐水按SXG(g)∶生理盐水(ml)=1∶20配置成SXG混悬液(0.05 g/ml),4℃冰箱贮存备用。
1.2.4用药 分组完成后第二天开始用药。空白组、模型组及化疗组均予以生理盐水0.4 ml,SXG组予以山仙颗粒混悬液0.4 ml[g/(kg·d)]灌胃,每天上午9点及下午3点各一次,连续14 d;用药第1、3、5天,空白组、模型组及SXG组,予以生理盐水1 ml腹腔注射,化疗组于,予以顺铂(DDP)生理盐水溶液1 ml(含DDP 0.1 mg)腹腔注射。即:空白组、模型组(生理盐水0.4 ml灌胃+生理盐水1 ml腹腔注射),化疗组(生理盐水0.4 ml灌胃+DDP生理盐水溶液1 ml腹腔注射),SXG组(SXG混悬液0.4 ml灌胃+生理盐水1 ml腹腔注射)。
1.2.5样品采集 各组小鼠于末次灌胃24 h后称量体重、记录,用2%的水合氯醛将小鼠麻醉,75%酒精消毒置超净工作台;腹主动脉穿刺取血,立即离心取血清冻存于-80℃冰箱备用;剥离瘤组织、游离出脾脏并称重记录。每组每只小鼠预留1/3的脾脏,生理盐水冲洗备用。其余脾脏和瘤组织块福尔马林固定备用。
1.2.6指标检测
1.2.6.1计算抑瘤率 根据记录的瘤组织重量计算各组小鼠瘤组织平均值,按照公式:抑瘤率=(模型组瘤重-治疗组瘤重)/模型组平均瘤重×100%,计算出抑瘤率。
1.2.6.2计算小鼠脾脏指数 根据记录的小鼠体重与脾脏重量,按照公式:脾脏指数(mg/g)=脾脏重量/体重×100%,计算小鼠脾脏指数。
1.2.6.3免疫组织化学法检测小鼠脾脏组织中T淋巴细胞CD4、CD8的表达 将脾组织常规制成石蜡切片,常规水化-洗片-封闭-洗片-抗原修复-加入CD4(或CD8)兔抗鼠多克隆抗体(1∶150)-洗片-加入生物素化羊抗兔第二抗体(1∶200)-洗片-封闭-显色-苏木素衬染-脱水、透明-封片。每例标本随机选取10个高倍镜视野(×400),计算阳性细胞百分率。
1.2.6.4CCK-8实验 ①制备小鼠脾脏淋巴细胞悬液及LLC细胞悬液:将空白组、模型组、化疗组、山仙颗粒组小鼠脾脏组织分别剪碎-研磨-PBS冲洗-离心-弃上清-加红细胞裂解液2 min-离心-PBS重悬沉淀-离心-弃上清-计数,得淋巴细胞,用10%小牛血清DMEM培养液分别调整为1×108、2×108和4×108个/ml的细胞悬液。另取对数生长期的LLC细胞,用10%小牛血清DMEM培养液调整为1×107个/ml细胞悬液。②分组接种培养:将空白组、模型组、化疗组、山仙颗粒组的不同浓度小鼠脾淋巴细胞悬液与LLC细胞悬液分别吸取100 μl进行混合培养,即形成效应细胞(淋巴细胞)∶靶细胞(LLC细胞)=10∶1、20∶1、40∶1的比例,并设对照组LLC细胞悬液100 μl+培养液100 μl及空白凋零组(培养液200 μl),每组均设3个复孔(n=3),置入37℃、5%CO2的二氧化碳培养箱中,分别于24、48 h后,倒置显微镜下观察,每孔加入10 μl CCK-8溶液,37℃孵育2 h。测定450 nm各孔的OD值。③计算抑制率:抑制率=(1-实验各组OD值/对照组OD值)×100%。
1.2.6.5ELISA 法检测小鼠外周血中IFN-γ、TNF-β与IL-10的变化 将冻存的血清置于37℃水浴箱中迅速溶解,从密封袋中取出实验所需要的板条。每组均设3个复孔(n=3),预留空白孔。加入备好的血清和标准品,37℃反应90 min-洗板2次-加入IFN-γ生物素化抗体工作液,37℃反应60 min-洗板3次-加酶结合物工作液(除空白孔外),37℃反应30 min-洗板5次-TMB显色-终止显色-测量OD值(450 nm)TNF-β与IL-10检测方法同上。
1.3统计学方法 本实验应用SPSS19.0统计分析
2 结果
2.1SXG对Lewis肺癌荷瘤小鼠实体瘤生长的影响,见表1。
2.2SXG对Lewis肺癌荷瘤小鼠脾脏指数的影响,见表2。
2.3免疫组织化学法检测SXG对Lewis肺癌荷瘤小鼠脾脏T淋巴细胞CD4+、CD8+亚群比例及CD4+/CD8+比值的影响,见表3、图1、2。
2.4CCK-8法检测SXG对Lewis肺癌细胞增殖的影响(表4、5,图2) 空白培养液中的Lewis肺癌细胞呈梭形并伸出伪足,贴壁生长;与淋巴细胞共培养的Lewis肺癌细胞,数量明显减少,并与淋巴细胞的浓度和作用的时间呈正相关,受到淋巴细胞的攻击,细胞伪足减少、蜷缩、甚或死亡碎裂。
2.5ELISA 法检测SXG对Lewis肺癌荷瘤小鼠外周血中的IFN-γ、TNF-β与IL-10的影响,见表6。

表2 各组小鼠脾脏指数比较分析表
Note:Compared with blank groups,1)P<0.05;compared with model group,2)P<0.05;compared with chemotherapy group,3)P<0.05.

表1 SXG与化疗药对LLC荷瘤小鼠实体瘤的抑制率
Note:Compared with model group,1)P<0.05;compared with chemotherapy group,2)P<0.05.

表3 各组小鼠脾脏CD4+、CD8+ T淋巴细胞比例及CD4+/CD8+比值
Note:Compared with blank groups,1)P<0.05;compared with model group,2)P<0.05;compared with chemotherapy group,3)P<0.05.

表4 不同浓度淋巴细胞作用24 h对Lewis肺癌细胞的抑制率
Note:Compared with blank groups,1)P<0.01; compared with model group,2)P<0.05,compared with chemotherapy group,3)P<0.05.20∶1 with 10∶1,4)P<0.05;40∶1 with 20∶1,5)P<0.05.

表5 不同浓度淋巴细胞作用48 h对Lewis肺癌细胞的抑制率
Note:Compared with blank groups,1)P<0.05;compared with model group,2)P<0.05;compared with chemotherapy group,3)P<0.05;20∶1 with 10∶1,4)P<0.05;40∶1 with 20∶1,5)P<0.05.
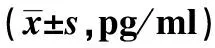
表6 小鼠外周血中的TNF-β、IFN-γ及IL-10的浓度
Note:Compared with blank groups,1)P<0.05;compared with model group,2)P<0.05;compared with chemotherapy group,3)P<0.05.

图1 小鼠脾脏T淋巴细胞CD4、CD8表达情况(×400)Fig.1 Expression of CD4 and CD8 in spleen T lymphocytes of mice(×400)

图2 不同浓度淋巴细胞24 h、48 h对Lewis肺癌细胞生长的影响Fig.2 Effects of different concentrations of lymphocytes on the growth of Lewis lung cancer cells at 24 h and 48 h

图3 CTL活化和杀伤肿瘤细胞机制示意图Fig.3 Mechanism of CTL activation and killing of tumor cells
3 讨论
肺癌是最常见的恶性肿瘤之一,尤其随着环境污染的加重,近年来肺癌的发病率和死亡率呈明显上升趋势,我国大多数城市肺癌的发病率和死亡率居恶性肿瘤的第一位和第二位[1]。目前,肺癌的治疗仍未能取得令人满意的效果,5年总生存率只有 10%~15%[2]。研究发现,恶性肿瘤患者免疫功能状态紊乱和低下[3],机体的免疫功能与肿瘤的发生发展密切相关[4]。2013年《Science》杂志将癌症免疫疗法评为本年度最重要的科学突破,并认为“免疫治疗完全经得起考验”。肿瘤免疫治疗是通过激发或调动机体免疫系统,增强抗肿瘤免疫力,从而控制和杀伤肿瘤细胞。
抗肿瘤免疫以T淋巴细胞介导的细胞免疫为主(图3),成熟的T淋巴细胞根据细胞表面是否表达CD4和CD8而分为CD4+T细胞(helper T cell,Th)和CD8+T细胞(cytotoxic T cell,Tc)2个亚群CTL是抗肿瘤免疫的主要效应细胞,主要为活化的CD8+T细胞[4]。肿瘤抗原经抗原提呈细胞摄取加工,提呈给 CD8+T细胞,直接激活增殖分化为CTL;提呈给CD4+T细胞,诱导Th0细胞分化为Th1和Th2细胞,Th1细胞分泌IL-2和IFN-γ可协同刺激CTL的增殖和分化[4]。CTL通过Fas-Fasl和TNF-TNFR两种途径特异性杀伤靶细胞,介导肿瘤细胞坏死或凋亡[4]。正常生理状态下CD4+和CD8+T细胞亚群比值保持动态平衡,以维持机体细胞免疫功能的稳定[3]。研究显示,恶性肿瘤患者则出现免疫失衡,多表现为细胞免疫功能紊乱,主要表现为T淋巴细胞亚群发生改变,具体表现为CD4+T 淋巴细胞含量明显低于正常人,CD4+/CD8+比值下降[5-7]。因此,可通过检测荷瘤机体CD4+T细胞含量及CD4+/CD8+比值的变化以观察机体的抗肿瘤免疫力。
另外,分化的Th1和 Th2 两个细胞亚群,各自分泌不同的细胞因子,均能刺激自身分化和发展而抑制对方的分化和发展,相互影响。Th1型细胞因子IL-2、IFN-γ和TNF-β等,IL-2、IFN-γ能刺激CTL的增殖和分化,IFN-γ可增强NK细胞的杀伤能力,TNF等可直接杀伤肿瘤细胞等,从而抑制肿瘤的发展[8-10]。Th2型细胞因子IL-10等为抑制性细胞因子,可抑制巨噬细胞的抗原提呈能力,抑制NK细胞活性,从而促进肿瘤免疫逃逸,促进肿瘤生长。研究显示,IL-10介导免疫机制是通过作用于不同的免疫细胞亚群,并通过多种方式发挥免疫抑制,造成机体抗肿瘤免疫逃逸能力下降[11]。正常生理状态下,机体通过调节Th1/Th2,维持细胞免疫和体液免疫的动态平衡,如果Th1/Th2平衡失调,出现Th1向Th2转化的趋势称为 Th1/Th2漂移。现已发现肺癌、乳腺癌、膀胱癌、胃癌、结直肠癌、白血病等多种类型肿瘤患者体内出现了Th1/Th2漂移现象[12-16],即荷瘤机体强势表达 Th2 型细胞因子,而Th1型细胞因子表达减弱。Wang等[16]对消化道肿瘤的研究表明,胃癌、结直肠癌患者血清中IL-2、IFN-γ等 Th1 型细胞因子与正常组比较均显著降低,而 IL-4、IL-6、IL-10 等 Th2 型细胞因子均显著升高。因此,使荷瘤机体由 Th2向 Th1漂移,为肿瘤的免疫治疗提供了新思路。
山仙颗粒是陕西中医药大学第一附属医院肿瘤科根据中医基础理论,结合多年临床经验以及现代药理研究,在“扶正培本、活血化瘀”基本治疗法则的基础上研制而成的纯中药抗肿瘤复方制剂,由西洋参、龟板、鳖甲、莪术、仙鹤草、生山楂等组成,方中各味药的现代药理研究均显示有一定的抑瘤作用,并可促使肿瘤细胞的凋亡[17-21]。并且,临床研究表明,山仙颗粒可提高机体抗肿瘤免疫、明显改善临床症状,有抑瘤、抗转移、防复发作用[22,23];实验研究发现,山仙颗粒可以抑制Lewis肺癌转移,还可影响肿瘤细胞凋亡相关基因bcl-2/bax、fasl/fas、caspase-3等和Hsp70、VEGF的表达[24-27]。
本实验显示,山仙颗粒能明显抑制Lewis肺癌荷瘤小鼠肿瘤组织的生长。小鼠脾组织中CD4+T细胞、CD4+/CD8+比值及淋巴细胞对Lewis肺癌细胞抑制率的检测结果均显示:模型组低于空白组,化疗组低于模型组,SXG组高于模型组,SXG组与空白组比较无显著差异,显示Lewis肺癌荷瘤小鼠机体出现免疫功能紊乱,而化疗可进一步破坏机体免疫力,但山仙颗粒可通过调节CD4+T 淋巴细胞含量、CD4+/CD8+比值恢复机体的免疫稳态。提示山仙颗粒可以显著改善Lewis肺癌荷瘤小鼠免疫功能,提高机体抗肿瘤免疫力,并且与时效呈正相关。另外,外周血中Th1型细胞因子IFN-γ和TNF-β,模型组低于空白组;Th2型细胞因子IL-10,模型组高于空白组;显示Lewis肺癌荷瘤小鼠Th1/Th2失衡,发生了Th1/Th2漂移。并且Th1型细胞因子IFN-γ和TNF-β,化疗组低于模型组,SXG组高于模型组;Th2型细胞因子IL-10,化疗组高于模型组,SXG组低于模型组;SXG组与空白组比较它们均无显著差异;提示,山仙颗粒可通过逆转Lewis肺癌荷瘤小鼠机体的Th1/Th2漂移,维持细胞免疫和体液免疫的动态平衡。综上所述并结合前期研究结果,山仙颗粒的临床抗肿瘤作用可能与其恢复肿瘤患者免疫功能稳态,提高机体抗肿瘤免疫力、加强免疫监视功能,介导肿瘤细胞坏死或凋亡有关。
[1] Jie C,Zhu CJ,Yan S,etal.Long noncoding RNAs and lung cancer[J].Acad J Second Military Medical University,2014,35(10):1115-1120.
[2] Yang X,Rutnam ZJ,Jiao C,etal.An anti-let-7 sponge decoys and decays endogenous let-7 functions[J].Cell Cycle,2012,11(16):3097-3108.
[3] 王 俞,崔书中.恶性肿瘤患者的免疫功能状态及免疫治疗研究进展[J].中国肿瘤临床,2014,41(13):876-879.
[4] 曹雪涛.医学免疫学[M].第6版,北京:人民卫生出版社,2013:176.
[5] Das S,Karim S,Datta RC,etal.Peripheral blood lymphocyte subpopulations in patients with cervical cancer[J].Int J Gynaecol Obstet,2007,98(2):143-146.
[6] Liu G,Ren H,Sun XJ,etal.Distribution of natural killer cells and T-lymphocyte subsets in peripheral blood,gallbladder cancer and surrounding tissue[J].Hepatobiliary Pancreat Dis Int,2007,6(1):81-86.
[7] Wang L,Shen Y.Imbalance of circulating T-lymphocyte subpopu-lation in gastric cancer patiens correlated with performance status [J].Clin Lab,2013,59(3-4):429-433.
[8] Jr TD,Patterson JR,Velascogonzalez C,etal.Interferon-gamma-induced nitric oxide inhibits the proliferation of murine renal cell carcinoma cells.[J].Int J Biological Sci,2012,8(8):1109-1120.
[9] Filho PAA,Ito D,Deleo AB,etal.CD8+T cell recognition of polymorphic wild-type sequence p53 65-73,peptides in squamous cell carcinoma of the head and neck[J].Cancer Immunol Immunothe,2010,59(10):1561-1568.
[10] 王晓华,王 宏,何安光,等.肿瘤坏死因子-β诱导胰腺癌细胞凋亡作用的实验研究[J].辽宁医学杂志,2003,17(6):314-315.
[11] 梁 晶.肺癌患者外周血Treg细胞与IL-10、TGF-β检测及其临床意义[J].临床肺科杂志,2015,11(11):1980-1983.
[12] Asselin-Paturel C,Echchakir H,Carayol G,etal.Quantitative analysis of Th1,Th2 and TGF-beta1 cytokine expression in tumor,TIL and PBL of non-small cell lung cancer patients[J].Int J Cancer,1998,77(1):7-12.
[13] Ehi K,Ishigami S,Masamoto I,etal.Analysis of T-helper type 1 and 2 cells and T-cytotoxic type 1 and 2 cells of sentinel lymph nodes in breast cancer[J].Oncol Rep,2008,19(3):601-607.
[14] Lang F,Linlin M,Ye T,etal.Alterations of dendritic cell subsets and TH1/TH2 cytokines in the peripheral circulation of patients with superficial transitional cell carcinoma of the bladder[J].J Clin Laborat Analysis,2012,26(5):365-371.
[15] Podhorecka M,Dmoszynska A,Rolinski J,etal.T type 1/type 2 subsets balance in B-cell chronic lymphocytic leukemia--the three-color flow cytometry analysis[J].Leuke Res,2002,26(7):657-660.
[16] Wang CY,Zou X,Che ZX,etal.The monitoring and analysis of Th1/Th2 cells in patients with gastrointestinal cancer[J].J Surg Oncol,2007,95(6):491-498.
[17] Chang ZJ,Hao GC,Huang XJ.Study of zedoray rhizome abstracts on growth-inhibiting effects for human liver cancer cell line Bel-7402[J].Med Pharmaceutical World,2009,11(4):13-14.
[18] Wang W,Zhao YQ,Elizabeth RR,etal.In vitro anti-cancer activity and structure-activity relationships of natural products isolated from fruits of Panax ginseng[J].Cancer Chemother Pharmacol,2007,59(5):589-601.
[19] Li-Chun XU,Chen P,Sun ZH,etal.Effect of cancer cell vaccine modified with curcumol on gastric tumor[J].J Modern Oncol,2008,16(12):2066-2069.
[20] 李佩文.实用临床抗肿瘤中药[M].沈阳:辽宁科学技术出版社,2001:153.
[21] 李 彬,郭力城.鳖甲的化学成分和药理作用研究概况[J].中医药信息,2009,26(1):25-27.
[22] 王希胜,陈光伟,李宏庭,等.山仙颗粒治疗恶性肿瘤56例[J].陕西中医,2002,23(9):778-779.
[23] 王希胜,陈光伟,李仁廷,等.山仙颗粒抗肿瘤的临床与实验研究[J].陕西中医学院学报,2002,25(3):47-49.
[24] 方 艳,应小平,王小平,等.山仙颗粒含药血清对S180细胞caspase-3及热休克蛋白70表达的影响[J].中成药,2013,35(9):2003-2005.
[25] 胥 冰,方 艳,吴肖晓,等.大鼠山仙颗粒含药血清对S-180肉瘤细胞bcl-2、VEGF表达的影响[J].现代肿瘤医学,2013,21(9):1926-1929.
[26] 方 艳,吴肖晓,应小平,等.山仙颗粒含药血清对大鼠S-180肉瘤细胞Fas/FasL基因表达的相关性研究[J].现代中医药,2011,31(2):46-48.
[27] 应小平,吴肖晓,方 艳,等.山仙颗粒含药血清诱导S-180肉瘤细胞凋亡及其对bcl-2、Bax基因表达的影响[J].现代肿瘤医学,2013,21(1):28-30.
[收稿2017-04-13 修回2017-05-25]
(编辑 许四平 刘格格)
EffectsofShanxianGranuleonantagonisticimmunityofLewislungcancermiceandlevelofIFN-γ,TNF-β,IL-10inperipheralblood
FANGYan,ZHANGChao-Yu,YINGXiao-Ping,PANYan-Fang,JIAOPei-Juan.
ShanxiUniversityofTraditionalChineseMedicine,Xianyang712046,China
Objective:To investigate the effects of Shanxian granule on proliferation of Lewis lung cancer cells and anti-tumor immunity and immune microenvironment of Lewis lung cancer-bearing mice in order to explore the molecular mechanism of anti- tumor of Shanxian Granule and improve the anti-tumor immunity of the body,and provide further theoretical basis for its clinical application.MethodsLewis lung cancer cells was transplanted to axillary skin to establish mouse tumor model.The mice divided into blank group,model group,chemotherapy group and Shanxian granule group.The tumor tissue of Lewis lung cancer tumor bearing mice was weighed and the tumor inhibition rate was calculated.Immunohistochemical method was used to detect the expression of CD and CD8 in spleen tissue.The effect of lymphocytes on the proliferation of Lewis lung cancer cells was detected by CCK-8 method.The level of IFN-γ,TNF-β and IL-10 in peripheral blood were detected by ELISA.Results①The tumor inhibition rate of Lewis lung cancer was 45.99% in Shanxian Granule group,which was significantly higher than that of chemotherapy group (P<0.05).②The lymphocytes of mouse can inhibit the proliferation of Lewis lung cancer cells and have a positive correlation with lymphocyte concentration and duration of action.Moreover,CD4+T cells,CD4+/CD8+ratio and lymphocyte inhibition rate of Lewis lung cancer cells in model group and chemotherapy group were significantly lower than those in blank group (P<0.05).Shanxian granule group was significantly higher than the model group and chemotherapy group (P<0.05).However,there was no significant difference between Shanxian granule group and blank group(P>0.05).③The levels of IFN-γ and TNF-β in peripheral blood of model group and chemotherapy group were significantly lower than those in blank group,while IL-10 was significantly higher than that in blank group (P<0.05).The levels of IFN-γ and TNF-β in peripheral blood of mice in Shanxian granule group were significantly higher than those in model group and chemotherapy group,while IL-10 was significantly lower than that in model group and chemotherapy group (P<0.05).There was no significant difference in IFN-γ,TNF-β and IL-10 in peripheral blood of mice between Shanxian granule group and blank group.ConclusionShanxian granule can significantly inhibit the growth of tumor tissue of Lewis lung cancer tumor bearing mice,increase the spleen index of mice,enhance the activity of T lymphocytes,upregulate IFN-γ and TNF-β in peripheral blood and decrease IL- I.These suggested that the anti-tumor effect of Shanxian granule may be achieved by regulating the content of CD4+T lymphocyte,the ration of CD4+/CD8+and Th1/Th2 ratio,in order to restore the immune steady function of tumor patients,improve the immune system and enhance the immune surveillance function.
Shanxian granule;Lewis lung cancer cells;T lymphocytes;IFN-γ;TNF-β;IL-10
①本文为陕西省教育厅专项科研教育项目(15JK1190)。
R73
A
1000-484X(2017)10-1487-06
10.3969/j.issn.1000-484X.2017.10.010
方 艳(1976年-),女,硕士,副教授, 主要从事中医药抗恶性肿瘤机制的研究,E-mail:fangyan9494@163.com。

