减毒鼠伤寒沙门菌SL1344ΔsseK1Δasd宿主-载体平衡致死系统的构建及其生物学特性研究①
杨亚东 丁 轲 张春杰 程相朝 贾艳艳 何 雷
(河南科技大学动物疫病与公共卫生重点实验室/洛阳市活载体生物材料与动物疫病防控重点实验室,洛阳 471023)
减毒鼠伤寒沙门菌SL1344ΔsseK1Δasd宿主-载体平衡致死系统的构建及其生物学特性研究①
杨亚东 丁 轲 张春杰 程相朝 贾艳艳 何 雷
(河南科技大学动物疫病与公共卫生重点实验室/洛阳市活载体生物材料与动物疫病防控重点实验室,洛阳 471023)
目的为构建减毒鼠伤寒沙门菌分泌性蛋白K1缺失株平衡致死系统,并将其开发为能够稳定携带外源基因的活疫苗载体。方法利用重组自杀性质粒(pREΔasd)介导的等位基因交换技术,以减毒鼠伤寒沙门菌株SL1344ΔsseK1为亲本株,运用二步法筛选asd基因缺失株SL1344ΔsseK1Δasd。将携带有asd基因的无抗性pYA3493质粒电转至上述缺失菌株SL1344ΔsseK1Δasd,构建SL1344ΔsseK1Δasd(pYA3493)重组菌株。结果PCR及测序结果表明SL1344ΔsseK1Δasd(pYA3493)构建成功。进一步研究表明重组菌株SL1344ΔsseK1Δasd(pYA3493)血清型和强毒株SL1344及亲本株SL1344ΔsseK1相同,且能稳定遗传缺失后的asd基因;其生化特性和生长速度与强毒株SL1344及亲本株SL1344ΔsseK1相比均无明显差异。小鼠毒力试验表明,SL1344ΔsseK1Δasd(pYA3493)口服感染6周龄BALB/c小鼠的LD50为5.24×108CFU,毒力较强毒株SL1344约下降至0.048%;免疫保护效力试验显示,运用鼠伤寒沙门菌野生毒株对免疫后第17天的小鼠攻毒有62.5%的保护率,与亲本株SL1344ΔsseK1基本一致。结论以上结果表明,鼠伤寒沙门菌分泌性蛋白K1缺失株宿主-载体平衡致死系统构建成功,且遗传稳定,毒力明显降低,具有较好的免疫原性,为深入研究以鼠伤寒沙门菌为载体的口服多价疫苗奠定基础。
鼠伤寒沙门菌;自杀性质粒;宿主-载体平衡致死系统;活疫苗载体
鼠伤寒沙门菌(Salmonella typhimurium)属于肠道致病菌,也是重要的人类食物源性病原体,是引起世界人类食物中毒中最重要的病原体之一,在医学及公共卫生学上亦具有十分重要的意义[1]。
近年来,随着基因工程技术的发展以及对沙门菌毒力遗传学研究的不断深入,以减毒沙门菌为活载体表达外源抗原、研制多价疫苗已成为该领域的研究热点[2]。沙门菌的一个重要致病机制是在SPI-1和SPI-2两个毒力岛编码的Ⅲ型分泌系统(T3SS)介导下,细菌效应蛋白易位到宿主细胞,诱导炎症反应[3]。沙门菌分泌性蛋白K1(Salmonella secreted effector K1)是沙门菌T3SS的一种效应蛋白,已有研究发现sseK1能由T3SS1和T3SS2同时分泌,与介导细菌的易位分泌有关,为沙门菌T3SS的一种调节底物,是沙门菌重要的毒力调节基因,在沙门菌的致病中发挥着重要作用[4]。同时,已有研究表明该类减毒菌能够有效地刺激机体产生黏膜、细胞和体液等免疫应答,已被证明是携带外源基因的良好载体[5]。但在临床应用中,减毒沙门菌所携带的外源质粒常因生存压力的存在而不能稳定遗传,且质粒所携带的抗性基因也对生物安全带来了潜在威胁[6]。近年来发展起来的宿主-载体平衡致死系统克服了质粒携带外源基因表达不稳定的问题[7],其原理是将外源基因插入含有与沙门菌载体营养缺陷互补基因的质粒中,以期实现外源基因的稳定遗传。已有相关研究表明asd基因平衡致死系统是有效的载体系统[8],该系统质粒中含有asd基因,可与asd缺失的沙门菌载体形成互补,从而保证减毒沙门菌携带外源抗原能够持续稳定的表达。
SL1344ΔsseK1是本研究室在强毒株SL1344的基础上构建的减毒株,试验证明sseK1基因缺毒力降低显著,并具有良好的免疫效果。本研究中,将进一步缺失编码天冬氨酸β-半乳糖脱氢酶的asd基因,构建asd平衡致死系统,进而为研发更加安全有效的鼠伤寒沙门菌弱毒疫苗以及开发以鼠伤寒沙门菌SL1344为载体的多价疫苗奠定基础。
1 材料与方法
1.1材料
1.1.1细菌菌株、质粒和培养条件 鼠伤寒沙门菌SL1344标准强毒株由南京农业大学惠赠;减毒鼠伤寒沙门菌菌株SL1344ΔsseK1和缺失315 bp asd基因的重组自杀性质粒pREΔasd由本室构建并保存;自杀性质粒pRE112、pYA3493(asd+,pBRori,β-lactamase signal sequence)及其宿主菌χ7213由美国华盛顿大学Dr.Roy Curtiss III教授惠赠,本室保存。鼠伤寒沙门菌和大肠杆菌在各种培养基中恒温培养,根据需要加入终浓度为25 μg/ml的氯霉素(Chloramphenicol,Cm),50 μg/ml的二氨基庚二酸(D L-α,ε-Diaminopimelic acid,DAP)及其他所需物质。
1.1.2试剂和实验动物 各种生化鉴定试剂购于杭州天和微生物试剂有限公司;11种沙门菌属诊断血清及各种单因子血清购于宁波天润生物药业有限公司;DAP、蔗糖、麦芽糖购于美国Sigma-Aldrich公司;麦康凯琼脂和SS琼脂培养基购于广东环凯微生物科技有限公司;Taq DNA聚合酶、dNTPs、DNA Marker和限制性内切酶购于TaKaRa(大连)有限公司;质粒小量提取试剂盒、DNA胶回收试剂盒购于上海生工生物公司;6~8周龄BALB/c小鼠购于郑州大学实验动物中心。
1.1.3引物 根据GenBank上已公布的鼠伤寒沙门菌LT2(GenBank No.AE006468.1)asd基因序列设计引物,根据鼠伤寒沙门菌invA基因序列合成特异性引物用于沙门菌的鉴定。各引物由生工生物工程(上海)股份有限公司合成(表1)。
1.2方法
1.2.1鼠伤寒沙门菌SL1344株ΔsseK1Δasd缺失株的构建及筛选 根据文献[8]的方法并加以改良,首先利用重组自杀性质粒介导等位交换技术二步法筛选SL1344ΔsseK1Δasd缺失突变株。供体菌χ7213(pREΔasd)和受体菌SL1344ΔsseK1分别培养过夜,各取100 μl细菌悬液混合,补充LB(含DAP)液体培养基1 ml,37℃培养24 h,取适量菌液涂布于含氯霉素(Cm)和10%蔗糖的LB固体平板上培养过夜,挑取Cm抗性(Cmr)蔗糖敏感(SUCs)菌落,用引物Pa1/Pa2扩增鉴定。将Cmr/SUCs阳性接合子转接于含10%蔗糖无抗性无NaCl的LB(NB)液体培养基中过夜培养,连续10倍稀释后,选取合适的稀释度涂布于含有1%麦芽糖的麦康凯固体平板,筛选SL1344ΔsseK1Δasd缺失株。用氯霉素检测其抗性,进一步提取阳性缺失株基因组,用引物Pa1/Pa2、Pa3/Pa2进行PCR扩增鉴定,并将扩增产物送至生工生物工程(上海)股份有限公司进行测序。

表1 PCR扩增所用的引物序列
1.2.2鼠伤寒沙门菌重组菌株SL1344ΔsseK1Δasd(pYA3493)的构建及鉴定 挑取携带有asd基因的无抗性质粒pYA3493阳性结合子接种于4 ml LB液体培养基中过夜培养,参照上海生工有限公司质粒提取试剂盒的步骤提取质粒并将该质粒电转化至缺失菌株SL1344ΔsseK1Δasd感受态细菌液中,37℃、100 r/min振荡培养90 min,涂布在预热的LB固体平板上。挑取长出后的单菌落于LB液体培养基中培养过夜,运用引物Pa2/Pa3进行PCR扩增鉴定,并将扩增产物送至生工生物工程(上海)股份有限公司进行测序。
1.2.3重组菌株SL1344ΔsseK1Δasd(pYA3493)的生物学特性的研究
1.2.3.1SL1344ΔsseK1Δasd(pYA3493)的表型鉴定 利用玻片凝集试验对重组菌株SL1344Δsse-K1Δasd(pYA3493)进行血清型鉴定,同时将重组菌株SL1344ΔsseK1Δasd(pYA3493)、缺失株SL1344ΔsseK1与强毒株SL1344分别划线接种于含和不含1%麦芽糖的麦康凯琼脂平板,然后进一步将细菌转接至麦芽糖、甘露醇、阿拉伯糖等生化鉴定管中,检测其生化特性情况。
1.2.3.2SL1344ΔsseK1Δasd(pYA3493)的遗传稳定性 将重组菌株SL1344ΔsseK1Δasd(pYA34 93)于LB培养基中连续培养传代,挑取第10、20、30、40、50、60代单菌落做PCR扩增鉴定,利用引物pa2/pa3研究asd缺失基因在缺失株中的遗传稳定性。
1.2.3.3SL1344ΔsseK1Δasd(pYA3493)的生长特性 分别挑取重组菌株SL1344ΔsseK1Δasd(pYA34 93)、缺失株SL1344ΔsseK1与强毒株SL1344单菌落,接种于LB液体培养基中37℃培养过夜,连续10倍无菌生理盐水稀释,取适当稀释度菌液100 μl于LB固体平板上均匀涂布,每个稀释度做3个重复,37℃培养过夜,计数,计算原液的平均CFU。调整菌落浓度约为1×106CFU/ml后,37℃、200 r/min振摇培养,每1 h取样涂板计数,并绘制生长曲线。
1.2.4SL1344ΔsseK1Δasd(pYA3493)的毒力测定 分别将重组菌株SL1344ΔsseK1Δasd(pYA3493)、缺失株SL1344ΔsseK1与强毒株SL1344在LB液体培养基中37℃振荡培养过夜,按1.2.3.3所述方法平板计数并计算攻毒剂量,连续10倍无菌生理盐水稀释,根据预实验结果,选取合适的稀释度,每个稀释度口服感染6只6周龄BALB/c小鼠,每只200 μl,观察直至无小鼠死亡,同时设生理盐水空白对照组。统计死亡情况,剖检观察死亡小鼠的临床变化,并取肝脏无菌接种SS和含有1%麦芽糖的麦康凯固体平板,用引物pi1/pi2进行PCR扩增鉴定,根据Bliss法计算菌株对小鼠半数致死量(LD50)。
1.2.5SL1344ΔsseK1Δasd(pYA3493)毒力稳定性的测定 将重组菌株SL1344ΔsseK1Δasd(pYA34 93)于LB液体培养基中连续传代60代,收集原代、10、20、30、40、50、60代细菌,稀释至预期浓度后感染BALB/c小鼠,具体步骤同1.2.4所述,同时设无菌生理盐水对照组。利用引物Pi1/Pi2对分离菌株进行PCR鉴定,并计算小鼠的LD50。
1.2.6SL1344ΔsseK1Δasd(pYA3493)免疫保护率的测定 将32只6周龄BALB/c小鼠随机平均分成4组,设实验1组和实验2组,对照1组和对照2组,按1.2.3.3所述方法制备免疫和攻毒菌液。实验组分别于第1天和第8天以鼠伤寒沙门菌SL1344ΔsseK1Δasd(pYA3493)重组菌株100 μl(1.0×107CFU)口服免疫每只小鼠,对照组每只口服100 μl生理盐水。在免疫后第17天,分别对实验1组和对照1组小鼠进行口服攻毒SL1344强毒株100 μl(1.0×108CFU),实验2组和对照2组的小鼠不做任何处理。攻毒后持续观察记录免疫小鼠生长及死亡情况,以评价减毒沙门菌的免疫保护作用。
1.3统计学处理 所有数据采用SPSS17.0软件进行分析,各组间差异比较采用t检验,P<0.05为差异具有统计学意义。
2 结果
2.1缺失株SL1344ΔsseK1Δasd的构建及鉴定 大肠杆菌χ7213(pREΔasd)与SL1344ΔsseK1亲本株在含氯霉素的培养基中混合培养后,由于自杀性质粒pREΔasd整合到SL1344ΔsseK1染色体上,会得到野生型和缺失型的asd两个拷贝且表型均为Cm抗性的阳性结合子。用上臂内部引物pa1和下臂内部引物pa2扩增结合子,可得到315 bp缺失型和1 803 bp野生型的两条带(图1A)。pREΔasd含有负向选择基因(sacB蔗糖敏感基因),阳性结合子在含DAP和10%蔗糖NB培养基连续传代培养中发生第二次同源重组,挑取单菌落用引物pa1/pa2扩增产生315 bp大小的突变型和1 803 bp大小的恢复野生型两种结果(图1B)。为证明缺失发生于染色体,进一步用下臂内部引物pa2和上臂以外染色体上的引物pa3对阳性缺失株进行PCR鉴定,结果缺失型可扩得2 229 bp的片段,野生型扩得3 717 bp的片段,pREΔasd则扩不出任何条带(图1C)。此时所筛选阳性结合子呈Cm敏感(Cms)和蔗糖抗性(SUCr),同时PCR及测序结果表明,SL134 4ΔsseK1Δasd缺失株构建成功。
2.2重组菌株SL1344ΔsseK1Δasd(pYA3493)的构建及鉴定 将无抗性表达质粒pYA3493电转入缺失株SL1344ΔsseK1Δasd中,利用引物pa2/pa3进行PCR扩增,结果可得到2 229 bp大小的片段(图2),并且该菌能够在普通LB培养基(不含DAP)中生长,PCR及测序结果表明重组菌株SL1344ΔsseK1 Δasd(pYA3493)构建成功。
2.3重组菌株SL1344ΔsseK1Δasd(pYA3493)的生物学特性
2.3.1SL1344ΔsseK1Δasd(pYA3493)的表型鉴定 血清型鉴定表明,重组菌株SL1344ΔsseK1Δasd(pYA3493)的血清型没有变化,与亲本菌株SL1344ΔsseK1和强毒株SL1344相同,仍为1,4,5,12:i:1,2。生化鉴定结果表明,重组菌株SL1344ΔsseK1Δasd(pYA3493)与强毒株SL1344相比,其生化特性没有发生明显变化,与亲本株SL1344ΔsseK1保持一致。
2.3.2SL1344ΔsseK1Δasd(pYA3493)的遗传稳定性 将重组菌株SL1344ΔsseK1Δasd(pYA3493)在LB固体培养基上连续培养60代,挑取第10、20、30、40、50、60代单菌落用引物Pa1/Pa2做PCR扩增鉴定,都能扩增出315 bp的asd缺失型片段,而亲本株SL1344ΔsseK1则扩增出1 803 bp的asd野生型片段(图3),这表明重组菌株SL1344ΔsseK1Δasd(pYA3493)能够稳定遗传无抗性表达载体pYA3493和315 bp大小的asd缺失片段。

图1 缺失菌株SL1344ΔsseK1Δasd PCR鉴定Fig.1 PCR identification of SL1344ΔsseK1Δasd mutantNote:A.PCR identification of ΔsseK1Δasd mutant conjugants with Pa1 and Pa2.M.DNA marker Ladder(DL 5000);1.pREΔasd control;2.SL1344ΔsseK1 control;3.ΔsseK1Δasd mutant conjugants;4.ddH2O control;B.PCR identification of ΔsseK1Δasd mutant with Pa1 and Pa2.M.DNA marker Ladder(DL 2000);1.SL1344ΔsseK1 control;2.SL1344ΔsseK1Δasd mutant;3.ddH2O control;C.PCR identification of ΔsseK1Δasd mutant with Pa2 and Pa3.M.DNA marker Ladder(DL 5000);1.ΔsseK1Δasd mutant;2.SL1344ΔsseK1 control;3.pREΔasd control;4.ddH2O control.
2.3.3SL1344ΔsseK1Δasd(pYA3493)的生长特性 重组菌株、亲本株及强毒株均以1×106CFU/ml为起始浓度开始振荡培养,然后每1 h取50 μl菌液稀释相应的倍数涂板,过夜培养后计数,结果表明两种缺失株的生长速度基本一致,而重组菌株SL1344ΔsseK1Δasd(pYA3493)和亲本菌株SL1344ΔsseK1的生长速度略慢于强毒株SL1344(图4)。
2.4重组菌株SL1344ΔsseK1Δasd(pYA3493)的毒力测定 小鼠经重组菌株SL1344ΔsseK1Δasd(pYA3493),亲本株SL1344ΔsseK1与强毒株SL1344口服感染后,出现不同程度的死亡。无菌生理盐水对照组小鼠均未发生死亡。剖检死亡小鼠具有典型沙门菌病变,且用引物pi1/pi2均能从死亡小鼠分离的细菌中扩增出约580 bp左右的特异性条带。经Bliss法计算,SL1344的口服感染LD50为3.16×105CFU,亲本株SL1344ΔsseK1口服感染LD50为6.63×108CFU,重组菌株SL1344ΔsseK1 Δasd(pYA3493)口服感染LD50为5.24×108CFU,其毒力较强毒株SL1344下降了约103倍,而与亲本株相比无明显变化(表2)。
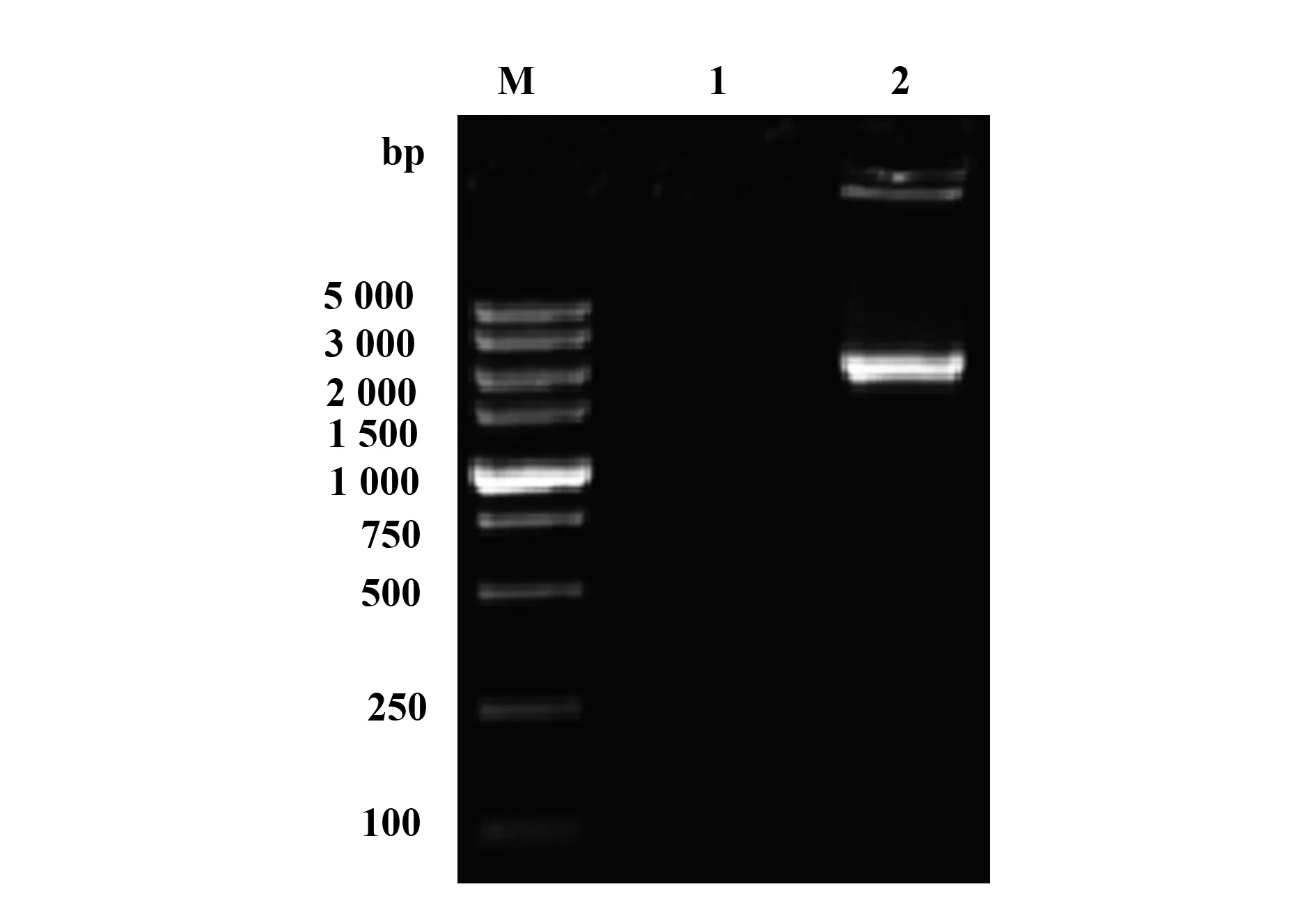
图2 PCR鉴定SL1344ΔsseK1Δasd(pYA3493)Fig.2 PCR identification of SL1344ΔsseK1Δasd(pYA 3493)Note:M.DNA marker Ladder(DL 5000);1.ddH2O control;2.SL1344ΔsseK1Δasd(pYA3493).

图3 PCR鉴定asd缺失片段的稳定性Fig.3 PCR identification of stability of Δasd mutantNote:M.DNA marker Ladder(DL 2000);1-6.The 10th,20th,30th,40th,50th and 60th generation of SL1344ΔsseK1Δasd(pYA3493);7.SL1344ΔsseK1 control;8.ddH2O control.

图4 重组菌株SL1344ΔsseK1Δasd(pYA3493)、亲本菌株SL1344ΔsseK1与强毒株SL1344的生长曲线Fig.4 Growth curves of SL1344ΔsseK1Δasd(pYA3493),SL1344ΔsseK1 and SL1344

表2 重组菌株SL1344ΔsseK1Δasd(pYA3493),亲本株SL1344ΔsseK1与强毒株SL1344的毒力测定
2.5重组菌株SL1344ΔsseK1Δasd(pYA3493)的毒力稳定性测定 将重组菌株SL1344ΔsseK1Δasd(pYA3493)第10、20、30、40、50、60代细菌经平板法培养计数后,用无菌生理盐水稀释至预期浓度后感染小鼠,并计算LD50。利用引物pi1/pi2对小鼠肝脏分离到的细菌进行PCR扩增,可得到约580 bp的特异性条带。应用Bliss法计算,重组菌株经传代后其口服感染LD50差异无统计学意义(P>0.05)。
2.6重组菌株SL1344ΔsseK1Δasd(pYA3493)免疫保护率的测定 对照1组小鼠7 d内全部死亡;实验1组7 d内死亡2只,8~15 d死亡1只,其余5只存活至观察期结束;对照2组和实验2组8只小鼠均无死亡现象。经SL1344ΔsseK1Δasd(pYA3493)重组菌株免疫的小鼠对野毒强毒株攻毒有62.5%的免疫保护率。
3 讨论
宿主-载体平衡致死系统又叫作染色体-质粒平衡致死系统,是解决外源质粒不能稳定遗传的有效途径[9],同时解决了在实际生产中应用抗生素标记的质粒载体表达外源抗原时带来的抗药性风险问题[10]。其原理为asd基因编码的天冬氨酸β-半乳糖脱氢酶是DAP生物合成途径中的必需酶,而DAP又是革兰氏阴性菌细胞壁肽聚糖的必需成分,是形成细胞壁所必要的,所以若无外源DAP补充的情况下,asd基因的缺失会出现自发溶菌死亡现象。而互补的无抗性pYA3493含有asd基因的表达质粒,因此,本研究将携带有asd基因的质粒电转至缺失了asd基因的突变株SL1344ΔsseK1Δasd之后可形成互补,进而构建出宿主-载体平衡致死系统。该系统不仅用营养缺陷代替了抗生素的选择压力,同时解决了质粒丢失等外源基因表达不稳定的问题[11],为沙门菌活疫苗载体的研发开辟了新的途径。同时,本研究在缺失菌株构建上运用重组自杀性质粒pREΔasd介导的细菌等位基因交换技术进行,与以往同源重组及转座子随机插入等传统的方法相比,自杀性质粒同时具备负向和正向两种筛选标记,正向氯霉素(Cm)标记选择有助于在接合转移的第一步迅速筛选出含有抗性的接合子,负向蔗糖敏感基因(SacB)标记选择有助于加速第二步的同源重组,具有重组率高、筛选方便等诸多优点,很大程度上提高了重组的速度和几率[7]。
在前期研究中我们发现鼠伤寒沙门菌sseK1基因缺失后其毒力会发生显著的降低,并且具有较好的免疫原性。因此,本研究运用鼠伤寒沙门菌SL1344ΔsseK1株作为亲本菌,用接合转移的方法将含有缺失315 bp的asd基因的重组自杀性质粒导入鼠伤寒沙门菌SL1344ΔsseK1中,通过同源重组、抗性筛选标记和PCR检测技术,最终筛选出不含任何抗性的SL1344ΔsseK1Δasd缺失株,然后将含有asd基因的无抗性pYA3493质粒电转至上述缺失株,获得SL1344ΔsseK1Δasd(pYA3493)重组菌株。并对其生物学特性进行了比较研究,重组菌株的生长速度、生化特性与亲本株SL1344ΔsseK1保持一致,说明asd基因并不影响亲本株SL1344ΔsseK1的生长速度与生化特性,并且具有遗传稳定性。小鼠毒力测定试验表明,重组菌株SL1344ΔsseK1Δasd(pYA3493)的毒力较强毒株SL1344约下降至0.048%,与亲本株SL1344ΔsseK1的安全性基本相同,说明由于无抗性质粒pYA3493携带有asd基因可与SL1344ΔsseK1Δasd形成互补,对毒力不构成影响,具有良好的安全性,可用于外源基因的稳定表达。小鼠免疫保护实验结果显示SL1344ΔsseK1Δasd(pYA3493)重组菌株免疫后野毒攻毒有62.5%的免疫保护率,与亲本株SL1344ΔsseK1的免疫保护力基本一致,这可能与sseK1基因作为T3SS的一种调节底物,缺失后能够降低或终止对某些免疫原性基因的易位和表达产物的分泌有关,但具体机制尚需要进一步验证。
总之,本研究成功构建了鼠伤寒沙门菌SL1344株ΔsseK1Δasd缺失株平衡致死系统,并对其生物学特性进行了检测。研究表明,外源质粒PYA3493能够稳定存在于该系统中,并具有遗传稳定性,这与张俊峰等[10]报道的猪霍乱沙门菌的结果一致,该系统能够克服外源基因不能稳定遗传的问题,同时,该系统没有任何抗生素基因的标记,不会带来生物安全问题,并且毒力发生了明显的降低,具有较好的免疫原性,为进一步将减毒鼠伤寒沙门菌开发为一种更加安全高效的口服多价疫苗活载体提供了新的靶点。
[1] Chalker RB,Blaser MJ.A review of human salmonellosis:III.Magnitude of Salmonella infection in the United States[J].Rev Infect Dis,1988,10(1):111-124.
[2] Nguyen VH,Kim HS,Ha JM,etal.Genetically engineered Salmonella typhimurium as an imageable therapeutic probe for cancer[J].Cancer Res,2010,70(1):18-23.
[3] Perugini AG,Carullo MR,Esposito A,etal.Characterization of antimicrobial resistant Salmonella enterica serovars Enteritidis and Typhimurium isolates from animal and food in Southern Italy[J].Vet Res Commun,2010,34(4):387-392.
[4] Lillehoj EP,Yun CH,Lillehoj HS.Vaccines against the avian enteropathogens Eimeria,Cryptosporidium and Salmonella[J].Anim Health Res Rev,2000,1(1):47-65.
[5] Hur J,Lee JH.Enhancement of immune responses by an attenuated Salmonella enterica serovar typhimurium strain secreting an Escherichia coli heat-labile enterotoxin B subunit Protein as an adjuvant for a live Salmonella vaccine candidate[J].Clin Vaccine Immunol,2011,1(2):203-209.
[6] Curtiss R 3rd,Galan JE,Nakayama K,etal.Stabilization of recombinant avirulent vaccine strains in vivo[J].Res Microbiol,1990,141(7-8):797-805.
[7] 徐引第,郭爱珍,刘维红,等.猪霍乱沙门氏菌C500株ΔcrpΔasd缺失株平衡致死系统的构建及鉴定[J].生物工程学报,2006,22(3):366-372.
[8] 陈松彪,李 静,尚 珂,等.鸡白痢沙门菌C79-13ΔcrpΔasd平衡致死系统的构建及其生物学特性的研究[J].中国免疫学杂志,2014,30(8):1083-1087,1092.
[9] Spreng S,Dietrich G,Weidinger G,etal.Rational design of Salmonella-based vaccination strategies[J].Methods,2006,38(2):133-143.
[10] 张俊峰,张春杰,程相朝,等.减毒猪霍乱沙门菌△cya△asdC78-1宿主-载体平衡致死系统的构建及其生物学特性研究[J].中国预防兽医学报,2015,37(5):366-370.
[11] Galán JE,Nakayama K,Curtiss R.Cloning and characterization of the Δasd gene of Salmonella typhimurium:use in stable maintenance of recombinant plasmids in Salmonella vaccine strains[J].Gene,1990,94(1):29-35.
[收稿2017-05-26]
(编辑 张晓舟)
Constructionandcharacterizationofhost-vectorbalancedlethalsystemofattenuatedSalmonellatyphimuriumSL1344ΔsseK1Δasd
YANGYa-Dong,DINGKe,ZHANGChun-Jie,CHENGXiang-Chao,JIAYan-Yan,HELei.
TheKeyLaboratoryofAnimalDiseaseandPublicHealth,HenanUniversityofScienceandTechnology/LuoyangKeyLaboratoryofLiveCarrierBiomaterialandAnimalDiseasePreventionandControl,Luoyang471023,China
Objective:To develop a host-vector balanced lethal system of attenuated Salmonella typhinurium secreted effector K1 mutant,and an live vaccine vector which stably carries exogenous genes.MethodsWe constructed SL1344ΔsseK1Δasd mutant strain by recombinant suicide plasmid(pREΔasd),and screened by two-step method,transformed pYA3493 plasmid containing the asd gene without resistance electric into the mutant strain of SL1344ΔsseK1Δasd,then the recombinant strain SL1344ΔsseK1Δasd(pYA3493) was constructed successfully.ResultsThe results of PCR and sequencing showed that SL1344ΔsseK1Δasd(pYA3493)was constructed successfully.Further studies had shown that the serotype of the recombinant strain was identical to the parent SL1344ΔsseK1 and wild SL1344 strains,and the mutant was stable with the recombinant Δasd gene in vitro.It was found that the recombinant strain had displayed identical growth profile and biochemical characteristics compared with the parent SL1344ΔsseK1 strain and wild SL1344 strain.The oral challenge of bacteria in mice revealed that LD50 of the recombinant strain was 5.24×108CFU,and the toxicity reduced to about 0.048%;the immunoprotective effect assay showed that the protection rate infected with wild strain of Salmonella typhimurium was 62.5% on the 17th day post-immunization,which was identical to the parent SL1344ΔsseK1.ConclusionThese results show that the secreted effector K1 gene deleted mutant host-vector balanced lethal system of Salmonella typhimurium SL1344 strain has been successfully constructed,and genetic stability,significantly reduced virulence,which has laid a foundation for developing potential oral live vaccin vector to express foreign genes.
Salmonella typhimurium;Suicide plasmid;Host-vector balanced lethal system;Live vaccine vector
①本文受河南省科技攻关项目(112102110019)资助。
S852.612
A
1000-484X(2017)10-1520-06
10.3969/j.issn.1000-484X.2017.10.016
杨亚东(1990年-),男,在读硕士,主要从事人畜共患病的诊断和防治研究,E-mail:youngyadong@139.com。
及指导教师:张春杰(1964年-),女,博士,教授,硕士生导师,主要从事动物疫病防控和分子免疫学方面的研究,E-mail:cjzhang@sina.com。

