基于生源合成途径代谢产物质证黄花菜中含秋水仙碱
刘秀斌,汤敏娜,黄嘉璐,曾建国*
基于生源合成途径代谢产物质证黄花菜中含秋水仙碱
刘秀斌1a,2,汤敏娜1b#,黄嘉璐2,曾建国1a,2*
(1.湖南农业大学a.园艺园林学院;b.食品科学技术学院,湖南长沙410128;2.湖南省植物功能成分利用协同创新中心,湖南长沙410128)
基于已解析的秋水仙中秋水仙碱生源合成途径,采用–四级杆/飞行时间质谱联用(HPLC–Q/TOF MS)方法,检测黄花菜和秋水仙样本中秋水仙碱生源合成途径中的中间代谢产物(以下简称中间代谢物)。结果从黄花菜样本中未检出中间代谢物和终产物秋水仙碱,而在秋水仙样本中均能检出中间代谢物和秋水仙碱,其中的中间代谢物秋水仙胺(Cp5)、去乙酰基秋水仙碱(Cp6)和终产物秋水仙碱(Cp7)已进一步经对照品确证,因此认为食用黄花菜中不存在秋水仙碱的生源合成途径,也不含秋水仙碱。
黄花菜;秋水仙碱;生源合成途径;中间代谢产物
黄花菜(Baroni)又称忘忧草、金针菜、柠檬萱草,属于百合科萱草属植物。有报道[1]认为新鲜黄花菜中含有秋水仙碱,如果加工处理不当,食用新鲜黄花菜后会出现头痛、恶心、呕吐、腹泻等症状。本课题组前期采用HPLC–Q/ TOF MS方法,对采集于9个不同产地的食用黄花菜不同部位的新鲜样、冻干样和烘干样(共156个样品)进行分析,均未检出秋水仙碱,已初步证实了食用黄花菜中不含秋水仙碱[2]。
NASREEN等[3–7]的研究表明,秋水仙碱在秋水仙植株内最初是由多巴胺和4–羟基苯丙醛缩合反应生成Autumnaline (秋丽碱,Cp1),再经过Isoandro- cymbine(Cp2)→–Methylandrocymbine(Cp3)→– Formyldemecolcine(–甲酰秋水仙胺,Cp4)→ Demecolcine(秋水仙胺,Cp5)→Deacetylcolchicine (去乙酰基秋水仙碱,Cp6)→Colchicine (秋水仙碱,Cp7)的生源途径合成,得到终产物秋水仙碱。
根据已解析的秋水仙中秋水仙碱生源合成途径,可以清楚了解秋水仙碱生源合成前体化合物的结构。若黄花菜中存在秋水仙碱,则应该存在对应的秋水仙碱生源合成途径,那么黄花菜中参与秋水仙碱生源合成的中间代谢物必然会在植物体内留下印迹而被仪器所检识。本试验中采用灵敏度高、专属性强的HPLC–Q/TOF MS检测方法,对黄花菜样品中的秋水仙碱生源合成中间代谢物进行检识,旨在从生源合成途径的角度进一步探寻黄花菜中是否存在秋水仙碱。
1 材料与方法
1.1 材料与试剂及仪器设备
试验材料:黄花菜(Baroni,冲里花,湖南祁东)的花蕾;秋水仙(Pleniflorum,玫瑰重瓣秋水仙,英国)的球茎。另外有四川渠县、甘肃大庆、陕西大荔、山西大同、湖南长沙、辽宁沈阳、德国、江苏等不同产地的黄花菜不同部位(根、茎、叶、花)的156个试验材料,其详细信息见文献[2]。
对照品:秋水仙胺(Cp5,Toronto Research Chemicals,批号为D230785);去乙酰基秋水仙碱(Cp6,Toronto Research Chemicals,批号为D198920);秋水仙碱(Cp7,中国食品药品检定研究院,批号为101176–201202)。
主要试剂:甲醇、超纯水、乙腈(色谱级,默克化工技术(上海)有限公司);无水乙醇(分析纯,安徽安特生物化学有限公司);甲酸(色谱级,美国天地有限公司(上海))。
主要仪器设备:超高效液相色谱–四级杆飞行时间质谱联用仪(1290–6530,安捷伦科技有限公司,美国);冷冻干燥机(18N,宁波新芝生物科技股份有限公司,浙江);冷冻离心机(5430R,艾本德公司,德国);超纯水制备仪(Milli–Q Advantage A10 系统,密理博公司,美国);粉碎机(YS–02,北京燕山正德机械设备有限公司,北京);超声波清洗器(KQ– 5200DE,昆山市超声仪器有限公司,浙江);电热恒温鼓风干燥箱(DHG–9246A型,上海精宏实验设备有限公司,上海);分析天平(梅特勒–托利多仪器有限公司,上海);色谱柱(Xaqua C18,华谱新创科技有限公司,浙江);无菌注射器(5 mL,圣光医用制品有限公司,河南);0.22 μm有机相/水相通用针式滤器及样品瓶(北京八方世纪科技有限公司,北京);移液枪(艾本德公司,德国)。
1.2 方法
1.2.1对照品溶液的制备
用分析天平分别精密称取秋水仙胺、–去乙酰基秋水仙碱、秋水仙碱对照品各0.005 00 g,分别置于25 mL棕色容量瓶中,用甲醇超声溶解冷却至室温后定容至刻度,摇匀,即得0.2 mg/mL对照品储备液。分别取50 μL秋水仙胺、–去乙酰基秋水仙碱、秋水仙碱储备液至10 mL棕色容量瓶中,用甲醇定容至刻度,摇匀,即得1 μg/mL 对照品溶液,备用。
1.2.2供试品溶液的制备
取新鲜的试验材料30 g,经液氮预冷后粉碎,即刻用分析天平精确称取5.000 g,置于具塞磨口锥形瓶中,加入85%乙醇35 mL,密塞封膜并振荡均匀,在25 ℃下超声提取2 h(功率250 W,频率50 kHz)后静置2 min,取10 mL上清液至具塞离心管中,用冷冻离心机离心(25 ℃,6 700 r/min)10 min,随后用无菌注射器吸取2 mL上清液,过0.22 μm微孔滤膜,滤液置于液相小瓶中,备用[2]。
1.2.3HPLC–DAD–Q/TOF MS检测[2]
色谱条件:色谱柱,华谱X–aqua C18(2.1 mm×150 mm,5 μm);流动相,水相(A)为0.1%甲酸,有机相(B)为0.1%甲酸乙腈;梯度洗脱程序为0~3 min,90%~85% A,3~8 min,85%~70% A,8~16 min,70%~35% A,16~21 min,35%~5% A,21~25 min 5% A,25.1~30 min 90% A;柱温35 ℃;流速0.3 mL/min;进样量2 μL。
质谱条件:离子源为Dual AJS ESI源;采用正离子全扫描模式;扫描范围100~1 000;鞘气温度350 ℃;鞘气流速11.0 L/min;干燥气温度345 ℃;干燥气压力0.31 MPa;干燥气流速10 L/min;毛细管电压4 000 V;碎裂电压135 V;干燥气和鞘气均为高纯氮气。
1.2.4数据处理
数据采集、处理软件为Agilent MassHunter Workstation Software (B.05.00)。数据处理方法:在样品的总离子流色谱图(TIC)中分别提取秋丽碱(Cp1)、Isoandrocymbine(Cp2)、–Methylandrocymbine (Cp3)、–甲酰秋水仙胺(Cp4)、秋水仙胺(Cp5)、–去乙酰基秋水仙碱(Cp6)、秋水仙碱(Cp7)的[M+H]+理论精确分子量()374.196 2、372.180 5、386.196 2、400.175 5372.180 5、358.164 9、400.175 5,质量偏差范围为0.002 5。
若能在样品TIC中提取出Cp5、Cp6和Cp7的离子色谱峰(EIC),且EIC中保留时间()与Cp5、Cp6和Cp7的对照品的保留时间一致,EIC中的精确分子量与Cp5、Cp6和Cp7的对照品的精确分子量一致,则认为样品中存在秋水仙胺、–去乙酰基秋水仙碱和秋水仙碱;反之,则不存在。
若样品中能提取Cp1、Cp2、Cp3和Cp4离子色谱峰(EIC),对EIC中一级质谱数据的高分辨质量数采用Masshunter软件中Genreate Formulas From Spectrum Peaks功能生成分子式,若生成的分子式与理论分子式一致,且同位素丰度和高分辨质量数匹配分数大于90,则认为样本中可能存在该化合物;反之,则不存在。
2 结果与分析
2.1 对照品HPLC–DAD–Q/TOF MS定性分析结果
秋水仙胺(Cp5)、–去乙酰基秋水仙碱(Cp6)、秋水仙碱(Cp7)对照品按1.2.1制备,并按1.2.3中色谱和质谱条件进行LC–MS检测,Cp5、Cp6、Cp7对照品总离子流色谱图及质谱图见图1。

2.2 秋水仙样本中秋水仙碱生源合成中间代谢产物的HPLC–Q/TOF MS定性分析
秋水仙样本按1.2.2制备成供试液,并按1.2.3色谱质谱条件进行LC–MS检测,按照1.2.4进行数据分析。结果(图2)显示,从秋水仙球茎样本总离子流图中能提取出中间代谢产物秋丽碱(Cp1)、Isoandrocymbine (Cp2)、–Methylandrocymbine (Cp3)、–甲酰秋水仙胺(Cp4)、秋水仙胺(Cp5)、去乙酰基秋水仙碱(Cp6)及终产物秋水仙碱(Cp7)的[M+H]+精确分子量的提取离子色谱峰,中间代谢物Cp1、Cp2、Cp4、Cp5、Cp6及终产物 Cp7均存在同分异构体色谱峰,其中Cp5、Cp6和Cp7进一步经对照品保留时间和精确质量数确证,分别是保留时间为9.08、8.70、11.29 min的色谱峰。另外,中间代谢物Cp1、Cp2、Cp3、Cp4检出的EIC质谱图中的目标高分辨质量数生成分子式分别为C21H27NO5、C21H25NO5、C22H27NO5、C22H25NO6,且匹配分数均大于95,与文献[4–6]报道的分子式一致。以上试验结果说明秋水仙样本中存在秋水仙碱生源合成途径中直接前体Cp6和中间体Cp5,还很有可能存在秋水仙碱生源合成的其他前体化合物Cp1、Cp2、Cp3、Cp4。

2.3 黄花菜中秋水仙碱生源合成途径中间代谢产物的HPLC–Q/TOF MS定性分析
结果(图3)显示,从黄花菜新鲜花样本总离子流图中没有提取出中间代谢物秋丽碱(Cp1)、Isoandrocymbine(Cp2)、–Methylandrocymbine (Cp3)、–甲酰秋水仙胺(Cp4)、秋水仙胺(Cp5)、去乙酰基秋水仙碱(Cp6)及终产物秋水仙碱(Cp7)精确分子量的提取离子色谱峰,说明在黄花菜新鲜花样本中未能检出已报道秋水仙碱生源合成途径中的中间代谢产物。另外对本课题组前期报道的来源于9个不同产地的156个食用黄花菜不同部位的新鲜样、冻干样和烘干样[2]进行秋水仙碱生源合成中间代谢物分析,结果均未检出秋水仙碱生源合成中间代谢物,说明食用黄花菜中不存在秋水仙碱生源合成途径中的中间代谢产物,亦不存在秋水仙碱的生源合成途径。
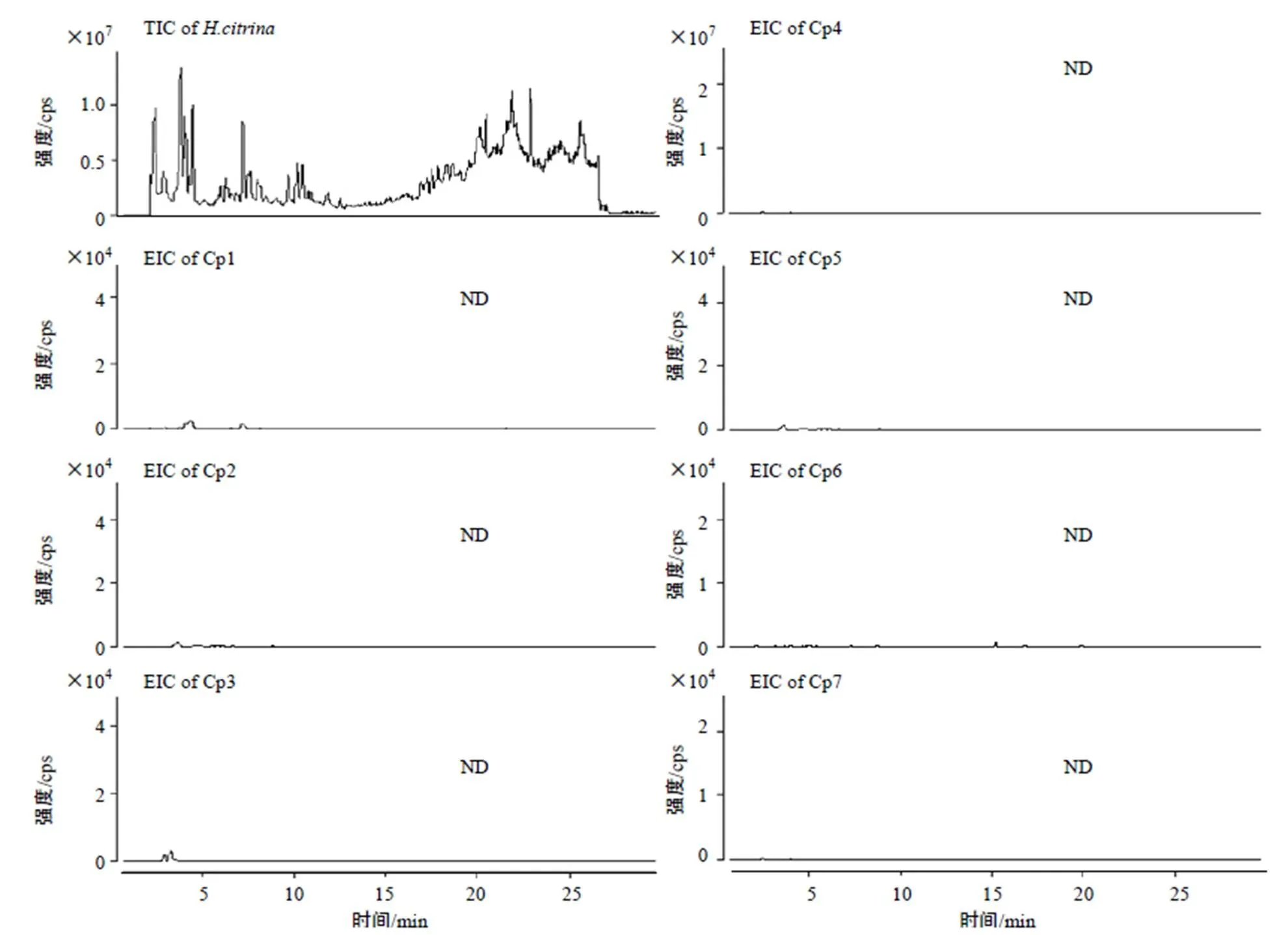
“ND”示未检出。
3 结论
笔者采用HPLC–Q/TOF MS分析方法,对黄花菜样本中秋水仙碱生源合成中间代谢产物进行检测。结果显示,在供试黄花菜样本中均未检出已报道的秋水仙碱生源合成途径中的中间代谢产物及终产物秋水仙碱,而在秋水仙的球茎样本中均能检出这些物质。结合本课题组前期报道的在大量黄花菜样本中均未检出秋水仙碱[2]的结果,认为从秋水仙碱生源合成途径的角度再一次证明了食用黄花菜中不存在秋水仙碱。
[1] 关颖.中毒患者血清中秋水仙碱的快速检验[J].中国卫生检验杂志,2001(5):625–626.
[2] 汤敏娜,刘秀斌,黄嘉璐,等.食用黄花菜中含秋水仙碱的质证研究[J].中草药,2016(18):3293–3300.
[3] NASREEN A,RUEFFER M,ZENK M H.Cytochrome P–450–dependent formation of isoandrocymbine from autumnaline in colchicine biosynthesis[J].Tetrahedron Letters,1996,37(45):8161–8164.
[4] BARKER A C,JULIAN D R,RAMAGE R,et al. Biosynthesis.Part 28.Colchicine:definition of intermediates between–methylandrocymbine and colchicine and studies on speciosine[J].Journal of the Chemical Society–Perkin Transactions 1,1998(18):2989–2994.
[5] WOODHOUSE R N,MCDONALDE,RAMAGE R,et al.Biosynthesis.Part 29.Colchicine:studies on the ring expansion step focusing on the fate of the hydrogens at C–3 of autumnaline[J].Journal of the Chemical Society–Perkin Transactions 1,1998(18):2995–3001.
[6] SHELDRAKE P W,SUCKLING K E,WOODHOUSE R N,et al.Biosynthesis.Part 30.Colchicine:studies on the ring expansion step focusing on the fate of the hydrogens at C–4 of autumnaline[J].Journal of the Chemical Society–Perkin Transactions 1,1998(18):3003–3009.
[7] RUEFFER M,ZENK M H.Microsome–mediated transformation of–methylandrocymbine to demecolcine and colchicine[J].Febs Letters,1998,438(1/2):111–113.
责任编辑:苏爱华
英文编辑:梁 和
Based on metabolites of biosynthetic pathway to research on whether day lily(Baroni)contains colchicine
LIU Xiubin1a,2, TANG Minna1b#, HUANG Jialu2, ZENG Jianguo1a,2*
(1.a. College of Horticulture and Landscape; b.College of Food Science and Technology, Hunan Agricultural University, Changsha 410128, China; 2.Hunan Collaborative Innovation Center for Utilization of Functional Ingredients from Botanicals, Changsha 410128, China)
Based on parsed colchicine biosynthetic pathway inL.(), the intermediate metabolites of colchicine biosynthetic pathway (IMCBP) were analyzed by HPLC–Q/TOF MS inBaroni () andsamples. The result showed that IMCBP was found inbut notdetected insamples. Demecolcine (Cp5),deacetylcolchicine(Cp6) and colchicine(Cp7)were confirmed by authentic standard substances. The results support that there are no colchicine biosynthetic pathway and colchicine in
Baroni; colchicine; biosynthetic pathway; metabolite
S644.3
A
1007-1032(2017)05-0485-05
2016–10–24
2017–04–23
国家科技支撑计划项目(2012BAI29B04)
刘秀斌(1988—),男,湖南邵阳人,博士研究生,主要从事药用植物功能成分分析研究,xiubin_liu@163.com;#并列第一作者,汤敏娜(1992—),女,湖南长沙人,硕士研究生,主要从事食品成分分析,545574941@qq.com;*通信作者,曾建国,博士,教授,主要从事中药资源综合利用研究,zengjianguo@hunau.edu.cn
投稿网址:http://xb.hunau.edu.cn

