水稻谷氨酰胺合成酶同工型基因转录表达量与启动子结构关系分析
金正勋,李 丹,李明月,同拉嘎,潘 冬,张玉磊,王海微,韩云飞,张忠臣
(东北农业大学农学院,哈尔滨 150030)
水稻谷氨酰胺合成酶同工型基因转录表达量与启动子结构关系分析
金正勋,李 丹,李明月,同拉嘎,潘 冬,张玉磊,王海微,韩云飞,张忠臣
(东北农业大学农学院,哈尔滨 150030)
研究选用籽粒蛋白质含量差异显著的5个品种(系),比较分析品种间GS同工型基因在灌浆过程中籽粒和叶片表达特性及启动子序列与结构特点。结果表明,不同品种间OsGS同工型基因表达量差异显著;OsGS1;1和OsGS1;2基因在籽粒和叶片中大量表达;OsGS1;3和OsGS2基因分别仅在籽粒和叶片中大量表达;在灌浆过程中籽粒和叶片中OsGS同工型基因mRNA表达量均呈单峰曲线变化,灌浆前期mRNA表达量平稳升高,中期出现峰值,后期快速降低,且高蛋白质含量品种mRNA表达量高于低蛋白质含量品种。籽粒蛋白质含量差异显著品种间OsGS同工型基因启动子序列同源性高达99%以上;品种间有性杂交子代OsGS同工型基因启动子序列可发生碱基变化,但启动子核心元件无变化。在调控元件数量和功能上OsGS同工型基因启动子保守性很强,启动子在结构和功能上不易发生遗传变异,籽粒OsGS同工型基因mRNA表达量变化受OsGS基因启动子调控影响较小。
水稻;超亲变异系;谷氨酰胺合成酶基因;转录表达;启动子序列
谷氨酰胺合成酶(Glutamine synthetase,GS)为调控籽粒蛋白合成关键酶之一,与植物中GS活性、GS基因表达量及其蛋白质含量密切相关[1]。Bernard等利用转基因技术沉默油菜GS2基因后发现转基因油菜蛋白质含量显著下降[2]。在GS1基因过表达杨树植株中发现叶总可溶性蛋白质含量增加[3-4]。GS在水稻中有2个同工型酶,即GS1和GS2,其中GS1由OsGS1;1,OsGS1;2和 OsGS1;3基因共同编码[5],而GS2仅一个成员OsGS2。
基因启动子中含基因转录表达调控元件,启动子序列和结构变异可能引起启动子活性和功能变化,影响下游结构基因mRNA水平变化。近年研究通过克隆基因启动子序列,分析不同材料间启动子活性差异原因。GS基因表达调控始于GS启动子[6]。Cai等研究表明,转GS1启动子植株叶片中GS活性及可溶性蛋白质含量显著提高[7]。Takaiwa等通过克隆2.3和1.3 kb GluB-1启动子片段,发现其表达模式相似,但前者活性为后者10倍,2.3 kb启动子中存在一个或多个ACGT基序[8]。
品种间有性杂交是选育新品种主要途径,稻米籽粒中蛋白质含量是影响蒸煮食味品质重要内在因素之一。然而,有关品种间有性杂交后代结构基因启动子碱基序列变异与其转录表达量间关系研究较少。因此,本研究选用籽粒蛋白含量较高籼稻品种马尾占及遗传背景相似但籽粒蛋白质含量差异显著粳稻亲本和杂交子代为供试材料,分析水稻灌浆过程中GS基因mRNA表达特性及其与GS启动子序列和结构变化间关系,旨在深入了解GS基因启动子结构特点及其与转录水平上调控关系,为解析基因分子调控机理提供理论依据。
1 材料与方法
1.1 材料
选用籽粒蛋白质含量差异显著五个水稻品种(系),即亲本系选1号和通769及子代稳定品系东农1601和东农1624及籼稻品种马尾占,其籽粒蛋白质含量分别为9.52%、8.24%、7.81%、10.18%、14.50%。2016年在哈尔滨东北农业大学农学院开展盆栽试验,盆规格为长60 cm×宽40 cm×高40 cm。为使抽穗期尽量一致,4月初按供试材料生育期分期播种,大钵体育秧盘,每穴播催芽籽3粒,大棚旱育秧管理,5月中旬选取长势一致秧苗等距离插秧,每个品种插4盆,每盆插8穴,每穴插3棵,正常水肥管理。
取样方法参照文献[9],抽穗时以穗部抽出叶鞘3 cm为准挂牌标记抽穗日期,分别在抽穗后10、20、30 d取同一天抽穗和剑叶,取剑叶中间部分5 cm,籽粒取灌浆程度基本一致的穗中部籽粒,低温去颖壳,叶片和籽粒迅速放入液氮冷冻处理,-80℃保存,用于荧光定量分析。
1.2 方法
1.2.1 RNA提取与qRT-PCR扩增
取-80℃冰箱中叶片和籽粒,采用Trizol法分别提取总RNA,加入RNase-free DNase I消除基因组DNA污染,NOVA反转录试剂盒(Nova,购自江苏愚公生命科技有限公司)合成cDNA。根据NCBI公布GS基因序列及RNA序列,OsGS1;1(GeneBank:AK109397)、OsGS1;2(GeneBank:AB180688.1)、OsGS1;3(GeneBank:AK063913)及 OsGS2(Gene-Bank:AK065491),用Primer 5.0软件设计qRTPCR引物(见表1),NCBI网站上作Blast比对,保证引物专一性。以cDNA为模板,UBI5为内参基因,参照Taq SYBR®Green qPCR试剂盒作qRT-PCR,每个样品重复3次。参照基因ΔCT法[10],依据公式 ΔCT = 2Ct(reference)-Ct(target)计算目标基因相对表达量。其中,Ct(reference)和Ct(target)分别为内参基因表达量和目标基因达到设定荧光值时扩增循环次数。采用SPSS17.0软件分析数据。

表1 引物序列Table 1 Primer sequences
1.2.2 启动子克隆与载体构建
大肠杆菌感受态细胞DH5α和载体QBV-3由中国科学院东北地理与农业生态研究所提供。PrimeSTAR®HS DNA Ploymerase、 DL 5000 DNA Marker vector、EcoR V限制性核酸内切酶均购自宝生物工程有限公司;ClonExpress®ⅡOne Step Cloning Kit购自中国哈尔滨诺唯赞生物科技有限公司;DNA凝胶回收Kit购自美国Thermo Fisher Scientific。使用方法参照产品说明。采用改良酚抽提法提取水稻叶片基因组DNA。在国家水稻数据中心(http://www.ricedata.cn/index.htm)查找OsGS基因,获取其基因序列,用Primer 5.0软件设计引物,引入EcoR V酶切位点(见表1)。
参照Primer STAR HS DNA Polymerase说明书作PCR特异性扩增,PCR反应体系(20 μL):5× PrimeSTAR Buffer(Mg2+Plus) 4.0 μL, dNTP Mixture(2.5 mmmol· L-1each)1.6 μL, Forward Primer 0.8 μL,Reverse Primer 0.8 μL,DNA模板 1.0 μL,Primer STAR HS DNA Polymerase(2.5 U·μL-1)0.2 μL,灭菌超纯水 11.6 μL。PCR 反应条件为:98℃预变性5 min;98℃ 10 s;65℃ 10 s;72℃ 2 min,作30个循环;72℃延伸10 min,最后16℃保温 10 min。
扩增产物在1%琼脂糖凝胶电泳上分离,DNA琼脂糖凝胶回收试剂盒回收目的片段,将回收目的片段通过克隆试剂盒连接到克隆载体pQBV-3,用热激法将构建克隆载体pQBV-3转化到大肠杆菌感受态细胞DH5α中,涂布在含有氯霉素(25 μg·mL-1)LB培养基平板上,37℃培养箱倒置培养16~20 h。挑取LB培养基上单克隆作PCR鉴定。鉴定出阳性克隆活化摇菌,提取质粒,将部分质粒送上海生工公司测序。
利用 NCBI在线比对工具 Blast对所得序列作同源性分析。PlantCARE(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)在线分析启动子序列中潜在顺式作用元件。
2 结果与分析
2.1 灌浆不同时期叶片和籽粒谷氨酰胺合成酶同工型基因mRNA表达量比较
由表2可知,OsGS1;1和OsGS1;2在籽粒和叶片中表达量均较大,OsGS1;3和 OsGS2分别仅在籽粒和叶片中表达,不同组织中OsGS基因表达水平差异显著。蛋白质含量差异显著的5份供试材料,谷氨酰胺合成酶同工型基因mRNA表达量变化趋势基本一致,4个同工型基因在水稻灌浆进程中呈单峰曲线变化,随灌浆进程mRNA表达量逐 渐升高,达到峰值后快速下降,峰值出现在灌浆中期。
在灌浆过程中,5份供试材料籽粒中OsGS1;3基因mRNA表达量分别较同时期OsGS1;1和OsGS1;2高;在叶片中OsGS2基因mRNA表达量分别较同时期OsGS1;1和OsGS1;2高,说明OsGS1;3基因主要在籽粒中表达,OsGS2基因主要在叶片中表达。

表2 灌浆不同时期谷氨酰胺合成酶同工型基因mRNA表达量比较Table 2 Expression comparison of glutamine synthase gene mRNA in different stages of grain filling
此外,灌浆中期籽粒蛋白质含量最高的籼稻品种马尾占籽粒3个GS同工型基因和叶片OsGS1;2与OsGS2基因mRNA表达量均显著或极显著高于其他4个供试材料。蛋白质含量差异显著的4个品种,在灌浆中期,高蛋白亲本系选1号及子代东农1624的OsGS同工型基因mRNA表达量均显著或极显著高于低蛋白质亲本通769及子代东农1601,并且高蛋白子代东农1624 mRNA表达量显著高于高蛋白亲本系选1号,而低蛋白子代东农1601 mRNA表达量显著低于低蛋白亲本通769。说明在籽粒灌浆过程中OsGS同工型基因mRNA表达量与籽粒蛋白质含量密切相关,籽粒蛋白质含量高品种其OsGS同工型基因mRNA表达量也高,可产生超亲变异。
2.2 供试材料GS同工型基因启动子长度比较
以5个供试材料基因组DNA为模板,利用引物P1/P2、P3/P4、P5/P6、P7/P8分别扩增OsGS同工型基因启动子,获得与预期片段大小相近条带(见图1)。由表3可知,系选1号、通769、东农1601、东农1624、马尾占等5个供试材料OsGS1;1基因启动子长度均为1 977 bp,OsGS1;2基因启动子长度为1 812~1 814 bp,OsGS1;3基因启动子长度为1 547~1 548 bp,OsGS2基因启动子长度为1 837~1 847 bp。
图1 OsGS1;1、OsGS1;2、OsGS1;3和OsGS2基因启动子序列的PCR扩增Fig.1 PCR amplification of OsGS1;1、OsGS1;2、OsGS1;3 and OsGS2 promoter sequence

表3 供试材料间OsGS同工型基因启动子长度比较Table 3 Length comparison of OsGS promoter gene between the tested materials
2.3 供试材料OsGS同工型基因启动子序列比较
不同供试材料OsGS1;1、OsGS1;2、OsGS1;3、OsGS2基因启动子序列与GenBank数据库中日本晴OsGS基因启动子序列比对(见表4)。在系选1号、通769、东农1601和东农1624中OsGS1;1基因启动子序列与日本晴完全一致,但马尾占有11个位点碱基发生变化;系选1号、通769和东农1601品种其OsGS1;2基因启动子序列与日本晴完全一致,而东农1624和马尾占品种的启动子序列分别有2个和3个位点碱基发生变化;OsGS1;3基因启动子中仅马尾占有1个位点碱基发生变化,其他品种均无变化;在OsGS2基因启动子中马尾占有5个位点碱基发生变化,而系选1号有2个位点碱基发生变化,通769有3个位点碱基发生变化,东农1601和东农1624仅1个位点碱基发生变化。用PlantCARE和PLACE数据库预测各材料不同基因启动子元件发现,上述个别位点碱基变化并未改变启动子调控元件功能,说明水稻有性杂交子代OsGS基因启动子序列虽然发生个别位点碱基变化,但启动子调控元件功能保守性较强。
2.4 供试材料OsGS同工型基因启动子结构比较
本试验通过比较不同材料中4种OsGS同工型基因ATG上游约2 000 bp序列中顺式作用元件差异,归纳不同OsGS同工型基因启动子中重要顺式作用元件数目,结果见表5。
由表5可知,在4个GS同工型基因启动子中均含有TATA-box、CAAT-box、光响应元件、MYB结合位点、水杨酸响应元件和胚乳表达相关元件、茉莉酸甲酯(MeJA)响应元件、赤霉素响应元件、脱落酸响应元件等核心元件,且供试品种间核心元件数目无差异,但不同基因启动子所含重要作用元件在数目上存在差异。4个同工型基因启动子含多个光响应元件,其中OsGS1;2和OsGS1;3基因启动子分别含有4个和3个MYB结合位点,而OsGS1;1和OsGS2基因启动子仅含1个;OsGS1;1、OsGS1;2和OsGS1;3基因启动子均含有水杨酸响应元件;OsGS1;1、OsGS1;2、OsGS1;3和OsGS2基因启动子均含有胚乳表达相关元件和茉莉酸甲酯(MeJA)响应元件,其中OsGS1;3基因启动子中含有5个与胚乳表达相关顺式调控元件,包括2个GCN4 motif和 3 个 Skn-1_motif, 而 OsGS1;1 含 有3个Skn-1_motif及1个GCN4 motif,OsGS1;2只含有3个Skn-1_motif,在OsGS2基因启动子中含有9个胚乳表达相关顺式调控元件(1个GCN4 motif和8个Skn-1_motif),1个醇溶蛋白响应元件,OsGS1;1和OsGS1;2基因中分别仅含有3个和4个胚乳表达相关元件,无醇溶蛋白响应元件;OsGS1;2和OsGS1;3基因启动子均含有赤霉素响应元件,OsGS1;1、OsGS1;3和OsGS2基因启动子均含有脱落酸响应元件。OsGS1;1和OsGS1;2基因启动子含有昼夜节律调节元件CAAATCCATC,OsGS1;2和OsGS1;3基因启动子含有高转录水平顺式作用元件TTTCTTCTCT,OsGS1;2基因启动子含有特异性元件GATAATGATG,OsGS2基因启动子还含有乙烯响应元件ATTTCAAA和生长素响应元件AACGAC及叶形态发展调控元件CAAT(G/C)ATTG。说明GS同工型基因启动子结构不完全一致,不同基因启动子在调控元件数量差异显著,但不同品种间GS同工型基因启动子结构一致, GS同工型基因表达与多种环境因素有关。
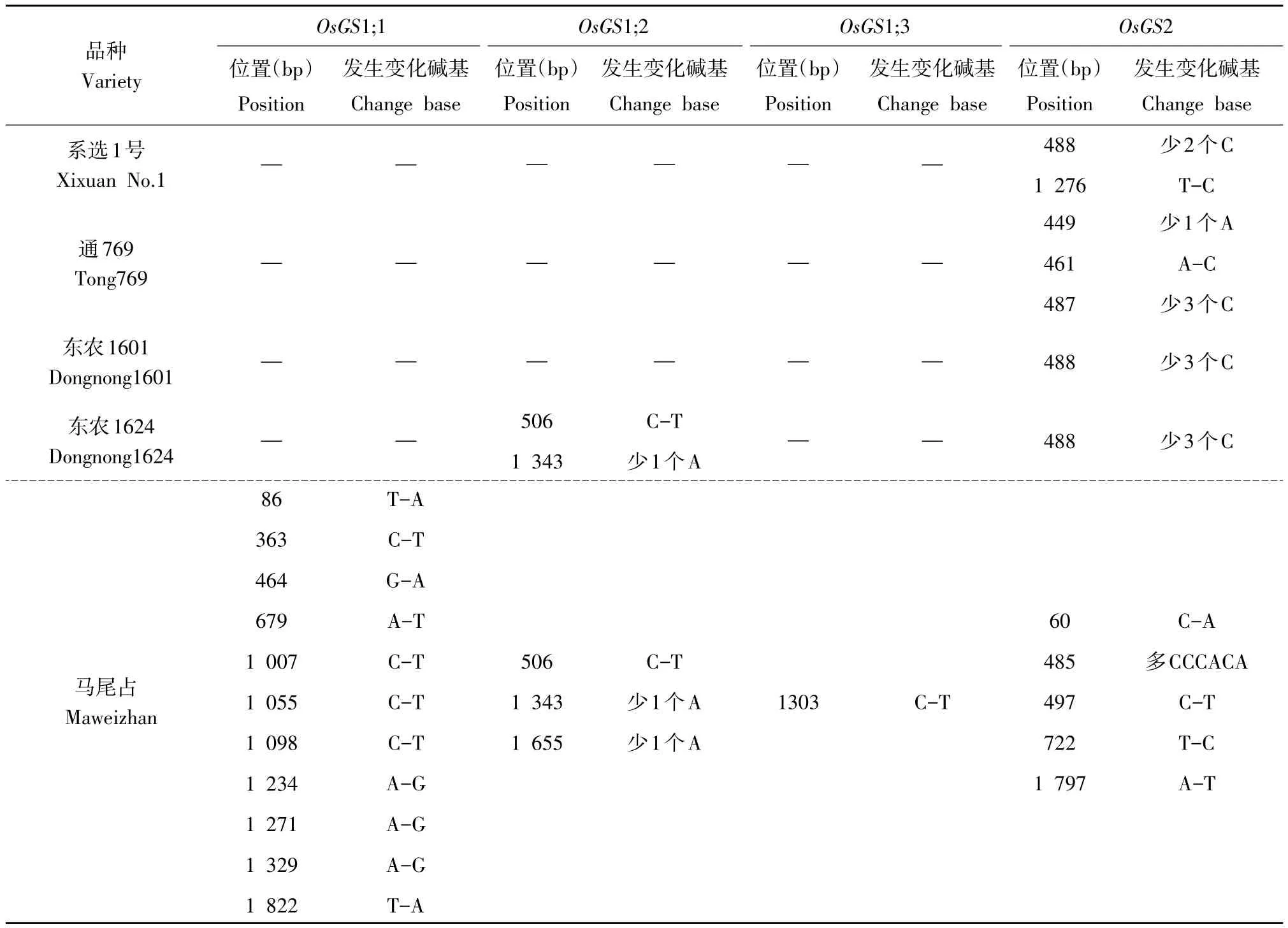
表4 供试材料OsGS同工型基因启动子序列比较Table 4 Sequence comparison of OsGS promoter gene between the tested materials

表5 GS同工型基因启动子顺式作用元件统计Table 5 Listing of the cis-trans elements on the promoters of glutamine synthetase genes in rice

续表
3 讨论与结论
OsGS同工型基因表达存在组织特异性,不同组织中OsGS基因表达水平之间差异显著,且OsGS同工型基因mRNA表达量与氮素利用效率和籽粒蛋白质含量密切相关。Tabuchi等研究发现,OsGS1;1在根和小穗等组织中均表达,OsGS1;2和OsGS1;3则主要在根和小穗中表达[11]。董芙荣等研究发现,OsGln1.1基因在穗和根系中均表达,且氮高效型品种OsGln1.1基因表达量高于氮低效型品种;OsGln1.2基因在叶片和根系中均表达,叶片中OsGln1.2基因表达量在氮高效型品种与氮低效型品种间差异不大,氮高效型品种OsGln1.2基因在根系中表达量高于氮低效型品种;OsGln2基因仅在茎秆中表达,氮高效型品种表达量高于氮低效型品种[12]。徐振华等发现,籽粒蛋白质含量不同的亲本及超亲变异系子代在籽粒灌浆过程中OsGS1.3和OsGS2基因mRNA表达量变化趋势基本一致,mRNA表达量在灌浆过程中逐渐增加,至抽穗后15~20 d达到最高值后逐渐下降,OsGS1.3和OsGS2基因mRNA表达量与籽粒蛋白质含量关系密切[13]。本试验结果与前人基本一致,在籽粒灌浆过程中OsGS同工型基因表达存在组织特异性,OsGS1;1和OsGS1;2基因在籽粒和叶片中均表达,OsGS1;3基因仅籽粒中表达,OsGS2基因仅叶片中表达;OsGS同工型基因在不同组织中表达水平差异显著;氮素利用效率和籽粒蛋白质含量不同品种OsGS同工型基因mRNA表达量也存在差异,籽粒蛋白质含量较高品种OsGS同工型基因mRNA表达量较高。因此,调控OsGS同工型基因mRNA在水稻中表达有望干扰氮代谢及氮素积累,提高氮素利用效率,改善稻米品质。
启动子为结构基因5'UTR上游DNA序列,其区域中各种特征元件序列和结构变异可影响基因表达水平变化。李俊等发现,不同材料Zm-NAS1基因启动子中多处单核苷酸多态性位点可引起表达水平差异,而Zm-NAS2基因启动子在不同材料中序列较为保守[14]。王昊龙等发现10个抗性淀粉含量不同小麦品种(系)SBEⅡa基因编码区上游2 896 bp序列相似性为99.92%,推测SBEⅡa基因启动子序列及结构变化可能并非造成SBEⅡa基因表达差异主要原因[15]。孙晓红等研究发现启动子区单核苷酸变异引起顺式作用元件种类和数量差异,引起基因表达量变化[16]。本研究与前人试验结果一致,籽粒蛋白质含量不同的品种OsGS同工型基因启动子序列长度存在差异,有性杂交子代OsGS基因启动子序列与亲本存在个别碱基差异,但不同品种OsGS同工型基因启动子调控元件数量和功能无变化。因此,本试验不同供试材料OsGS同工型基因mRNA表达量差异并非由启动子序列差异引起。另外,本研究分析发现,4个OsGS同工型基因启动子均含MYB转录因子结合位点,推测转录因子在转录表达过程中可能起重要作用,有待进一步研究。
路静等研究发现,基因启动子启动基因表达通常至少需要两种顺式元件,且不同调控元件种类、数量、顺序及距离可能影响转录起始与转录程度[17]。Wu等研究发现,不同水稻材料中编码谷蛋白OsGluB基因启动子中均含有调控谷蛋白基因在胚乳中特异性表达GCN4-motif顺式元件[18]。Yoshihara等研究发现,水稻中OsGluB基因启动子上游AACA和GCN4等两个顺式作用元件协同调控水稻谷蛋白基因特异性表达,当GCN4单独存在时只能增强启动子活性[19]。牟少亮等推测水稻Xa1基因启动子对MeJA具有强烈应答特性与启动子区2个MeJA应答元件(CGTCA-motif)有关[20]。本试验研究发现相同品种中不同OsGS同工型基因启动子结构不完全一致,在调控元件数量上存在差异,猜测不同OsGS同工型基因表达差异与启动子结构差异相关。因此,通过基因敲除等手段针对性地改变不同结构基因启动子结构,调节不同结构基因表达情况,是遗传改良目标性状重要途径。
[1] 莫良玉,吴良欢,陶勤南.高等植物GS/GOGAT循环研究进展[J].植物营养与肥料学报,2001,7(2):223-231.
[2] Bernard S M,Habash D Z.The importance of cytosolic glutamine synthetase in nitrogen assimilation and recycling[J].New Phytologist,2009,182(3):608-620.
[3] Fu J,Sampalo R,Gallardo F,et al.Assembly of a cytosolic pine glutamine synthetase holoenzyme in leaves of transgenic poplar leads to enhanced vegetative growth in young plants[J].Plant Cell&Environment,2003,26(3):411-418.
[4 ] Jing Z P,Gallardo F,Pascual M B,et al.Improved growth in a field trial of transgenic hybrid poplar overexpressing glutamine synthetase[J]. New Phytologist, 2004,164:137-145.
[5] Swarbreck S M,Defoin-platel M,Hindle M,et al.New perspectives on glutamine synthetase in grasses[J].Journal of Experimental Botany,2011,62(4):1511-1522.
[6] Marsolier M C,Carrayole E,Hirel B.Multiple functions of promoter sequences involved in organ-specific expression and ammonia regulation of a cytosolic soybean glutamine synthetase gene in transgenic Lotus corniculatus[J].The Plant Journal,1993,3(3):405-414.
[7] Cai H,Zhou Y,Xiao J,et al.Overexpressed glutamine synthetase gene modifies nitrogen metabolism and abiotic stress responses in rice[J].Plant Cell Report,2009,28(3):527-537.
[8] Takaiwa F,Oono K,Wing D,et al.Sequence of three members and expression of a new major subfamily of glutelin genes from rice[J].Plant Molecular Biology,1991,17(4):875-885.
[9] 金正勋,朱方旭,郭雪冬,等.不同施氮方法对粳稻灌浆成熟期蔗糖代谢相关酶活性及品质性状影响[J].东北农业大学学报,2016,47(6):1-7.
[10] Rajeevan M S,Ranamukhaarachi D G,Vernon S D,et al.Use of real-time quantitative PCR to validate the results of cDNA array and differential display PCR technologies[J].Methods,2001,25:443-451.
[11] Tabuchi M,Sugiyama K,Ishiyama K,et al.Severe reduction in growth rate and grain filling of rice mutants lacking OsGS1;1,a cytosolic glutamine synthetase1;1[J].Plant Journal of Cell&Molecular Biology,2005,42(5):641-51.
[12]董芙荣.不同氮效率基因型水稻氮代谢关键酶活性及其基因表达特征分析[D].扬州:扬州大学,2010.
[13] 徐振华,曲莹,刘海英,等.粳稻超亲变异系籽粒谷氨酰胺合成酶基因表达特性及序列变异分析[J].中国水稻科学,2016,30(3):304-312.
[14] 李俊,李岩,吴承来,等.玉米ZmNAS1和ZmNAS2基因启动子的克隆与序列分析[J].玉米科学,2012,20(1).15-23.
[15] 王昊龙,韩俊杰,李卫华,等.抗性淀粉含量不同的小麦品种(系)淀粉分支酶SBEⅡa和SBEⅡb基因多态性分析[J].新疆农业科学,2015,52(6):981-987.
[16] 孙晓红,陈明杰,潘迎捷.启动子克隆概述[J].食用菌学报,2002,9(3):57-62.
[17] 路静,赵华燕,何奕昆,等.高等植物启动子及其应用研究进展[J].自然科学进展,2004,14(8):856-862.
[18] Wu C,Washida H,Onodera Y,et al.Quantitative nature of the Prolamin-box,ACGT and AACA motifs in a rice glutelin gene promoter:minimal cis-element requirements for endosperm-specific gene expression[J].Plant Journal for Cell&MolecularBiology,2000,23(3):415-421.
[19] Yoshihara T,Washida H,Takaiwa F.A 45-bp proximal region containing AACA and GCN4 motif is sufficient to confer endosperm-specific expression of the rice storage protein glutelin gene,GluA-3[J].Febs Letters,1996,383(3):213-218.
[20] 牟少亮,官德义,林琳,等.水稻Xa1基因启动子的克隆及功能分析[J].植物遗传资源学报,2012,13(5):865-869.
Comparative analysis on gene expression and promoter sequence in rice glutamine synthetase/
JIN Zhengxun,LI Dan,LI Mingyue,TONG Laga,PAN Dong,ZHANG Yulei,WANG Haiwei,HAN Yunfei,ZHANG Zhongchen
(School of Agriculture,Northeast Agricultural University,Harbin,150030,China)
The experiment selected five rice cultivars with significant different in grain protein content to analyze gene expression and promoter sequence of glutamine synthetase(GS)and its structural features in grain and leaf at filling stage.The results showed that gene expression was significantly different in OsGSisoform among different cultivars.There was a lot of expression ofOsGS1;1 andOsGS1;2 in grain and leaf,OsGS1;3 only in grain andOsGS2 only in leaf to different extent.Gene expression of glutamine synthetase(GS)in grain and leaf exhibited one-peak-curve variation at filling stage,increased to the peak and then decreased quickly.In addition,OsGSexpression level was higher in high protein content cultivar than that in low protein content cultivar.Promoter sequence inOsGSgenes was more conservative,above 99%similarity in rice cultivars with significantly different protein contents.Base variation was found inOsGSpromoter sequence in progenies from cultivar crossing,but was not involved in core elements.OsGSgene expression level was slightly regulated by its promoter.In the number of regulation elements and its function,the promoter ofOsGSgene had strong conservative property and was less likely to have genetic variation in structure and function.The change ofOsGSgene mRNA expression was few affected by the regulation of OsGSgene promoter.
rice;transgressive variant;glutamine synthetase genes;transcription expression;promoter sequence
S816
A
1005-9369(2017)10-0001-10
金正勋,李丹,李明月,等.水稻谷氨酰胺合成酶同工型基因转录表达量与启动子结构关系分析[J].东北农业大学学报,2017,48(10):1-10.
Jin Zhengxun,Li Dan,Li Mingyue,et al.Comparative analysis on gene expression and promoter sequence in rice glutamine synthetase[J].Journal of Northeast Agricultural University,2017,48(10):1-10.(in Chinese with English abstract)
2017-04-12
科技部“十三五”科技支撑计划项目(2015BAD23B05-11),东北农业大学学科团队建设资助项目,黑龙江省粮食产能提升协同创新中心资助项目
金正勋(1960-),男,教授,博士,博士生导师,研究方向为水稻遗传育种及生物技术。E-mail:zxjin326@hotmail.com

