SSR分子标记鉴定栽培茄与野生茄杂种F1研究
杨 旭,刘 飞,霍秋月,张 宇,成玉富
(扬州大学园艺与植物保护学院,江苏 扬州 225009)
SSR分子标记鉴定栽培茄与野生茄杂种F1研究
杨 旭,刘 飞,霍秋月,张 宇,成玉富
(扬州大学园艺与植物保护学院,江苏 扬州 225009)
SSR分子标记技术对鉴定作物杂种真实性及茄子种间杂交研究具有重要意义。文章以16份茄子杂交材料及其亲本为试验材料,参考茄子基因组,以SSR分子标记技术为鉴定手段,鉴别茄子杂交材料真伪。结果发现2对SSR引物(emg01J09和emh21J12)可用于试验材料杂交种真实性检测,与田间鉴定结果一致。研究表明,SSR分子标记可应用于栽培茄与野生茄杂种鉴定,可及时排除假杂种,减少后期试验工作量,准确验证杂交结果。该技术对杂种后续研究及茄子品种改良具有应用价值。
茄子;种间杂交;SSR分子标记;鉴定
茄子(Solanum melongena L.)是暖季蔬菜作物, 茄子生产易遭受病虫危害,出现黄萎病(Verticillium wilt)、根结线虫(Nematodes)等。刘富中等研究表明,茄子野生资源中具有多种优良抗性基因[1],赤茄(S.aethiopicum L.)对青枯病具有抗性[2];喀西茄(S.khasianum L.)和刺天茄(S.indicum L.)对小叶、嫩芽和果实蛀虫具有抗性[3-4];托鲁巴姆(S.torvum L.)和刺天茄(S.indicum L.)对黄萎病有抗性[5]。茄子野生种质是砧木材料、抗病虫害材料和抗逆性材料重要来源,也是茄子新品种变异来源,可改善茄子品质、提高产量[6]。
为实现栽培品种改良,Behera等研究表明可以通过多种方法将抗性基因导入栽培茄[7],Daunay等认为种间杂交是实现基因转移的重要途径[8]。由于种间杂交存在杂交障碍,检测杂种F1真实性十分重要。本研究通过SSR(微卫星DNA)分子标记技术,鉴定茄子栽培种与野生种杂种F1真实性,筛选有效SSR引物,为杂种后续研究及创制杂种优势种质资源奠定基础。
分子标记是继形态标记、细胞标记和生化标记后发展的理想遗传标记形式,以蛋白质和核酸分子突变为基础,检测研究对象遗传结构与变异现象。DNA分子标记技术具有多态性高、简单快速和限制因素(组织类别、发育阶段、环境影响)少等优点,第二代分子标记技术中SSR标记手段已广泛应用于基因定位及克隆、作物育种、亲缘分析与品种鉴定等领域及纯合体和杂合体鉴定。SSR(微卫星DNA)是一类由几个(多为1~5个)碱基组成的基序串联重复DNA序列,串联数目不同决定SSR高度多态性,不同材料重复次数不同,PCR反应根据差异核心序列重复数目扩增不同长度PCR产物,检测DNA多态性[9]。
茄子种间杂交研究,目前主要集中于如何获得野生茄×栽培茄杂交种,刘园研究不同授粉方式对茄子远缘杂交影响,发现重复授粉法和破坏柱头法能克服远缘杂交亲本不亲和性[10]。目前茄子杂种鉴定及其后续利用方面研究较少。现在主要集中于形态学鉴定、亲本与杂种F1同工酶(POD,COD)分析及第一代分子标记RAPD检测等方面[11-13],形态学鉴定方法影响杂种鉴定和后续育种工作效率,同时形态指标主观判定也存在人为误差;同工酶(POD,COD)分析方法在鉴定过程中可能受非生物胁迫等因素限制。随着分子标记技术日益成熟,第二代乃至带三代分子标记相继开发。
目前,SSR分子标记技术已应用于番茄[14]、辣椒[15]、马铃薯[16]、甜瓜[17]、水稻[18]及大豆[19]等杂交种真实性和纯度鉴定及指纹图谱标记等,研究表明SSR分子标记鉴定杂种真实性具有可靠性,且检测时间短,为后续工作提供技术支撑和决策依据,减少假杂种造成经济损失和育种失误。Nunome等发表236对SSR标记引物[20],为开发高效SSR标记引物,利用SSR分子标记技术对栽培茄与野生茄杂交F1代杂种真实性鉴定提供可能,对杂种后续研究及茄子品种改良具有参考作用。
本研究以10份常见栽培茄为母本,5份具有优良抗性野生茄为父本,参照文献[13]方法,以杂交获取16份杂交组合种子为鉴定材料,引物序列来源于Nunome等公开发表236对SSR标记引物[20],结合课题组前期研究茄子种质资源遗传多样性筛选的SSR引物为扩增材料,通过7对多态性较好SSR引物作DNA产物PCR扩增[21],解决不同物种间共用SSR引物造成盲目性大、费时费力和操作理论依据不足等问题。通过SSR分子标记分析杂种F1真实性,为茄子种间杂交提供验证方法,为提高茄子杂交品种选育质量提供参考依据。
1 材料与方法
1.1 供试材料
16份栽培茄与野生茄杂交种F1,10份母本材料(栽培茄)和5份父本材料(野生茄)种子均由扬州大学园艺与植物保护学院提供(见表1,2)。
备选多态性较好的7对SSR引物由生工生物工程(上海)股份有限公司合成(见表3)。
PCR扩增过程所需Taq酶、10×Buffer和dNTP购自宝生物工程(大连)有限公司,基因组DNA提取试剂盒购自生工生物工程(上海)股份有限公司。
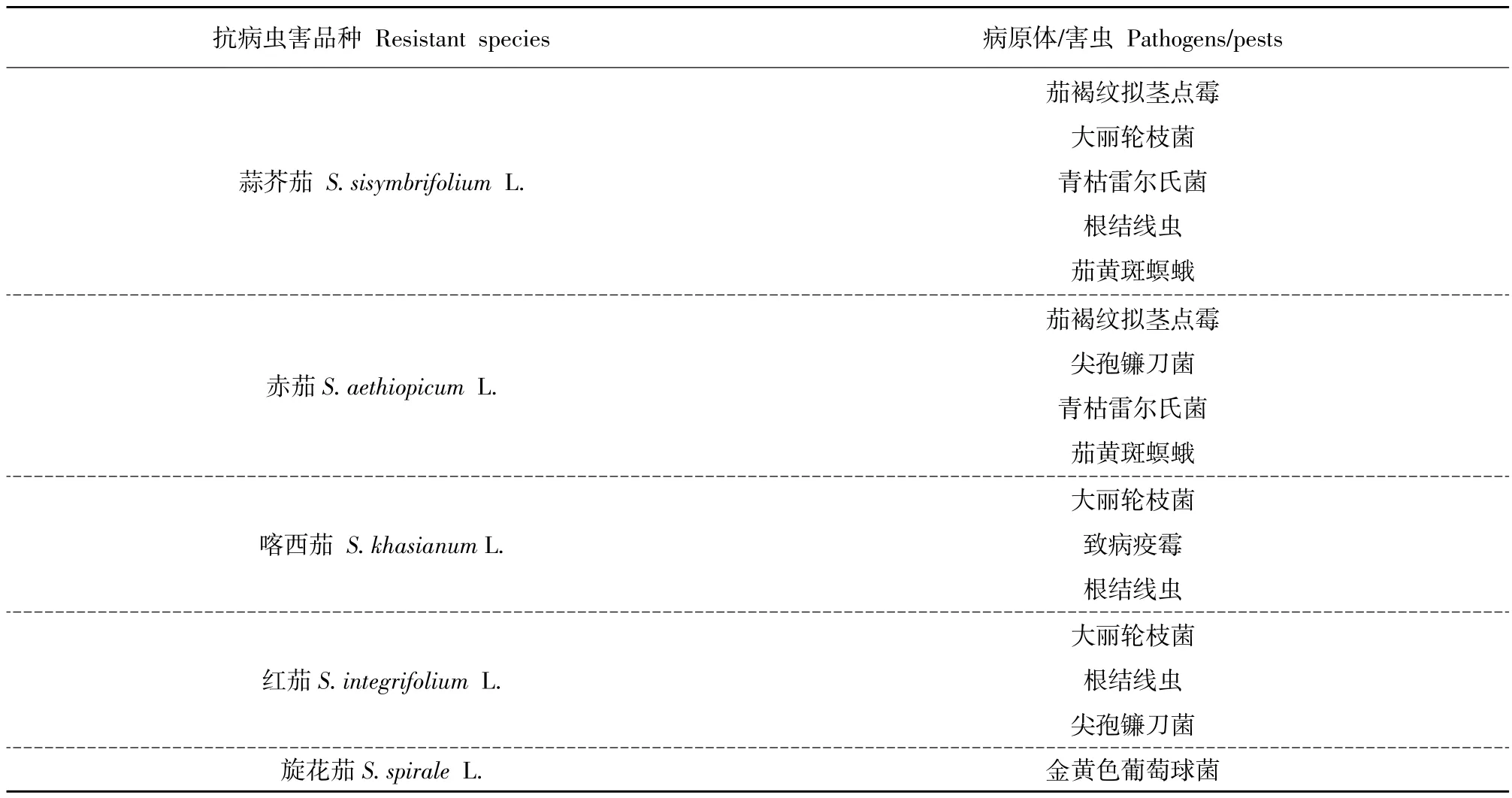
表1 茄子抗病虫害野生种质资源Table 1 Sources of resistance against diseases and pests in wild species of eggplant

表2 16份茄子杂种组合基本情况Table2 Basic situation of sixteen eggplant hybrid combinations
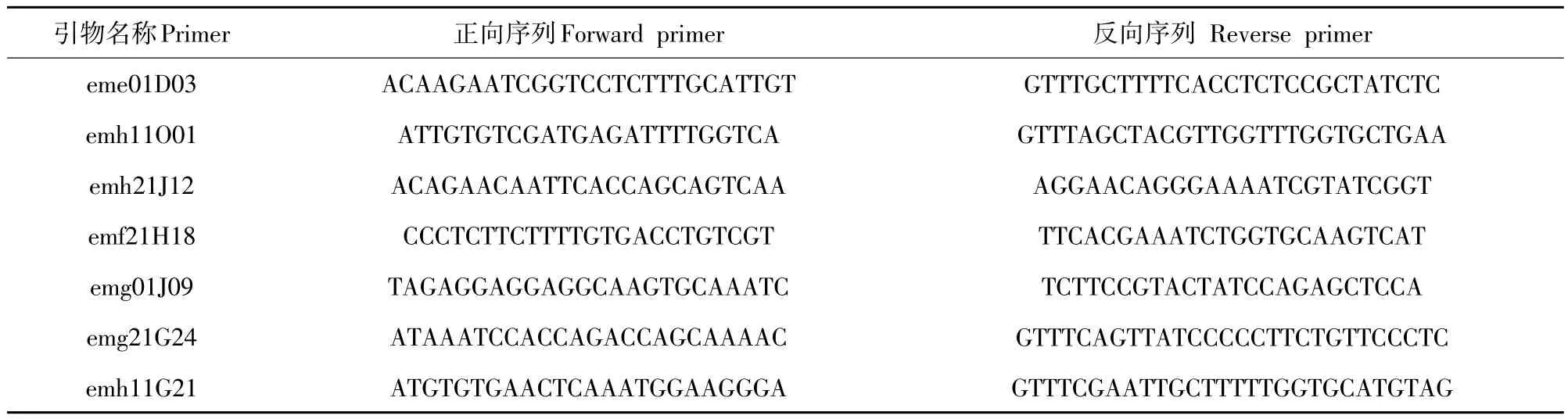
表3 7对多态性SSR引物序列Table 3 Seven pairs of polymorphic SSR primer sequences
1.2 方法
1.2.1 材料
2016年选择10份栽培茄为母本,与5份优良抗性野生茄为父本杂交,设计多个杂交组合,并以5:2(栽培种:野生种)比例种植,每份母本材料种植10株。以杂种植株坐果率、单果种子数、F1代种子发芽率以及父本野生茄花粉活力确定种间杂交可交配性,其中16种组合可交配性较好,可用于后续试验。2017年4月对母本、父本和16份杂交种F1种子55℃浸种催芽,在扬州大学园艺与植物保护学院实验基地穴盘育苗,待幼苗长至四叶一心时采集植株叶片,样品于-80℃保存。其余幼苗种植于实验基地大棚。
1.2.2 DNA提取及质量检测
所有试验枪头和容器均高压灭菌锅灭菌,采用生工生物工程(上海)股份有限公司Ezup柱式植物基因组DNA抽提试剂盒作亲本和F1植株叶片DNA提取,步骤参照试剂盒说明书。用1.0%琼脂糖凝胶电泳检测DNA纯度和完整性,取5 μL DNA溶液和1 μL 6×Loading Buffer充分混匀后快速点样于1.0%琼脂糖凝胶中,30 min后紫外透射仪观察并拍照,优良DNA样品于-20℃冰箱保存。
1.2.3 SSR反应体系及扩增程序
对提取基因组DNA建立10 μL SSR反应体系:6.7 μL ddH2O,1.0 μL 10×PCR Buffer,0.2 μL dNTPs,1.0 μL 引物,0.1 μL rTaq聚合酶、1.0 μL DNA模板。将PCR反应管置于PCR仪中基因扩增,扩增程序:94℃预变性5 min;94℃变性5 min,55~60 ℃退火30 s,72 ℃延伸45 s,35个循环;最后72℃充分延伸10 min,4℃保存。扩增产物用于后续聚丙烯酰胺凝胶反应。
1.2.4 聚丙烯酰胺凝胶电泳与银染检测
扩增产物在6%非变性聚丙烯酰胺凝胶电泳下检测,每个样品取 1.4 μL 和 0.7 μL 6×Loading Buffer混合点样,以DL500 DNA Maker为对照,在180V恒压下,电泳1.5 h。电泳结束后银染:先放入固定液(2.5 mL冰醋酸+95%乙醇55 mL+450 mL蒸馏水)中轻摇2~3 min;在0.2%AgNO3染色液中轻晃3~5 min;取出后蒸馏水中漂洗2~3次,每次时间不超过15 s;最后于显影液中(7.5 g NaOH+ 2 mL甲醛+500 mL蒸馏水)轻轻摇晃,直至条带出现。观察后拍照作条带分析。
1.2.5 杂种鉴定
对于共显性标记SSR分子标记,在杂交后代扩增产物中,通过比较亲本与杂种PCR扩增条带,杂种F1具有父母本互补型或父本型条带,鉴定为真杂交种,反之仅有母本型条带鉴定为假杂交种。
1.2.6 田间形态学观察
其余幼苗种植于扬州大学园艺与植物保护学院实验基地大棚,待茄子到成熟期,调查茄子田间农艺性状。
2 结果与分析
2.1 特征型引物筛选
本研究利用多态性较好7对SSR引物作多态性筛选,通过聚丙烯酰胺凝胶电泳与银染,获得7对SSR引物扩增条带,其中2对SSR引物(emg01J09和emh21J12)在亲本与杂种中扩增出清晰、稳定特异性条带,其余5对SSR引物扩增条带较模糊。研究引物emg01J09和emh21J12扩增出亲本与杂种条带大小、特征型,分析杂种F1真实性。
2.2 杂种F1鉴定分析
利用emg01J09对杂交组合eH6、eH7、eH8、eH9、eH10、eH11、eH12、eH13、eH14、eH15、eH16及亲本作谱带特征分析,PCR扩增产物大小为150~200bp,鉴定出西安绿茄、 迷你茄、 苏牛角、14c-28和14c-30与野生茄杂交杂种F1真实性(见图 1a);emh21J12对杂交组合 eH1、eH2、eH3、eH4、eH5及亲本作谱带特征分析,PCR扩增产物大小为330~340 bp,鉴定出L146、L161、L162、L165和L171与野生茄杂交杂种F1真实性(见图1b)。通过聚丙烯酰胺凝胶电泳可见,eH1表现出母本L146带型,eH11表现母本14c-30带型,eH12带型存在不稳定性,认定eH1、eH11和eH12为 假 杂 种 ; 而 eH2、 eH3、 eH4、 eH6、 eH7、eH9、eH14、eH15和eH16显示出父母本互补带型,eH5、eH8、eH10和eH13显示为父本带型,出现父母本型或父本型两种带型F1认定为真杂种。通过对SSR引物扩增条带分析,结果表明,eH1、eH11和eH12在SSR分子标记鉴定下,为假杂种;而其余13份杂交种(eH2、eH3、eH4、eH5、 eH6、 eH7、 eH8、 eH9、 eH10、 eH13、eH14、eH15、eH16)在SSR分子标记鉴定结果均为真杂种,图中以箭头标注。

图1 引物emg01J09和emh21J12对茄子各杂种及父母本扩增结果Fig.1 SSR bands amplified with primer emg01J09 and emh21J12 from eggplant hybrids and parents
2.3 SSR扩增带型分析
通过emg01J09和emh21J12引物扩增产物,鉴定出13份真杂交种,其中父母互补带型9个(eH2、eH3、eH4、eH6、eH7、eH9、eH14、eH15和 eH16),父本带型 4个(eH5、eH8、eH10和eH13)。在杂交后代中,扩增谱带消失或出现新增谱带,可能是在配子体形成过程中,染色体减数分裂中同源染色体发生配对与交换、染色体复制过程中碱基发生突变等,证明杂交可使作物后代发生丰富变异。
2.4 田间性状调查结果
通过调查杂交种和亲本植株农艺性状,参照文献[22]方法,观察种植在实验基地的种间F1杂种及其亲本植株生长发育情况,主要性状有:叶刺、叶色、叶脉色、茎刺、茎色、花序、花色和花萼色等。其中,eH3、eH8和eH13父本均为赤茄,在杂种植株有无刺性状方面,eH8和eH13更近似于父本赤茄;eH4和eH5父本均为红茄,在杂种植株农艺性状方面,eH5叶色和花色更接近于父本红茄,结果与SSR分子标记鉴定结果相近。
通过比对亲本与杂交种形态学性状,鉴定出13份真杂种和3份假杂种,与SSR分子标记鉴定结果一致,列出真杂交种及其亲本形态学性状(见表4)。

表4 真杂交种及其亲本形态学性状Table 4 Morphological traits of true hybrids and their parents
3 讨论与结论
传统茄子杂种真实性鉴定方法以田间形态学鉴定为主,但易受田间环境影响,周期长、操作复杂,存在一定局限性[23]。随着分子标记技术发展,SSR分子标记技术在杂种真实性鉴定、遗传图谱构建、基因定位、基因克隆和物种亲缘关系等方面应用广泛。韩小霞等利用SSR分子标记鉴定南瓜杂种纯度[24];石星星等利用SSR分子标记鉴定结球甘蓝杂种真实性[25];朱骏驰等则采用SSR分子标记鉴定葡萄F1代杂种[26]。Nunome等公开发表236对SSR标记引物,本研究利用茄子基因组文库开发SSR引物,结合SSR分子标记方法,鉴定茄子种间杂种并获得真杂种,与王艳娜等茄子杂种研究结论一致[27]。张敏等和潜宗伟等在茄子杂种鉴定中,分别于100对SSR引物中发现2对,152对SSR引物中发现2对可以用于杂交种子纯度鉴定[28-29]。本试验在茄子基因组基础上开发7对SSR引物发现,2对快速有效鉴定杂种。刘军等发现2对SSR引物可用于栽培茄杂交种鉴定[30],张洪源等研究表明,8对引物可鉴定杂交种纯度[31]。本研究筛选出多态性较好SSR引物在杂种鉴定上具有高效性和针对性,能够可靠、准确鉴定真杂交种。
本研究利用7对SSR多态性标记鉴定15个亲本及其16份杂交种,以区分真假杂种。在实际应用中,emg01J09和emh21J12可扩增出全部条带,用于野生茄和栽培茄杂交种鉴定。在利用分子标记鉴定时,引物选择至关重要。另外,从亲本和杂交种条带上看,多数杂种条带偏向于父母互补带型,部分杂种条带偏向于父本带型,研究结果呈父母互补带型:父本带型=9:4,与谢文刚等在鸭芽杂交种SSR分子鉴定中父母互补带型:父本带型=4:3(80:60)一致[32],证明本试验可靠性。
本研究运用SSR分子标记技术,在杂种F1苗期即可鉴定种子真实性,及时排除假杂种,减少后期试验,准确验证杂交结果,为杂种后续研究提供依据同时,有利于推进茄子品种改良研究。后续研究中,可运用SSR标记对材料在非生物胁迫处理下相关性状作关联分析[33],进一步通过ISSR分析方法对优良抗性茄子种质资源作相关遗传研究[34]。
采用SSR分子标记方法,鉴定栽培茄与野生茄杂交获得16个杂交组合的杂交种,鉴定出13份真杂种(eH2、eH3、eH4、eH5、eH6、eH7、eH8、eH9、eH10、eH13、eH14、eH15、eH16)和3份假杂种(eH1、eH11、eH12),并且田间形态学和SSR分子标记鉴定结果一致。
[1] 刘富中,连勇,冯东昕,等.茄子种质资源抗青枯病的鉴定与评价[J].植物遗传资源学报,2005,6(4):381-385.
[2] Collonnie C,Mulya K,Fock I,et al.Source of resistance against Ralstonia solanacearum in fertile somatic hybrids of eggplant(Solanum melongena L.)with Solanum aethiopicum L.[J].Plant Science,2001,160(2):301-313.
[3] Sharma D R,Chawdhury J B,Ahuja U,et al.Interspecific hybridization in the genus Solanum.A cross between S.melongena and S.khasianum through embryo culture[J].Zeitschrift Fur Pflanzenzuchtung,1980,85:248-253.
[4] Bahgat A,AbdelAziz H,Raafat M,et al.Solanum indicum ssp.distichum extract is effective against L-NAME-induced hypertension in rats[J].Fundam.Clin.Pharmacol,2008,22(6):693-699.
[5] Prohens J,Whitaker B D,Plazas M,et al.Genetic diversity in morphological characters and phenolic acids content resulting from an interspecific cross between eggplant(Solanum melongena)and its wild ancestor(S.incanum)[J].Annals of Applied Biology,2013,162(2):242-257.
[6] Kaushik P,Prohens J,Vilanova S,et al.Phenotyping of eggplant wild relatives and interspecific hybrids with conventional and phenomics descriptors provides insight for their potential utilization in breeding[J].Frontiers in Plant Science,2016,7:1-16.
[7] Behera T K,Singh N,Kalda T S,et al.Genetic diversity in eggplant for resistance to shoot and fruit borer[J].Indian Journal of Horticulture,1999,56(3):259-261.
[8] Daunay M C,Chaput M H,Sihachakr D,et al.Production and characterization of fertile somatic hybrids of eggplant(Solanum melongena L.)with Solanum aethiopicum L.[J].Theoretical and Applied Genetics,1993,85(6-7):841-850.
[9] 白玉.DNA分子标记技术及其应用[J].安徽农业科学,2007,35(24):7422-7424.
[10] 刘园.茄子远缘杂交种获得、鉴定与评价[D].保定:河北农业大学,2013.
[11] 柳李旺,汪隆植,龚义勤,等.栽培茄(Solanum melongena)与野生茄种间杂交及F1鉴定[J].江苏农业学报,1999,15(2):100-103.
[12] 柳李旺,汪隆植,龚义勤,等.栽培茄与红茄(Solanum integrifolium)种间杂交及其杂种的特性分析[J].南京农业大学学报,2004,27(1):6-10.
[13] 曹必好,雷建军,王勇,等.栽培茄与野生茄种间杂交研究[J].园艺学报,2009,36(2):209-214.
[14] Liu L W,Wang Y,Gong Y Q,et al.Assessment of gentic purity of tomato(Lycopersicon esculentum L.)hybrid using molecular markers[J].Scientia Horticulturae,2007,115(1):7-12.
[15] 孙润生.辣椒种间杂交亲和性研究及其杂种鉴定[D].南京:南京农业大学,2014.
[16] 张自强,于肖夏,鞠天华,等.2个马铃薯杂交组合F1的SSR鉴定[J].中国生态农业学报,2013,21(11):1411-1415.
[17]艾呈祥.甜瓜杂交种SSR指纹图谱标记和鉴定技术的研究[D].儋州:华南热带农业大学,2005.
[18] 周会,苏秀,毛双林,等.杂交水稻品种真实性和纯度的SSR分子标记鉴定[J].种子世界,2014(3):34-35.
[19] 韩冬伟,刘春燕,胡振帮,等.利用SSR分析标记鉴定大豆育种中杂交真伪和后代系谱[J].东北农业大学学报,2012,43(10):91-95.
[20] Nunome T,Negoro S,Kono I,et al.Development of SSR markers derived from SSR-enriched genomic library of eggplant(Solahum melohgeha L.)[J].Theor Appl Genet,2009,119(6):1143-1153.
[21] 杨旭,刘飞,张宇,等.利用SSR标记研究茄子种质资源遗传多样性[J].基因组学与应用生物学,2016,35(12):3450-3457.
[22] 李锡香,朱德蔚,等.茄子种质资源描述规范和数据标准[M].北京:中国农业出版社,2006.
[23] 王利英,乔军,石瑶,等.基于SSR优化反应体系的茄子亲子鉴定[J].山西农业科学,2011,39(8):782-785.
[24] 韩小霞,胡新军,袁祖华,等.利用SSR标记技术鉴定南瓜杂交种纯度的研究[J].分子植物育种,2014,12(1):112-117.
[25] 石星星,纪小红,张磊,等.利用SSR标记鉴定结球甘蓝杂交种真实性及纯度[J].分子植物育种,2015,13(2):331-337.
[26] 朱骏驰,郭印山,刘镇东,等.利用SSR分子标记鉴定葡萄F1代杂种[J].沈阳农业大学学报,2016,47(2):148-152.
[27] 王艳娜,王益奎,李文嘉,等.利用SSR分子标记技术鉴定和分析茄子杂种F1的纯度[J].南方农业学报,2015,46(9):1551-1556.
[28] 张敏,谈太明,徐长城,等.SSR分子标记技术在茄子杂交种子纯度鉴定中的应用[J].湖北农业科学,2013,52(8):1959-1962.
[29] 潜宗伟,陈海丽,崔彦玲.茄子种子纯度SSR标记快速鉴定[J].北方园艺,2014(23):75-78.
[30]刘军,周晓慧,庄勇.茄子杂交品种种子纯度的SSR分子标记鉴定[J].分子植物育种,2013,11(6):790-794.
[31] 张洪源,谈杰,张敏,等.茄子SSR多态性标记筛选及杂交种纯度鉴定[J].南方农业学报,2017,48(7):1148-1154.
[32] 谢文刚,张新全,陈永霞.鸭茅杂交种的SSR分子标记鉴定及其遗传变异分析[J].草业学报,2010,19(2):212-217.
[33] 柏锡,梁爽,邢雪莹.干旱、高温胁迫下大豆SSR标记与产量性状关联分析[J].东北农业大学学报,2015,46(10):15-22.
[34] 杨洪升,李富恒,王长宝,等.珍稀濒危植物黄檗种群遗传多样性ISSR分析[J].东北农业大学学报,2016,47(6):26-32.
Identification of interspecific F1hybrid betweenSolanum melongena and wild relatives by using SSR molecular marker technology/
YANG Xu,
LIU Fei,HUO Qiuyue,ZHANG Yu,CHENG Yufu
(School of Horticulture and Plant Protection,Yangzhou University,Yangzhou Jiangsu 225009,China)
SSR molecular marker technology has the advantages of identificating the authenticity of crop hybrids,which is of great significance to intergeneric hybridization in eggplant.In this study,16 eggplant hybrid materials and their parents were used as experimental materials.Based on the genome of eggplant,SSR molecular marker technique was used to identify the true and false species of eggplant hybrids.The results showed that two pairs of SSR primers(emg01J09 and emh21J12)could be used to confirm the hybrids of the tested materials and the results were consistent with the field identification results.Our study showed that SSR molecular markers could be effectively used in the identification of cultivated and wild eggplant hybrids,so as to accurately confirm the hybridization,eliminate the fake hybrids and reduce the post-trial workload.The application of this technology will have a positive effect on the follow-up study of hybrids and the improvement of eggplant varieties.
eggplant;interspecific hybridization;SSR molecular marker;identification
S641.1
A
1005-9369(2017)10-0020-08
杨旭,刘飞,霍秋月,等.SSR分子标记鉴定栽培茄与野生茄杂种F1研究[J].东北农业大学学报,2017,48(10):20-27.
Yang Xu,Liu Fei,Huo Qiuyue,et al.Identification of interspecific F1hybrid betweenSolanum melongenaand wild relatives by using SSR molecular marker technology[J].Journal of Northeast Agricultural University,2017,48(10):20-27.(in Chinese with English abstract)
2017-07-08
江苏省“六大人才高峰”高层次人才选拔培养资助项目(2015-NY-020)
杨旭(1974-),男,副教授,博士,研究方向为蔬菜遗传育种与生物技术研究。E-mail:yangxu@yzu.edu.cn

