新琼四糖通过改善肠道微环境对力竭运动小鼠脂质代谢的影响
李 晶,张 娜,宋 佳,毛相朝,薛长湖,唐庆娟*
(中国海洋大学食品科学与工程学院,山东 青岛 266003)
新琼四糖通过改善肠道微环境对力竭运动小鼠脂质代谢的影响
李 晶,张 娜,宋 佳,毛相朝,薛长湖,唐庆娟*
(中国海洋大学食品科学与工程学院,山东 青岛 266003)
目的:研究新琼四糖对力竭运动所致脂质代谢紊乱的调节作用。方法:采用BALB/C雄性小鼠,并将其随机分为3 组,即正常组、力竭运动组和新琼四糖干预组。本研究采用小鼠转轮式疲劳仪力竭运动模型,力竭运动组和新琼四糖组小鼠给予力竭运动干预,而正常组保持正常活动。连续喂养16 d后,测定血清血脂指标并无菌收集小鼠粪便,进行肠道菌群的宏基因组分析。结果显示:力竭运动导致小鼠脂质代谢紊乱,血清总胆固醇、低密度脂蛋白胆固醇和高密度脂蛋白胆固醇水平显著升高(P<0.05),而甘油三酯水平显著降低(P<0.05)。同时,新琼四糖能显著改变力竭运动小鼠肠道菌群结构以及菌群功能。总之,新琼四糖可靶向调节肠道菌群结构,改善肠道菌群脂质代谢通路,调控脂肪酸氧化和脂质合成相关酶,进而缓解力竭运动导致的脂质代谢紊乱。
新琼四糖;力竭运动;脂质代谢紊乱;肠道菌群;宏基因组
新琼寡糖是一种以β-D-半乳糖残基为还原性末端,以3,6内醚-α-L-半乳糖残基为非还原性末端的寡糖,是琼胶/琼脂糖经琼胶酶水解的产物[1-3]。其作为一种新的益生元,已成为国内外研究热点。实验室前期通过从海藻中提取琼胶酶基因,在大肠杆菌中重组表达琼胶酶,以琼胶为底物,成功制备新琼四糖。作为海洋来源的新琼四糖,其生物活性和功能都有待探索。
宏基因组学通过直接从样品中提取全部微生物的DNA,构建宏基因组文库,利用基因组学的研究策略研究环境样品所包含的全部微生物的遗传组成及其群落功能[4]。利用宏基因组学可以全面分析微生物组成及功能的特点,可以将其应用到对一类物质生物活性的预测上。京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)以基因组信息和化学物质信息为构建模块,通过代谢网络将基因组和生物系统联系起来,然后根据功能等级进行归纳分类。KEGG还为各种组学研究提供相关软件,用于代谢途径重建、遗传分析和化合物比对。宏基因组学通常与KEGG相结合,能够成功预测生物活性物质的功能[5-9]。
合理、适度的运动锻炼能够增强机体的免疫力,而力竭、缺氧等极端条件下的运动通常伴随着多种疾病的发生。在剧烈运动中,机体器官受损,如肝细胞凋亡、心肌损伤、肾脏机能减退以及胃肠道的氧化损伤[10-12],同时伴有机体代谢紊乱。因此,本研究选用力竭运动模型,运用宏基因组学,对实验室前期制备出的新琼四糖的生物活性进行预测。丰富新琼四糖的生物活性研究,为挖掘新琼四糖的新用途提供实验依据。
1 材料与方法
1.1 动物、材料与试剂
健康雄性BALB/C小鼠,4~6 周龄,18~22 g,SPF级(许可证号:SCXK(京)2012-0001),购自北京维通利华实验动物技术有限公司。
新琼四糖来源于实验室自制琼脂糖。通过从威海海岸的海藻中筛选出菌株Agarivorans gilvus WH0801,提取得到琼胶酶基因,其所编码的琼胶酶agWH50A属于糖苷水解酶GH50家族。将琼胶酶基因与质粒pET-21(a+)构建重组表达载体,转化至大肠杆菌BL21,实现了琼胶酶基因的重组原核表达,制备了重组酶。重组琼胶酶agWH50A和0.2%低熔点琼脂糖混合,加入50 mmol/L KH2PO4-NaOH缓冲液(pH 6.0),于30 ℃孵育,降解琼脂糖得到新琼四糖[9]。
总胆固醇(total cholesterol,TC)测定试剂盒、总甘油三酯(total triglycerides,TG)测定试剂盒、高密度脂蛋白胆固醇(high density lipoprotein-cholesterol,HDL-C)测定试剂盒、低密度脂蛋白胆固醇(low density lipoprotein-cholesterol,LDL-C)测定试剂盒 南京建成生物工程研究所;Mg-Mk磁珠法细菌DNA抽提试剂盒生工生物工程(上海)股份有限公司;Agencourt Ampure XP beat kit核酸纯化试剂盒 美国贝克曼库尔特公司;TruSeq®DNA PCR-Free Sample Preparation Kit建库试剂盒美国Illumina公司。
1.2 仪器与设备
BioAnalyzer 2000 美国Agilent公司;Nanodrop 2000C分光光度计 美国Thermo Scientific公司;QUANTIFLUOR™荧光计仪 美国Promega公司;iQ5型Real Time聚合酶链式反应(polymerase chain reaction,PCR)仪 美国Bio-Rad公司;Miseq测序平台 美国Illumina公司;YLS-10B小鼠转轮式疲劳仪 山东医学科学院。
1.3 方法
1.3.1 力竭运动小鼠模型建立
BALB/C小鼠适应性喂养1 周,按体质量随机分为3 组,每组8 只,即正常组(Control)、力竭运动组(Motion)、新琼四糖组(NAT)。自由摄食小鼠标准维持饲料AIN-93M。室内温度21~24 ℃,相对湿度40%~55%,空气流通,光照时间12 h。
以BALB/C小鼠为实验对象,Control组不做力竭运动干预,灌胃200 μL生理盐水;Motion组进行力竭运动——利用小鼠转轮式疲劳仪给予2.5 h力竭运动,转速20 r/min,连续运动2 d,间歇5 d,持续16 d,同时灌胃200 μL生理盐水;NAT组进行相同的力竭运动计划,同时灌胃200 μL的150 mg/kg新琼四糖,研究新琼四糖对力竭运动小鼠脂质代谢的影响。
1.3.2 血清脂质水平的测定
取10 μL小鼠血清,按照试剂盒说明书对血清TG、TC、LDL-C和HDL-C水平进行测定。
1.3.3 粪便细菌基因组DNA提取
将粪便样品准确称质量,按照每0.1 g小鼠粪便加入1 mL 0.01 mol/L磷酸盐缓冲液(phosphate buffered saline,PBS)的比例添加相对应体积的PBS,使用无菌枪头反复搅拌捣碎,之后使用漩涡振荡混合均匀。将均匀的粪便混合样于室温条件下1 500 r/min离心5 min后弃去沉淀,所得液体即为菌体悬浮液。将菌体悬浮液在室温下10 000 r/min离心3 min,弃去上清液,收集沉淀即初步得到菌体。再用1 mL 0.01mol/L PBS洗涤菌体2~3 次,无菌水1 mL洗涤1~2 次,室温条件下10 000 r/min离心3 min,弃去上清液,获得最终菌体沉淀。采用试剂盒提取沉淀中的肠道细菌总DNA。
1.3.4 DNA样品质量检测
取1.0~1.5 μL DNA样品于Nanodrop 2000C分光光度计进行DNA质量浓度的测定。统计DNA的质量浓度、OD260nm/OD280nm和OD260nm/OD230nm。
1.3.5 PCR扩增及产物纯化
以提取的粪便DNA为模板,采用细菌16S PCR引物341/357F(5’-NNNNCCTACGGGNGGCWGCAG-3’)和805/785R(5’-GACTACHVGGGTATCTAATCC-3’)扩增16S rRNA的V1~V3高变区序列。PCR扩增体系(50 μL)为:Taq DNA聚合酶2.5 U、引物200 nmol/L、dNTP 200 nmol/L、60 mmol/L Tris-SO4、18 mmol/L(NH4)2SO4、2.0 mmol/L MgSO4、1%甘油、100 ng/μL牛血清白蛋白、模板DNA 10 ng,补ddH2O至50 μL。扩增程序为:95 ℃预变性2 min;95 ℃变性30 s、60 ℃复性30 s、72 ℃延伸6 s,20 个循环。所得PCR产物采用Agencourt Ampure XP beat kit核酸纯化试剂盒纯化回收,具体步骤参考试剂盒说明书。
1.3.6 文库构建和序列测定
纯化后的扩增产物根据质量浓度进行等量混合。使用TruSeq®DNA PCR-Free Sample Preparation Kit建库试剂盒进行文库构建,构建好的文库用BioAnalyzer Highsensitivity DNA chip kit定量,文库合格后,使用Miseq 测序平台进行上机测序。
1.3.7 测序数据分析
采用MiSeq控制软件MCS 2.4.1进行数据的预处理。FastQC 0.11.2软件进行测序原始数据的质量控制。随后双端读长的序列经PandaSeq 2.8软件拼接成Contigs。QIIME pipeline 1.9.1软件用来分析16S rRNA基因序列。使用PyNAST 1.2.2软件与GreenGene数据库中的数据信息进行快速多序列比对进行物种注释分析,并分别在各个分类水平(界、门、纲、目、科、属、种)统计各样本的群落组成。采用LEfSe algorithm计算操作分类单元(operational taxonomic units,OTU)的相对丰度。采用PICRUSt 1.0.0软件进行菌群的功能预测以及KEGG信号通路的注释[8]。
1.4 数据统计分析
各组小鼠DNA浓度实验数据以 ±s表示,采用SPSS 11.5统计软件进行单因素方差统计学分析(One-way ANOVA),以P<0.05表示差异有统计学意义。
2 结果与分析
2.1 新琼四糖对菌群结构的影响
2.1.1 样品复杂度分析
2.1.1.1 样品中微生物的Rank-abundance曲线
Rank-abundance曲线反映单个或整体样品中每个OTU按丰度(包含的序列数目)由大到小,再以OTUs的排序编号为横坐标,OTUs中的丰度(也可用该等级OTUs中序列数的相对比例)为纵坐标绘制的曲线图。Rank-abundance曲线可直观地呈现样品中包含的OTUs的丰富度和均匀度。在水平方向,物种的丰度由曲线的宽度来反映,物种的丰富度越高,曲线在横轴上的范围越大;曲线的形状(平滑程度)反映了样品中物种的均匀度,曲线越平滑,物种分布越均匀。

图1 微生物的丰度曲线Fig. 1 Rank-abundance distribution curves of microbiota
使用QIIME软件,根据各样品的丰度大小排序绘制了Rank-abundance曲线(图1)。横坐标为OTUs丰度排序的序号(OTUs rank),纵坐标为对应的OTUs相对丰度,不同的样品使用不同灰度的曲线表示。从图1中可看出,大部分样本曲线水平方向较宽和平缓,说明所有样品所含物种的丰富程度和均匀程度较合理。OTUs是在相对丰度10-3或以下时达到平台期。
2.1.1.2 样品中微生物的稀释曲线
稀释曲线用来评价测序量是否足以覆盖所有微生物物种,并间接反映样品中物种的丰富程度。当曲线趋于平缓或者达到平台期时也就可以认为测序深度已经基本覆盖到样品中所有物种;反之,则表示样品中物种多样性较高,还存在较多未被测序检测到的物种。
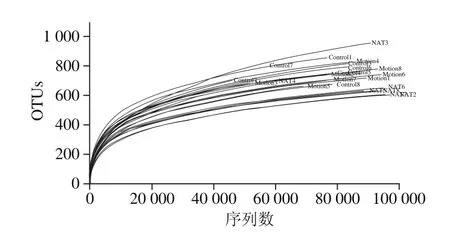
图2 微生物稀释曲线Fig. 2 Rarefaction curves of microbiota
如图2所示,随测序量的不断增加,各样品的稀释曲线趋于平缓。曲线在序列数目20 000左右时出现拐点,后续随着测序深度不断增加(序列数目升高),曲线均呈趋于平缓,当序列数达60 000条时,已经处于平台期。本研究中平均每个样本测序量均在60 000 条以上,结合曲线的走势可以说明各样品稀释曲线证实测序量足够,可以覆盖所有细菌物种。
2.1.2 多样品比较分析
Beta多样性表示不同样品在微生物群落构成上的比较。将不同样品中属于同一物种的Reads数量汇总在同一表格中,生成物种丰度信息表,用于计算unweighted unifra,来表征Beta多样性。计算unweighted unifra得到的矩阵,进一步用于多样性分析(principal coordinate analysis,PCoA)。PCoA是一种从复杂的多维变量数据中提取主要变量,并进行可视化的方法。与主成分分析(principal component analysis,PCA)的主要思想类似,PCoA的目的也是找到一个矩阵中的主要的一些坐标系。

图3 微生物的PCoA分析Fig. 3 PCoA analysis of microbiota
如图3所示,横坐标表示一个主成分,纵坐标表示另一个主成分,百分比表示主成分对样品差异的贡献值;图中的每个点表示一个样品。由图3可知,PC1为第一主坐标,对总体菌群的代表性的贡献率为20.38%,虽然组内聚集程度(特别是Motion组)并不理想(可能是个体差异引起),但所有样品可以大致分开。从整体趋势看,Control组聚集在第一和第三象限,NAT组集中在第二象限,Motion组集中在第四象限。
2.1.3 菌群结构变化分析
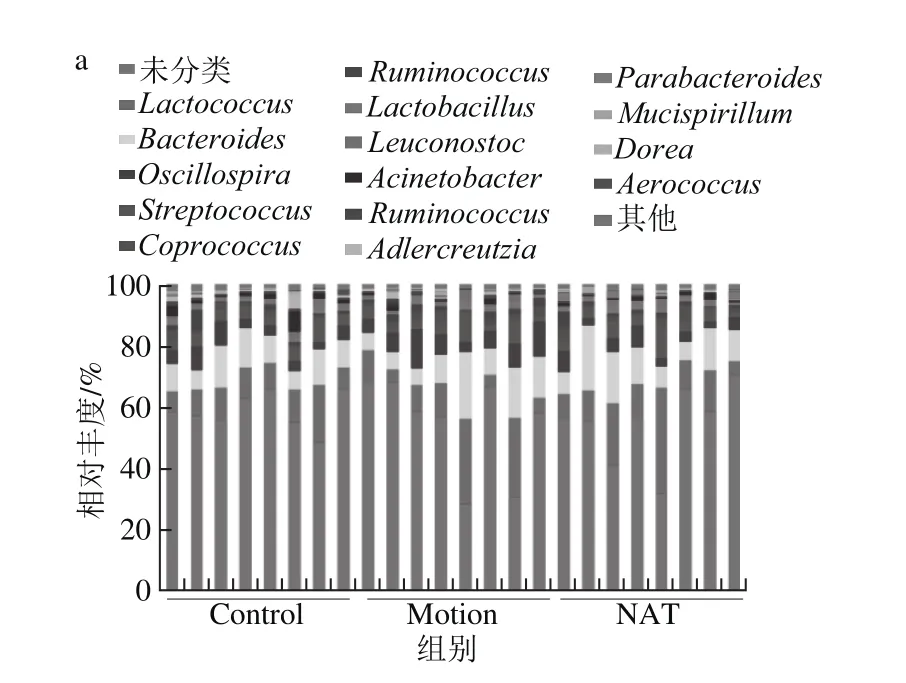
本研究在属水平上对小鼠肠道菌群结构进行了分析。如图4a所示,新琼四糖对力竭运动导致的菌群结构具有一定的调节作用。其中,乳球菌属(Lactococcus)和拟杆菌属(Bacteroides)变化最为明显。由图4b中可以得知,力竭运动导致乳球菌属由10.39%增加为27.7%,而新琼四糖干预后下降到10.20%。乳球菌属的主要代谢产物为乳酸,说明力竭运动会导致血乳酸含量升高。另外,力竭运动导致拟杆菌属由12.80%上升到22.11%,而新琼四糖干预后降低到21.37%。
肠道菌群作为人体的“第二器官”以及“第二基因组”,可以通过调控机体新陈代谢相关基因的表达,进而改变机体能量代谢,改善机体机能[14-15]。由对小鼠体内肠道菌群结构进行研究发现,力竭运动后影响较大的菌群均与脂质代谢有关,由此进一步研究力竭运动是否会导致小鼠机体脂质代谢紊乱,同时研究新琼四糖是否可以缓解紊乱症状。
2.2 新琼四糖对力竭运动小鼠肠道菌群功能的调节作用
现有的研究表明了肠道菌群与宿主代谢之间复杂的联系,肠道菌群可以通过调节脂质代谢来发挥对机体的作用,例如高脂饮食诱导的代谢性疾病,可通过低聚果糖等益生元进行肠道菌群调节[16-18]。由前两部分研究结果发现:1)新琼四糖能缓解力竭运动导致的脂质代谢紊乱;2)新琼四糖能够调节力竭运动导致的菌群失调。因此,推测新琼四糖可能通过调节肠道菌群缓解脂质代谢紊乱。为了阐明肠道菌群调节脂质代谢的机理,本研究开展了肠道菌群的基因功能注释,并与KEGG数据库进行比对。

图5 新琼四糖对肠道菌群脂质代谢通路的影响Fig. 5 Effect of NAT on lipid metabolism pathway of microbiota
本研究针对目前已知的15 种脂质代谢途径进行检测,在开展了肠道菌群的基因功能注释,并与KEGG数据库进行比对后,得出与脂质代谢通路有关的菌的相对丰度,结果如图5所示。新琼四糖能显著提高脂质代谢(P<0.01)、花生四烯酸代谢(P<0.05)、亚油酸代谢(P<0.01),并且显著抑制酮体合成(P<0.05)。
花生四烯酸是合成前列腺素、血栓烷素和白细胞三烯等二十碳衍生物的直接前体[19],这些生物活性物质可以有效地提高人体心血管系统及免疫系统的功能,对机体具有十分重要的作用。亚油酸是公认的一种必需脂肪酸。经研究发现,亚油酸具有降低血液胆固醇,预防动脉粥样硬化的功效,因而倍受重视[20]。在脂肪酸分解的过程中,酮体作为一种中间代谢产物,在肝脏中大量产生,是运动时肝脏快速输出脂肪酸供能的一种形式,在调节体内燃料平衡方面起重要作用。但同时酮体含量升高,常引发代谢性酸中毒[21]。
综上所述,新琼四糖可能通过调节花生四烯酸以及亚油酸代谢,降低血液胆固醇,预防动脉粥样硬化,降低机体心血管疾病的风险;同时,调节酮体水平既能为机体供能又能防止因酮体含量过高引起的代谢性酸中毒。
2.3 新琼四糖对力竭运动小鼠肠道菌群脂肪酸氧化和脂质合成相关酶的调控


图6 新琼四糖对肠道菌群脂质代谢通路的影响Fig. 6 Effect of NAT on lipid metabolism pathway of microbiota
研究证实,肠道微生物调控脂质代谢主要通过对脂质合成、脂肪酸氧化、胆汁酸功能和肠道内分泌功能的调控来实现[22-23];因此,本研究对肠道菌群脂肪酸氧化和脂质合成相关酶进行了检测。图6为在开展了肠道菌群的基因功能注释,并与KEGG数据库进行比对后,得出分泌与机体脂肪酸氧化和脂质合成酶有关的菌的相对丰度。新琼四糖能有效调控脂肪酸氧化以及脂质合成相关酶。其中,Motion组相比于Control组,硫辛酸合成酶(K03644)以及磷脂酶A1(K01058)、三酰甘油酯酶(K01046)、月桂酰基转移酶(K02517)、乙酰辅酶A脱氢酶(K06446)的表达量降低,长链脂肪酸脂肪酶(K05939)表达升高,而NAT组相比于Motion组,硫辛酸合成酶(K03644)以及磷脂酶A1(K01058)、三酰甘油酯酶(K01046)、月桂酰基转移酶(K02517)、乙酰辅酶A脱氢酶(K06446)的表达量升高(P<0.05),长链脂肪酸脂肪酶(K05939)表达降低(P<0.01)。
有报道称,硫辛酸能有效地调节体内糖脂代谢,抑制糖尿病及其并发症的发生[24]。而磷脂酶A1可以催化降解脂质中的磷脂,产生脂肪酸,因此磷脂酶A1的表达增加,可以加速脂质的分解代谢,减少脂肪堆积[25]。此外脂肪酶即三酰甘油酰基水解酶,它可催化天然底物油脂水解,作用于甘油三酯的酯键,使甘油三酯降解为甘油二酯、单甘油酯、甘油和脂肪酸,脂肪酸再经过一系列酶的作用转移到肝脏中。长链脂肪酸脂肪酶可以催化脂肪酸氧化,脂肪酸的氧化是动物体内脂肪酸分解的途径,也是脂质代谢的重要环节[26]。这表明新琼四糖灌胃干预可以有效地缓解力竭运动造成的小鼠脂质代谢紊乱的情况,降低脂肪分解速率和脂肪酸氧化程度,抑制脂质代谢。
该结果证明了前面的假设:新琼四糖可通过改变肠道菌群脂质代谢相关酶的活性,调控菌群脂质代谢功能,进而缓解力竭运动导致的脂质代谢紊乱。
2.4 新琼四糖对力竭运动小鼠脂代谢紊乱的缓解作用

表1 血清中脂代谢相关指标水平Table 1 Effect of NAT on serum lipoprotein metabolism in mice under exhaustive exercise
在前面研究中,基于16S基因组结果,预测出新琼四糖这一种益生元可以通过调节肠道菌群结构,改变机体脂质代谢通路,改善机体因力竭运动造成的代谢紊乱。
现有报道指出,血脂水平异常是脂质代谢紊乱的最显著的指标之一。TC与冠心病、动脉粥样硬化发病率呈正相关。甘油三酯是人体内含量最多的脂类,大部分组织均可以利用甘油三酯分解产物供给能量,同时肝脏、脂肪等组织还可以进行甘油三酯的合成,在脂肪组织中储存。LDL可以运载胆固醇进入组织细胞,同时可被氧化成氧化LDL。当LDL过量时,它携带的胆固醇便积存在动脉壁上,引起动脉粥样硬化,增加机体负担。HDL是一种抗动脉粥样硬化的血浆脂蛋白,是冠心病的保护因子,俗称“血管清道夫”[27-30]。但是HDL含量要控制在一定的范围内,否则就可能暗示着其他疾病的存在。胆汁淤积性肝硬化、慢性肝炎、肝硬化、酒精中毒性肝损伤、脂肪肝等疾病均可导致HDL-C含量升高[31-34]。
因而针对血清中TC、TG、HDL-C、LDL-C含量进行检测,验证新琼四糖可以调节机体脂质代谢。
由表1可以得出,相比于Control组,Motion组血清中TC以及HDL-C含量升高,并且LDL-C含量也呈现升高趋势。相比于Motion组,NAT组的血清中TC、HDL-C以及LDL-C含量降低。从血清中指标检测结果可以看出,力竭运动造模后,机体血清中胆固醇含量、HDL-C、LDL-C含量升高,可见力竭运动可以造成机体脂质代谢紊乱。随后研究发现,经过新琼四糖灌胃干预,机体胆固醇含量有所下降,表示在灌胃干预后,机体脂代谢紊乱有所改善。
3 讨 论
益生元物质的开发利用已成为当前研究热点,益生元被认为具有提高机体免疫力、降低疾病发生率、缓解机体器官损伤等功效。力竭运动通常伴随着多种疾病的发生,同时伴有机体代谢紊乱。新琼四糖作为一种多糖成分,在机体中可以到达结肠与菌群作用,所以本实验要验证新琼四糖这种新型的益生元是否可以通过调节肠道菌群结构来达到缓解机体脂质代谢的效果。
本研究利用宏基因组测序方法详细解析肠道菌群结构,深入研究菌群的功能以及菌群产生酶,对新琼四糖这一益生元进行功能预测,发现新琼四糖对力竭运动所致脂质代谢紊乱具有调节作用,并通过对血清中指标检测进行验证。研究结果表明,新琼四糖可以通过调节肠道菌群结构,其中乳球菌属(Lactococcus)和拟杆菌属(Bacteroides)变化最为明显,调控脂肪代谢相关酶的表达,此外检测得知血清中TC、LDL-C和HDL-C水平显著升高(P<0.05),TG水平显著降低(P<0.05)。本研究证实,新琼四糖可通过调节肠道菌群结构,保护肠道菌群脂质代谢通路,调控脂肪酸氧化和脂质合成相关酶,进而缓解力竭运动导致的脂质代谢紊乱。
综上,本研究利用宏基因组测序方法,成功预测新琼四糖靶向肠道微生态调控机体脂质代谢的功效,为缓解运动性疲劳提供了新思路,也为新琼四糖作为益生元的实际生产应用提供了理论依据。
[1] 郭晓凤. 新琼寡糖的益生元作用研究[D]. 青岛: 中国海洋大学,2014: 6-8.
[2] 刘美英, 梅建凤, 易喻, 等. 琼胶寡糖生物活性的研究进展[J]. 药物生物技术, 2008, 15(6): 493-496.
[3] 刘刚. 琼胶寡糖的制备及生物活性研究[D]. 上海: 上海海洋大学,2010: 12-16.
[4] 贺纪正, 张丽梅, 沈菊培, 等. 宏基因组学(Metagenomics)的研究现状和发展趋势[J]. 环境科学学报, 2008, 28(2): 209-218.DOI:10.13671/j .hjkxxb .2008.02.001.
[5] BACKES C, MEESE E, LENHOF H P, et al. A dictionary on microRNAs and their putative target pathways[J]. Nucleic Acids Research, 2010, 38(13): 4476-4486. DOI:10.1093/nar/gkq167.
[6] 韩增叶, 田平芳. KEGG数据库在生物合成研究中的应用[J].生物技术通报, 2011(1): 76-82. DOI:10.13560/j.cnki.biotech.bull.1985.2011.01.007.
[7] KANEHISA M, GOTO S. KEGG: Kyoto encyclopedia of genes and genomes[J].Nucleic Acids Research, 2000, 28(1): 27-30. DOI:10.1093/nar/28.1.27.
[8] FAUST K, CROES D, HELDEN J V. Metabolic pathfinding using RPAIR annotation[J]. Journal of Molecular Biology, 2009, 388(2):390-414. DOI:10.1016/j.jmb.2009.03.006.
[9] KANEHISA M, GOTO S, SATO Y, et al. KEGG for integration and interpretation of large-scale molecular data sets[J]. Nucleic Acids Research, 2012, 40: 109-114. DOI:10.1093/nar/gkr988.
[10] 熊延连, 熊艳蕾, 李遥金, 等. 大鼠力竭运动诱导的氧化应激损伤对红细胞变形性的影响[J]. 中国应用生理学杂志, 2014, 30(4):289-293. DOI:10.13459/j.cnki.cjap.2014.04.001.
[11] 王福文, 赵敬国, 王燕, 等. 力竭性运动后大鼠血清CK, CK-MB活性和心肌组织形态学的动态改变[J]. 中国应用生理学杂志, 2011,27(1): 52-55. DOI:10.13459/j.cnki.cjap.2011.01.024.
[12] HUANG C C, LIN T J, CHEN C C, et al. Endurance training accelerates exhaustive exercise-induced mitochondrial DNA deletion and apoptosis of left centricle myocardium in rats[J]European Journal of Applied Physiology, 2009, 107(6): 697-706. DOI:10.1007/s00421-009-1177-4.
[13] LIU N, MAO X Z, DU Z J, et al. Cloning and characterisation of a novel neoagarotetraose-forming-β-agarase, AgWH50A from Agarivorans gilvus WH0801[J]. Carbohydrate Research, 2014, 388:147-151. DOI:10.1016/j.carres.2014.02.019.
[14] QIN J, LI R, RAES J, et al. A human gut microbial gene catalogue established by metagenomic sequencing[J]. Nature, 2010, 464: 59-65.DOI:10.1038/nature08821.
[15] GILL S R, POP M, DEBOY R T, et al. Metagenomic analysis of the human distal gut microbiome[J]. Science, 2006, 312: 1355-1359.DOI:10.1126/science.1124234.
[16] FUSTER V, VOUTE J, HUNN M, et al. Low priority of cardiovascular and chronic diseases on the global health agenda: a cause for concern[J]. Circulation, 2007, 116(17): 1966-1970. DOI:10.1161/CIRCULATIONAHA.107.733444.
[17] 易安妮, 张慧晔, 刘宾, 等. 益生元对抗生素引起的肠道菌群失调的作用[J]. 中国微生态学杂志, 2012, 24(4): 318-320. DOI:10.13381/j.cnki.cjm.2012.04.032.
[18] FUKUSHIMA M, DOI S, OHASHI T, et al. A mixture of organisms affects cholesterol metabolism together with rat cecal flora[J].Agricultural and Biological Chemistry, 1999, 63(7): 1160-1164.DOI:10.1271/bbb.63.1160.
[19] KOVATCHEVA-DATCHARY P, NILSSON A, AKRAMI R, et al.Dietary fiber-induced improvement in glucose metabolism is associated with increased abundance of prevotella[J]. Cell Metabolism,2015, 22(6): 971-982. DOI:10.1016/j.cmet.2015.10.001.
[20] LEY R E, PETERSON D A, GORDON J I. Ecological and evolutionary forces shaping microbial diversity in the human intestine[J]. Cell, 2006, 124(4): 837-848. DOI:10.1016/j.cell.2006.02.017.
[21] LEI H, SUN Y, LUO Z, et al. Fatigue-induced orosomucoid 1 acts on C-C chemokine receptor type 5 to enhance muscle endurance[J].Scientif i c Reports, 2016, 6: 128-129. DOI:10.1038/srep18839
[22] 陈昊杰. 胆汁酸对草鱼生长、脂质代谢及肠道微生物区系的影响[D].杨凌: 西北农林科技大学, 2016: 23-30.
[23] 郭秀兰. 猪肠道硬壁菌门和拟杆菌门数量的检测及其相对丰度与脂肪沉积的相关性研究[D]. 雅安: 四川农业大学, 2009: 68-75.
[24] 邴国强, 熊为民, 孙茹. 间竭性过量运动大鼠血液生化指标的变化及其影响[J]. 吉林大学学报, 2007, 33(5): 875-878. DOI:10.13481/j.1671-587x.2007.05.061.
[25] BERMON S, PETRIZ B, KAJĖNIENĖ A, et al. The microbiota: an exercise immunology perspective[J]. Exercise Immunology Review,2015, 21: 70-79.
[26] 侯方丽, 张瑞芬, 张名位, 等. 黑米花色苷调节脂质代谢作用及其分子机制研究进展[J]. 热带作物学报, 2016, 37(3): 640-646.DOI:10.3969/j.issn.1000-2561.2016.03.033.
[27] 蔡潭溪, 刘平生, 杨福全, 等. 脂质组学研究进展[J]. 生物化学与生物物理进展, 2010, 2: 121-128. DOI:10.3724/SP.J.1206.2009.00479.
[28] 陈宇欢, 李静, 范亚苇, 等. 脂质组学及其在营养与健康研究中的应用研究进展[J]. 食品科学, 2014, 35(15): 272-276. DOI:10.7506/spkx1002-6630-201415055.
[29] 张名位. 黑米抗氧化与降血脂的活性成分及其作用机理[D]. 广州:华南师范大学, 2003: 56-67.
[30] YAO S L, XU Y, ZHANG Y Y, et al. Black rice and anthocyanins induce inhibition of cholesterol absorption in vitro[J]. Food &Function, 2013, 4(11): 291-299. DOI:10.1039/c3fo60196j.
[31] NAPOLI C, CRUDELE V, SORICELLI A, et al. Primary prevention of atherosclerosis: a clinical challenge for the reversal of epigenetic mechanisms?[J]. Circulation, 2012, 125(19): 2363-2373.DOI:10.1161/CIRCULATIONAHA.111.085787.
[32] 陈国良, 刘立伟, 谢爽, 等. 高密度脂蛋白胆固醇代谢及其对冠心病影响的研究进展[J]. 心血管病学进展, 2010, 31(3): 360-363.DOI:10.3969/j.issn.1004-3934.2010.03.010.
[33] 蔡教英, 欧阳克蕙, 上官新晨, 等. 脂质代谢组学的研究进展[J]. 动物营养学报, 2011, 23(11): 1870-1876. DOI:10.3969/j.issn.1006-267x.2011.11.004.
[34] 喻松仁. 冠心病痰瘀衍变与脂质代谢的关联性研究[D]. 长沙: 湖南中医药大学, 2014: 5-12.
Neoagarotetraose Protects Mice against Exhaustive Exercise-Induced Dyslipidemia by Modulating Gut Microbial Composition and Function
LI Jing, ZHANG Na, SONG Jia, MAO Xiangzhao, XUE Changhu, TANG Qingjuan*
(College of Food Science and Engineering, Ocean University of China, Qingdao 266003, China)
Purpose: To investigate the possible mechanism of neoagarotetraose (NAT) in regulating lipid metabolism.Methods: Male BALB/C mice were randomly divided into three groups: control group, exhaustive exercise group and NAT intervention group. A wheel-track treadmill was used in this study to propose an exhaustive exercise protocol. The animals in both the exhaustive exercise and NAT groups were subjected to exhaustive exercise, while those in the control group maintained normal physical activity. After sixteen consecutive days of treatment, serum lipid parameters were measured and fecal samples were collected to investigate gut microbiota changes by metagenome sequencing. Our results showed that the concentrations of total cholesterol (TC), low-density lipoprotein cholesterol (LDL-C) and high-density lipoprotein cholesterol (HDL-C) in serum increased sharply (P < 0.05) after exhaustive exercise, while serum triglycerides(TG) concentration decreased signif i cantly (P < 0.05) indicating that exhaustive exercise could be an important cause of lipid metabolism disorder. Our data also showed that NAT treatment resulted in a profound change in the gut microbiome structure, which subsequently led to widespread shifts in its function. Meanwhile, our fi ndings suggested that NAT may protects mice against dyslipidemia induced by exhaustive exercise through modulating the gut microbial composition,improving the lipid metabolism signal pathway of the microbiota, and regulating enzymes activities involved in fatty acid oxidation and lipid synthesis.
neoagarotetraose; exhaustive exercise; dyslipidemia; gut microbiota; metagenome
10.7506/spkx1002-6630-201801025
TS201.4
A
1002-6630(2018)01-0165-07
李晶, 张娜, 宋佳, 等. 新琼四糖通过改善肠道微环境对力竭运动小鼠脂质代谢的影响[J]. 食品科学, 2018, 39(1):165-171.
10.7506/spkx1002-6630-201801025. http://www.spkx.net.cn
LI Jing, ZHANG Na, SONG Jia, et al. Neoagarotetraose protects mice against exhaustive exercise-induced dyslipidemia by modulating gut microbial composition and function[J]. Food Science, 2018, 39(1): 165-171. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201801025. http://www.spkx.net.cn
2016-10-08
国家自然科学基金面上项目(31271923);国家自然科学基金联合基金项目(U1406402)
李晶(1992—),女,硕士研究生,研究方向为食品营养学。E-mail:798183191@qq.com
*通信作者简介:唐庆娟(1971—),女,教授,博士,研究方向为食品营养学。E-mail:tangqingjuan@ouc.edu.cn

