PRF对下颌骨牵引成骨区骨保护素表达的影响*
付颖,董庆文,李新,王稚英,许王汉
(锦州医科大学附属第二医院,辽宁 锦州 121000)
PRF对下颌骨牵引成骨区骨保护素表达的影响*
付颖,董庆文,李新,王稚英,许王汉
(锦州医科大学附属第二医院,辽宁 锦州 121000)
目的探讨富血小板纤维蛋白(PRF)对牵引成骨(DO)区骨保护素(OPG)表达的影响。方法将25只大耳白兔随机分5组,分别行双侧下颌骨皮质骨切开术,一侧下颌骨牵引间隙放置PRF膜,作为实验组,对侧作为对照组,分别于牵引稳定期1、3、7、14和28d各处死一组动物,将下颌骨DO区骨块制成脱钙石蜡切片,进行苏木精-伊红染色及OPG免疫组织化学染色,细胞图像分析仪测量牵引间隙处骨痂OPG表达情况。结果下颌骨牵引处形成新生骨,免疫组织化学OPG染色主要表达在成骨细胞的胞浆中。实验组与对照组在稳定期1、3、7、14和28d的OPG阳性表达细胞数比较,差异有统计学意义(P<0.05)。结论PRF能促进兔下颌骨DO区新骨的生成,OPG可能在DO过程的早期调控组织细胞应力信号传递,发挥成骨作用。
下颌骨;牵引成骨;新骨形成;富血小板纤维蛋白;骨保护素
牵引成骨(distraction osteogenesis,DO)虽然已广泛应用,但是仍存在治疗周期较长、局部易感染不易愈合等缺点。富血小板纤维蛋白(platelet-rich fibrin,PRF)是一种自体静脉血经离心后的蛋白凝块,能诱导组织再生和促进愈合[1],推测可能促进DO新骨形成,缩短治疗周期。在新骨的形成中,骨保护素(Osteoprotegerin,OPG)能间接抑制破骨细胞的分化、成熟,促进新骨形成[2]。因此,本研究通过兔下颌骨DO模型,探讨在DO局部应用PRF膜的作用及OPG的表达,为促进新骨的形成提供依据。
1 材料与方法
1.1 材料与试剂
北京大学王兴教授设计的外置式下颌骨纯钛牵引器由西安中邦公司制作。牵引杆每旋转1周,牵引器两固定臂间隙增大0.4 mm。高速离心机(KLG,Osterrode,德国Sigma公司)、齿科低速手机、操作台、器械及麻醉药由辽宁医学院科学实验中心提供,OPG的SABC免疫组织化学法试剂盒(北京中杉金桥)。
1.2 仪器与设备
组织切片机(德国Leica公司,Leita1512),Vixwin2000图像分析系统(美国Display公司),万能显微镜照相机(日本Olympus公司),CIAS-1000细胞图像分析仪(北京大恒公司)。
1.3 方法
1.3.1 PRF膜的制备在无菌条件下,每只大耳白兔抽取静脉血5 ml,先后2400 r/min离心10 min,3 600 r/min离心15 min,静置后取出纤维蛋白凝块,即PRF膜[3],放入-70℃冰箱标号备用。
1.3.2 实验动物和分组日本大耳白兔25只,体重2.0~2.5 kg购自辽宁医学院实验动物中心。在安静、温暖、避强光的环境中适应性圈养1周,随机分为5组,每组5只。复制双侧下颌骨DO动物模型,一侧牵引间隙处放置PRF膜,作为实验组,对侧为对照组,分别于牵引稳定期1、3、7、14和28d处死。
1.3.3 下颌骨DO动物模型的复制实验动物按2.5 mg/kg经耳缘静脉注射10%平衡液全身麻醉后,在每只动物一侧下颌骨磨牙前部行骨切开术,安放牵引器,并于间隙处放置PRF膜;另一侧下颌骨磨牙前部行骨切开术并安放牵引器作为对照组,骨膜复位缝合,分层缝合肌肉、皮肤,牵引器加力杆端暴露于口外,间歇期5d后,用牵引器按0.8 mm/d(2次/d,0.4 mm/次,间隔12 h)的速度缓慢延长下颌骨。连续牵引5d,共延长下颌骨4 mm后固定牵引器,进入稳定期。
1.3.4 光镜标本的制备与染色分别于稳定期第1、3、7、14和28d处死1组动物,将下颌骨修剪成以DO区为中心的12 mm长组织块,放入4℃、4%中性甲醛溶液中固定24 h。0.5 mol/L EDTA脱钙,乙醇梯度脱水,透明,包埋,制成5μm厚切片,苏木精-伊红染色法(hematoxylin-eosin staining,HE)染色,光镜下观察。
1.3.5 免疫组织化学法兔下颌骨DO区标本放入4℃、4%中性甲醛溶液固定24 h,0.5 mol/L EDTA脱钙后,流水冲洗过夜,脱水,石蜡包埋,制成5μm厚切片。切片于60℃烘烤30 min,脱蜡至水,10%过氧化氢液室温5~10 min,0.02 mol/L PBS洗3次,5 min/次,切片浸入0.01 mol/L枸橼酸钠缓冲液(pH=6.0)微波修复抗原,滴加1∶100稀释的一抗OPG抗体,4℃孵育过夜;滴加生物素化二抗,37℃水浴30 min,0.02 mol/L PBS洗3次,5 min/次,滴加SABC于湿盒中37℃水浴30 min,0.02 mol/L PBS洗3次,5 min/次,DAB显色,取1 ml蒸馏水,加试剂盒中试剂,混匀后加到载玻片上,室温显色,镜下控制反应时间,蒸馏水终止反应,苏木精复染胞核,脱水,透明,封片,镜下观察。PBS代替一抗作为阴性对照。
1.4 统计学方法
数据分析采用SPSS 21.0统计软件,计量资料以均数±标准差(±s)表示,用重复测量设计的方差分析,P<0.05为差异有统计学意义。
2 结果
2.1 大体观察
实验动物下颌骨均被成功延长,术后7d内咀嚼功能稍有障碍,不影响健康和基本活动。牵引器固定稳定,周围无严重并发感染。取材时发现个别实验动物中切牙明显偏斜。
2.2 光镜观察HE染色
2.2.1 稳定期1d两组见紊乱排列的纤维结缔组织,有大量增殖的成骨样细胞。
2.2.2 稳定期3d两组间隙内纤维结缔组织沿牵引方向呈条束样,实验组纤维结缔组织更密集。见图1。

图1 稳定期3d两组纤维结缔组织排列情况(HE染色×100)
2.2.3 稳定期7d对照组胶原纤维束增多密集,沿牵引力方向有序排列。实验组于交界处有稀少的骨小梁。见图2。

图2 稳定期7d两组纤维组织及骨小梁排列情况(HE染色×100)
2.2.4 稳定期14d对照组出现幼稚骨小梁,成骨细胞排列在其周围并大量增生。实验组骨小梁增多,稀疏且不规则。见图3。

图3 稳定期14d两组骨小梁形成情况(HE染色×100)
2.2.5 稳定期28d对照组骨小梁稀疏,分散,不连接,排列于骨断开方向。实验组骨小梁有序,连接紧密,成骨细胞在骨小梁周围整齐排列。见图4。
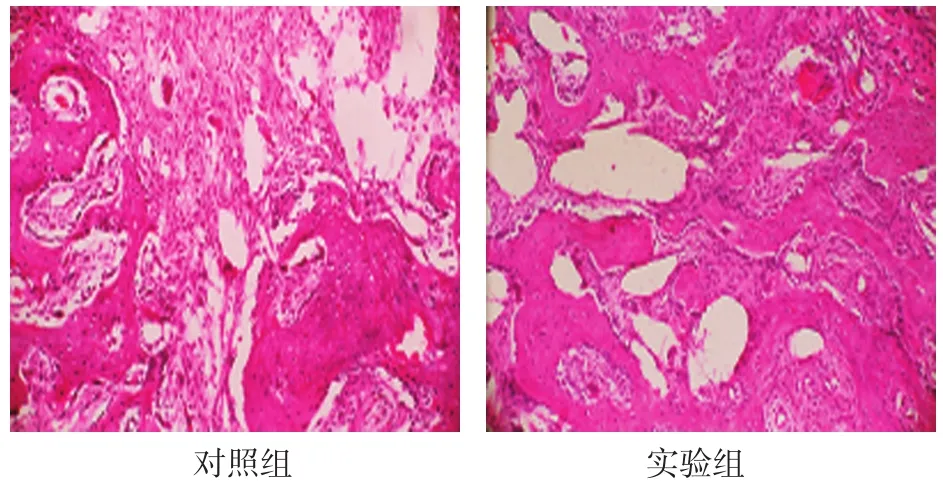
图4 稳定期28d两组骨小梁形成情况(HE染色×100)
2.3 免疫组织化学法染色结果
2.3.1 稳定期1d两组DO区见大量增殖的间充质细胞,新骨生成区OPG阳性表达,主要集中在间充质细胞的胞浆中。实验组增殖的细胞更明显,OPG表达更多。见图5。
2.3.2 稳定期3d对照组DO区新骨OPG在大量增殖的间充质细胞、成纤维细胞和成骨细胞中表达。实验组纤维束密集,OPG表达于沿牵引力方向排列的成纤维细胞的胞浆中。见图6。
2.3.3 稳定期7d对照组沿牵引力方向的成骨细胞胞浆中有OPG的表达。实验组在切开边缘的新生骨小梁周围有表达。见图7。
2.3.4 稳定期14d对照组OPG表达于排列在少量骨小梁表面的成骨细胞胞浆中。实验组OPG表达于增多的骨小梁周围的成骨细胞的胞浆中。见图8。
2.3.5 稳定期28d两组新骨形成区,OPG表达于骨小梁周围的成骨细胞胞浆中。见图9。
2.4 OPG阳性表达细胞数比较
两组在牵引稳定期1、3、7、14和28d的DO区OPG阳性表达细胞数比较,采用重复测量设计的方差分析,结果:①不同时间点OPG阳性表达细胞数有差异(F=124.679,P=0.000)。②实验组与对照组OPG阳性表达细胞数有差别(F=3.650,P=0.015),实验组较对照组在DO区OPG阳性表达细胞数高,能较好地促进兔下颌骨DO区新骨的生成。③实验组和对照组OPG阳性表达细胞数变化趋势有差别(F=119.093,P=0.000)。见图10和表1。
2.5 OPG阳性表达面积比较
两组在牵引稳定期1、3、7、14和28d的DO区OPG阳性表达面积比较,采用重复测量设计的方差分析,结果:①不同时间点OPG阳性表达面积有差异(F=58.365,P=0.000);②实验组与对照组OPG阳性表达面积有差异(F=73.215,P=0.000),实验组较对照组高。③实验组与对照组OPG阳性表达面积变化趋势无差异(F=0.111,P=0.978)。见表2。

图5 稳定期1d两组OPG在间充质细胞的胞浆中呈阳性表达 (免疫组织化学法×400)
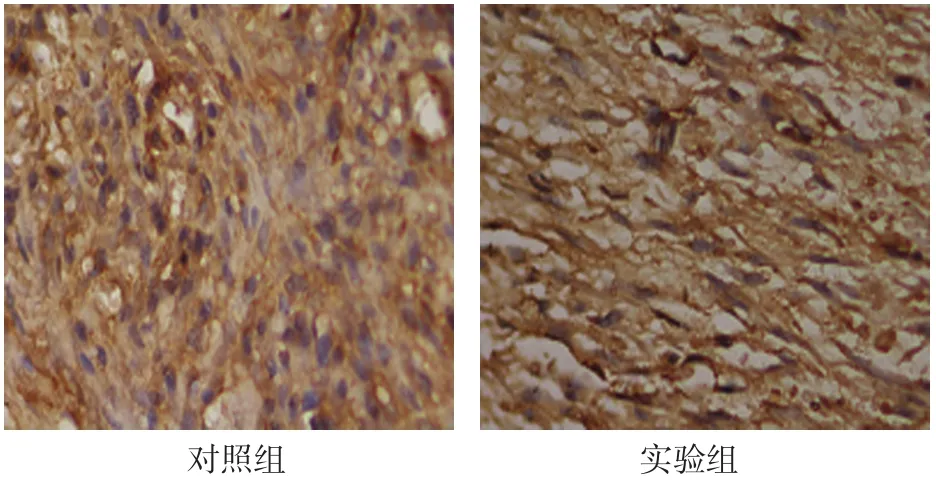
图6 稳定期3d两组OPG在成纤维细胞和成骨细胞中表达 (免疫组织化学法×400)

图7 稳定期7d两组OPG在成骨细胞胞浆中呈阳性表达(免疫组织化学法×400)

图8 稳定期14d两组OPG在成骨细胞胞浆中呈阳性表达 (免疫组织化学法×400)

图9 稳定期28d两组OPG在少量骨小梁表面成骨细胞中表达 (免疫组织化学法×400)

图10 两组OPG阳性表达细胞数不同时间点变化趋势
表1 两组各时间OPG阳性表达细胞数比较 (n =25,个,±s)

表1 两组各时间OPG阳性表达细胞数比较 (n =25,个,±s)
组别 稳定期1d 稳定期3d 稳定期7d 稳定期14d 稳定期28d对照组 11.000±1.000 7.600±1.140 5.600±1.140 2.800±0.837 1.800±0.836实验组 14.600±0.894 11 600±1.140 10.000±1.871 5.200±1.304 2.600±1.140
表2 两组各时间OPG阳性表达面积比较 (n =25,μm2,±s)
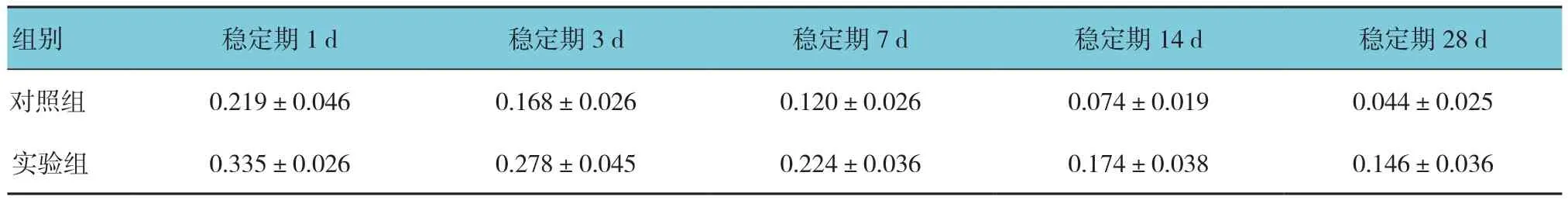
表2 两组各时间OPG阳性表达面积比较 (n =25,μm2,±s)
组别 稳定期1d 稳定期3d 稳定期7d 稳定期14d 稳定期28d对照组 0.219±0.046 0.168±0.026 0.120±0.026 0.074±0.019 0.044±0.025实验组 0.335±0.026 0.278±0.045 0.224±0.036 0.174±0.038 0.146±0.036
3 讨论
DO技术已广泛应用于颅颌面外科领域,并取得较好的效果,但还有一定的局限性,尤其治疗过程偏长,患者携带牵引器不方便,影响美观和生活质量。随着该技术的发展,如何缩短治疗过程且保持DO的效果,是该领域研究的重点问题。以往的研究中,许多生长因子,如骨形态发生蛋白、成纤维细胞生长因子、血小板衍生生长因子(platelet-derived growth factor,PDGF)、血管内皮细胞生长因子(vascular endothelial growth factor,VEGF)、转化生长因子β(transforming growth factor-beta,TGF-β)及胰岛素样生长因子(insulin-like growth factor,IGF)等都能促进成骨细胞的增殖、分化,从而加速新骨的形成与重建,而哪些骨修复材料或生物材料能具备以上多种因子促进骨生长的特性呢?近几年外科和种植方面研究较多的是富血小板血浆(platelet-rich plasma,PRP)和PRF,而PRF膜是区别于传统PRP的新一代血小板浓缩物,富含血小板、白细胞、多种生长因子和细胞因子。有研究表明,其能使成骨细胞增殖、分化,促进骨组织的修复愈合[4-6]。本实验HE染色结果提示,实验组在牵引间隙处加入PRF膜,新骨生成区的骨痂质量高于对照组,PRF膜能加速骨的愈合与修复。由于PRF膜中的血小板能释放PDGF、VEGF、TGF-β及IGF等,其对细胞的分化、血管增生和成骨细胞的增殖起促进作用,同时还能抑制破骨细胞的功能。这些因子有着天然的比例,具有协同效应并相互作用,共同维持着组织环境的平衡,对骨再生、愈合发挥重要的作用。
骨的愈合与修复需要多种细胞因子的相互作用。有研究显示,PRF能调节VEGF、BMP-2、OPG、TGF-β1等多种生长因子[7]。其中OPG和RANKL为骨的关键调控分子,在骨改建过程中,OPG具有抑制破骨细胞的增殖、分化、活化成熟及诱导破骨细胞的凋亡的功能,能通过与RANK结合,抑制RANKL与RANK的结合,从而抑制破骨细胞的形成、分化,进而阻止骨的吸收[2]。OPG在DO过程中间隙处的表达与骨折断端愈处的表达具有相似性。KON等[8]在鼠骨折后愈合过程中OPG表达的研究中发现,OPG在骨折后的1周内表达较高,以后逐渐下降,4周后恢复正常。国内祝为桥等[9]在大鼠的下颌DO区新骨形成的研究中发现,OPG和RANKL在早期表达明显,以后逐渐下降。LI等[10]用原位杂交方法在对兔子的DO过程中OPG/RANKL/RANK的研究中发现,OPG/ RANKL比率对于骨的修复与生成起着重要作用。本实验的免疫组织化学法研究发现,OPG主要表达于新生骨痂组织中的成纤维细胞及增殖活跃的成骨细胞中。两组在稳定期1、3、7、14和28d的OPG阳性表达细胞数有差异,且在稳定期1、3和7d,牵引间隙处组织中OPG表达水平较高;随着时间的延长,在牵引稳定期14d,新生骨组织逐渐成熟,成骨细胞埋入骨基质中,OPG表达水平降低;到稳定期28d,新生骨小梁逐渐成熟、稳定,OPG在成骨细胞中仅有微弱的表达。在稳定期1、3和7d,由于成纤维细胞与成骨细胞等大量增殖,在其胞浆中大量表达OPG,实验组与对照组的OPG阳性表达细胞数有差异。随着细胞增殖的逐渐减弱,成骨细胞表达OPG逐渐减弱,到稳定后期,实验组新生骨痂处成骨细胞趋于稳定。
DO间隙的愈合与成骨细胞、破骨细胞关系密切,PRF与牵引应力同时作用于成骨细胞,新骨生成受牵引信号和PRF两方面的调控。牵引力的施加对周围组织有一定的刺激,引起局部生长因子的释放,本实验前期基础研究显示,在牵引早期能促进OPG及其配体在DO区域的表达[11-12]。在本研究中,将PRF膜植入DO区,稳定早期,牵引间隙处覆盖PRF膜后,其表面形成纤维蛋白网络结构,期间有许多小孔,为大量增殖的成骨细胞等提供一定的增殖分化空间,并为骨断端的愈合搭建支架,促进牵引间隙处局部OPG浓度的增高。然后,局部高浓度的OPG与RANKL相结合,从而阻断RANKL与RANK的结合,促进骨合成代谢,增加骨小梁和骨密度表面新骨沉积,阻止牵引间隙的骨吸收,增加骨的厚度与强度。本实验的免疫组织化学法分析OPG发现,实验组在稳定期1、3和7d,OPG在增殖活跃的成纤维细胞和成骨细胞呈阳性高表达,随着时间延长至稳定期14d,成骨细胞等增殖逐渐减弱,OPG表达呈下降趋势;稳定期28d,牵引间隙处的成骨细胞不再大量增殖,趋于稳定或减少,出现破骨细胞,在这一时期主要表现为是骨的改建与再塑形,以骨吸收为主,从而保持动态的平衡关系。此时,HE染色发现,骨小梁周围出现细胞核较大、胞浆少的大量成骨细胞,成行或复层排列,与李绍兰等[13]的研究一致。
本实验结果显示,局部应用PRF膜可以促进成骨细胞的增殖,能提高下颌骨新骨生成的速度和质量,而且PRF可增加局部OPG在稳定期早期的表达,在新生骨痂成熟后OPG的表达逐渐减弱。提示OPG可能在PRF促进下颌DO的新骨生成中有重要的作用,为加快新骨的形成,缩短DO的治疗周期,减少并发症,以及临床的应用提供实验依据。
[1]HAMZACEBI B, ODUNCUOGLU B, ALAADDINOGLU E E, et al. Treatment of peri-implant bonedefects with platelet-rich fibrin[J]. Int J Periodontics Restorativedent, 2015, 5(3): 415-422.
[2]HONMA M, IKEBUCHI Y, KARIYA Y, et al. Regulatory mechanisms of RANKL presentation to ostelclast precursors[J]. Curr Osteoporos Rep, 2014, 12(1): 115-120.
[3]HATAKEYAMA I, MARUKAWA E, TAKAHASHI Y, et al. Effects of platelet-poor plasma, platelet-rich plasma, and platelet-rich fibrin on healing of extraction sockets with buccaldehiscence indogs[J]. Tissue Eng Part A, 2014, 20(3/4): 874-882.
[4]GASSLING V, HEDDERICH J, ACIL Y, et al. Comparison of platelet rich fibrin and collagen as osteoblast-seeded scaffolds for bone tissue engoneerong application[J]. Clin Oral Implants Res, 2013, 24(3): 320-328.
[5]KÖKDERE N N, BAYKUL T, FINDIK Y. The use of plateletrich fibrin (PRF) and PRF-mixed particulated autogenous bone graft in the treatment of bonedefects: an experimental and histomorphometrical study[J].dent Res J (Isfahan), 2015, 12(5): 418-424.
[6]PRIPATNANONT P, BALABID F, PONGPANICH S, et al. Effect of osteogenic periostealdistraction by a modified Hyraxdevice with and without platelet-rich fibrin on bone formation in a rabbit model: a pilot study[J]. Lnt J Oral Maxillofac Surg, 2015, 44(5): 656-663.
[7]杨世茂, 王明国, 李静. 富血小板纤维蛋白与富血小板血浆体外释放生长因子的比较及其对脂肪干细胞增殖分化的影响[J]. 华西口腔医学杂志, 2012, 30(6): 641-649.
[8]KON T, CHO T J, AIZAWA T, et al. Expression of osteoprotegerin, receptor activator of NF-kappa B ligand (osteoprotegerin ligand) and related proin flammatory cytokinesduring fracture healing[J]. J Bone Miner Res, 2001, 16(6): 1004-1014.
[9]祝为桥, 王兴, 王晓霞, 等. 大鼠下颌骨牵引成骨过程中骨改建机制的探讨[J]. 中华口腔医学杂志, 2007, 42(12): 729-732.
[10]LI W, ZHU S, HU J. Bone regeneration is promoted by orally administered bovine lactoferrin in a rabbit tibialdistraction osteogenesis model[J]. Clin Orthop Relat Res, 2015, 473(7): 2383-4893.
[11]付颖, 王稚英, 李新. 护骨素及其配体在兔下颌骨牵引成骨过程中的表达[J]. 江苏医药, 2013, 39(8): 882-884.
[12]付颖, 王稚英, 李新. 核因子KB受体活化因子配基在兔下颌骨牵引成骨过程中表达水平的变化[J]. 解剖学杂志, 2012, 35(5): 581-583.
[13]李绍兰. 基因转染对下颌骨牵引区细胞生长因子表达的影响[D]. 泸州: 泸州医学院, 2011.
Effect of platelet-rich fibrin ondistraction osteogenesis and osteoprotegerin expression*
Ying Fu, Qing-wendong, Xin Li , Zhi-ying Wang, Wang-han Xu
(The Second Affiliated Hospital of Jinzhou Medical University, Jinzhou, Liaoning 121000, China)
ObjectiveTo investigate the effect of platelet-rich fibrin (PRF) on mandibular osteogenesis and the expression of osteoprotegerin (OPG) in the period ofdistraction osteogenesis.MethodsTwenty-five mature rabbits were randomlydivided into five groups, bilateral mandibular osteotomies were performed in the rabbits. PRF was implanted in one side of the mandible as experimental group. The other side of madible was taken as control group. The rabbits were sacrificed and thedistracted calluses were harvested and processed for HE and OPG immunohistochemical staining on the 1st, 3th, 7th, 14th and 28thday after the end ofdistraction. The expression of OPG in the calluses was analyzed by celldigital imaging soft-ware.ResultsThe regenerated bone was found in thedistraction gap after mandibular lengthening, OPG was co-localized in cytoplasm of osteoblasts and newly-embedded osteocytes. Compared with the control group, the OPG-positive cell number was statistically different in the experimental group on the 1st, 3th, 7th, 14th and 28thday afterdistraction (P< 0.05).ConclusionsOur preliminary resultdemonstrated that PRF increases new bone formation and has a positive effect on early bone healing. OPG may play important roles at the early stage of mandibulardistraction.
mandible;distraction osteogenesis; new bone formation; platelet-rich fibrin; osteoprotegerin
10.3969/j.issn.1005-8982.2018.02.003
1005-8982(2018)02-0014-06
R782.2
A
2016-04-18
辽宁省自然科学基金(No:2015020352);辽宁省大学生创新创业训练计划项目(No:201510160000019)
李新,E-mail:httplixin@163.com;Tel:13841637172
(童颖丹 编辑)

