INO80参与拟南芥气孔数量调控的分子机制
任媛媛,朱 炎
(1.复旦大学 生命科学学院 植物科学研究所,上海 200438;2.复旦大学 遗传工程国家重点实验室,上海200438)
INO80参与拟南芥气孔数量调控的分子机制
任媛媛1,2,朱 炎1,2
(1.复旦大学 生命科学学院 植物科学研究所,上海 200438;2.复旦大学 遗传工程国家重点实验室,上海200438)
气孔是植物表皮特有的结构,参与到植物的呼吸、蒸腾作用等多种生理活动.植物通过气孔与大气进行气体交换.INO80是一类保守的染色质重塑因子,可以与组蛋白变异体H2A.Z结合.与野生型相比,拟南芥ino80缺失突变体对于渗透压的敏感度及其失水率都有明显提高.与此相应的是,ino80缺失突变体植物表现出气孔明显增多的表型.bHLH转录因子家族中的SPCH和MUTE对于气孔的发育起到正调控的作用.RT-PCR检测显示,在ino80突变体的背景下,气孔正调控基因SPCH和MUTE的表达量都显著上调.ChIP-PCR实验显示,相对于野生型,H2A.Z在SPCH和MUTE上染色质的分布在ino80缺失突变体内下调.我们的工作表明,在拟南芥中,INO80可能通过调控气孔正调控基因染色质区域组蛋白变体H2A.Z的分布影响靶基因的转录水平,进而改变气孔数量以及植物的相应生理指标.
INO80; 气孔; bHLH转录因子; H2A.Z
气孔是在4亿年前开始进行演化的.为了在干燥的大气中生存,植物必须进化出相应的组织或器官,即气孔.植物可以通过气孔进行气体和水的交换,从而进行高效的光合作用和呼吸作用[1].气孔由一对对称的保卫细胞组成,主要产生于植物的地上器官,如植物的茎、叶和花,在根部中很少发生,偶尔可以从黑暗中生长的幼苗的下胚轴中发现[2-4].通过组织内膨胀压力的高低来控制气孔的状态,从而能够有效地避免植物脱水.蒸腾作用或通过气孔发生的水分损失,都可以促进水分子在植物上进行向上和向外的运动,从而冷却植物表面.为了使气体能够有效地到达内部组织,气孔是均匀分布的;并严格遵循“一个细胞间距”原则[3],这意味着两个气孔之间至少存在一个非气孔表皮细胞将其隔开.“一个细胞间距”原则使气孔能够进行恰当的打开和关闭,从而使气体(包括二氧化碳与水蒸气)与离子的交换能够高效有序的进行[5].
在拟南芥(Arabidopsisthaliana)中,气孔的产生主要是由一个专门的表皮细胞谱系所决定的[1,3,6-8].表皮细胞谱系主要由5种细胞构成: 拟分生母细胞(Meristemoid Mother Cells, MMCs),拟分生细胞(meristemoid),气孔谱系基础细胞(Stomatal Lineage Ground Cells, SLGCs),保卫母细胞(Guard Mother Cells, GMCs)以及保卫细胞(Guard Cells, GCs).拟分生母细胞来源于表皮原细胞(protodermal cell)的分化,而后经过一次不对称的分裂,产生小的通常呈三角形的拟分生细胞和大的气孔谱系基础细胞.拟分生细胞具有有限的自我更新的能力,并可进行额外的不对称分裂从而产生新的拟分生细胞和气孔谱系基础细胞.通常拟分生细胞在分化为保卫母细胞之前,会经过不超过两次的分裂.保卫母细胞可以通过其独特的圆形形态进行识别,经过一次对称分裂并发生细胞形态的转变,形成一对保卫细胞,从而形成气孔.在分裂过程中产生的气孔谱系基础细胞的转变过程是复杂的,它们可以分化为表皮细胞,也可以进行不对称分裂产生次生或卫星拟分生细胞.虽然被称为“气孔谱系”,拟分生细胞和气孔谱系基础细胞具有继续分裂的能力,意味着这个谱系负责在叶片中产生多数的表皮细胞[9].表皮细胞谱系可以提高植物适应环境的灵活性,如从逆境(如干旱)[10-11]中存活下来.
气孔复杂并灵活的发育过程意味着其需要复杂的细胞形态调控程序进行调控.SPCH(SPEECHLESS),MUTE和FAMA蛋白是气孔谱系细胞形态转变过程中的正调控因子[12],三者同属于bHLH(basic helix-loop-helix)转录因子家族[2-4].在它们的bHLH结构域中,三者的氨基酸具有90%的相似性;而在全部的氨基酸序列中,三者具有40%的相似性[11,13-15].SPCH可以促进表皮原细胞向拟分生母细胞转化以及拟分生母细胞进行不对称分裂产生拟分生细胞[13,15-16].SPCH只在拟分生母细胞和拟分生细胞中进行表达,SPCH的缺失突变体几乎完全没有气孔,表皮仅由表皮细胞构成.MUTE控制着拟分生细胞不对称分裂的停止以及促进拟分生细胞向保卫母细胞的转化.MUTE功能性缺失的植物不具有气孔,但并不完全缺乏气孔谱系细胞;过表达MUTE会使表皮完全由气孔组成[13,15].FAMA可以促进保卫母细胞向保卫细胞的转变,FAMA的缺失突变体中,转化会停止在保卫母细胞状态;过表达FAMA会产生异位的保卫细胞,从而使保卫细胞不能进行正确的配对[5,13-14].
在拟南芥中,细胞与细胞之间的信号通路可以使气孔严格遵循“一个细胞间距”原则.富含亮氨酸的受体激酶ERECTA(ER)家族与受体蛋白TOO MANYMOUTHS(TMM)功能存在部分冗余,都会影响气孔的分布以及密度[17].TMM的功能具有器官依赖性以及复杂性: 在TMM缺失突变体中,叶片显示出成簇的气孔,但茎却完全观察不到气孔[18].ERECTA,ERECTA-LIKE 1(ERL1)和ERECTA-LIKE 2(ERL2)是构成ERECTA(ER)家族的3个成员[19-23].ER家族与TMM家族都可以抑制气孔细胞形态的转变,是气孔谱系细胞形态转变的过程中的负调控因子.受体介导的信号通路又会激活MAPK级联信号通路,信号通路中包括MAPKKK YODA[24],MPKK4/5,MAPK MPK3/6[25-26],抑制气孔的发育.一般来讲,MAPK级联信号通路可以通过磷酸化转录因子来调节其活性.YODA-MKK4/5-MPK3/6可以通过磷酸化SPCH抑制表皮谱系细胞分裂[27-28].
ATP依赖的染色质重塑因子可以通过利用ATP水解释放的能量,催化DNA-组蛋白结构的解体,滑动核小体[29].此外,它们也可以通过置换组蛋白或者组蛋白的变异体从而介导核小体组装或者改变核小体的组份,改变染色质的包装状态.染色质重塑因子在进化上相对保守,它们都具有一个保守的ATPase结构域,同属于SWI2/SNF2家族.目前为止,可以将SNF2家族染色质重塑因子分为SWI/SNF、ISWI亚家族、CHD亚家族和INO80亚家族[30].由于ATPase结构域毗邻的结构域的不同,这4种染色质重塑因子的功能也有所区别.INO80和SWR1是INO80亚家族中重要的成员,可以催化组蛋白H2A.Z/H2B与H2A/H2B之间的置换[31-32].在酵母中,INO80染色质重塑复合物可以被招募至DNA断裂部位[33].在芽殖酵母中,INO80复合物的量在损伤时期更高.在植物ino80缺失突变体中,DNA修复存在缺陷[34],这证明INO80参与DNA修复的机制很保守.在拟南芥中,INO80可以与H2A.Z相互作用,并通过促进H2A.Z在开花抑制基因FLC和MAF4/5上的富集调控拟南芥的开花调控[35].也有研究表明,INO80作为正调控因子参与了细胞的同源重组[36].本工作通过对表型的分析,发现拟南芥ino80突变体中气孔增多.运用分子生物学等手段,我们深入研究了INO80参与拟南芥中气孔数量调控的表观遗传机制.
1 材料与方法
1.1 材料
拟南芥ArabidopsisthalianaCol-0,Arabidopsisthalianaino80-5(背景为Col-0);以上材料均保存于本实验室.
土壤成分: 黑土、蛭石、珍珠岩按质量比2∶2∶1混合.PNS营养液: 1L营养液含2.5mL 1mol/L磷酸缓冲液(pH5.5),5mL 1mol/L KNO3,2mL 1mol/L MgSO4·7H2O,2mL 1mol/L Ca(NO3)2·4H2O,2.5mL 20mmol/L Fe·EDTA, 1mL MS微量元素.植物MS培养基: MS-0255 4.9g/L, 10g/L蔗糖, KOH调至pH5.7~5.8后,固体培养基中加入8g/L琼脂粉,PEG600-MS培养基中加入PEG-600至终浓度为22%,118℃的条件下灭菌30min.植物在相对湿度80%,20~24℃恒温,光照强度80~200μE/(M2·S)和光照周期为16h光照/8h黑暗(长日照)的条件下培养.
RNA提取试剂TRIzol购自Ambion公司;反转录试剂盒购自Promega公司;MS-0255购自Duchefa Biochemie公司;SYBR购自TaKaRa公司;聚乙二醇PEG-600以及其他常规试剂购自国药集团试剂有限公司.引物合成由上海杰李生物科技有限公司完成.
1.2 方法
1.2.1 渗透压敏感度检测
将灭过菌的种子分别铺在固体MS培养基中,4℃春化2d后,于培养箱中培养.8~9d后,将幼苗分别移置于含有22% PEG-600的固体MS培养基以及不含PEG-600的MS培养基中,再置于培养箱中培养6~7d,对其表型进行观察与拍摄,并检测植物净重.
1.2.2 失水率检测
将灭过菌的种子分别铺在固体MS培养基中,4℃春化2d后,于培养箱中培养.14~16d后,以20棵为一个单位,分别将野生型拟南芥(WT)和INO80突变体型拟南芥(ino80-5)的植株从培养基中小心的拔出,置于称量纸上,在电子天平上称量其重量,为初始净重;称量后将植株置于室温下,每隔5min进行称量,绘制曲线图.
1.2.3 拟南芥气孔密度测定
将消毒后的WT和ino80-5种子分别铺在土壤中,4℃春化2d后,于温室中培养.25d后,取第1对和第3对真叶7~8片,置于DIC透明液(含有8g三氯乙醛,1mL甘油,2mL水)中,55℃水浴2~3h.通过微分干涉相差显微镜(DIC)对拟南芥叶片的保卫细胞进行观察,选取4~5个不同的视野对叶片进行拍摄.
1.2.4 RNA提取及荧光定量PCR
将灭过菌的种子分别铺在植物固体MS培养基中,4℃春化2d后,于培养箱中培养,14~16d后,用TRIzol试剂抽提WT和ino80-5中的总RNA.按照Promega试剂盒中的方法进行反转录,通过荧光定量PCR对WT和ino80-5植株中有关气孔发育基因的mRNA水平进行检测,从而分析基因的转录本,引物序列如表1所示.

表1 基因表达水平检测引物Tab.1 Primers for testing gene transcription level
1.2.5 染色质免疫共沉淀(ChIP)
取生长于土壤中40~50d的WT和ino80-5植株的莲座叶,浸泡于固定液中(0.4mol/L蔗糖,pH 8.0的10mmol/L Tris-HCL,1mmol/L EDTA,1mmol/L PMSF,1.0%甲醛),在室温下用真空抽气机抽15min,抽气3次后加入2.5mol/L的甘氨酸终止反应.Milli-Q洗干净之后,用纸吸干水分.在液氮中将植物材料研磨为粉末,加入20~30mL ChIP裂解缓冲液(50mmol/L HEPES pH 7.5,150mmol/L NaCl,1mmol/L EDTA,1.0% Triton X-100,5mmol/L β-巯基乙醇,10%甘油,1mmol/L PMSF,1片Cocktail),振荡混匀,4℃孵育30min.用100μm的尼龙膜进行过滤,4℃离心20min,去上清,加入ChIP裂解缓冲液重悬,加入SDS使其浓度为0.5%.超声波处理1min 30s,4℃高速离心20min,取上清稀释至SDS浓度为0.1%,加入40μL Protein A beads,4℃孵育1h,除去其中的杂蛋白.除去Protein A beads,加入抗体,4℃孵育过夜.加入40μL Protein A beads,4℃孵育1h,先后用低盐洗脱液(50mmol/L HEPES pH 7.5, 150mmol/L NaCl,1mmol/L EDTA,5mmol/L β-巯基乙醇),高盐洗脱液(50mmol/L HEPES pH 7.5, 500mmol/L NaCl,1mmol/L EDTA,5mmol/L β-巯基乙醇),LiCl洗脱液(0.25mol/L LiCl,0.5%NP-40,1mmol/L EDTA, 10mmol/L Tris-HCL pH 8.0, 5mmol/L β-巯基乙醇)洗脱一次,TE(10mmol/L Tris-HCL pH 8.0, 1mmol/L EDTA)洗两次.加入250μL洗脱液(1%SDS, 0.1mmol/L NaHCO3),65℃水浴15min,收集洗脱液,重复一遍.向洗脱液中加入20μL 5mol/L NaCl,65℃水浴过夜解交联.加入8μL 0.5mol/L EDTA,16μL Tris-HCL(pH 8.0),2μL蛋白酶K,45℃消化1h.加入酚氯仿,离心后向上清中加入4μL DNA mate,1/10体积的3 mol/LNaAc,两倍体积的无水乙醇,4℃离心20min,75%乙醇洗涤沉淀,进行定量PCR检测.
2 结 果
2.1 检测WT和ino80-5在PEG-600处理下对渗透压的敏感度
PEG-600为环氧乙烷水解产物的聚合物,无毒且无刺激性,具有吸水性.在MS培养基中加入PEG-600,可改变培养基的渗透压.当将WT和ino80-5幼苗从正常MS培养基上移至22%的PEG600-MS培养基,培养6~7d后,对其表型进行观察.野生型和ino80-5突变体植株都有明显的黄化以及植株弱小表型(图1(a)),然而ino80-5突变体受损更为明显.为了得到量化的数据,我们对WT和ino80-5植株进行称重.经过22%的PEG-600处理后,WT的净重平均下降至34.2%,而ino80-5的净重平均下降至23.7%(图1(b)),表明ino80-5突变体植株相较于野生型植株对于渗透压的变化更为敏感.
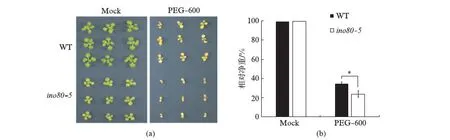
图1 野生型与ino80-5突变体植株在PEG-600处理之后的表型与净重Fig.1 The phenotype and net weight of wild-type and ino80-5 mutant after PEG-600 treatment(a) 佳能相机所拍摄的ino80-5在PEG-600处理之后的表型;(b) WT和ino80-5在22% PEG-600处理之后净重的变化.WT用黑色标记,ino80-5用白色标记.(误差线代表3次生物学重复的SD,*代表t-test检验出的显著性差异,P<0.05)
2.2 检测WT和ino80-5的失水率

图2 野生型和ino80-5突变体的失水率Fig.2 The transpiration rate of wild-type and ino80-5 mutant数值来自于20棵幼苗数据的均值,误差线代表3次生物学重复的SD.
在本实验室培养条件下,14~16d后幼苗已长出真叶,取幼苗于称量纸上称其初始重量,而后将植株置于室温下,每隔5min称量其净重,绘制曲线图.从图中可以看出,随着时间的逐渐推移,WT和ino80-5的净重都有显著性下调,然而ino80-5的下降幅度更为明显,室温放置65min后,WT的净重下降至35.6%,而ino80-5的净重下降至初始净重的21.8%(图2).这说明当处于同样的生长状况下,ino80-5的失水率显著高于WT.
2.3 拟南芥ino80-5突变体中气孔数目明显增加
将WT和ino80-5种子铺在土壤中,于温室中培养.25d后,取第1对和第3对真叶进行DIC透明液处理,通过微分干涉相差显微镜(DIC)对拟南芥叶片的表皮细胞进行观察统计.当视野的面积相同时,ino80-5突变体中气孔数目明显多于WT.第1对真叶已发育完全,而第3对真叶尚处于生长发育阶段,二者虽然生长发育阶段不同,但都有气孔增多的表型,证明该表型与发育阶段无关.此处我们选取第3对真叶的拍摄结果进行作图(图3).ino80-5突变体中,气孔并未出现发育上的异常,表明INO80没有影响到气孔的形态发生.
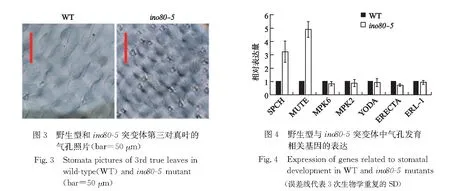
2.4 拟南芥ino80-5突变体中与气孔发育相关基因的表达情况
我们通过对WT与ino80-5植株叶片的表型观察,发现ino80-5植株叶片的气孔数目明显增加.接下来,我们通过RT-PCR检测调节气孔发育的相关基因在ino80-5突变体中的表达情况.RT-PCR结果显示,在ino80-5突变体中,调节气孔发育的正调控因子bHLH转录因子SPCH和MUTE的表达量特异性地显著提升.SPCH的表达量上调至3倍,而MUTE的表达量更是上调至大约5倍(图4).ERECTA家族受体激酶和MAPK级联信号通路位于SPCH和MUTE的上游[9],抑制气孔的发育,而ERECTA家族中的ERECTA、ERL1,MAPK级联信号通路中的YODA、MPK6的表达量都没有明显改变,证明ino80-5突变体气孔增多的表型并不是由ERECTA家族受体激酶和MAPK级联信号通路调控的.因此,INO80调控SPCH和MUTE的表达是特异的.此外,SPCH和MUTE基因的转录本的显著性升高也与ino80-5突变体中气孔明显增多的表型相符合.
2.5 INO80影响气孔正调控基因上H2A.Z的分布
在拟南芥中,组蛋白H2A的变体H2A.Z可以参与基因的转录调控,维持基因组的稳定性并参与DNA修复,在表观遗传学方面具有重要的意义[38].之前已有报道指出,INO80可以直接结合组蛋白变体H2A.Z,通过调控H2A.Z在开花抑制基因FLC和MAF4/5染色质区域的分布,进而调控相应基因的表达[35].我们进行了染色质免疫共沉淀实验(ChIP).当用H2A.Z多克隆抗体检测时,我们发现在WT背景下,H2A.Z在SPCH编码区的第1个和第2个外显子区间有明显的富集,在该基因的其他区段富集程度相对较低.而在ino80-5背景下,H2A.Z在第1个和第2个外显子区间富集程度显著性降低,在该基因的其他区段的富集程度也有一定程度的降低.与此同时,我们也检测了WT和ino80-5植物材料中,组蛋白H3在SPCH基因上的富集程度,结果显示并没有明显区别(图5(a),).上述结果显示,INO80特异性地影响SPCH基因上H2A.Z的分布.
在WT背景下,H2A.Z在MUTE的第3、第5至第7区段有明显的富集.而在ino80-5背景下,H2A.Z在MUTE基因上的富集程度与WT相比,有一定程度的降低,在第3至第7区段之间降低程度最为明显.而在WT和ino80-5背景下,组蛋白H3在MUTE基因上的富集程度并没有明显区别(图5(b),).同时,我们选取SPCH的上游基因MPK6进行检测.RT-PCR结果显示,MPK6在WT和ino80-5背景下,转录水平差异不大,ChIP实验也证明H2A.Z在MPK6基因上的分布不受INO80的影响(图5(c),).进一步表明,INO80可以特异性地影响H2A.Z在SPCH和MUTE基因上的分布,尤其是基因内部区域.

图5 INO80特异性地调控H2A.Z在SPCH和MUTE染色质区域的分布Fig.5 INO80 specifically regulate the distribution of H2A.Z in the chromatin regions of SPCH and MUTE(a) SPCH染色质区域H2A.Z和H3的富集程度.上图示意基因结构.黑色方框代表外显子区域,数字代表用于ChIP-PCR检测的引物顺序.下图显示H2A.z和H3的ChIP结果;(b) MUTE染色质区域H2A.Z和H3的富集程度, 黑色方框代表外显子区域, 浅色方框代表非编码区;(c) MPK6染色质区域H2A.Z和H3的富集程度.
3 讨 论
气孔是植物表皮特有的结构,是植物与大气进行气体交换的主要通道.气孔的发育需要经历细胞形态的转变,表皮谱系细胞的不对称分裂,细胞之间的信号传导[7].目前对于气孔的研究已经日益深入,在ino80-5突变体中,气孔的数目明显增多,我们就此现象对其机制进行了研究.
PEG-600处理后,ino80-5显示出植株弱小、黄化严重,净重减少的表型,表明其对渗透压的敏感度明显高于WT;后于室温下通过测量其净重,检测其失水率,结果显示ino80-5的失水率亦高于WT,上述结果均与ino80-5突变体气孔增多的表型相一致.
RT-PCR实验中,ino80-5背景下bHLH转录因子家族的SPCH,MUTE的表达量显著性上调,二者均属于气孔发育的正调控因子.ERECTA家族受体激酶和MAPK级联信号通路位于SPCH和MUTE的上游,对气孔发育起负调控作用,而ERECTA家族中的ERECTA、ERL1,MAPK级联信号通路中的YODA、MPK6的表达量都没有明显改变.因此,INO80可以特异性的抑制SPCH和MUTE的表达,从而抑制气孔的发育.
Coleman-Derr等人通过分析ChIP-Sequence数据发现,在拟南芥全基因组中,H2A.Z在对环境有应答性的基因内部有富集,富集程度与基因受环境因素诱导后的应答程度成正比.有意思的是,应答基因内部H2A.Z富集程度往往与基因最终表达量成反比[38].植物气孔数量的调控与植物应对环境变化有着紧密的联系,被认为也受到表观遗传机制的调控.ChIP实验表明,H2A.Z在SPCH的第4至第11区段具有较高的富集程度,之后逐渐降低;H2A.Z在MUTE的第3、第5至第7区段有明显的富集并在第7区段达到了最高丰度,从图中可以看出H2A.Z更多地分布在基因内部(gene body)区域而非转录起始位点(TSS)[38].在ino80-5突变体背景下,H2A.Z在SPCH和MUTE的相对丰度都有明显的降低.而组蛋白H3在SPCH基因上的相对丰度较为稳定且富集程度高,在MUTE基因上的相对丰度虽较为降低,但仍在第7区段到达最高值,且在WT与ino80-5背景下,H3在SPCH和MUTE基因上的富集程度并没有明显区别.RT-PCR结果显示SPCH和MUTE基因的表达量显著升高,这与Coleman-Derr等人的研究是一致的.之前有研究指出,INO80可以结合H2A.Z,通过调控H2A.Z在开花抑制基因FLC和MAF4/5染色质区域的分布,进而调控相应基因的表达.我们的工作表明INO80可能通过相类似的方式影响H2A.Z在SPCH和MUTE基因上的分布进而影响相应基因的转录水平,最终对气孔的数量进行调节.此外也有研究表明INO80可以催化组蛋白H2A.Z/H2B与H2A/H2B之间的置换[31-32],因此我们也猜测INO80在SPCH和MUTE的染色质区域,可能通过催化组蛋白的置换从而改变与基因转录水平有着紧密联系的H2A.Z的富集程度,调节气孔的发育.
综上所述,我们的研究显示在拟南芥中,INO80可能通过调节气孔发生的正调控基因上H2A.Z的分布,对相应基因的转录进行负调控,抑制气孔的数量.组蛋白变体H2A.Z可以参与许多胁迫应答基因的转录调控.植物如何通过表观遗传机制对植物自身的发育进行调节需要将来更多的机理研究进一步揭示.
[1] DOW G J, BERGMANN D C. Patterning and processes: How stomatal development defines physiological potential [J].CurrOpinPlantBiol, 2014,21: 67-74.
[2] KLERMUND C, RANFTL Q L, DIENER J,etal. LLM-domain B-GATA transcription factors promote stomatal development downstream of light signaling pathways inArabidopsisthalianaHypocotyls [J].PlantCell, 2016,28(3): 646-660.
[3] PILLITTERI L J, TORII K U. Mechanisms of stomatal development [J].AnnuRevPlantBiol, 2012,63: 591-614.
[4] WENGIER D L, BERGMANN D C. On fate and flexibility in stomatal development [J].ColdSpringHarbSympQuantBiol, 2012,77: 53-62.
[5] PETERSON K M, RYCHEL A L, TORII K U. Out of the mouths of plants: The molecular basis of the evolution and diversity of stomatal development [J],PlantCell, 2010,22(2): 296-306.
[6] WANG M, YANG K, LE J, Organ-specific effects of brassinosteroids on stomatal production coordinate with the action of too many mouths [J].JIntegrPlantBiol, 2015,57(3): 247-255.
[7] BERGMANN D C, SACK F D. Stomatal development [J].AnnuRevPlantBiol, 2007,58: 163-181.
[8] NADEAU J A, SACK F D. Stomatal development inArabidopsis[J].ArabidopsisBook, 2002,1: e66.
[9] GEISLER M, NADEAU J, SACK F D. Oriented asymmetric divisions that generate the stomatal spacing pattern in arabidopsis are disrupted by the too many mouths mutation [J].PlantCell, 2000,12(11): 2075-2086.
[10] SKIRYCZ A, CLAEYS H, DE BODT S,etal. Pause-and-stop: The effects of osmotic stress on cell proliferation during early leaf development inArabidopsisand a role for ethylene signaling in cell cycle arrest [J].PlantCell, 2011,23(5): 1876-1888.
[11] LAU O S, BERGMANN D C. Stomatal development: A plant’s perspective on cell polarity, cell fate transitions and intercellular communication [J].Development, 2012,139(20): 3683-3692.
[12] LAU O S, DAVIES K A, CHANG J,etal. Direct roles of SPEECHLESS in the specification of stomatal self-renewing cells [J].Science, 2014,345(6204): 1605-1609.
[13] MACALISTER C A, OHASHI-ITO K, BERGMANN D C. Transcription factor control of asymmetric cell divisions that establish the stomatal lineage [J].Nature, 2007,445(7127): 537-540.
[14] OHASHI-ITO K, BERGMANN D C.ArabidopsisFAMA controls the final proliferation/differentiation switch during stomatal development [J].PlantCell, 2006,18(10): 2493-2505.
[15] PILLITTERI L J, SLOAN D B, BOGENSCHUTZ N L,etal. Termination of asymmetric cell division and differentiation of stomata [J].Nature, 2007,445(7127): 501-505.
[16] ROBINSON S, BARBIER D R P, CHAN J,etal. Generation of spatial patterns through cell polarity switching [J].Science, 2011,333(6048): 1436-1440.
[17] SHPAK E D, MCABEE J M, PILLITTERI L J,etal. Stomatal patterning and differentiation by synergistic interactions of receptor kinases [J].Science, 2005,309(5732): 290-293.
[18] BHAVE N S, VELEY K M, NADEAU J A,etal. TOO MANY MOUTHS promotes cell fate progression in stomatal development ofArabidopsisstems [J].Planta, 2009,229(2): 357-367.
[19] HARA K, YOKOO T, KAJITA R,etal. Epidermal cell density is autoregulated via a secretory peptide, EPIDERMAL PATTERNING FACTOR 2 inArabidopsisleaves [J].PlantCellPhysiol, 2009,50(6): 1019-1031.
[20] HARA K, KAJITA R, TORII K U,etal. The secretory peptide gene EPF1 enforces the stomatal one-cell-spacing rule [J].GenesDev, 2007,21(14): 1720-1725.
[21] HUNT L, GRAY J E. The signaling peptide EPF2 controls asymmetric cell divisions during stomatal development [J].CurrBiol, 2009,19(10): 864-869.
[22] LEE J S, HNILOVA M, MAES M,etal. Competitive binding of antagonistic peptides fine-tunes stomatal patterning [J].Nature, 2015,522(7557): 439-443.
[23] RICHARDSON L G, TORII K U. Take a deep breath: Peptide signalling in stomatal patterning and differentiation [J].JExpBot, 2013,64(17): 5243-5251.
[24] BERGMANN D C, LUKOWITZ W, SOMERVILLE C R. Stomatal development and pattern controlled by a MAPKK kinase [J].Science, 2004,304(5676): 1494-1497.
[25] JEWARIA P K, HARA T, TANAKA H,etal. Differential effects of the peptides Stomagen, EPF1 and EPF2 on activation of MAP kinase MPK6 and the SPCH protein level [J].PlantCellPhysiol, 2013,54(8): 1253-1262.
[26] WANG H, NGWENYAMA N, LIU Y,etal. Stomatal development and patterning are regulated by environmentally responsive mitogen-activated protein kinases inArabidopsis[J].PlantCell, 2007,19(1): 63-73.
[27] LAMPARD G R, MACALISTER C A, BERGMANN D C.Arabidopsisstomatal initiation is controlled by MAPK-mediated regulation of the bHLH SPEECHLESS [J].Science, 2008,322(5904): 1113-1116.
[28] LIU Y K, LIU Y B, ZHANG M Y,etal. Stomatal development and movement: The roles of MAPK signaling [J].PlantSignalBehav, 2010,5(10): 1176-1180.
[29] PIATTI P, ZEILNER A, LUSSER A. ATP-dependent chromatin remodeling factors and their roles in affecting nucleosome fiber composition [J].IntJMolSci, 2011,12(10): 6544-6565.
[30] EISEN J A, SWEDER K S, HANAWALT P C. Evolution of the SNF2 family of proteins: Subfamilies with distinct sequences and functions [J].NucleicAcidsRes, 1995,23(14): 2715-2723.
[31] PAPAMICHOS-CHRONAKIS M, WATANABE S, RANDO O J,etal. Global regulation of H2A.Z localization by the INO80 chromatin-remodeling enzyme is essential for genome integrity [J].Cell, 2011,144(2): 200-213.
[32] TOSI A, HAAS C, HERZOG F,etal. Structure and subunit topology of the INO80 chromatin remodeler and its nucleosome complex [J].Cell, 2013,154(6): 1207-1219.
[33] HORIGOME C, OMA Y, KONISHI T,etal. SWR1 and INO80 chromatin remodelers contribute to DNA double-strand break perinuclear anchorage site choice [J].MolCell, 2014,55(4): 626-639.
[34] WU S, SHI Y, MULLIGAN P,etal. A YY1-INO80 complex regulates genomic stability through homologous recombination-based repair [J].NatStructMolBiol, 2007,14(12): 1165-1172.
[35] ZHANG C, CAO L, RONG L,etal. The chromatin-remodeling factor AtINO80 plays crucial roles in genome stability maintenance and in plant development [J].PlantJ, 2015,82(4): 655-668.
[36] ZHOU W,etal. Distinct roles of the histone chaperones NAP1 and NRP and the chromatin-remodeling factor INO80 in somatic homologous recombination inArabidopsisthaliana[J].PlantJ, 2016,88(3): 397-410.
[37] ZLATANOVA J, THAKAR A. H2A.Z: View from the top [J].Structure, 2008,16(2): 166-179.
[38] COLEMAN-DERR D, ZILBERMAN D. Deposition of histone variant H2A.Z within gene bodies regulates responsive genes [J].PLoSGenet, 2012,8(10): e1002988.
MolecularMechanismofChromatinRemodelingFactorINO80inRegulatingtheNumberofStomatainArabidopsisthaliana
RENYuanyuan1,2,ZHUYan1,2
(1.InstituteofPlantBiology,SchoolofLifeSciences,FudanUniversity,Shanghai200438,China;2.StateKeyLaboratoryofGeneticEngineering,FudanUniversity,Shanghai200438,China)
Stomata, the specified forms of the plant epidermis, are involved in plant respiration, transpiration and other physiological activities. INO80 is one highly conserved chromatin remodeling factor, which can interact with histone variant H2A.Z. The osmotic sensitivity and transpiration rate were significantly enhanced inArabidopsisino80-deficient mutant compared with in wild type plants. In accordance, the leaves ofino80 mutant showed higher stomata amount compared with those of wild type. bHLH transcription factors SPCH and MUTE play a positive role in the regulation of stomatal development. RT-PCR analysis showed that the transcriptional levels ofSPCHandMUTEwere significantly up-regulated inino80 mutant. ChIP-PCR experiments indicated that the distribution of histone variant H2A.Z on theSPCHandMUTEchromatin regions was down regulated inino80 mutant. Our work suggests that inArabidopsisthaliana, chromatin remodeling factor INO80 modulates the transcriptional levels of key development genes of stomata probably through altering the distribution of H2A.Z on target chromatin regions, as well as the stomata amount and plant physiological indexes.
INO80; stomata; bHLH transcription factor; H2A.Z
0427-7104(2017)06-0653-09
2017-02-21
国家自然科学基金(31671341)
任媛媛(1989—),女,硕士研究生;朱 炎,副教授,通信联系人,E-mail: zhu_yan@fudan.edu.cn.
Q945
A

