一种新的真核DNA表观遗传标记
——6mA
祁 婧,涂艳阳 (空军军医大学唐都医院实验外科,陕西西安710038)
0 引言
基因在某种程度上决定大多数常见疾病的风险[1-3],同时也不排除环境因素等一系列其他的因素,而其中表观遗传学在个体的遗传因素和环境之间提供了一个机械的交叉点[4-6],那么通过找出该交叉口控制分子机制就有可能探究出疾病发生的秘密,以及采取具体的直接的治疗方案来影响这一过程并改变其中的疾病风险[7]。目前所报道的,与表观遗传学相关的疾病主要有肿瘤、心血管病、精神病和自身免疫系统性病等[8-9]。
DNA甲基化属于表观遗传学[1-2]范畴,是其研究中最深入的方向。DNA甲基化是最常见的复制后及转录后修饰方式之一,它不改变DNA一级结构,在细胞生长分化、基因表达模式以及基因组的稳定性中起着至关重要的作用。DNA甲基化是目前研究最为广泛的表观遗传现象。在真核生物体内,DNA甲基化是一种酶介导的化学修饰,在DNA甲基转移酶(DNA methyltransferase,DNMTs)的作用下,以 S-腺苷甲硫氨酸(S-adenosyl methionine,SAM)为甲基供体,将甲基基团转移到胞嘧啶和鸟嘌呤双核苷酸(CpG岛或称CpG)的胞嘧啶上,当然生物亦能通过屏蔽甲基转移酶的作用实现去甲基化[10-11]。
2015年,三项研究发现在三种不同的真核生物中6mA独立存在,揭示了这种甲基化修饰在真核生物中的功能[12-14]。通过利用和开发几种高通量测序方法在Chlamydomonas基因组DNA中绘制6mA,显示6mA不仅富含转录起始位点(TSS)周围的ApT二核苷酸,还标记了活性转录基因,并标记了接头相邻核小体之间的DNA区域,表明衣藻基因组中腺嘌呤甲基化的潜在基因激活功能(图 1B)[15-16]。
1 m6A的发现
最初N6-甲基腺嘌呤(6mA或 m6dA)在细菌DNA中被发现,参与DNA修复、复制和细胞防御。20世纪50年代Dunn等[17]在探究胸腺胞嘧啶(T)的结构类似物对需T菌株的影响时,将DNA水解后利用二维纸层析方法进行碱基分离时,发现了第5个紫外吸收光点 X——6mA。然而6mA目前在莱茵衣藻、秀丽隐杆线虫、果蝇、真菌等真核生物中发现了DNA-6mA的存在。然而,真核系统中6mA的功能仍然没有得到完全揭示。m6A的广泛存在得到研究人员越来越多的关注,从而针对其生物学意义和重要性进行更深入的研究。
随着免疫沉淀、限制酶切、LC-MS/MS以及生物测序等生物技术的发展,研究人员在秀丽隐杆线虫中发现6mA,其去甲基化酶NMAD-1和潜在的甲基转移酶DAMT-1改变了之前的观点,即秀丽隐杆线虫缺乏DNA甲基化,提出了6mA作为DNA甲基化标记而不是5mC的可能性。nmad-1和damt-1缺失的表型以及腺嘌呤甲基化和组蛋白修饰之间的串扰表明6mA 的潜在基因激活作用(图1C)[18]。
通过敲除果蝇基因组中的去甲基化酶候选物并监测6mA水平,Zhang等发现果蝇Tet同源物可能是果蝇基因组中6mA去甲基化的原因。鉴定的DNA 6mA去甲基化酶(DMAD)在胚胎发生和组织稳态过程中调节6mA的水平。进一步的测序分析表明,动态去甲基化与转座子表达相关,并在发育中起关键作用(图 1D)[16]。
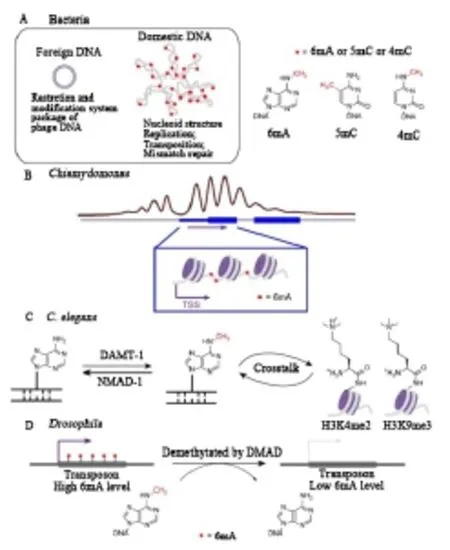
图1
2 m6A的普遍
近年来,随着测序技术的不断发展,人们已经在莱茵衣藻、秀丽隐杆线虫、果蝇、真菌等真核生物中发现了DNA-6mA的存在,并且发现6mA甲基化参与了调控基因和转座子的表达。此外,已有大量研究表明RNA-m6A修饰在人类mRNA中广泛存在,与RNA剪接、mRNA稳定性和基因表达有关。但有关DNA-6mA是否在基因调控和疾病致病机制中发挥作用等问题仍未得到深入研究。
大多数真核生物6mA研究都集中在单细胞原生生物上,包括纤毛虫四膜虫、草履虫以及绿藻。6mA占这些基因组中总腺嘌呤的约0.4%~0.8%,这比哺乳动物和植物中5mC的普遍率低几倍。有趣的是,也有极少数的报道表明在最近进化的生物体中存在6mA,包括蚊子、植物,甚至哺乳动物。
3 m6A的生物学功能
目前表观遗传学在癌症的发展中的关键作用越来越受到人们的重视。单靠遗传学并不能解释没有家族史的个体的散发性癌症和癌症的发展。表观遗传学为解释这种情况下癌症的发展提供了一种机制。表观遗传学特征的改变可以提供对癌症的病因和发生发展的重要见解。由于几种表观遗传变化发生在组织病理学改变之前,它们可以作为癌症诊断和风险评估的生物标志物。根据表观基因组信息,已经确定了一些可作为诊断工具的表观遗传标记物;其中一些生物标记物也可能有助于预后以及治疗效果的判断[26]。腺嘌呤甲基化对DNA结构的直接影响及其在原核生物学中的作用已被充分表征[27-28]。6mA是否在真核生物中发挥保守的功能作用还有待观察[29-30],但讨论其在原核生物中的功能效应提出了几项的潜在功能,需要在真核生物中进一步探索。
3.1 转录 腺嘌呤的甲基化可通过修饰转录因子结合或改变染色质结构来影响转录。在细菌中,6mA已经被证明可以调节转录[31-32],这提高了真核生物中保留类似功能的可能性。有趣的是,已显示N6腺嘌呤甲基化对哺乳动物和植物中的转录因子结合具有相反的作用。在腺嘌呤的N6位甲基化的转染DNA降低了哺乳动物细胞中转录因子的DNA结合亲和力[27-28]。 在植物中,锌指蛋白 AGP1与 DNA 的结合亲和力可以通过靶序列的N6腺嘌呤甲基化来增强[33]。此外,在大麦中使用瞬时表达系统,发现转录在6mA修饰的报告质粒中增加,而5mC对转录效率几乎没有或没有影响[33]。
在C.reinhardtii中,6mA在TSS周围富含超过14 000个基因,其中大多数是活跃转录的,并且这些6mA位点中的大多数在几乎每个分析的细胞中都被甲基化[34]。相反,沉默基因在其TSS周围具有较低的6mA水平。因此,似乎6mA是活性基因的一般标记,尽管目前还不清楚它是否在基因表达的动态调节中起作用。相比之下,5mC也存在于C.reinhardtii的基因组中,但位于基因体并且与转录抑制相关。尚不清楚在线虫中转录期间6mA具有什么作用。有趣的是,突变体中6mA水平升高,组蛋白H3赖氨酸4二甲基化(H3K4me2)水平升高,这是与活跃转录相关的标志[35]。这表明6mA也可以标记秀丽隐杆线虫中的活性基因,就像在C.reinhardtii中一样。
在D.melanogaster中,6mA被提议用于促进转座子表达。6mA-IP-seq测定显示转座子富集6mA,并且假定的脱甲基酶DMAD的丧失导致转座子表达增加[36]。因此,三个进化上遥远的生物中的最新发现表明6mA与基因表达升高的相关性,尽管仍然有待观察这种机制的一般性以及6mA是否已进化为在不同物种和/或不同背景中具有不同功能。未来重要的实验将涉及将DNA甲基转移酶或去甲基化酶引导至特定基因座并分别检查添加或去除6mA对转录的影响[37]。
3.2 DNA甲基化和核小体定位 嗜热链球菌的先前研究表明,核小体DNA中的6mA水平低于接头DNA[38]中的6mA水平。秀丽隐杆线虫和黑腹果蝇都没有发现6mA[38]的核小体定位偏倚。然而,秀丽隐杆线虫研究是在混合组织上进行的,特定的基因组模式可能只在更详细的组织特异性检查中出现。另一方面,在莱茵衣藻中,发现6mA优先位于TSS-近端接头DNA上。这可以通过有利于接头DNA的甲基化机制来解释,可能是由于物理上易于接近,或者通过6mA调节核小体定位。有趣的是,某些藻类物种的CG重复中的甲基化发生在极端密度下,这不利于核小体组装,从而决定核小体定位[39]。因此,DNA甲基化可以提供控制单细胞真核生物中核小体定位的一般机制。
3.3 表观遗传标记 在原核生物中,6mA甲基转移酶在特定序列基序的情况下甲基化腺嘌呤[40],但真核生物6mA似乎不强烈依赖于序列基序识别。在莱茵衣藻中,6mA发生在多个序列中,主要位于ApT二核苷酸,类似于哺乳动物中CpG二核苷酸的5mC甲基化[41]。在多个裂变单元循环期间,稳定地保持6mA水平。单碱基图谱表明大多数单个6mA位点在变异培养条件下忠实保守,强化了6mA作为可遗传的表观遗传标记[34]的推测。尽管尚未在莱茵衣藻中鉴定出6mA甲基转移酶,但很可能存在从母细胞到子细胞继承6mA特征的机制。在秀丽隐杆线虫中,H3K4me2去甲基化酶spr-5的缺失导致跨代的生育力逐渐丧失[42]。这种生育缺陷与H3K4me2的逐渐积累和抑制标记H3K9me365[43]的水平下降同时发生。在spr-5突变体蠕虫中,6mA也会在几代人中增加;6mA去甲基化酶nmad-1的缺失加速,而潜在的6mA甲基转移酶damt-1的缺失抑制了spr-5突变体蠕虫的进行性生育缺陷。此外,删除damt-1抑制了H3K4me2的积累,表明N6-腺嘌呤甲基化和H3K4二甲基化可能是共调节的并相互增强[44]。虽然6mA或H3K4me2本身是否可以跨代传输表观遗传信息仍有待确定,但当表观遗传信息被不正确地遗传时,这些修饰会累积。这些发现提高了6mA可能作为表观遗传标记的可能性,其在真核生物中携带可遗传的表观遗传信息。
4 展望
在几十年前的真核基因组中发现了5mC和6mA都是如此[45]。由于其在哺乳动物和植物中的丰富性,研究集中于表征5mC已经揭示了5mC的多种功能,而6mA的研究在真核生物中非常有限。众所周知,5mC可以自发脱氨基,导致 C-to-T突变[46];因此,由于甲基化胞嘧啶的脱氨作用,具有5mC的生物体往往会失去CpG二核苷酸[47]。相反,6mA不倾向于自发突变,这显然可能有利于基因组稳定性。
最近显示真核mRNA中的腺嘌呤甲基化对基因表达具有深远的影响[48]。6mA DNA在塑造基因表达中的潜在作用仍然很大程度上未知。RNA N6-甲基腺嘌呤的甲基可以使Watson-Crick碱基配对不稳定~1.0 kcal/mol[49-50],这显示出诱导“m2A-转换”机制,其改变RNA结构并因此通过蛋白质结合[51]。DNA中的相同特性可能影响转录,复制和其他需要链分离或DNA弯曲的过程。此外,甲基可以促进或抑制DNA结合蛋白的识别和结合,以调节基因表达。在哺乳动物细胞中,FTO催化的RNA N6-甲基腺嘌呤的去甲基化产生两种新发现的中间体,N6-羟甲基腺苷(hm6A)和N6-甲酰腺苷(f6A),在非编码RNA和mRNA[52]中。由于hm6A和f6A是非常稳定的修饰,它们可能不仅仅是中间体,而且具有调节功能。还有待观察是否在DNA 6mA的氧化去甲基化反应期间产生类似的修饰,并且如果它们存在,是否它们具有任何生物学作用。这些修饰可以进一步使DNA双链体失稳或产生新的蛋白质结合位点。
值得注意的是,秀丽隐杆线虫和黑腹果蝇在其基因组DNA中几乎没有或没有5mC,类似于其他一些含 6mA 的生物,如 P.aurelia[51]和 T.thermophila[52]。然而,莱茵哈迪在其基因组中含有6mA和5mC,但5mC的相对总体低水平加上其在外显子上的不寻常富集表明与最近进化的植物和动物相比,5mC具有不同的功能,其中它主要是标记。6mA和5mC丰度和功能的相对变化可能具有不同的进化后果。正如最近的研究[52]所揭示的,N6-腺嘌呤甲基化可能是影响某些真核生物中基因表达的主要DNA甲基化机制。在其他系统中,它可能在功能上更显着的5mC DNA甲基化中起补充作用。不同物种中6mA-甲基转移酶同源物的存在提高了6mA可能存在于更多生物体中的可能性,包括哺乳动物。6mA的相对生物学重要性是否随着其在最近进化的生物中的较低丰度而下降仍有待观察。我们推测6mA可能在这些物种中进化出更为特殊的功能。随着新的,灵敏的检测技术的出现,目前的研究聚焦于详细探究这种DNA修饰在整个生命树中的功能和精确的基因组分布。

