百合花花青素对改善CCl4诱导的大鼠肝纤维化作用研究
熊英,王玉婷,王诗
(1.武汉市第五医院药学部,湖北武汉 430050)(2.武汉大学药学院,湖北武汉 430072)(3.湖北科技学院药学院,湖北咸宁 437100)
世界卫生组织(WHO)报道全球每年肝病死亡人数达到100万,其中肝纤维化(hepatic fibrosis)是肝脏疾病中最为常见的环节。肝纤维化是许多慢性致病因子如酒精、化学物质四氯化碳、药物扑热息痛等对直接作用于肝脏造成损伤而引起肝内纤维结缔组织广泛增生并沉积的病理过程,其主要的特征是肝脏细胞外基质(extra cellular matrix)合成与降解失去平衡,最终导致肝脏正常结构被破坏肝功能发生紊乱[1,2]。大量实验研究证实[3,4],肝纤维化的病理病变是可以预防并治疗的。如何预防、阻断及逆转肝纤维化是当今肝病研究领域的重要内容。国内外诸多学者发现,许多天然产物具有清除自由基、抗氧化、抗炎等多种生物活性,通过下调氧化应激产生的脂质过氧化物、炎症因子的表达而减少纤维组织的增生沉积,从而逆转肝纤维化[4,5]。因此,人们将目光聚焦于天然产物的开发与利用,希望寻找到治疗肝损伤,逆转肝纤维化的有效单体物质。
近年来,有相关研究报道了百合鳞片的部分生理功效,包括抗氧化、抗炎和抗癌等药理活性,但是百合花花瓣的抗氧化活性、对肝损伤的保护作用及其可能的机制尚未有人研究。本实验参照文献方法[6,7]从卷丹百合花(Lilium lancifolium)花瓣中提取花青素,通过建立CCl4诱导的大鼠肝纤维化模型,检测大鼠血清丙氨酸氨基转移酶ALT、氨酸氨基转移酶AST活力值及肝组织匀浆超氧化物歧化酶 SOD、过氧化氢酶CAT、谷胱甘肽过氧化物酶GSH-Px的活力、丙二醛MDA的含量,研究卷丹百合花花青素的抗氧化活性,探讨其对 CCl4诱导的肝纤维化大鼠是否有保护机预防作用。于此同时,本实验还采用Western Blot的方法初步分析了卷丹百合花花青素对肝保护效应的可能机制,为后续进一步深入研究奠定基础。
1 材料与仪器
1.1 实验动物
SPF级SD雄性大鼠,体重220~250 g,购自武汉大学动物实验中心,实验动物生产许可证:SCXK(鄂)2008-0004。
1.2 药物与试剂
卷丹百合花花瓣(江苏南京艺馨花卉有限公司);四氯化碳CCl4(天津市恒兴化学试剂制造有限公司);食用油;无水乙醇(上海生化);天门冬氨酸氨基转移酶(AST)、丙氨酸氨基转移酶(ALT)、超氧化物歧化酶(SOD)、丙二醛(MDA)、谷胱甘肽过氧化物酶(GSH-Px)、过氧化氢酶(CAT)试剂盒均购买于南京建成生物工程研究所;小鼠抗大鼠 α-SMA单克隆抗体(美国Abcom),小鼠抗大鼠TGF-β1单克隆抗体(美国Abcom)。其他试剂均为分析纯。
1.3 仪器
离心机(飞鸽牌系列);分析天平,HANGPING FA1004;超声仪,厦门华益通超声设备有限公司;恒温水浴装置,TB-85型,日本岛津公司;酶标仪,KHB ST-360,上海科华;免疫印迹电泳系统(Bio-Rad)。
1.4 方法
1.4.1 百合花花青素提取
根据文献方法略微调整后提丹百合花花青素[8,9],步骤如下:将卷丹百合花花瓣粉碎,80%乙醇75 ℃回流提取3次,提取液合并后旋转蒸发至无乙醇至无醇味,用蒸馏水配成1 g/mL的百合花醇提物。混合液经101大孔树脂分离得到花青素溶液,收集后经武汉大学分析实验中心HPLC检测为花青素类物质。提取样品回收乙醇,浓缩干燥成膏,水溶解制成高低两个浓度,即1 g/kg和0.5 g/kg。
1.4.2 动物实验及检测
1.4.2.1 动物分组
随机将32只大鼠随机分为空白对照组(Sham)、肝纤维化模型组(M)、百合花花青素低剂量组(LFF,0.5 g/kg)和百合花花青素高剂量组(LFF,1 g/kg),每组各8只。除Sham组外,其余三组大鼠皮下注射50% CCl4花生油溶液2.5 mL/kg进行造模,每周2次,连续造模8周,首次造模CCl4花生油剂量加倍,正常大鼠皮下注射等量生理盐水。造模同时,给药组大鼠分别给予 1 g/kg和 0.5 g/kg的百合花花青素灌胃,Sham组和M组以等体积生理盐水灌胃,每日1次,连续8周。末次给药24 h后,10%水合氯醛麻醉大鼠,下腔静脉采血后4500 r/min离心10 min,分离得到血清,同时采集肝脏等脏器组织-80 ℃冻存备用。
1.4.2.2 检测指标
(1)血清生化指标:取血清上清液,按试剂盒操作步骤ALT、AST活力值。
(2)肝组织匀浆生化指标:制备 10%肝组织匀浆(生理盐水)样本,取上清液按照试剂盒操作步骤,测得SOD、CAT、GSH-Px的活力和MDA的含量。
(3)免疫印迹 Western-blot检测肝组织 TGF-β1和 α-SMA的表达:蛋白裂解液提取蛋白样品,BCA法检测样品蛋白含量并调节蛋白浓度至相同,加入5×上样缓冲液沸水浴10 min,-80 ℃保存备用。取样15 μL进行SDS-PAGE凝胶电泳,湿转法转膜结束后脱脂奶粉封闭PVDF膜。剪下不同区域的PVDF膜,分别加小鼠抗大鼠的TGF-β1、α-SMA和β-actin抗体,4 ℃孵育过夜,TBST摇床震荡漂洗8 min×4次;加入1:4000的二抗室温孵育 1 h,TBST摇床震荡漂洗 8 min×4次;ECL法曝光显色。
1.5 统计学处理
采用SPSS 21.0统计软件对数据进行处理,先进行数据的正态分布检验,方差齐性检验,计量数据用±s表示,组间差异用单因素方差分析,p<0.05表示差异有统计学意义。
2 结果与分析
2.1 百合花花青素对肝纤维化大鼠肝功能的影响
当肝组织受损时,血清中ALT、AST这两种酶活性的增高反映了肝细胞的损害程度。由表1中的实验结果可知,模型M组大鼠血清中ALT、AST水平分别升高至257.64±23.53 U/L和384.36±32.68 U/L,约是正常Sham组的6倍(p<0.05或p<0.01)。

表1 百合花花青素对肝纤维化大鼠血清中ALT和AST含量影响Table 1 The effect of Lilium lancifolium anthocyanins on the ALT and AST content in serum of liver fibrosis rats
这一实验结果证实,模型M组大鼠在CCl4连续造模8周后血清中的ALT、AST显著升高,造成了肝损伤。给予百合花花青素LFF灌胃治疗后,低剂量组大鼠血清中 ALT、AST水平下降至 M 组的一半(p<0.05),而高剂量组大鼠血清中 ALT、AST明显降低至 65.67±17.38 U/L 和85.58±13.68 U/L(p<0.01),接近正常水平。肝损伤大鼠在给予百合花花青素治疗后,血清中ALT、AST较M组明显下降,且百合花花青素对大鼠肝脏的保护作用呈现剂量依赖性,对肝功能的改善作用随浓度的增加而增加。本研究这一结果和Al-Dbass等人的研究相似,中药醇提物抗肝损伤呈现剂量依赖性[4],首次发现百合花花青素具有良好的肝功能改善作用。
2.2 百合花花青素对肝纤维化大鼠肝组织中SOD、CAT、GSH-Px及MDA的影响
肝纤维化中,超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、谷胱甘肽过氧化物酶(GSH-Px)能清除自由基及过氧化物,从而避免氧化应激对肝细胞造成的损伤,保护肝脏。丙二醛(MDA)是脂质过氧化的终产物,肝纤维化程度越重,肝组织释放的 MDA也越多。
从表2中可知,模型M组大鼠肝组织SOD、CAT、GSH-Px活力分别下降至 109.54±28.38 U/mg pro、13.56±6.37 U/mg pro 和435.23±108.95 U/mg pro,而MDA升高至14.84±2.37 nmol/mg pro,与空白Sham组比较,结果有统计学差异(p<0.05或 p<0.01)。给予百合花花青素 LFF干预治疗后,低剂量组大鼠SOD、CAT、GSH-Px活力较M组均有明显上升,分别增加至 175.78±21.74 U/mg pro、27.46±8.57 U/mg pro和496.96±115.64 U/mg pro(p<0.05);高剂量组大鼠上述指标进一步回升接近正常水平,分别为215.87±23.78 U/mg pro、35.86±6.03 U/mg pro 和568.63±94.58 U/mg pro和M组比较结果有统计学差异(p<0.05或p<0.01)。低剂量和高剂量给药组MDA含量较M组明显降低,分别下降至9.25±2.51 nmol/mg pro和6.79±2.38 nmol/mg pro(p<0.05或p<0.01)。SOD、CAT、GSH-Px在肝纤维化病理发展中,对机体的氧化与抗氧化平衡起着至关重要的作用,其活性反映了机体清除氧自由基和过氧化物的能力。
机体防御体系抗氧化能力越强,则可避免细胞膜受到攻击产生脂质过氧化物 MDA,从而逆转有害物质对肝细胞的损伤[8]。本研究给药干预后,大鼠肝组织抗氧化酶活力SOD、CAT、GSH-Px显著上升,脂质过氧化物MDA生成减少。这表明百合花花青素具有良好的体内抗氧化活性,能抵御氧化应激造成的肝损伤。百合花花青素通过增强肝脏的抗氧化功能对肝纤维化有一定的治疗和保护作用,且疗效与百合花花青素所用剂量正相关。这和李晓斐等人的研究色素抗肝损伤的结果一致[10],百合花花青素具由较强的抗氧化能力,治疗肝损伤效果优于红花红色素。

表2 百合花花青素对肝纤维化大鼠肝组织中抗氧化物指标的影响Table 2 The effect of Lilium lancifolium anthocyanins on the antioxidant indexes in liver tissue of liver fibrosis rats
2.3 百合花花青素对肝纤维化大鼠肝组织中TGF-β1和α-SMA表达的影响
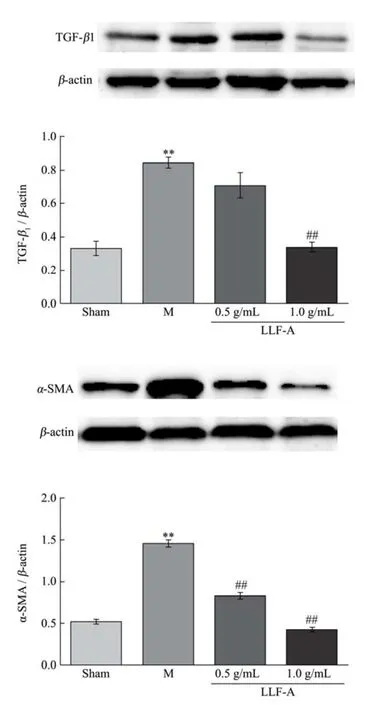
图1 百合花花青素对肝纤维化大鼠肝组织中TGF-β1和α-SMA表达的影响Fig.1 Effects of Lilium lancifolium anthocyanins on the expression of TGF-β1 and α-SMA in liver of liver fibrosis rats
从图1中可知,与空白Sham组比较,模型M组大鼠肝组织中TGF-β1和α-SMA表达增加了近2倍,结果有统计学差异(p<0.05或 p<0.01)。百合花花青素能明显减少肝组织TGF-β1、α-SMA的表达,给药组大鼠肝纤维化相关指标降低。尤其是低剂量组和高剂量组大鼠肝组织 α-SMA表达显著下调,结果呈现剂量依赖性。
CCl4在肝组织富集可启动氧化应激反应释放脂质过氧化物,进而诱导 Kuffer大量表达 TGF-β1。TGF-β1激活肝星状细胞后作用于细胞上的I型受体,刺激胶原纤维的前体物质大量释放。α-SMA是肝星状细胞活化的标志物,也是胶原纤维合成的相关物质。TGF-β1和α-SMA的大量表达使得细胞外基质金属蛋白酶及胶原纤维的分泌释放失衡,加剧了肝纤维化程度[9,10]。本实验结果显示,给药组大鼠肝组织中TGF-β1、α-SMA 表达量较模型组显著降低,表明百合花花青素能有效的对抗 CCl4引起的肝星状细胞活化,逆转肝纤维化进程,改善肝功能。
3 结论
3.1 CCl4诱导的大鼠肝纤维化模型是研究药物护肝活性的经典方法,其肝脏病理变化类似临床肝纤维化。肝纤维化的发生和发展受诸多因素的影响,如氧化应激、炎症联级反应、细胞因子的激活与释放等[8]。这些因素相互影响相互促进,最终导致肝脏细胞外基质结缔组织增生发生肝纤维化。因此,人们认为抗氧化减少氧化应激过程中相关细胞因子的释放、下调纤维化物质的表达,是治疗、预防肝纤维化的重要靶点之一[9,11]。百合是中医领域传统的中药药材,研究表明百合提取物中的有效成分具有一定的抗氧化、抗炎、抗肿瘤等生理活性。基于这一观点,本实验就百合花提取物花青素改善 CCl4诱导的大鼠肝纤维化及其可能的作用机制进行了探讨。
3.2 本文研究结果首次证实,百合花花青素能通过降低大鼠血清中ALT、AST水平平,增加肝组织抗氧化酶活力SOD、CAT、GSH-Px,减少脂质过氧化物MDA的生成,起到保护肝脏的作用。百合花花青素可以清除机体内的氧自由基和过氧化物,具有良好的抗氧化能力,进而显著改善大鼠地肝损伤。百合花花青素通过下调肝组织TGF-β1、α-SMA的表达,实现逆转CCl4诱导的肝纤维化形成。百合花花青素的护肝效应机制可能与抗脂质过氧化物损伤及下调细胞外纤维组织增生有关。
3.3 综上所述,百合花花青素具有抗氧化、保护肝细胞、逆转肝纤维化的作用,其可能的机制是通过抗氧化介导了氧化应激反应,使TGF-β1和α-SMA表达下调,最终导致肝星状细胞活性受到抑制,细胞外间质增生沉积减少,纤维化程度减轻。
[1]B S da Silva, G B Rodrigues, S W Rocha, et al. Inhibition of NF-kappaB activation by diethylcarbamazine prevents alcohol-induced liver injury in C57BL/6 mice [J]. Tissue &Cell, 2014, 46(5): 363-371
[2]Y Ijiri, R Kato, M Sadamatsu, et al. Chronological changes in circulating levels of soluble tumor necrosis factor receptors 1 and 2 in rats with carbon tetrachloride-induced liver injury [J].Toxicology, 2014, 316: 55-60
[3]G L Tipoe, T M Leung, E C Liong, et al.Epigallocatechin-3-gallate (EGCG) reduces liver inflammation, oxidative stress and fibrosis in carbon tetrachloride (CCl4)-induced liver injury in mice [J].Toxicology, 2010, 273(1-3): 45-52
[4]A M Al-Dbass, S K Al-Daihan, R S Bhat. Agaricus blazei Murill as an efficient hepatoprotective and antioxidant agent against CCl4-induced liver injury in rats [J]. Saudi Journal of Biological Sciences, 2012, 19(3): 303-309
[5]M Vuda, R D'Souza, S Upadhya, et al. Hepatoprotective and antioxidant activity of aqueous extract of Hybanthus enneaspermus against CCl4-induced liver injury in rats [J].Experimental and Toxicologic Pathology: Official Journal of the Gesellschaft Fur Toxikologische Pathologie, 2012, 64(7-8): 855-859
[6]B Shen, H Chen, C Shen, et al. Hepatoprotective effects of lignans extract from Herpetospermum caudigerum against CCl4-induced acute liver injury in mice [J]. Journal of Ethnopharmacology, 2015, 164: 46-52
[7]B Lu, Y Xu, L Xu, et al. Mechanism investigation of dioscin against CCl4-induced acute liver damage in mice [J].Environmental Toxicology and Pharmacology, 2012, 34(2):127-135
[8]W Peng, C Zhang, H Lv, et al. Comparative evaluation of the protective potentials of human paraoxonase 1 and 3 against CCl4-induced liver injury [J]. Toxicology Letters, 2010, 193(2): 159-166
[9]R Jeyadevi, T Sivasudha, A Rameshkumar, et al. Phenolic profiling by UPLC-MS/MS and hepatoprotective activity of Cardiospermum halicacabum against CCl4induced liver injury in Wistar rats [J]. Journal of Functional Foods, 20113,5: 289-298
[10]Y Xie, H Hao, H Wang, et al. Reversing effects of lignans on CCl4-induced hepatic CYP450 down regulation by attenuating oxidative stress [J]. Journal of Ethnopharmacology, 2014, 155: 213-221
[11]李晓斐,李志珂,武双婵,等.红花红色素对小鼠急性 CCl4性肝损伤的作用[J].现代食品科技,2013,29(7):1569-1573 LI Xiao-fei, LI Zhi-ke, WU Shuang-chan, et al. Effect of safflower red pigment on acute liver injury induced [J].Modern Food Science and Technology, 2013, 29(7): 1569-1573

