人参酶解物中的皂苷成分及其对髓源抑制性细胞的作用研究
冯孔龙,朱晓艾,刘飞,余庆涛,戴伟杰,葛亚中,陈媛媛,,李赟,梁雅蕾,陈运娇,曹庸
(1.华南农业大学食品学院,广东省天然活性物工程技术研究中心,广东广州 510642)(2.广州绿萃生物科技有限公司,广东广州 510663)(3.无限极(中国)有限公司,广东广州 510665)
人参是指五加科植物人参(Panax ginseng C. A.Mey.)的根,是中国延用了两千多年珍贵的传统中药材之一。目前研究表明,人参皂苷是人参的主要活性成分之一,由Rc、Rd、Re、Rf、Rg1、Rg2、Rh1和Rh2等50余种亚型组成[1],其中,人参皂苷单体化合物Rg1、Re、Rb1的含量较高,是常见的人参定量指标,而Rh1、Rh2、F2、CK和Rg3等皂苷含量稀少,被称为稀有皂苷,但其生物活性更强[2,3]。人参稀有皂苷具有抗肿瘤、抗炎症、免疫调节、抗疲劳、抗过敏、抗衰老和抗氧化等多种生物活性[4~8]。其中,稀有人参皂苷及苷元(如人参皂苷 Rg3,Rh1,CK,Rb3,Rh2等)具有很强的抗肿瘤活性[9]。Kim和Choi等[10,11]发现人参皂苷的抗肿瘤作用随着糖基的减少而增强,如具有较少的糖基人参皂苷Rg3,Rh2,Compound K等,具有十分显著的抗肿瘤效果。然而,稀有人参皂苷在天然人参中的含量极少,因此将人参中常见的皂苷转化为稀有人参皂苷的研究具有重要的意义。
酶解法可以有效改变人参皂苷的糖链结构从而实现人参皂苷的转化,由此能提高稀有活性皂苷的产量,具有一定的经济价值[12]。目前酶解法主要以人参皂苷单体及皂苷混合物为转化底物[13,14],鲜有文献报道以人参提取物作为转化底物,酶解转化得到稀有皂苷。MDSC在肿瘤微环境中发挥了免疫抑制效应,能够抑制杀伤性 T细胞对肿瘤细胞的清除作用,是目前MDSC成为肿瘤治疗的重要细胞靶点之一。在小鼠结肠癌肿瘤模型中,人参及西洋参表现出较强的抑制肿瘤细胞生长的效果[15,16]。人参皂苷CK能促进体外培养的MDSC细胞凋亡并拮抗其免疫抑制功能,从而抑制肿瘤细胞的生长与增殖[17]。但是目前为止,国内外尚无文献报道人参酶解物对MDSC细胞的影响,且未见对酶解前后的人参提取物的抗肿瘤活性差异分析。
本研究建立了同时测定人参提取物及酶解物中12种人参皂苷的高效液相色谱方法,探讨酶解前后的人参提取物中主要皂苷成分差异,并且以髓源抑制性细胞(MDSC)为靶点,分别用酶解前后人参提取物作用于 MDSC细胞和 CT26荷瘤小鼠脾细胞,采用MTT法测定细胞增殖水平和流式细胞仪分析方法检测CT26荷瘤小鼠脾细胞中MDSC的水平,对提高人参提取物的生物活性,开发预防肿瘤发生的保健食品具有重要价值和意义。
1 材料与方法
1.1 材料、试剂与仪器设备
1.1.1 材料与试剂
生晒参和商品酶由无限极(中国)有限公司提供,人参酶解物由广东省天然活性物工程技术研究中心提供,Rg1、Re、Rf、Rb1、Rh1、Rb2、F1、Rd、F2、Rg3、CK和Rh2标准物均购自于吉林大学天然药物化学实验室,质量分数均在98%以上,甲醇、乙腈均为色谱纯试剂;水为超纯水;其余试剂为分析纯。
1.1.2 主要仪器设备
LC-15C高效液相色谱仪,配备检测器为SPD-M20A紫外检测器,日本岛津公司;Purospher STAR LP RP-18柱(250 mm×4.6 mm,5 μm),默克公司;KQ-250台式超声波清洗器,苏州江东精密仪器有限公司;R204旋转蒸发器,上海申生科技有限公司;SHB循环水式多用真空泵,河南省予华仪器有限公司;SN510C型高压灭菌锅,日本雅马拓科技公司;Allegra X-12R高速离心机,Beckman公司;流式细胞仪,美国BD公司。
1.2 实验方法
1.2.1 人参提取物及酶解物制备
参照文献[18],生晒参粉碎后过4号筛,精密称取200.00 g,加入10倍蒸馏水煎煮提取3次,每次1 h。过滤,滤液合并浓缩得流浸膏,真空冷冻干燥后得到人参提取物。
人参酶解物是人参提取物经过酶解后真空冷冻干燥制备得到,酶解方法参照文献[12],由广东省天然活性物工程技术研究中心提供。
1.2.2 供试品溶液的制备
称取人参提取物0.50 g,加5 mL甲醇密封,超声提取45 min,离心,取上清液,用0.22 μm有机滤膜滤过,密封,4 ℃下低温储藏备用。
称取人参酶解物0.50 g,加5 mL甲醇密封,超声提取45 min,离心,取上清液,用0.22 μm有机滤膜滤过,密封,4 ℃下低温储藏备用。
1.2.3 对照品溶液的制备
分别精密称取12种人参皂苷Rg1、Re、Rf、Rb1、Rh1、Rb2、F1、Rd、F2、Rg3、CK和Rh2对照品各适量,置同一5 mL量瓶中,加甲醇溶液溶解并稀释至刻度,摇匀,使其终浓度范围在0.60~1.00 mg/mL,作为混合对照品溶液,备用。
1.2.4 高效液相色谱条件与系统适用性试验
检测器为 SPD-M20A紫外检测器,色谱柱为Purospher STAR LP RP-18柱(250 mm×4.6 mm,5 μm);流动相为水(A)-乙腈(B),梯度洗脱洗脱程序见表1;流速1.0 mL/min;检测波长203 nm;柱温30 ℃;进样量 20 μL。

表1 梯度洗脱时间程序Table 1 Time sequence of gradient elution
1.2.5 标准曲线的制作
分别精密吸取上述混合对照品母液50、100、200、400、800、1000 μL,分别置于1 mL量瓶中,加甲醇稀释至刻度,制备成不同质量浓度的系列对照品溶液,分别精密吸取系列对照品溶液各20 μL按上述色谱条件进样。以对照品质量浓度X为横坐标,峰面积值Y为纵坐标,绘制标准曲线并进行回归计算,回归方程和相关系数见表2。
1.2.6 样品测定
精密称取人参提取物和人参酶解物各3份,每份约0.50 g,按供试品溶液制备方法制成样品溶液,按“1.2.4”项色谱条件进样分析,根据线性回归方程计算人参提取物和人参酶解物中 12种人参皂苷的质量分数,结果见表3。
1.2.7 比色法测定样品中人参总皂苷含量
(1)标准曲线的制备
参照文献[19,20],精密称取人参皂苷Re对照品约5 mg于10 mL的容量瓶中,加入甲醇超声溶解,放置至室温,用甲醇定容至刻度,摇匀,即得对照品溶液。分别精密吸取对照品溶液 50 μL、100 μL、150 μL、200 μL、250 μL,分别置于具塞试管中,水浴挥去溶剂,加入新配制的5%香草醛-冰醋酸溶液200 μL,高氯酸溶液800 μL,摇匀,然后在60 ℃的水浴15 min,取出,流水冷却2 min,再加入冰醋酸5 mL,摇匀,以相应试剂作为空白,在555 nm处测定溶液的吸收值(A)。以吸收值(A)为纵坐标,Re浓度为横坐标,绘制标准曲线,求得线性回归方程:A=2.5583X-0.0694,r=0.9958。
(2)人参总皂苷的测定
精密称取人参提取物和人参酶解物各3份,每份约0.50 g,按供试品溶液制备方法制成样品溶液,分别精密量取供试品溶液适量,按标准曲线项下操作,测定A值,利用标准曲线求其浓度,并计算样品中人参总皂苷的含量,结果见表3。
1.2.8 人参提取物及酶解物对髓源抑制性细胞的效应研究
(1)人参提取物及酶解物对 MSC2细胞系抗肿瘤活性评价
将MDSC细胞系MSC2细胞接种于96孔板,1×104/孔,人参提取物及酶解物加入培养体系,浓度为1 mg/mL。48 h后,采用MTT法测细胞增殖情况。
(2)人参提取物及酶解物对荷瘤小鼠脾脏细胞MDSC的抑制作用
荷瘤(结肠癌 CT26)小鼠脾脏细胞单细胞悬液的制备:取小鼠脾脏在 PBS缓冲液中进行研磨,经100目滤网过滤后1500 r/min离心3 min,去上清。加入红细胞裂解液(RLB)裂解1 min,加入5 mL PBS重悬,过滤后1500 r/min离心3 min,去上清。加入1640+/+培养基重悬,细胞板计数得到细胞液浓度,加入 1640+/+培养基调至所需终浓度,得到脾脏单细胞悬液。
将制备得到的单细胞悬液接种于96孔板,2×106/孔,48 h后,进行流式检测MDSC比例。CT26荷瘤小鼠脾细胞接种于96孔板,细胞密度为5×104/孔,加入人参提取物和人参酶解物,终浓度为1 mg/mL。阴性对照每孔加入等体积的 1640+/+培养基至终体积200 μL/孔。37 ℃,5% CO2细胞培养箱培养 48 h。适当力度吹打细胞后吸出液体,分别注入 1.5 mL离心管,4 ℃条件下4000 r/min离心5 min。去上清,加入含2% NCS的PBS 50 μL,依比例加入流式染料,冰上放置,抗体染色30 min(7AAD最后染5 min)后,4 ℃条件下4000 r/min离心5 min,沉淀用200 mL含2% NCS的PBS重悬,将细胞悬液转移至流式管,上机检测,流式细胞仪为FACScan flow cytometer(BD Calibur),采用Flowjo 7.6进行结果分析。
1.2.9 统计学分析
采用SPSS18.0软件进行统计分析。所有实验结果的数据以均数±标准差(±s)表示,采用单因素方差分析,方差齐时组间的多重比较采用最小显著差异法(least significiant difference,LSD)方法,方差不齐时组间比较采用Dunnett’s T3法,与空白组相比,“*”表示p<0.05,“**”表示p<0.01,具有统计学意义。
2 结果与讨论
2.1 高效液相色谱法检测结果
2.1.1 高效液相色谱条件适用性
由图1可知,本试验建立的同时测定12种人参皂苷的高效液相色谱方法,除了一些常见皂苷Rg1、Re、Rf、Rb1、Rb2和 Rd外,增加了人参稀有皂苷Rh1、F1、F2、Rg3、CK和Rh2的测定。该方法采用梯度洗脱,12种人参皂苷均得到良好分离,相邻色谱峰之间的分离度均大于 2,色谱峰形对称,保留时间合适,适用于本试验检测。
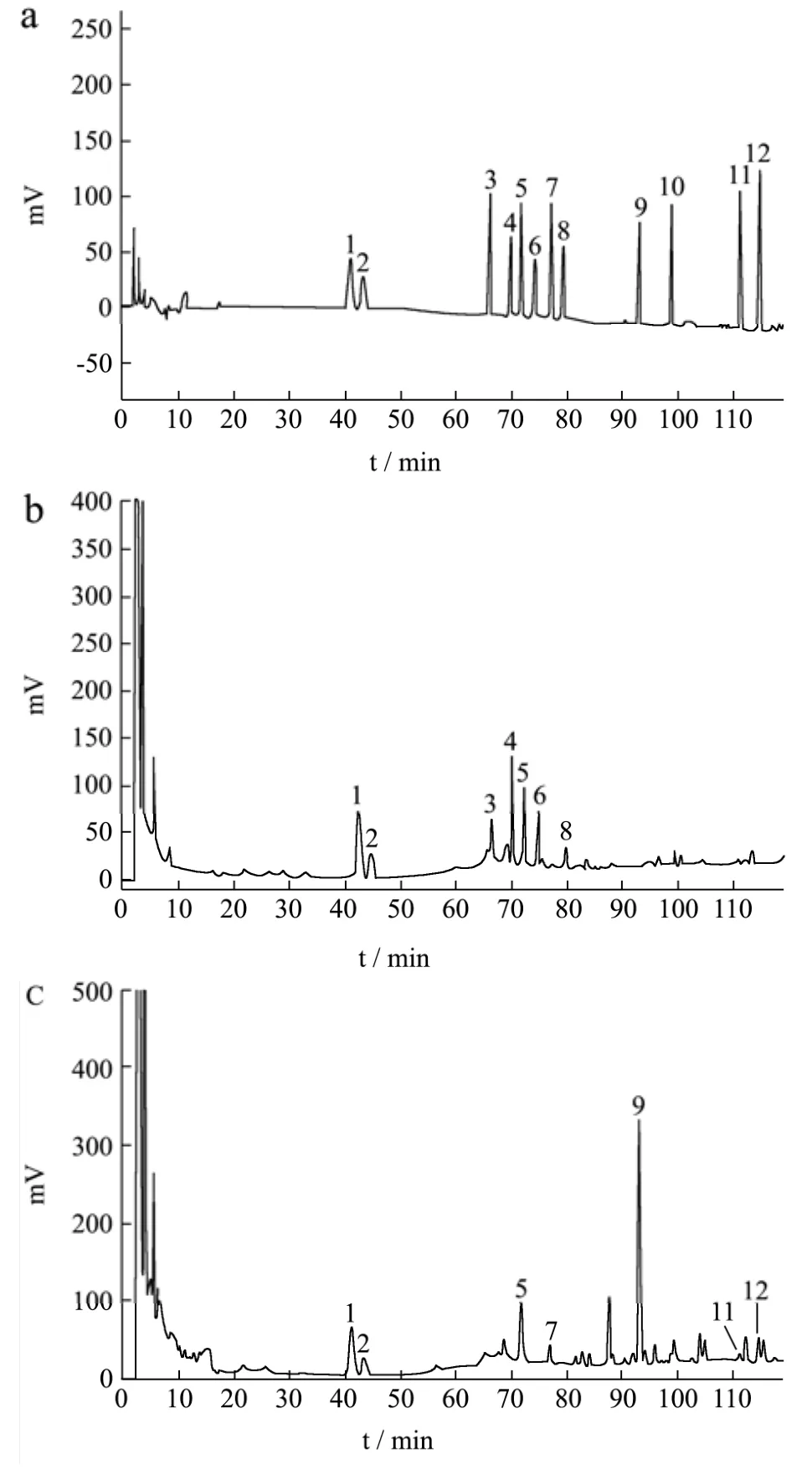
图1 混合对照标准品(a)、人参提取物(b)和人参酶解物(c)的高效液相色谱图Fig.1 HPLC chromatograms of mixed reference substances (a),ginseng extracts (b) and ginseng enzymatic hydrolysates (c)
由图1(a)、1(b)和1(c)可知,人参提取物中含有7种人参皂苷Rg1、Re、Rf、Rb1、Rh1、Rb2和Rd,未检测到5种人参皂苷F1、F2、Rg3、CK和Rh2。而人参酶解物中检测到2种常见皂苷Rg1、Re及5种稀有皂苷Rh1、F1、F2、CK和Rh2。
2.1.2 线性关系考察
上述12种皂苷分别在0.01~0.980 mg/mL范围内,与峰面积呈现良好的线性关系(r≥0.9981),表明 12种人参皂苷的标准曲线拟合良好。
2.1.3 精密度试验
精密吸取对照品溶液各20 μL,按上述色谱条件进样分析,重复进样6次,人参皂苷单体Rg1、Re、Rf、Rb1、Rh1、Rb2、F1、Rd、F2、Rg3、CK 和 Rh2峰面积的精密度RSD结果见表2,RSD<1.50%,表明仪器精密度良好。
2.1.4 重复性试验
取同一人参酶解物样品6份,按供试品溶液的制备方法处理后,分别精密吸取20 μL,按上述色谱条件测定,人参提取物中人参皂苷Rg1、Re、Rf、Rb1、Rh1、Rb2、F1、Rd、F2、Rg3、CK和Rh2质量分数的RSD结果见表2,RSD<3.50%,表明重复性较好。
2.1.5 稳定性试验
取同一人参酶解物供试品溶液6份,按上述色谱条件,分别在0、2、4、8、16、24 h精密进样20 μL检测,人参提取物中人参皂苷 Rg1、Re、Rf、Rb1、Rh1、Rb2、F1、Rd、F2、Rg3、CK和Rh2质量分数的RSD结果见表2,RSD<3.50%,说明人参提取物供试品溶液在24 h内稳定。

表2 人参皂苷单体的回归方程Table 2 Regression equations with correlation coefficients of ginsenosides monomers
2.1.6 加标回收率试验
精密称取同一批已测定的人参酶解物样品6份,分别准确加入一定量的人参皂苷对照品,按供试品溶液的制备方法处理后,按上述色谱条件测定,人参提取物中人参皂苷Rg1、Re、Rf、Rb1、Rh1、Rb2、F1、Rd、F2、Rg3、CK和Rh2的平均回收率(RSD)结果见表2,表明该试验平均回收率均在97.5%~104.5%范围内,RSD<3.00%,说明本方法准确度良好。

接上页Rh1 Y=1.56×104X-9.18×10 0.9990 104.1 1.08 2.87 3.02 2.07 Rb2 Y=1.67×104X-2.60×103 0.9998 100.3 1.16 2.05 2.45 1.77 Rd Y=1.57×104X+1.32×103 0.9992 100.6 0.67 2.75 1.77 1.94 F2 Y=1.66×104X-1.79×103 0.9988 98.2 0.89 2.63 1.65 2.81 Rg3 Y=1.62×104X-2.79×103 0.9991 97.5 1.22 3.10 2.69 1.99 CK Y=1.67×104X-1.61×103 0.9981 103.1 1.45 2.88 2.04 2.34 Rh2 Y=1.57×104X+1.15×103 0.9999 103.5 0.73 2.51 2.43 1.19
2.2 人参提取物及酶解物中人参皂苷含量的检测
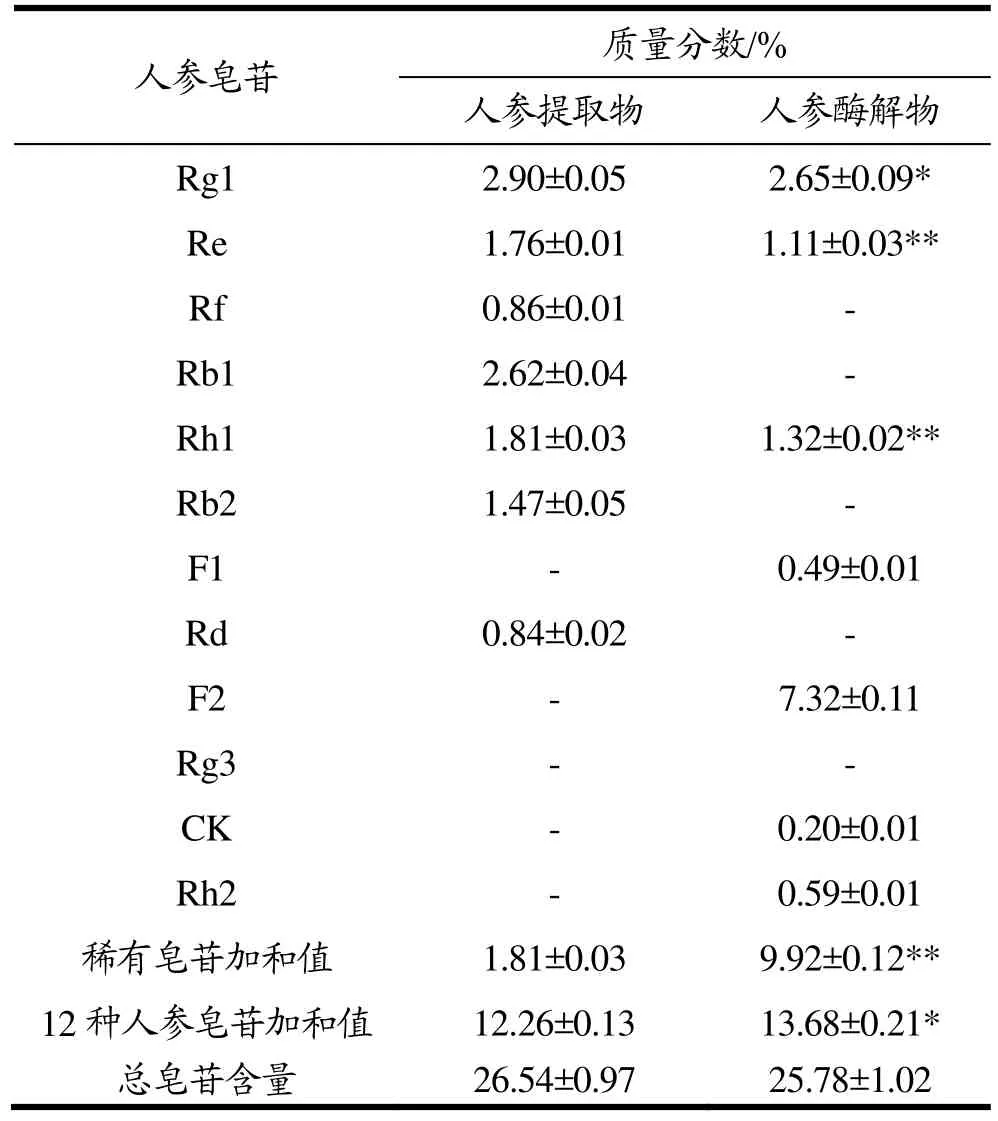
表3 人参提取物和酶解物中12种人参皂苷及总皂苷质量分数Table 3 Content of 12 ginsenosides monomers and total ginsenosides in ginseng extracts and ginseng enzymatic hydrolysates
供试品溶液中人参皂苷色谱峰的峰面积均在标准曲线的线性范围内,根据表2中12种人参皂苷的线性回归方程,计算出人参提取物和酶解物中每种单体皂苷的含量,并且通过比色法测定样品中人参总皂苷的含量,其结果如表3所示。
人参提取物总皂苷含量为265.4 mg/g,其中12种单体皂苷加和值占46.19%,稀有皂苷(Rh1、F1、F2、Rg3、CK和Rh2)占6.82%。人参提取物经过酶解后,总皂苷含量为257.8 mg/g,其中12种单体皂苷含量占53.06%,相对于人参提取物增加了11.58%,稀有皂苷占38.48%,相对于人参提取物增加了4.48倍。人参提取物经过酶解,将人参中含量较高的常见皂苷Rg1、Re、Rf、Rb1、Rb2和Rd,经过糖配基的选择性水解获得的稀有人参皂苷F1、F2、CK和Rh2等。与人参提取物相比,酶解后人参提取物中皂苷Rf、Rb1、Rb2和Rd均完全转化为其他皂苷,皂苷Rg1、Re和Rh1含量明显降低,发现酶解转化为大量的皂苷F2,占总皂苷含量28.39%,和少量的皂苷F1、CK和Rh2。
2.3 人参提取物及酶解物对髓源抑制性细胞的效应研究
2.3.1 人参提取物及酶解物对MSC2细胞抗增殖活性评价

图2 人参提取物及酶解物对MSC2细胞增殖的影响Fig.2 Effects of ginseng extracts and ginseng enzymatic hydrolysates on the proliferation of MSC2 cells
人参提取物和酶解物对MSC2细胞增殖的影响如图2所示,经过前期的试验研究,发现人参提取物作用于MSC2细胞的IC50值为1.00 mg/mL,因此选取1.00 mg/mL作为人参提取物和酶解物的处理浓度。经过1.00 mg/mL的人参提取物和酶解物处理48 h后,MSC2细胞增殖明显受到抑制,与空白组相比,黄精多糖阳性对照组、人参提取物组和人参酶解物组能够显著降低MSC2细胞存活率(p<0.05),细胞增殖抑制率分别为21.43%、28.57%和50.00%,其中人参酶解物对抑制MSC2增殖作用效果最佳,优于人参提取物和黄精多糖阳性对照组。
2.3.2 人参提取物及酶解物对荷瘤小鼠脾脏细胞MDSC的抑制作用
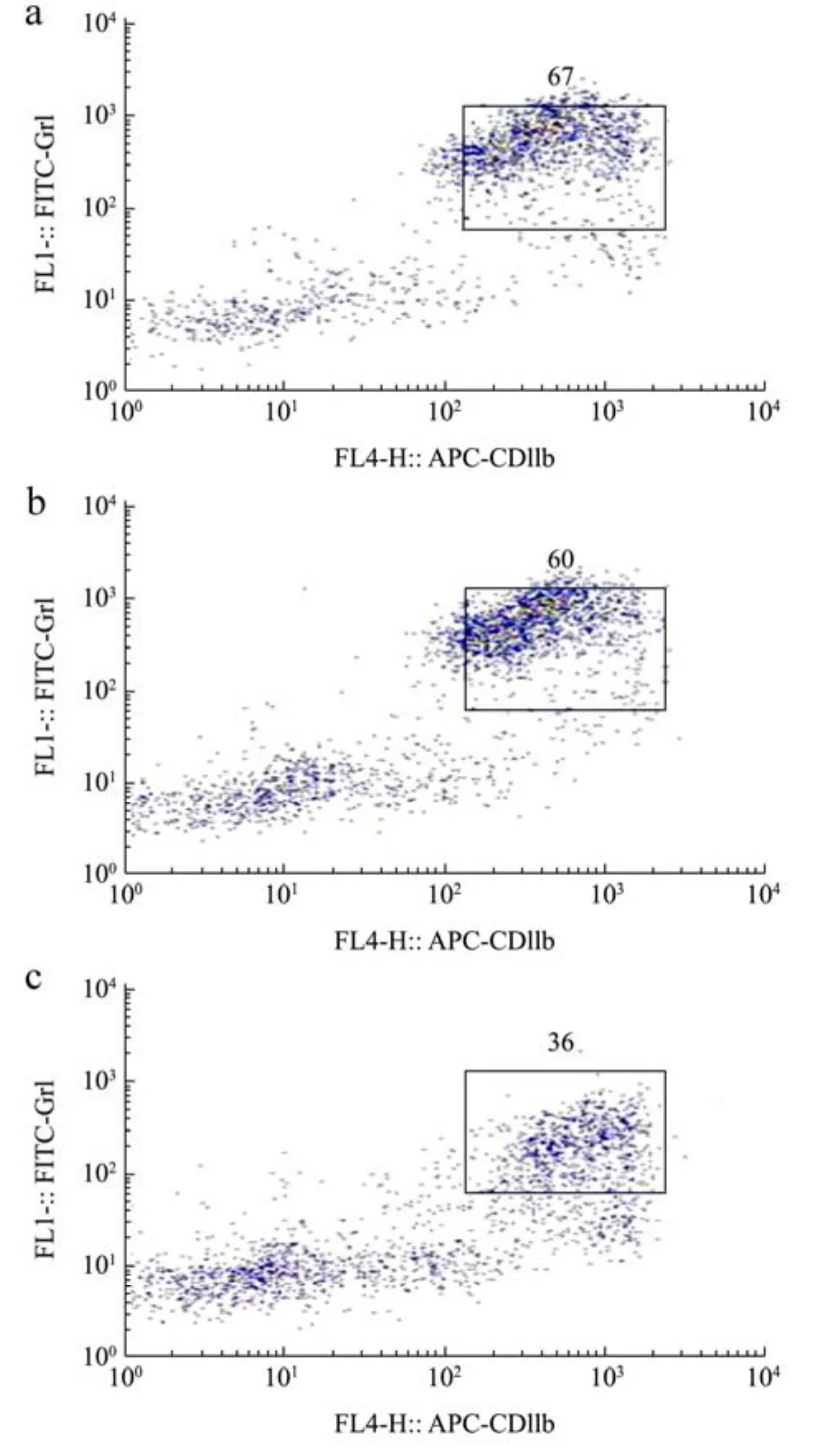
图3 人参提取物及酶解物对结肠癌荷瘤小鼠脾脏中MDSC细胞比例的影响Fig.3 Effects of ginseng extracts and ginseng enzymatic hydrolysates on the proportion of MDSC cells in the spleen of colon cancer-bearing mice
如图3和图4所示,经过1.00 mg/mL的人参提取物和酶解物处理后,结肠癌荷瘤小鼠脾脏中Gr-1+和CD11b+的MDSC细胞比例显著降低(p<0.05)。其中人参酶解物下调结肠癌荷瘤小鼠脾脏中MDSC细胞比例效果最佳,优于人参提取物组,人参酶解物组中结肠癌荷瘤小鼠脾脏中MDSC细胞比例平均36.00%,相对于空白组,人参酶解物组MDSC水平显著降低了46.27%(p<0.01)。表明人参提取物及酶解物能够抑制MDSC的形成,从而减少肿瘤发生,并且人参酶解物效果优于人参提取物。

图4 人参提取物及酶解物对结肠癌荷瘤小鼠脾脏中MDSC水平影响Fig.4 Effects of ginseng extracts and ginseng enzymatic hydrolysates on the level of MDSC cells in the spleen of colon cancer-bearing mice
2.4 讨论
人参皂苷具有广泛的生物活性,但由于结构不同的人参皂苷与成分差异,显示出的性质和活性具有较大差异。本研究为了探讨酶解前后的人参提取物主要皂苷成分的差异及其抗肿瘤活性,建立了反相高效液相色谱法,以 Purospher STARLP RP-18柱(250 mm×4.6 mm,5 μm)为分析柱;水-乙腈为流动相梯度洗脱;流速为1.0 mL/min;检测波长为203 nm。结果表明 12种人参皂苷分离良好,线性关系良好(r≥0.998),平均回收率在97.5%~104.5%之间。因此该HPLC分析方法精密度、重现性和准确度均较好,能够较好的应用于人参提取物及酶解物样品的分析检测。利用HPLC方法和比色法分析发现,人参酶解物中皂苷Rg1、Re和Rh1含量明显降低,皂苷Rf、Rb1、Rb2和Rd均完全转化生成其他皂苷,并且有大量的皂苷F2和少量的皂苷F1、CK、Rh2生成,稀有皂苷含量增加了4.48倍。
研究表明,利用糖配基的选择性水解获得的稀有皂苷(Rh1、Rh2、F2、CK和Rg3等)比人参中所含的原有人参皂苷(Re、Rg1、Rb1、Rb2、Rc和Rd)具有更好的机体吸收能力和药理活性[21]。目前研究中主要通过酶法转化制备人参皂苷单体,常用酶包括β-葡萄糖苷酶、柚苷酶、β-半乳糖苷酶、β-葡聚糖苷酶及β-糖苷酶等,转化二醇型人参皂苷单体(Rb1、Rb2和Rd)及皂苷混合物来制备CK、Rh1和Rh2等稀有人参皂苷[14]。金凤燮等[22]从人参总皂苷中提取的人参二醇系皂苷为底物,经β-葡萄糖苷酶处理后测得的人参皂苷Rh2的收率比红参中直接提取提高了500倍。Noh等[23]利用菌株Sulfolobus solfataricus发酵获得的β-糖苷酶,分别对Rb1、Rb2、Rd和Rc进行转化,获得了稀有皂苷C-K。而本研究选取人参水提取物为底物,通过商品化酶转化生成了F2、F1、CK和Rh2等稀有皂苷,通过HPLC检测到的12种人参皂苷含量可知,酶解后的人参皂苷(Rf、Rb1、Rb2和Rd)均完全转化为稀有人参皂苷F2、F1、CK和Rh2,其转化机理还有待进一步研究。
作为肿瘤微环境中非常重要的一群髓性免疫抑制细胞,MDSC分泌大量的促炎性细胞因子及趋化因子,从而促进肿瘤细胞的生长与增殖[24]。研究发现,人参皂苷对于肿瘤细胞的粘附、浸润、增殖有显著的抑制作用,其中稀有人参皂苷 Rh2、Rg3、C-K的抗肿瘤效果最为显著[12]。目前,已有文献报道通过对人参进行微波辐射热处理提高人参Rg3、Rg5和Rk1含量,进而提高人参的抗癌效果[25]。人参经过热处理后的红参及黑参的抗肿瘤活性明显强于生晒人参[26],主要是因为热处理后的人参皂苷发生脱糖及脱水反应而生成了极性更小的人参稀有皂苷[27]。本研究通过酶解法实现人参提取物中人参皂苷的转化过程,由此能提高稀有活性皂苷的含量,并且通过对髓源抑制性细胞的效应研究,发现与未酶解的人参提取物相比,酶解后的人参酶解物能够更有效抑制MSC2细胞增殖,显著降低结肠癌荷瘤小鼠脾脏中的MDSC细胞比例,其原因在于其具有较高稀有皂苷含量,尤其是存在大量的皂苷F2。因此通过酶解人参提取物,将人参中含量较高的常见皂苷Rg1、Re、Rf、Rb1、Rb2和Rd,经过糖配基的选择性水解获得的稀有人参皂苷 F1、F2、CK和Rh2等,提高了稀有皂苷的含量,能有效改善肿瘤微环境的效应,从而增强抗肿瘤活性。
3 结论
本研究建立了同时测定人参酶解物中的 12种人参皂苷的高效液相色谱检测方法。同时发现,人参提取物和酶解物的总皂苷含量差异不明显,而酶解后中12种人参皂苷和稀有皂苷(Rh1、F1、F2、Rg3、CK和Rh2)含量均显著增加;其中稀有皂苷含量增加了4.48倍,尤其是酶解后转化生成了F2、F1、CK和Rh2等稀有皂苷。并以酶解前后的人参提取物作为对象,探讨其对髓源抑制性细胞的影响,结果表明人参提取物及酶解物均能显著抑制MSC2细胞增殖并降低结肠癌荷瘤小鼠脾脏中MDSC细胞比例,其中人参酶解物效果更佳。人参酶解物含有丰富稀有皂苷,具有更高的生物活性,能够有效改善肿瘤微环境,从而加强了抗肿瘤能力。本文结果为深入开发人参酶解物产品进一步研究人参酶解物抗肿瘤活性机制提供理论依据。
[1]王中立,欧阳柳凤,张蔷,等.人参皂苷的提取及总皂苷纯化工艺的研究进展[J].世界科学技术-中医药现化,2016,18(9):1596-1601 WANG Zhong-li, OUYANG Liu-feng, ZHANG Qiang, et al.Advances in extraction of ginsenosides and purification of total saponins [J]. Modernization of Traditional Chinese Medicine and Materia Medica-World Science and Technology, 2016, 18(9):1596-1601
[2]朱伟,易琼,王鲁,等.人参皂苷 Rh2的药理学研究进展[C]//中国畜牧兽医学会 2010年学术年会-第二届中国兽医临床大会,长春,2010 ZHU Wei, YI Qiong, WANG Lu, et al Advances in Pharmacology of Ginsenoside Rh2 [C]// Chinese Society of Animal Husbandry and Veterinary 2010 Annual Conference -The 2nd China Veterinary Clinical Congress, Changchun,2010
[3]李相鹏,王鹏,李英霞.原人参二醇型皂苷活性代谢物Compound K药理活性的研究进展[J].中国药理学与毒理学杂志,2011,25(1):97-101 LI Xiang-peng, WANG Peng, LI Ying-xia. Research progress on pharmacological activity of compound ketah-dioside saponin active metabolite [J]. Chinese Journal of Pharmacology and Toxicology, 2011, 25(1): 97-101
[4]严弋敬,孙海燕,刘冬,等.不同生理状态下人参总皂苷对HepG2细胞CYP2B6 mRNA和蛋白表达的影响[J].现代食品科技,2016,2:39-44 YAN Yi-jing, SUN Hai-yan, LIU Dong, et al. Effects of total ginsenosides on expression of CYP2B6 mRNA and protein in HepG2 cells in normal and inflammatory states [J].Modern Food Science and Technology, 2016, 12: 39-44
[5]许云章,任烨,王静霞,等.响应面法优化加拿大原产地西洋参皂苷的提取工艺研究[J].现代食品科技,2013, 5:1040-1044 XU Yun-zhang, REN Ye, WANG Jing-xia, et al. Optimization of extraction process of ginsenoside from Panax Quinquefolius L. collected from canada by response surface methodology [J]. Modern Food Science and Technology,2013, 5: 1040-1044
[6]Shin Kyung-Chul, Oh Deok-Kun. Characterization of a novel recombinant β-glucosidase from Sphingopyxis alaskensis that specifically hydrolyzes the outer glucose at the C-3 position in protopanaxadiol-type ginsenosides [J]. Journal of Biotechnology, 2014, 172: 30-37
[7]Quan K, Liu Q, Wan J, et al. Rapid preparation of rare ginsenosides by acid transformation and their structureactivity relationships against cancer cells [J]. Scientific Reports, 2015, 5
[8]Oh J, Jeon S B, Lee Y, et al. Fermented red ginseng extract inhibits cancer cell proliferation and viability [J]. Journal of Medicinal Food, 2015, 18(4): 421-428
[9]Wang C, Xie J, Fishbein A, et al. Antiproliferative effects of different plant parts of Panax notoginseng on SW480 human colorectal cancer cells [J]. Phytotherapy Research, 2009, 23(1): 6-13
[10]Kim D, Jung K H, Lee D, et al. 20 (S)-Ginsenoside Rg3 is a novel inhibitor of autophagy and sensitizes hepatocellular carcinoma to doxorubicin [J]. Oncotarget, 2014, 5(12): 4438
[11]Choi Y J, Lee H J, Kang D W, et al. Ginsenoside Rg3 induces apoptosis in the U87MG human glioblastoma cell line through the MEK signaling pathway and reactive oxygen species [J]. Oncology Reports, 2013, 30(3): 1362-1370
[12]高娟.糖苷酶转化人参皂苷的研究[D].长春:东北师范大学,2012 GAO Juan. Study on biotransformation of ginsenosides by glycoside hydrolases [D]. Changchun: Northeast Normal University, 2012
[13]刘莉,齐滨,胡娜,等.酶法转化人参皂苷的研究[J].长春中医药大学学报,2013, 29(4):729-730 LIU Li, QI Bin, HU Na, et al. Study on enzymatic transformation of ginsenoside [J]. Journal of Changchun University of Traditional Chinese Medicine, 2013, 29(4): 729-730
[14]姬庆,郜玉钢,赵岩,等.酶法转化制备人参皂苷单体的研究进展[J].中草药,2014,45(22):3356-3360 JI Qing, GAO Yu-gang, ZHAO Yan, et al. Research progress on enzymatic conversion for preparing individual ginsenosides [J]. Chinese Traditional and Herbal Drugs, 2014,45(22): 3356-3360
[15]Wang C, Du G, Zhang Z, et al. Ginsenoside compound K, not Rb1, possesses potential chemopreventive activities in human colorectal cancer [J]. International Journal of Oncology, 2012,40(6): 1970-1976
[16]Dougherty U, Mustafi R, Wang Y, et al. American ginseng suppresses Western diet-promoted tumorigenesis in model of inflammation-associated colon cancer: role of EGFR [J].BMC Complementary and Alternative Medicine, 2011, 11(1):111
[17]王蓉,李亚林,王五洲,等.Compound K对小鼠CT26结肠肿瘤模型中髓系抑制细胞的抑制作用[J].南方医科大学学报,2015,5:748-752 WANG Rong, LI Ya-lin, WANG Wu-zhou, et al. Compound K suppresses myeloid- derived suppressor cells in a mouse model bearing CT26 colorectal cancer xenograft [J]. Journal of Southern Medical University, 2015, 5: 748-752
[18]张留记,周志敏,屠万倩.人参的提取工艺和人参皂苷的转化研究[J].中医临床研究,2016,8(34):5-10 ZHANG Liu-ji, ZHOU Zhi-min, TU Wan-qian. A study on extraction process of ginseng and transformation of ginsenosides [J]. Clinical Journal of Chinese Medicine, 2016,8(34): 5-10
[19]蔡治纲,张莉伟,龚晓英.不同来源西洋参中人参总皂苷及人参皂苷Rb_1含量的比较[J].中草药,2002,33(2):27-28 CAI Zhi-gang, ZHANG Li-wei, GONG Xiao-ying.Comparison of content of total ginsenoside and ginsenoside Rb1 in panax quinquefolius from different origins [J].Chinese Traditional and Herbal Drugs, 2002, 33(2): 27-28
[20]陈金鸾,孟繁玉,王振洲,等.林下山参片人参总皂苷及19种单体人参皂苷(元)的含量测定[J].人参研究,2015,4:2-5 CHEN Jin-luan, MENG Fan-yu, WANG Zhen-zhou, et al.Content determination of ttotal ginsenosides and 19 monomer ginsenosides or aglycones in tablets of panax pinseng C.A.Meyer cv. Silvatica [J]. Ginseng Research, 2015, 4: 2-5
[21]夏娟,张金秋,阮长春,等.天冬氨酸催化人参皂苷Re转化制备稀有人参皂苷的研究[J].中草药,2016,47(19):3389-3394 XIA Juan, ZHANG Jin-qiu, RUAN Chang-chun, et al.Preparation of rare ginsenoside by transformation of ginsenoside re catalyzed with aspartic acid [J]. Chinese Traditional and Herbal Drugs, 2016, 47(19): 3389-3394
[22]赵立亚,鱼红闪,金凤燮.酶法生产稀有人参皂甙及其产物成分的分析[J].大连轻工业学院学报,2002,21(2):112-115 ZHAO Li-ya, YU Hong-shan, JIN Feng-xie. Preparing rare ginsenoside from enzyme reaction and composition analysis of its products [J]. Journal of Dalian Institute of Light Inoustry, 2002, 2(12): 112-115
[23]Noh K H, Son J W, Kim H J, et al. Ginsenoside compound K production from ginseng root extract by a thermostable β-glycosidase from Sulfolobus solfataricus [J]. Bioscience,Biotechnology, and Biochemistry, 2009, 73(2): 316-321
[24]Solito Samantha, Marigo Ilaria, Pinton Laura, et al.Myeloid-derived suppressor cell heterogeneity in human cancers [J]. Annals of the New York Academy of Sciences,2014, 1319(1): 47-65
[25]Park J Y, Choi P, Kim H, et al. Increase in apoptotic effect of Panax ginseng by microwave processing in human prostate cancer cells: in vitro and in vivo studies [J]. Journal of Ginseng Research, 2016, 40(1): 62-67
[26]Fishbein A B, Wang C, Li X, et al. Asian ginseng enhances the anti-proliferative effect of 5-fluorouracil on human colorectal cancer: comparison between white and red ginseng[J]. Archives of Pharmacal Research, 2009, 32(4): 505-513
[27]Kim J Y, Lee K, Kim S, et al. Inhibitory effect of tumor cell proliferation and induction of G2/M cell cycle arrest by panaxytriol [J]. Planta Medica, 2002, 68(2): 119-122

