抑制G蛋白偶联受体35对小鼠缺血性心肌损伤的保护作用
贺磊,杨怡,田玥,王挺,沈阳,裴海峰,杨大春
G蛋白偶联受体(G protein-coupled receptors,GPRs)又称7次跨膜受体,是体内最大的蛋白质超家族,目前已发现1000多个成员[1-3]。GPRs作为细胞膜上的重要受体,也是一类药物作用的靶点,目前30%~40%的上市药物都是基于GPRs而设计的[4]。研究发现,GPR35作为G蛋白偶联受体家族中的一个孤儿受体,具有GPRs类膜蛋白的共同特征,但其生物学功能仍未完全明确[5]。
GPR35广泛分布在白细胞、单核细胞等各种免疫细胞中,并在脾脏、心脏等器官中呈中等水平表达[6-7]。随着新技术的应用[8],目前已证实GPR35可能与疼痛[9]、炎症[10]和哮喘[11]等多种疾病相关,并有研究表明GPR35与心血管系统疾病如高血压[12]、冠状动脉疾病[13]等密切相关。全基因组相关性研究发现GPR35单核苷酸多态性与冠状动脉的钙化等病变密切相关[13]。因此GPR35有可能成为一个新颖的、有潜力的心血管疾病治疗靶标。Ronkainen等[14]研究发现GPR35可被缺氧诱导因子1α(HIF-1α)激活,但并未进一步证实其在心肌缺氧/缺血损伤中的作用。本研究利用已证实的GPR35抑制剂CID2745678,采用心肌细胞系低氧环境及小鼠心肌梗死模型验证GPR35在缺血性心血管疾病中的作用,以期为缺血性心肌损伤提供新的治疗靶点。
1 材料与方法
1.1 材料
1.1.1 细胞及动物 小鼠心肌细胞系(MCM)购于中国医学科学院基础医学研究所细胞资源中心。8~10周龄C57雄性小鼠40只,体重25g左右,购自成都达硕生物公司,适应性饲养2周后再开展实验。
1.1.2 试剂 高糖型(4500mg/L) DMEM培养基(HyClone公司),胎牛血清(Sigma公司),Trizol(美国Invitrogen公司),胰蛋白酶(美国Sigma公司),反转录及PCR检测试剂盒(TaKaRa公司),q-PCR引物(成都擎科梓熙生物技术有限公司),流式凋亡试剂盒(美国BD公司),TUNEL染色试剂盒、DAPI胞核荧光染料(美国Roche公司),Masson染色试剂盒、二喹啉甲酸(BCA)蛋白测定试剂盒(上海碧云天公司),β-actin单克隆抗体(Santa Cruz Biotech公司),GRR35单克隆抗体(美国Abcam公司)。
1.2 方法
1.2.1 MCM低氧模型的建立及MCM培养 细胞置于含10%胎牛血清、100U/ml青霉素和100pg/ml链霉素的高糖型DMEM培养基中培养,待生长融合至80%~90%时用胰蛋白酶消化,按1∶2比例将细胞悬液接种于55cm2培养瓶中,置于5%CO2、37℃培养箱中培养。选择生长良好的对数生长期细胞,按细胞数为1×105/ml,接种于21cm2培养皿,给予不同干预并按分组进行实验。
1.2.2 MCM低氧模型 心肌细胞正常传代至60mm培养皿,细胞融合至50%左右时,将培养皿置于低氧细胞培养箱(3%O2,5%CO2,92%N2)6h,缺氧处理前更换为无血清无糖培养基。为检测GPR35在缺氧中的变化将小鼠心肌细胞分为常氧组、缺氧组;为进一步验证GPR35抑制剂的作用,将心肌细胞分为常氧组、缺氧组、缺氧+溶剂组、缺氧+CID2745678组。缺氧+CID2745678组在缺氧干预前6h加入浓度为3μm/L的GPR35抑制剂CID2745678;缺氧+溶剂组在缺氧干预前6h加入等量溶剂。
1.2.3 小鼠心肌梗死模型 动物实验:为检测GPR35在心肌缺血条件下的变化,将雄性C57小鼠分为假手术组(n=6),心梗组(n=8)。心梗组正常建模,假手术组小鼠除不结扎前降支冠脉外,其余流程均同心梗组。为进一步验证GPR35抑制剂的作用,将小鼠分为假手术组(n=6)、心梗组(n=8)、心梗+溶剂组(n=8)、心梗+CID2745678组(n=8)。心梗+CID2745678组分别在术前及术后24h腹腔注射12μg/kg CID2745678;心梗+溶剂组术前及术后24h腹腔注射等量溶剂。利用Gao等[15]动物模型制备方法进行建模。0.4%水合氯醛腹腔注射麻醉小鼠,固定于实验台上,循胸骨左侧第4、5肋间做一长2cm左右的纵行切口,采用4-0线沿切口周围皮肤做一荷包;止血钳钝性分离胸大肌与胸小肌,再分开肋骨暴露心脏,可见左侧冠状动脉前降支,用6-0缝合线在左心耳下缘处结扎前降支,送回心脏并排除胸内气体,收紧荷包并关闭胸腔。
1.2.4 q-PCR测心肌细胞GPR35 mRNA表达水平采用Trizol法提取MCM总RNA,再反转录为cDNA,采用q-PCR法进行基因扩增测定GPR35 mRNA表达量。18S为内参基因,用2–ΔΔCt法分析结果。引物序列如下:18S:正义5′-CGCGGTTCTATTTT GヰGGヰT-3′,反义5′-GCGCCGGTCCAAGAAヰT-3′;GPR35:正义5′-ATCACAGGTAAACTCTCAGACAC CAACT-3′,反义5′-CTTGAACGCTTCCTGGAACTC T-3′。
1.2.5 Western blotting检测GPR35蛋白表达水平待心肌细胞系经实验条件处理结束后,正常消化细胞至离心管,PBS洗涤后加入蛋白裂解液,BCA法检测蛋白浓度,根据蛋白浓度加入适量样品。配制SDS-PAGE凝胶后行蛋白电泳,然后转移至PVDF膜,5%脱脂奶粉封闭3h,分别加入相应的抗体GPR35及β-actin,4℃孵育过夜后加二抗,孵育3h后ECL法显色。心肌梗死小鼠正常取材,先用预冷的冰PBS清洗心脏组织后加入预冷的裂解液并剪碎组织样品,匀浆心脏组织后,4℃、12 000×g离心10min,留取上清液,余步骤相同。
1.2.6 流式细胞术测定心肌细胞凋亡水平 用0.25%不含EDTA的胰酶消化并收集细胞,用预冷的PBS洗涤,结合缓冲液重悬细胞,加入Annexin V-FITC及PI染料并混匀,同时设置空白组,室温避光孵育15min,1h内进行流式细胞仪检测,Flowjo软件分析数据。
1.2.7 TUNEL荧光染色检测心肌细胞凋亡水平利用DAPI和TUNEL双染法测定心肌细胞凋亡水平,蓝色为心肌细胞核,而绿色则为凋亡心肌细胞核。心肌细胞凋亡指数(AI)=阳性心肌细胞数/总心肌细胞数×100%。按照试剂盒说明书步骤进行染色,最后在荧光显微镜下观察并计数,再用Image-Pro软件分析心肌细胞凋亡情况。
1.2.8 小鼠心功能检测 小鼠心肌梗死模型建立4周后,用0.4%水合氯醛麻醉小鼠后置于检测台上,小鼠的心率维持在400次/min以上时开始进行超声检测。利用Visual Sonics Vevo770高分辨率小动物超声影像系统及专用小鼠RMV707B高频探头,行B型及M型超声检测左室射血分数值(LVEF)与左室短轴缩短分数(LVFS)等,同时留取典型超声影像图片。
1.2.9 Masson染色检测小鼠心肌纤维化水平 小鼠经心脏功能检测后,处死小鼠并取出心脏,在KCl溶液中浸泡使其呈舒张状态,浸泡于4%多聚甲醛中固定48h,石蜡包埋,制成石蜡切片。按照Masson染色试剂盒说明书染色,并调整染色时间。具体步骤如下:事先制备好的石蜡组织块切片经脱蜡至水处理后备用;利用Harris苏木素染料染胞核10min,水洗;再经过分化、水洗、返蓝、水洗等处理,用Masson复合染色液对切片染色12min;0.2%的醋酸溶液速洗5s两次,1%的磷钼酸液体处理5min,0.2%的醋酸速洗2次;利用苯胺蓝液或绿液复染5min,1%冰醋酸处理1min;新鲜的95%乙醇及无水乙醇脱水,然后二甲苯透明,中性树胶封片处理。最后在荧光显微镜下观察各组的组织切片并拍照,分析计算纤维化水平。蓝色显示为胶原纤维,红色显示为肌纤维。左心室蓝色部分面积/左心室面积即可得出左室心肌纤维化水平。
1.3 统计学处理 采用SPSS 17.0软件进行统计分析。计量资料以x±s表示,两组间比较采用独立样本t检验;多组间比较采用单因素方差分析,进一步两两比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结 果
2.1 缺氧/缺血环境对GPR35表达的影响 q-PCR及Western blotting检测结果显示,MCM经缺氧处理后,缺氧组GPR35 mRNA及蛋白表达水平较常氧组均明显升高(P<0.01或P<0.05,图1A、B)。C57小鼠结扎左冠状动脉前降支模拟心肌梗死3d后心脏取材,q-PCR及Western blotting检测结果显示,心梗组GPR35 mRNA及蛋白表达水平均较假手术组明显升高(P<0.01或P<0.05,图1C、D)。
2.2 抑制GPR35对低氧条件下心肌细胞凋亡的影响 流式细胞术检测结果显示,与常氧组比较,缺氧组、缺氧+溶剂组心肌细胞凋亡率明显增加(P<0.05),而缺氧+CID2745678组凋亡率差异无统计学意义;与缺氧组比较,缺氧+溶剂组心肌细胞凋亡率差异无统计学意义,而缺氧+CID2745678组心肌细胞凋亡率明显降低(P<0.05);与缺氧+溶剂组比较,缺氧+CID2745678组细胞凋亡率明显下降(图2A、B,P<0.05)。TUNEL荧光检测结果与流式细胞术检测结果一致(图2C、D)。

图1 缺氧/缺血环境对GPR35 mRNA及蛋白表达的影响Fig.1 Effects of hypoxia/ischemia on mRNA and protein level of GPR35
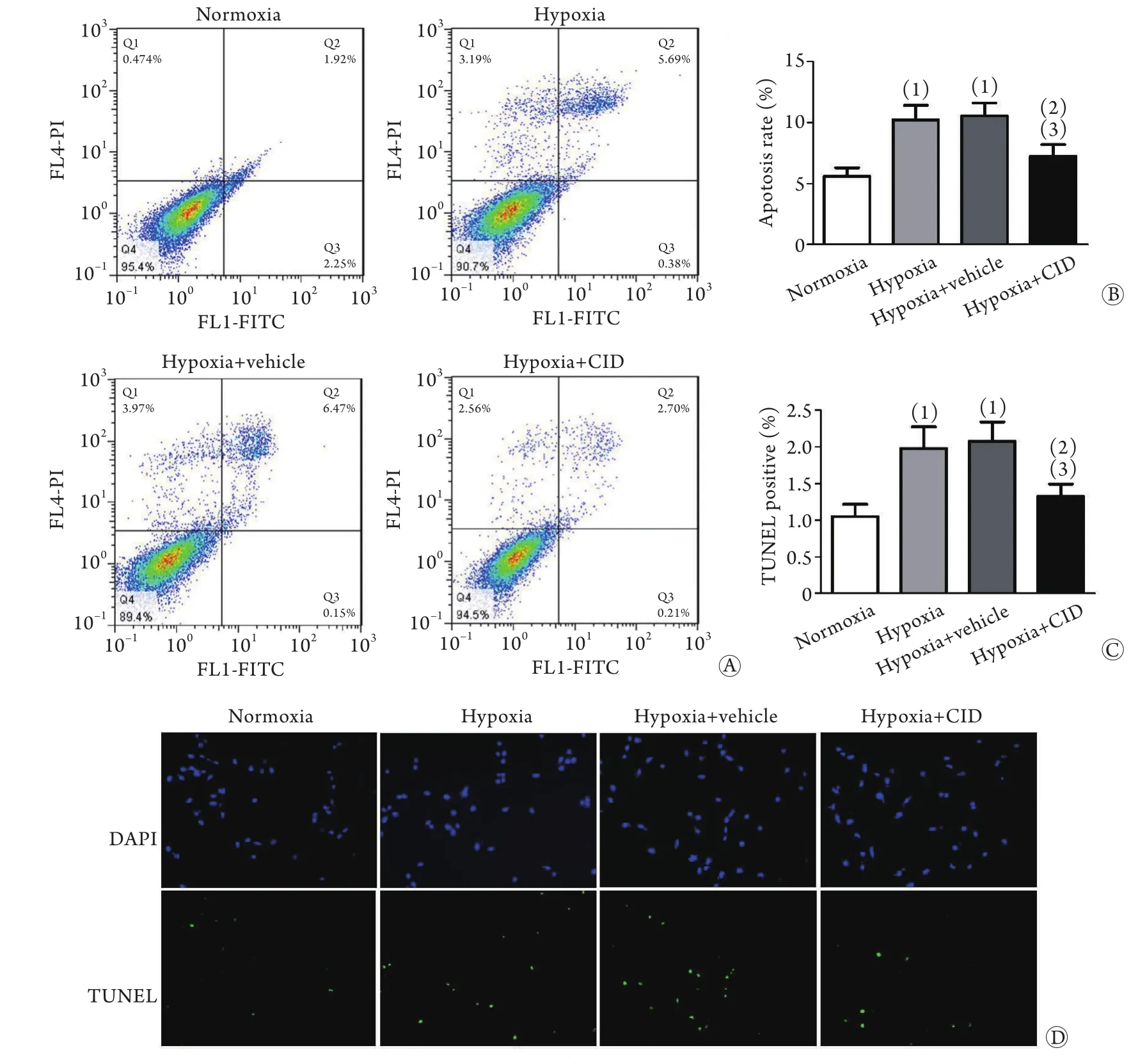
图2 抑制GPR35对低氧条件下心肌细胞凋亡的影响Fig.2 Inhibition of GPR35 preserved the viability of hypoxic myocardial cells
2.3 抑制GPR35对心肌梗死小鼠心肌组织纤维化的影响 术后4周使用小动物超声检测小鼠心脏功能,结果显示,与假手术组比较,心梗组、心梗+溶剂组LVEF、LVFS明显降低(P<0.05),而心梗+CID2745678组差异无统计学意义;与心梗组比较,心梗+溶剂组LVEF、LVFS差异无统计学意义,而心梗+CID2745678组LVEF、LVFS明显改善(P<0.05);与心梗+溶剂组比较,心梗+CID2745678组心脏LVEF、LVFS明显改善(图3A–C,P<0.05)。Masson染色也提示抑制GPR35后心脏左室纤维化明显减轻(图3D,P<0.05)。
3 讨 论
近年来随着疾病谱的变化,心血管系统疾病负担日渐加重,已成为我国乃至世界范围内的重大公共卫生问题[16-17]。《中国心血管病报告2014》指出,我国心血管病死亡占城乡居民总死亡原因的首位,农村为44.8%,城市为41.9%[18]。缺血性心脏病是指由于冠脉循环狭窄或阻塞引起心脏氧供失衡,并由此导致心肌细胞的缺失及心肌瘢痕形成,最终致心室功能衰竭的一类疾病[19],目前的治疗方法包括药物治疗、经皮冠状动脉介入术(PCI)、冠状动脉搭桥术(CABG)等,均有相应的适应证及利弊。深入探索缺血性心脏病的发病机制并寻找更合适的干预靶点有着重要的临床意义。

图3 抑制GPR35对心肌梗死小鼠心肌组织纤维化的影响Fig.3 Effects of inhibiting GPR35 on myocardial fibrosis of MI mice
众所周知,许多GPRs直接参与了疾病的病理过程,因此是较为理想的治疗靶点,而部分药物的确是GPRs的配体[20]。但是目前仅约1/6的非嗅觉相关GPRs被开发为药物,因此需要更多的研究投入其中[14]。GPR35因与众多疾病相关,自1998年发现以来便被作为潜在的治疗靶点获得研究者极大的关注[5]。然而,因缺乏明确可信的内源性配体,阻碍了对GPR35功能的进一步理解及其作为药物靶点的继续开发。相关研究表明,GPR35在小鼠心衰模型、急性心肌梗死阶段以及心肌肥厚的代偿及非代偿期表达均明显升高,而过表达GPR35可使心肌细胞内肌动蛋白、细胞骨架排列发生紊乱,并导致细胞形态的变化[21]。但上述研究并未进一步探究GPR35在心肌缺血缺氧损伤中的具体作用。Min等[12]研究发现,与正常小鼠比较,GPR35敲除小鼠血压明显升高,而患者发生心衰时也伴有GPR35基因表达的增加。在细胞水平,腺病毒转染细胞过表达GPR35后,细胞会发生类似心肌肥厚的改变并且伴随细胞活力的下降[12]。以上研究均提示GPR35在心血管疾病中有重要的作用。
心肌缺氧/缺血是多种心血管疾病发生的必经过程,进一步阐明GPR35在其中的作用具有重要意义。本实验利用心肌细胞系低氧环境及小鼠心肌梗死模型来模拟心血管疾病,研究GPR35的变化及其在该病理过程中的作用,结果发现缺氧/缺血环境可诱导GPR35的表达,与其他研究结果[21]一致,亦证实其可能参与该病理过程。而GPR35本身表达升高可能出现在整个病程中,在心肌急性缺血以及疾病进一步恶化导致的心衰过程中可能均有较高的表达,后续实验将继续在模型中进行验证。CID2745678是目前已被证实的GPR35活性抑制剂[9],能够抑制低氧环境导致的心肌细胞系凋亡,并能进一步减轻心肌梗死后的心肌重塑并改善心功能。作为GPRs中的一员,GPR35被激活后可能的下游分子包括Rho蛋白A(Rho A)、Ca2+、环磷酸腺苷(cAMP)等[11],而这些下游分子可作为第二信使参与多种生理过程。在心肌缺血性疾病中,GPR35表达升高,最终可能通过多条途径影响细胞的代谢及凋亡。但是,目前仍未明确GPR35是通过何种信号通路影响细胞凋亡的,仍须进一步探索。
综上所述,本研究验证了GPR35在心肌缺氧/缺血损伤中的作用,其活性抑制剂CID2745678能够减轻心肌缺氧/缺血损伤,为GPR35作为新的药物干预靶点提供了理论基础。
【参考文献】
[1]Wong SK. G protein selectivity is regulated by multiple intracellular regions of GPCRs[J]. Neurosignals, 2003, 12(1)∶1-12.
[2]Zhang Z, Zhu H, Song H,et al. Expressions of Lgr5 andβcatenin in epithelial ovarian cancer tissue and the effect on cell proliferation and migration of SKOV 3 cells[J]. J Zhengzhou Univ (Med Sci), 2017, 52(2)∶ 138-142. [张展, 朱海, 宋华, 等.Lgr5、β-catenin在卵巢上皮性癌组织中的表达及对SKOV3细胞增殖迁移的影响[J]. 郑州大学学报(医学版), 2017,52(2)∶ 138-142.]
[3]Zhang QL, Xie LQ. The role of PAR-2 in the proliferation,metastasis and invasion of malignant tumor[J]. J Logist Univ PAP (Med Sci), 2017, 26(4)∶ 364-368. [张其良, 谢立群. PAR-2在恶性肿瘤的增殖、转移及侵袭中的作用[J]. 武警后勤学院学报(医学版), 2017, 26 (4)∶ 364-368.]
[4]Overington JP, Al-Lazikani B, Hopkins AL. How many drug targets are there?[J]. Nat Rev Drug Discov, 2006, 5(12)∶ 993-996.
[5]O′Dowd BF, Nguyen T, Marchese A,et al. Discovery of three novel G-protein-coupled receptor genes[J]. Genomics, 1998,47(2)∶ 310-313.
[6]Taniguchi Y, Tonai-Kachi H, Shinjo K. Zaprinast, a well-known cyclic guanosine monophosphate-specific phosphodiesterase inhibitor, is an agonist for GPR35[J]. FEBS Lett, 2006, 580(21)∶5003-5008.
[7]Wang J, Simonavicius N, Wu X,et al. Kynurenic acid as a ligand for orphan G protein-coupled receptor GPR35[J]. J Biol Chem,2006, 281(31)∶ 22021-22028.
[8]Hu H, Deng H, Fang Y. Label-free phenotypic profiling identified D-luciferin as a GPR35 agonist[J]. PLoS One, 2012,7(4)∶ e34934.
[9]Zhao P, Sharir H, Kapur A,et al. Targeting of the orphan receptor GPR35 by pamoic acid∶ a potent activator of extracellular signal-regulated kinase and beta-arrestin2 with antinociceptive activity[J]. Mol Pharmacol, 2010, 78(4)∶ 560-568.
[10] Sparfel L, Pinel-Marie ML, Boize M,et al. Transcriptional signature of human macrophages exposed to the environmental contaminant benzo(a)pyrene[J]. Toxicol Sci, 2010, 114(2)∶ 247-259.
[11] Yang Y, Lu JY, Wu X,et al. G-protein-coupled receptor 35 is a target of the asthma drugs cromolyn disodium and nedocromil sodium[J]. Pharmacology, 2010, 86(1)∶ 1-5.
[12] Min KD, Asakura M, Liao Y,et al. Identification of genes related to heart failure using global gene expression profiling of human failing myocardium[J]. Biochem Biophys Res Commun, 2010,393(1)∶ 55-60.
[13] Sun YV, Bielak LF, Peyser PA,et al. Application of machine learning algorithms to predict coronary artery calcification with a sibship-based design[J]. Genet Epidemiol, 2008, 32(4)∶ 350-360.
[14] Ronkainen VP, Tuomainen T, Huusko J,et al. Hypoxia-inducible factor 1-induced G protein-coupled receptor 35 expression is an early marker of progressive cardiac remodelling[J]. Cardiovasc Res, 2014, 101(1)∶ 69-77.
[15] Gao E, Lei YH, Shang X,et al. A novel and efficient model of coronary artery ligation and myocardial infarction in the mouse[J]. Circ Res, 2010, 107(12)∶ 1445-1453.
[16] Wang LX, Meng QY, Yu T. 2016 National consensus on cardiopulmonary resuscitation in China[J]. Med J Chin PLA,2017, 42(3)∶ 243-269. [王立祥, 孟庆义, 余涛. 2016中国心肺复苏专家共识[J]. 解放军医学杂志, 2017, 42(3)∶ 243-269.]
[17] Chen WW, Gao RL, Liu LS,et al. Summary ofChinese Cardiovascular Disease Report, 2014[J]. Chin Circ J, 2015, 30(7)∶618-622. [陈伟伟, 高润霖, 刘力生, 等. 《中国心血管病报告2014》概要[J]. 中国循环杂志, 2015, 30(7)∶ 618-622.]
[18] Herber-Gast G, Brown WJ, Mishra GD. Hot flushes and night sweats are associated with coronary heart disease risk in midlife∶a longitudinal study[J]. BJOG, 2015, 122(11)∶ 1560-1567.
[19] Arora RR, Rai F. Antiplatelet intervention in acute coronary syndrome[J]. Am J Ther, 2009, 16(5)∶ e29-e40.
[20] Gashaw I, Ellinghaus P, Sommer A,et al. What makes a good drug target?[J]. Drug Discov Today, 2011, 16(23-24)∶ 1037-1043.
[21] Garland SL. Are GPCRs still a source of new targets?[J]. J Biomol Screen, 2013, 18(9)∶ 947-966.

