术前超声心动图检查异常与非心脏手术患者术后主要不良心脏事件的关系:一项巢式病例对照研究
李春晶,郭超,王博杰,穆东亮,王东信
临床上约30%的术后死亡归因于心脏不良事件,如急性冠脉综合征、心功能衰竭和心脏骤停等[1]。术前心脏疾病病史会增加主要心脏不良事件(major adverse cardiac events,MACE)的发生风险[2]。有文献报道,术前缺血性心脏病患者发生术后MACE的风险是普通患者的3.8倍[3]。一项关于6948例患者接受大血管手术的回顾性研究发现,患者术前1年内患有充血性心衰是术后心源性死亡的独立危险因素[4]。另一项研究结果提示患有心律失常(如心房纤颤)的患者行非心脏手术术后死亡风险增加[5]。缺血性心脏病、充血性心衰和心律失常等心脏疾病会导致心脏本身结构和功能的改变(如室壁运动不良和左室射血分数降低),这可能是导致这些患者MACE风险增加的基础[6-7]。因此准确评估心脏功能对于术前评估和预测危险分级具有重要意义[8]。术前经胸超声心动图(transthoracic echocardiography,TTE)检查可以对心脏的结构与功能进行综合评价,目前已广泛用于围术期心脏评估[6-8]。左室射血分数(left ventricular ejection fraction,LVEF)是TTE的重要指标。文献报道非心脏手术患者术前LVEF降低是围术期死亡的独立危险因素之一[9]。研究显示,术前具有中重度心脏舒张功能异常的患者术后死亡风险相比普通患者增加了21.2倍[10],心脏结构异常(如心室肥大和瓣膜疾病)也是MACE的危险因素[11-12]。但是也有研究对TTE是否可以预测MACE的发生风险提出了异议。一项回顾性研究显示即使在高危患者中进行术前TTE检查,检查结果与术后近期和远期生存率均无相关关系[13]。另一项针对老年患者的研究也发现,术前TTE检查没有降低围术期的死亡率[14]。国外已对TTE在术前的规范使用设立了相关指南,建议个体化应用而不作为常规检查[15]。但目前尚缺乏针对国内患者的临床数据支持,术前TTE检查在改善术后结局中的作用也还不明确,为此,本研究对术前TTE检查与择期非心脏手术患者术后MACE的关系进行了评估。
1 资料与方法
1.1 研究对象 选择2012年11月15日-2013年1月15日在北京大学第一医院接受择期非心脏手术的患者作为研究对象。病例排除标准:①年龄小于18岁;②急诊手术;③心脏手术;④在局部麻醉下接受手术;⑤缺少术前TTE诊断结果。本研究为巢式病例对照研究,研究方案获得北京大学第一医院伦理委员会批准,批准号2014[734]。采用回顾性研究方法,所有数据均从病历资料中获得,经伦理委员会同意免除患者知情同意,但涉及患者个人隐私的信息均严格保密。
1.2 MACE定义 MACE诊断标准如下[16]:①急性冠脉综合征,包括急性心肌梗死和不稳定心绞痛。心肌梗死的诊断标准为心肌肌钙蛋白I高于正常人检测值99%界限且伴有下列症状之一:心肌缺血症状、心电图新发ST-T改变、完全性左束支传导阻滞、病理性Q波、影像学证实心肌运动异常或血管造影异常。不稳定心绞痛的诊断标准为缺血性症状加重,持续时间大于10min;心肌肌钙蛋白I阴性;静息状态下心电图新发ST-T改变或加重,相邻两个导联J点上移0.1mV,或相邻两个导联ST段压低≥0.05mV,或T波倒置≥0.3mV且R/S>1。②充血性心衰,诊断标准为下列表现至少两项阳性:症状(咳嗽、呼吸困难、端坐呼吸),体征[外周水肿、腹胀或腹水增多(除外肝脏疾病),肺部啰音、颈静脉充盈和(或)肝颈静脉回流征],监测结果[肺毛细血管楔压≥18mmHg、中心静脉压≥12mmHg或心脏指数<2.2L/(min.m2)]和实验室检查结果[心房钠尿肽(BNP)>500pg/ml或N末端心房钠尿肽前体(NT-pro-BNP)>2000pg/ml]。③新发严重心律失常,是指术后新发并需要使用药物或心脏电复律/除颤治疗的心律失常,如Ⅱ型及以上的房室传导阻滞、持续的快速房扑或房颤、频发室早且影响血流动力学稳定、室速或室颤等。④非致死性心搏骤停,指患者发生心搏骤停后经积极抢救脱离生命危险的情况。⑤心源性死亡,指由明确的心脏疾病发作而导致的患者死亡。
1.3 TTE异常的定义 术前TTE检查及报告由心内科专科医师完成。基于之前的研究[17],TTE报告中只要一项指标超过正常范围即属于检查结果异常。
1.4 资料收集和病例分组 首先利用住院患者信息系统并通过电子病历系统查阅病历资料,筛选出术前接受TTE检查的患者。术前基础资料包括人口学信息(年龄、身高、体重)、既往病史、吸烟史、术前药物治疗情况、入院诊断和重要检查等,术中资料包括手术类型、手术风险、手术时间、麻醉方法、麻醉时间、术中液体出入量等。
收集术后并发症和住院期间的死亡发生率等资料。通过回顾病例资料并根据患者是否发生MACE,将患者分为MACE组和对照组。针对每一例MACE组患者,按照4∶1的比例为其匹配对照病例。匹配标准如下:①改良心脏风险指数(revised cardiac risk index,RCRI)得分相同;②手术部位相同。RCRI是一项包含6项危险因素(缺血性心脏病史、充血性心脏病史、脑血管病史、需要胰岛素治疗的糖尿病、慢性肾脏疾病,腹股沟以上的血管、胸腔、腹腔手术)的评分工具,已被广泛用于预测围术期心脏不良事件的发生率,患者具备的危险因素越多,术后心脏并发症的发生率就越高[18]。手术是影响围术期并发症发生率的重要因素,根据心脏疾病患者行非心脏手术围术期评估指南中的定义将手术分为低危、中危、高危手术[19]。
1.5 统计学处理 本研究采用SPSS 20.0软件进行统计分析。将入组患者按照是否发生MACE分为MACE组和对照组进行分析。计量资料以、中位数(四分位间距)或中位数(全距)表示,组间比较采用t检验或Mann-WhitneyU检验。计数资料及等级资料以例数(%)表示,组间比较采用χ2检验或Fisher精确检验。等级资料统计分析采用趋势χ2检验。P<0.05为差异有统计学意义。
使用受试者工作特征曲线(receiver operating characteristic curve,ROC)分析术前TTE异常对术后MACE的预测价值。首先应用单因素分析筛选与术后MACE可能相关的危险因素,然后将术前TTE整体异常及各单项指标异常分别与单因素分析中有统计学意义的变量(P<0.20)共同代入多因素logistic回归模型,分析校正后的TTE整体异常及各单项指标异常与MACE的关系。
2 结 果
2.1 患者入组情况 2012年11月15日-2013年1月15日共有2975例患者在北京大学第一医院接受了外科手术,其中2081例符合入选标准及排除标准,有530例完成术前TTE检查。研究流程见图1。
根据研究方法中设定的对照病例匹配条件及方法,共100例患者被纳入对照组。因此,对照组及MACE组共计125例患者进入统计分析。两组患者术前基本资料见表1,除MACE组中女性患者比例明显高于对照组外,其余基线资料差异均无统计学意义。两组患者的围术期资料见表2,MACE组与对照组各项资料比较差异均无统计学意义。
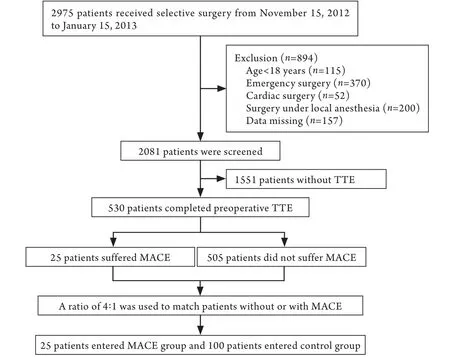
图1 入组流程图Fig. 1 Flowchart of study
2.2 TTE异常的发生情况 在530例接受TTE检查的患者中,TTE异常的整体发生率为91.9%(487/530),其中前三位的异常分别为三尖瓣轻度反流(75.7%)、二尖瓣轻度反流(72.5%)和主动脉瓣轻度反流(37.7%,图2)。
在纳入巢式病例对照研究的125例患者中TTE异常的整体发生率为92.8%,其中前三位的异常分别为三尖瓣轻度反流(72.0%)、二尖瓣轻度反流
(66.4%)和主动脉瓣轻度反流(44.8%,图3)。MACE组中TTE异常的整体发生率为92.0%(23/25),与对照组[93.0%(93/100)]比较差异无统计学意义(OR=0.866,95%CI 0.169~4.446,P=1.000)。

表1 两组患者术前基本资料Tab. 1 Preoperative baseline data of two groups
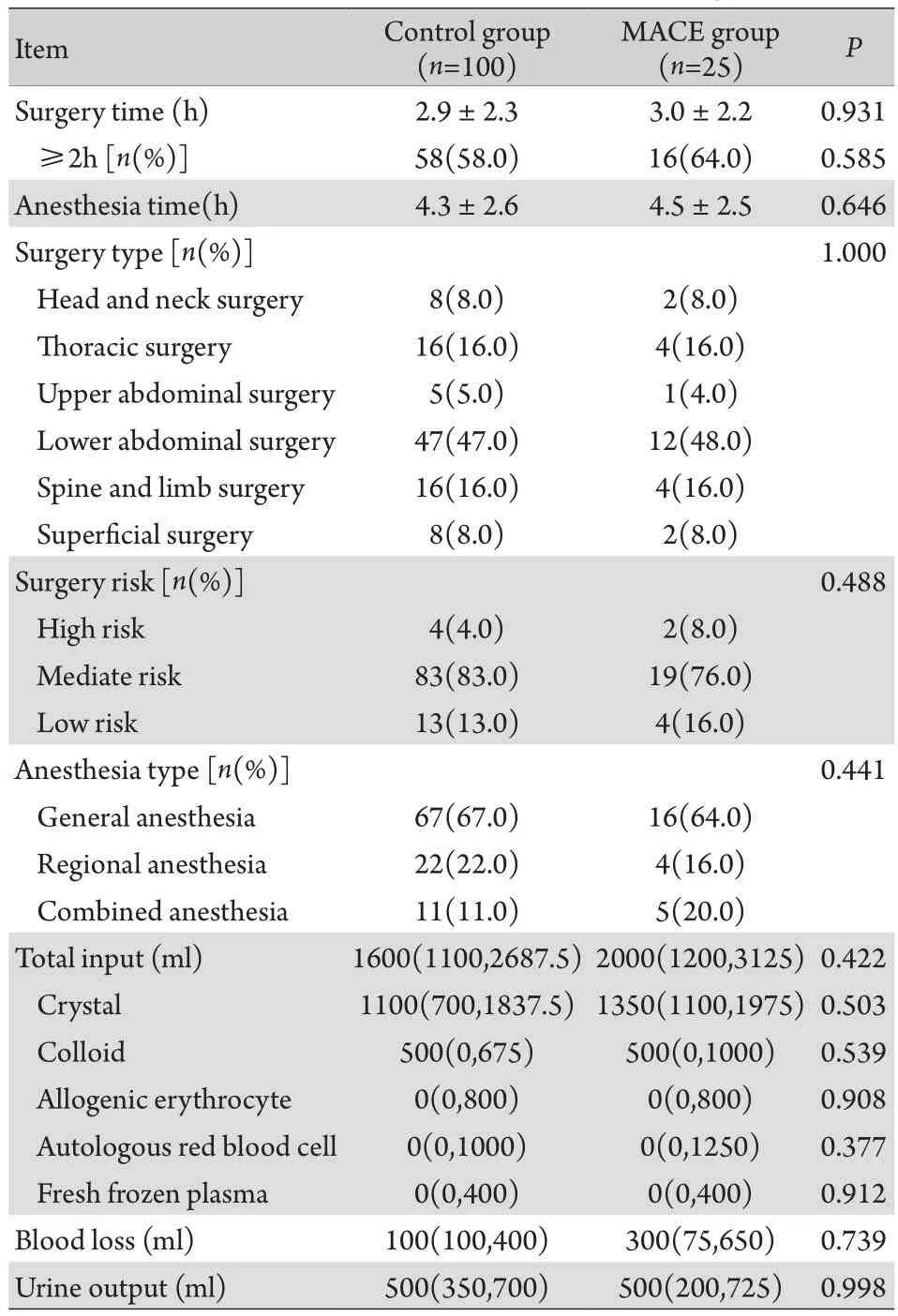
表2 两组患者围术期相关资料Tab. 2 Intraoperative data of two groups

图2 530例术前行TTE检查患者各单项异常的发生率Fig. 2 The prevalence of preoperative TTE abnormalities in 530 cases

图3 125例患者各项TTE异常的发生率Fig. 3 The prevalence of preoperative TTE abnormalities in 125 cases
2.3 术前TTE异常对术后MACE的预测作用 ROC曲线分析显示,术前TTE整体异常对于术后MACE的预测价值很低(曲线下面积为0.501,P=0.992)。
采用两种模型评估TTE异常与MACE的关系。在模型一中,将TTE异常作为一个整体与单因素分析中的危险因素共同代入多因素回归分析(表3)。在模型二中,将TTE的每一个单项异常代入多因素回归分析(表4)。模型一的多因素回归分析显示患者术前TTE整体异常与MACE无统计学关系(OR=1.055,95%CI 0.191~5.825,P=0.951,表3)。模型二的多因素回归分析显示左室肥厚(OR=4.324,95%CI 1.320~14.160,P=0.016)是术后发生MACE的独立危险因素之一(表4)。其他危险因素还包括女性(OR=4.782,95%CI 1.636~13.980,P=0.005)和慢性肾衰竭(OR=21.952,95%CI 1.547~311.475,P=0.016)。但ROC曲线显示左室肥厚对术后MACE的预测价值较低(曲线下面积为0.510,P=0.877)。

表3 术前TTE整体异常与术后主要不良心脏事件的关系(模型一)Tab. 3 The relationship between preoperative TTE abnormality and postoperative MACE (Model 1)
3 讨 论
本研究发现术前TTE检查左室肥厚是术后发生MACE的独立危险因素之一,但是否需要常规进行TTE检查仍有待进一步研究证实。
TTE作为一种可以评估心脏结构及功能的方法广泛用于临床实践,本研究发现接受择期非心脏手术的患者术前TTE异常的发生率约为91.9%(487/530),与以往报道的比例相似[6-8]。
本研究发现心脏左室肥厚是术后发生MACE的独立危险因素之一。本研究入组患者左室肥厚的发生率为13.6%,与其他研究报道的12.7%~17.9%近似[20-21]。左室肥厚在TTE检查中通常表现为室间隔增厚和(或)左室后壁增厚,是左心室克服高负荷的一种代偿机制[22]。Rohde等[23]研究发现对于接受非心脏大手术的中高危患者,术前TTE检查结果异常(如中重度左室肥厚)常伴随着术后严重心脏事件风险的增加。这可能与以下原因有关:第一,左室肥厚增加了发生心肌缺血的风险。室壁肥厚可引起血管内皮功能障碍,导致冠状动脉扩张不足,从而损害心肌供氧功能[24]。第二,左室肥厚增加了心力衰竭的风险。这可能是因为室壁肥厚伴随着间质细胞增生、心肌纤维化、淀粉样变性和毛细血管减少等,最终导致心脏收缩功能障碍和心脏衰竭[25],而在收缩功能未出现明显降低时,心室舒张功能很可能已经受到损害,这也是发生心力衰竭的另一重要因素[26]。有研究提示舒张功能障碍是术后死亡的独立危险因素之一[10]。此外,左室肥厚与磷酸肌酸和三磷酸腺苷的比值下降明显相关,表明室壁肥厚时可能存在能量代谢障碍,使其更易于发生心脏衰竭[27]。第三,左室肥厚增加了心律失常的风险。室壁中层心肌具有不同于内膜和外膜心肌的电生理特性,其动作电位时程更长,易引起跨室壁心肌复极和不应期离散,这在生理状态下影响并不明显,但在病理性左室肥厚状态下会导致心律失常的发生[28]。因此,在术前评估中应对左室肥厚的患者给予更密切的关注。
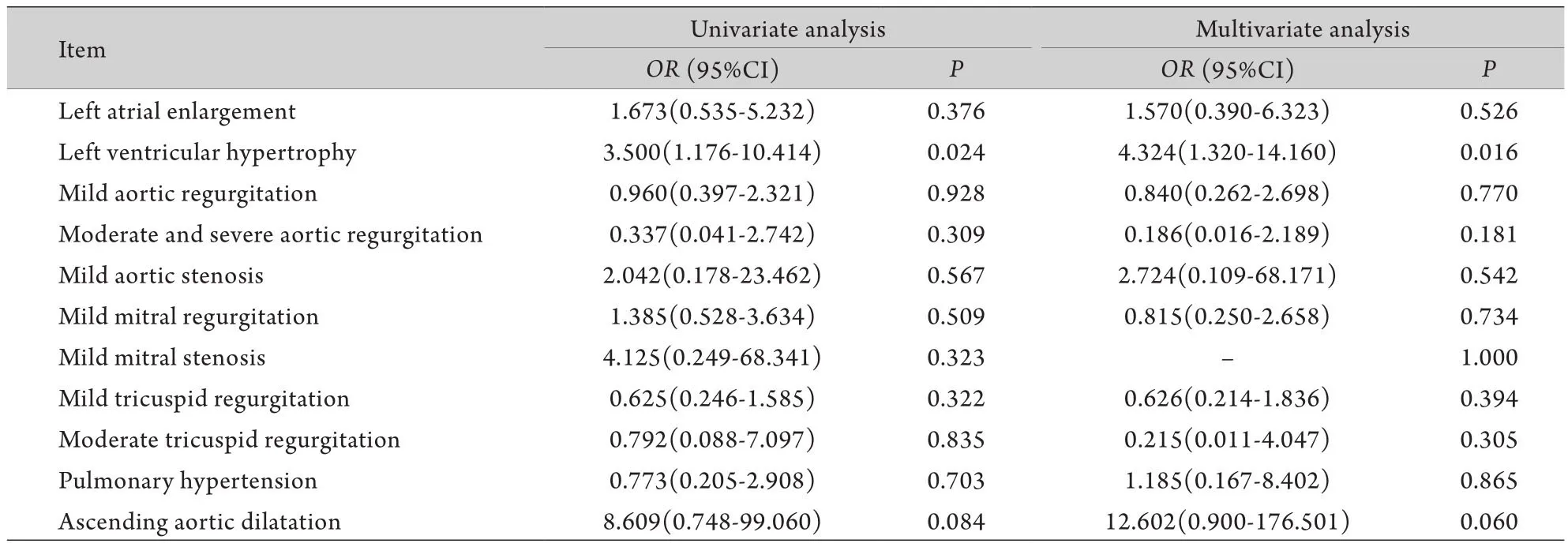
表4 术前TTE单项异常与术后主要不良心脏事件的关系(模型二)*Tab. 4 The relationship between single TTE item abnormality and postoperative MACE (Model 2)
左室射血分数(LVEF)是TTE检查结果中反映左室收缩功能的重要指标,其下降提示左心室收缩力减弱[22,29-30],但本研究并未发现LVEF与术后MACE的发生有关,与其他研究得到的结论相似。一项针对心脏疾病患者接受非心脏手术的人群回顾性研究发现,LVEF与围术期心脏事件无明显相关性[31]。另一项前瞻性研究也显示,在接受非心脏手术的老年患者中,术前LVEF与术后MACE的发生率无关[32]。有研究显示LVEF降低虽然意味着术后可能出现左室功能不全,但并不能有效预测术后早期心血管意外事件的发生[33]。
关于术前是否应该常规进行TTE筛查目前仍然存在争议。本研究发现以患者是否有MACE作为因变量,TTE异常对于MACE的预测价值很低,其可能的原因是:①患者往往是因为合并了冠心病、心律失常或高血压等疾病才会接受TTE检查,这些合并症才是导致患者发生MACE的根本原因[13];②在本研究中发生率比较高的异常项目是轻度瓣膜反流等轻微病变,这些病变对于患者预后的影响较小;③ヰE仅反映患者在静息状态下的心功能,不能反映其储备功能,因此仅有ヰE检查对患者心脏功能的评估尚不全面,应结合患者病史或进一步的检查(如多巴酚丁胺试验)进行全面评估[34-35]。尽管有研究显示术前某些ヰE检查项目异常与术后死亡发生率有关,但许多大样本研究均未发现ヰE异常与患者的预后存在确切关系[9-15]。2014年美国AHA/ACC关于非心脏病患者术前心脏评估的指南中推荐进行ヰE检查应该基于患者的具体病情,例如患者有不明原因的呼吸困难或者心衰患者出现症状加重等[18]。
本研究发现女性是术后MACE的高危人群。一项回顾性研究发现在接受腹主动脉瘤手术的患者中女性的死亡风险是男性的1.5倍[36]。慢性肾功能衰竭患者常合并存在高血压、心肌病或者冠心病,因此围术期发生MACE的风险高于其他患者[37]。一项对于接受普外科手术患者的研究发现慢性肾功能衰竭患者术后死亡风险是其他患者的9.05倍[38]。另外一项大样本回顾性研究也发现慢性肾功能衰竭是术后并发症的独立危险因素之一,而且慢性肾功能衰竭分级越高,术后发生并发症的风险也越高[39]。
本研究尚存在一些不足之处,首先,资料缺失是回顾性研究无法避免的缺点,在本研究中有157例患者出现资料缺失;第二,本研究是一项单中心研究,且实施单位为综合性教学医院,因此研究结果可能不适用于专科医院(如儿童医院);第三,本研究样本量较小,后续需要一项设计更为严谨的大样本研究来探讨TTE与患者预后的关系。
综上所述,本研究结果表明术前TTE检查发现左室肥厚是术后MACE的独立危险因素,但是术前是否需要常规进行TTE检查仍须进一步研究探讨。
【参考文献】
[1]Botto F, Alonso-Coello P, Chan MT,et al. Myocardial injury after noncardiac surgery∶ a large, international, prospective cohort study establishing diagnostic criteria, characteristics, predictors,and 30-day outcomes[J]. Anesthesiology, 2014, 120(3)∶ 564-578.
[2]Mercado DL, Ling DY, Smetana GW. Perioperative cardiac evaluation∶ novel interventions and clinical challenges[J]. South Med J, 2007, 100(5)∶ 486-492.
[3]Matsuyama T, Iranami H, Fujii K,et al. Risk factors for postoperative mortality and morbidities in emergency surgeries[J]. J Anesth, 2013, 27(6)∶ 838-843.
[4]Sprung J, Abdelmalak B, Gottlieb A,et al. Analysis of risk factors for myocardial infarction and cardiac mortality after major vascular surgery[J]. Anesthesiology, 2000, 93(1)∶ 129-140.
[5]van Diepen S, Bakal JA, McAlister FA,et al. Mortality and readmission of patients with heart failure, atrial fibrillation,or coronary artery disease undergoing noncardiac surgery∶ an analysis of 38 047 patients[J]. Circulation, 2011, 124(3)∶ 289-296.
[6]Xu L, Huang X, Ma J,et al. Value of three-dimensional strain parameters for predicting left ventricular remodeling after ST-elevation myocardial infarction[J]. Int J Cardiovasc Imaging,2017, 33(5)∶ 663-673.
[7]Boriani G, Tukkie R, Biffi M,et al. Atrial antitachycardia pacing and atrial remodeling∶ a substudy of the international,randomized MINERVA trial[J]. Heart Rhythm, 2017, 14(10)∶1476-1484.
[8]Fleisher LA, Fleischmann KE, Auerbach AD,et al. 2014 ACC/AHA guideline on perioperative cardiovascular evaluation and management of patients undergoing noncardiac surgery∶ a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines[J]. Circulation,2014, 130(24)∶ e278-e333.
[9]Kontos MC, Brath LK, Akosah KO,et al. Cardiac complications in noncardiac surgery∶ relative value of resting two-dimensional echocardiography and dipyridamole thallium imaging[J]. Am Heart J, 1996, 132(3)∶ 559-566.
[10] Kaw R, Hernandez AV, Pasupuleti V,et al. Effect of diastolic dysfunction on postoperative outcomes after cardiovascular surgery∶ A systematic review and meta-analysis[J]. J Thorac Cardiovasc Surg, 2016, 152(4)∶ 1142-1153.
[11] Duncan AI, Lowe BS, Garcia MJ,et al. Influence of concentric left ventricular remodeling on early mortality after aortic valve replacement[J]. Ann Thorac Surg, 2008, 85(6)∶ 2030-2039.
[12] Flint N, Rozenbaum Z, Biner S,et al. Diastolic mitral regurgitation following transcatheter aortic valve replacement∶Incidence, predictors, and association with clinical outcomes[J].J Cardiol, 2017, 70(5)∶ 491-497.
[13] Wijeysundera DN, Beattie WS, Karkouti K,et al. Association of echocardiography before major elective non-cardiac surgery with postoperative survival and length of hospital stay∶ population based cohort study[J]. BMJ, 2011, 342∶ d3695.
[14] Marcantonio A, Steen B, Kain M,et al. The clinical and economic impact of preoperative transthoracic echocardiography in elderly patients with hip fractures[J]. Bull Hosp Jt Dis (2013), 2015,73(4)∶ 239-242.
[15] O′Neill F, Carter E, Pink N,et al. Routine preoperative tests for elective surgery∶ summary of updated NICE guidance[J]. BMJ,2016, 354∶ i3292.
[16] Hicks KA, Tcheng JE, Bozkurt B,et al. 2014 ACC/AHA key data elements and definitions for cardiovascular endpoint events in clinical trials∶ A report of the American College of Cardiology/American Heart Association Task Force on Clinical Data Standards (Writing Committee to Develop Cardiovascular Endpoints Data Standards)[J]. Circulation, 2015, 132(4)∶ 302-361.
[17] Echocardiography Group of Chinese Medical Association Ultrasound Medical Branch. Guidelines for echocardiography of Chinese adult[J]. Chin J Ultrason, 2016, 25(8)∶ 645-666.[中华医学会超声医学分会超声心动图学组. 中国成年人超声心动图检查测量指南[J]. 中华超声影像学杂志, 2016, 25(8)∶645-666.]
[18] Lee TH, Marcantonio ER, Mangione CM,et al. Derivation and prospective validation of a simple index for prediction of cardiac risk of major noncardiac surgery[J]. Circulation, 1999, 100(10)∶1043-1049.
[19] Fleisher LA, Beckman JA, Brown KA,et al. ACC/AHA 2007 guidelines on perioperative cardiovascular evaluation and care for noncardiac surgery∶ executive summary∶ A report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines (Writing Committee to Revise the 2002 Guidelines on Perioperative Cardiovascular Evaluation for Noncardiac Surgery)∶ developed in collaboration with the American Society of Echocardiography, American Society of Nuclear Cardiology, Heart Rhythm Society, Society of Cardiovascular Anesthesiologists, Society for Cardiovascular Angiography and Interventions, Society for Vascular Medicine and Biology, and Society for Vascular Surgery[J]. Circulation,2007, 116(17)∶ 1971-1996.
[20] Levy D, Labib SB, Anderson KM,et al. Determinants of sensitivity and specificity of electrocardiographic criteria for left ventricular hypertrophy[J]. Circulation, 1990, 81(3)∶ 815-820.
[21] Hanis CL, Redline S, Cade BE,et al. Beyond type 2 diabetes,obesity and hypertension∶ an axis including sleep apnea, left ventricular hypertrophy, endothelial dysfunction, and aortic stiffness among Mexican Americans in Starr County, Texas[J].Cardiovasc Diabetol, 2016, 15∶ 86.
[22] Kosiolova NA, Shatunova IM. Clinical Value of Left Ventricular Hypertrophy in Arterial Hypertension[J]. Kardiologiia, 2015,55(8)∶ 62-67.
[23] Rohde LE, Polanczyk CA, Goldman L,et al. Usefulness of transthoracic echocardiography as a tool for risk stratification ofpatients undergoing major noncardiac surgery[J]. Am J Cardiol,2001, 87(5)∶ 505-509.
[24] Stanton T, Dunn FG. Hypertension, left ventricular hypertrophy,and myocardial ischemia[J]. Med Clin North Am, 2017, 101(1)∶29-41.
[25] Lazzeroni D, Rimoldi O, Camici PG. From left ventricular hypertrophy to dysfunction and failure[J]. Circ J, 2016, 80(3)∶555-564.
[26] Tanoue MT, Kjeldsen SE, Devereux RB,et al. Relationship of diastolic function to new or persistent electrocardiographic left ventricular hypertrophy[J]. Blood Press, 2016, 25(6)∶ 364-372.
[27] Jameel MN, Zhang J. Myocardial energetics in left ventricular hypertrophy[J]. Curr Cardiol Rev, 2009, 5(3)∶ 243-250.
[28] Gao C, Yang D. Electrical inhomogeneity in left ventricular hypertrophy[J]. Cell Biochem Biophys, 2014, 69(3)∶ 399-404.
[29] Flu WJ, van Kuijk JP, Hoeks SE,et al. Prognostic implications of asymptomatic left ventricular dysfunction in patients undergoing vascular surgery[J]. Anesthesiology, 2010, 112(6)∶ 1316-1324.
[30] Healy KO, Waksmonski CA, Altman RK,et al. Perioperative outcome and long-term mortality for heart failure patients undergoing intermediate- and high-risk noncardiac surgery∶impact of left ventricular ejection fraction[J]. Congest Heart Fail, 2010, 16(2)∶ 45-49.
[31] Saito S, Takagi A, Kurokawa F,et al. Usefulness of tissue Doppler echocardiography to predict perioperative cardiac events in patients undergoing noncardiac surgery[J]. Heart Vessels, 2012,27(6)∶ 594-602.
[32] Cho DH, Park SM, Kim MN,et al. Presence of preoperative diastolic dysfunction predicts postoperative pulmonary edema and cardiovascular complications in patients undergoing noncardiac surgery[J]. Echocardiography, 2014, 31(1)∶ 42-49.
[33] Rossi E, Citterio F, Vescio MF,et al. Risk stratification of patients undergoing peripheral vascular revascularization by combined resting and dipyridamole echocardiography[J]. Am J Cardiol,1998, 82(3)∶ 306-310.
[34] Malik SB, Chen N, Parker RA 3rd,et al. Transthoracic echocardiography∶ pitfalls and limitations as delineated at cardiac CT and MR imaging-erratum[J]. Radiographics, 2017,37(3)∶ 1004.
[35] Piccione MC, Zito C, Trio O,et al. The diagnostic challenge of dipyridamole-atropine stress echocardiography in a patient with myocardial bridge[J]. J Cardiovasc Echogr, 2016, 26(4)∶ 120-122.
[36] Deery SE, Shean KE, Wang GJ,et al. Female sex independently predicts mortality after thoracic endovascular aortic repair for intact descending thoracic aortic aneurysms[J]. J Vasc Surg,2017, 66(1)∶ 2-8.
[37] Engelbertz C, Reinecke H, Breithardt G,et al. Two-year outcome and risk factors for mortality in patients with coronary artery disease and renal failure∶ The prospective, observational CADREF Registry[J]. Int J Cardiol, 2017, 243∶ 65-72.
[38] Brakoniecki K, Tam S, Chung P,et al. Mortality in patients with end-stage renal disease and the risk of returning to the operating room after common General Surgery procedures[J]. Am J Surg,2017, 213(2)∶ 395-398.
[39] Gaber AO, Moore LW, Aloia TA,et al. Cross-sectional and casecontrol analyses of the association of kidney function staging with adverse postoperative outcomes in general and vascular surgery[J]. Ann Surg, 2013, 258(1)∶ 169-177.

