孕激素对人子宫内膜样癌JEC细胞ER亚型、PR亚型及p57kip2表达的影响
刘蒙蒙,孙小杰,周正平,袁 丹,刘俊江
(1.遵义医学院 病理学教研室,贵州 遵义 563099;2.滨州市人民医院 病理科,山东 滨州 256610;3.遵义医学院 基础医学院电镜室,贵州 遵义 563099)
子宫内膜癌是女性最常见的恶性肿瘤之一,在西方发达国家高居女性恶性肿瘤之首[1]。目前在发展中国家,由于人群平均寿命的延长以及激素替代疗法的广泛应用,子宫内膜癌的发病率也呈上升趋势[2]。子宫内膜癌按流行病学特征、临床特点等分为 I型(雌激素依赖型)、II型(非雌激素依赖型),I型主要病理学类型为子宫内膜样癌(endometrioid carcinoma,EC),属于雌激素依赖性肿瘤,其发病因素与长期缺乏孕激素对抗的高水平雌激素刺激密切相关。孕激素可通过与孕激素受体(progesterone receptor,PR)结合后,下调雌激素受体(estrogen receptor,ER)的表达,对抗ER介导的雌激素促进细胞增殖的作用,使增生的子宫内膜向分泌期转化,从而避免子宫内膜癌的发生与发展[3-6]。
在哺乳动物体内,细胞在正常细胞周期的调控下有序增殖,一旦细胞周期调控紊乱,则引起细胞无序增殖,甚至导致肿瘤的发生。通过各种正负调控因子的协同调节,细胞周期得以正常进行。其中,细胞周期蛋白依赖性激酶抑制因子(cyclin-dependent kinase inhibitors,CKI)是细胞周期进程的负调控因子,包括两大家族,其中Cip/Kip家族包括p57kip2、p21kip1、p27kip1[7]。p57kip2被最晚发现,在许多肿瘤中表达降低[8-10],但目前在子宫内膜癌中的研究较少。本研究拟通过对体外培养的JEC细胞(中分化EC细胞)进行孕激素干扰后,用MTT法观察JEC细胞的生长曲线,在光镜、电镜下观察JEC细胞的生长情况及超微结构变化,用免疫蛋白印迹(Western Blot,WB)法检测JEC细胞中ER亚型、PR亚型及p57kip2蛋白的表达,以探讨孕激素对细胞周期进程的干扰调控,以及对EC发展的影响。
1 材料与方法
1.1 细胞株 人EC中分化JEC细胞株(遵义医学院微生物学教研室)。
1.2 主要试剂 孕酮购于北京华迈科公司,MTT粉剂购于北京Solarbio公司,WB相关试剂购于上海碧云天生物研究所,鼠抗人β-actin单克隆抗体购于上海碧云天生物研究所,ER两种亚型、PR两种亚型、p57kip2鼠抗人单克隆抗体购于美国SantaCruz公司,荧光山羊抗鼠抗体购于美国LI-COR公司。
1.3 主要仪器 倒置显微镜(CKX41SF)购于日本OLYMPUS公司,透射电子显微镜(H-7650)购于日本日立公司,超薄切片机(EM UC6)购于德国Leica公司,酶标仪购于美国Thermo Fisher公司。
1.4 方法
1.4.1 实验分组 每90 mL RPMI-1640培养基中加入10 mL胎牛血清、1 mL双抗(青霉素、链霉素混合液),制成完全培养基。实验组:将P以3种不同浓度(10-4mol/L,10-6mol/L,10-8mol/L)加入完全培养基,对JEC细胞进行培养(37 ℃、5%CO2、饱和湿度)。对照组:用不含药物的等量培养基对JEC细胞进行培养。
1.4.2 MTT法观察各组细胞的增殖情况 将培养的JEC细胞制成单细胞悬液后接种于96孔板,设空白组、对照组、实验组,其中空白组只加不含细胞的等量完全培养基。24 h后PBS冲洗各孔,对照组加入100 μL完全培养基,实验组分别加入100 μL高、中、低不同浓度的P溶液,继续培养。分别在培养24、48、72、96 h后,PBS冲洗各孔,每孔加20 μL MTT溶液,再培养4 h后,每孔加100 μL二甲基亚砜,震荡10 min后用酶标仪测各孔的OD值。实验重复3次。
1.4.3 倒置显微镜观察各组细胞的形态及生长情况 将培养的JEC细胞制成1×106个/mL的单细胞悬液后接种于6孔板,设对照组、实验组,将6孔板放入细胞培养箱中培养24 h,PBS冲洗各孔,实验各组分别加入等量不同浓度的P溶液分别培养,于培养24、48、72 h后在倒置显微镜下观察JEC细胞的生长情况。实验重复3次。
1.4.4 透射电镜观察各组细胞的超微结构变化 各组JEC细胞分别培养,通过酶消化、离心成细胞团,加入固定液固定,经脱水、浸透、包埋聚合,用超薄切片机进行超薄切片、电子染色,然后在透射电镜下进行观察。
1.4.5 WB法检测各组细胞中ER亚型、PR亚型及p57kip2蛋白的表达 JEC细胞按照实验分组分别进行培养,于培养24、48、72 h后,分别提取各组细胞总蛋白,检测所提蛋白浓度。按照配胶说明书配制分离胶,待分离胶完全凝好后,配制浓缩胶并插入梳子。拔出梳子,加入电泳液,在第一个孔加入彩色预染蛋白质分子量标准,其余各孔分别加入相应蛋白样品。80V电压下电泳约15 min,120 V电压下电泳约50 min。切下目的蛋白所在区域的凝胶后,220 mA电流下转膜约110 min。室温封闭约2 h后,将膜取出放入配好的相应一抗稀释液中(p57kip2、ERα、ERβ、PR-A、PR-B单克隆抗体稀释比例均为1∶200,β-actin单克隆抗体稀释比例为1∶1 000),4 ℃摇床上过夜。用TBS溶液洗膜2次,TBST溶液洗膜1次,每次约10 min。把膜放入二抗稀释液(稀释比例为1∶10 000)中,室温下避光约2 h。再次洗膜,扫描成像后测各组条带OD值。
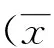
2 结果
2.1 各组细胞的增殖情况 相同实验分组比较:随着药物作用时间的延长,对照组与P各浓度组JEC细胞均逐渐增殖,各时间段之间比较,差异均有统计学意义(P<0.05)。
相同作用时间比较:与对照组JEC细胞比较,P低、中浓度组细胞的增殖能力增强,高浓度组的增殖能力减弱,其中低、高浓度组分别与对照组之间比较,高浓度组分别与低、中浓度组之间比较,差异均有统计学意义(P<0.05)(见表1,图1)。
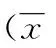

组别24h48h72h96h对照12.69±0.4318.83±0.6227.92±0.2031.44±0.84P低浓度▲※13.37±0.0921.03±1.1030.05±1.1733.05±0.44P中浓度※13.23±0.4220.06±1.0629.08±1.6032.10±0.73P高浓度▲11.60±0.2416.78±1.2924.76±0.8429.11±0.27
▲与对照组比较,※与高浓度组比较,P<0.05。
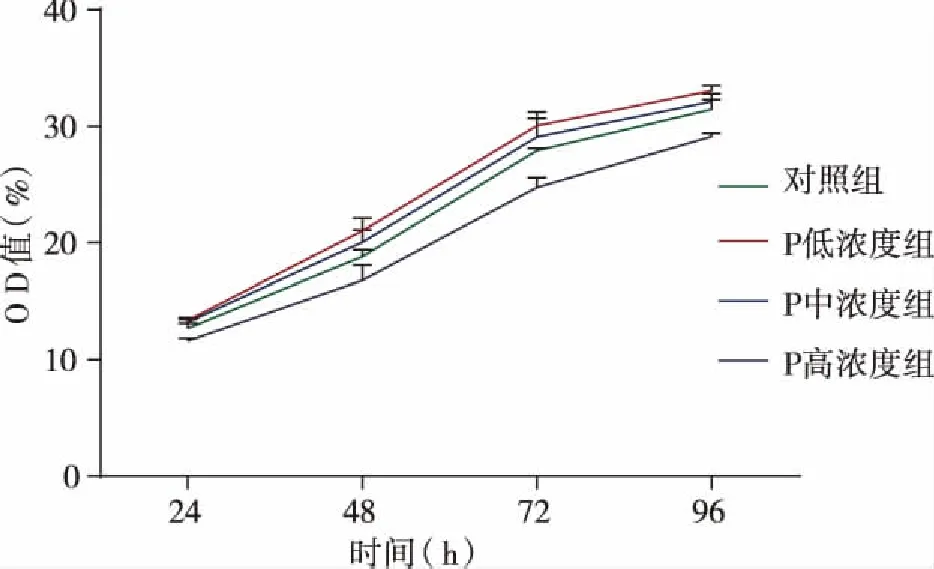
图1 MTT法检测P干扰JEC细胞的生长曲线
2.2 各组细胞的形态及生长情况 培养72 h后,对照组JEC细胞呈多边形、长梭形、不规则形,局部细胞围成腺腔样结构;随着培养时间的增加,细胞密度逐渐增大,且伴少量细胞凋亡。与对照组比较,P干扰后低、中浓度组细胞密度略有增大,高浓度组则明显减小;各组细胞的形态未见明显改变(见图2)。
2.3 各组细胞的超微结构变化 培养72 h后,对照组JEC细胞形态以圆形或椭圆形为主,表面可见微绒毛,细胞内可见内质网、线粒体等细胞器,还可见分泌泡、次级溶酶体等结构,核呈不规则形,核仁明显。与对照组比较,P各浓度组胞质内均可见自噬现象,中浓度组细胞表面微绒毛出现体积增大、融合等形态改变,高浓度组细胞表面微绒毛及胞质内分泌泡均增多(见图3~6)。

A:对照组;B:P低浓度组;C:P中浓度组;D:P高浓度组。图2 P干扰 JEC细胞72 h后的生长情况(×100)
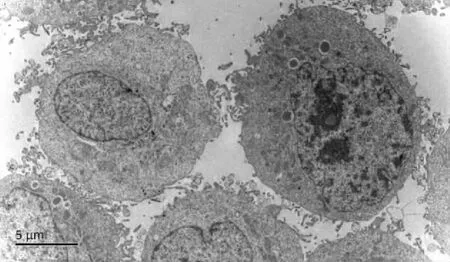
Bar=5.0 μm。图3 JEC细胞对照组72 h时的超微结构变化

可见自噬现象(↑),A,B:Bar=5.0 μm,2.0 μm。图4 JEC细胞P低浓度组72 h时的超微结构变化

可见微绒毛肿胀、融合(↑↑),分泌泡增多(▲),Bar=5.0 μm。图5 JEC细胞P中浓度组72 h时的超微结构变化

分泌泡增多(▲),A,B:Bar=5.0μm,2.0μm。图6 JEC细胞P高浓度组72 h时的超微结构变化
2.4 各组细胞中ER亚型、PR亚型及p57kip2蛋白的表达情况
2.4.1 P干扰后,对照组及各浓度组JEC细胞均无ERα、PR-A、PR-B蛋白的表达(见表2,图7)。
2.4.2 随着P干扰浓度的增高,在24、72 h时,ERβ蛋白表达逐渐增加,在48 h时,ERβ蛋白在高浓度组表达最高,在中浓度组表达最低,但仅72 h各实验组与对照组之间表达差异比较有统计学意义(P<0.05)。随着P干扰时间的延长, ERβ蛋白在高浓度组表达逐渐增高,在低、中浓度组以72 h表达最高、 48 h表达最低,但仅高浓度组在24 h与72 h之间表达差异比较有统计学意义(P<0.05),中浓度组在24 h与72 h、48 h与72 h之间表达差异比较有统计学意义(P<0.05)(见表2,图7)。
2.4.3 随着P干扰浓度的增高,p57kip2蛋白表达增高,但仅在48 h,中、高浓度组分别与对照组之间,高浓度组与低浓度组之间表达差异比较有统计学意义(P<0.05);在72 h,高浓度组与对照组之间表达差异比较有统计学意义(P<0.05)。随着P干扰时间的延长,p57kip2蛋白在各组表达均逐渐增高,但仅高浓度组在24 h与48 h、24 h与72 h之间表达差异比较有统计学意义(P<0.05)(见表2,图7)。
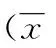

时间组别ERβp57kip2ERαPR-APR-B24h对照 3.90±0.6515.73±0.64---低浓度3.94±0.4115.40±0.24---中浓度3.94±0.6115.64±0.87---高浓度4.12±0.45★15.70±0.88△---48h对照 3.87±1.4615.45±0.78---低浓度3.86±0.3515.99±0.28---中浓度3.80±1.5416.53±0.56▽---高浓度5.54±0.9517.03±0.38◆---72h对照 3.17±0.3515.40±1.16---低浓度4.85±0.42▲16.23±0.98---中浓度5.00±0.56▲※16.65±0.61---高浓度5.82±0.99▲17.23±0.54#---
★与72 h高浓度组比较;※与24、48 h中浓度组比较;▲与72 h对照组比较;△与48、72 h高浓度组比较;◆与48 h对照组、低浓度组比较;▽与48 h对照组比较;#与72 h对照组比较,P<0.05。

(孕酮干预24 h) (孕酮干预48 h) (孕酮干预72 h)A:对照组;B:P低浓度组;C:P中浓度组;D:P高浓度组。图7 WB检测P干预JEC细胞后ERα、ERβ、PR-A、PR-B、 p57kip2蛋白的表达
2.5 P干扰后JEC细胞中ERβ、p57kip2蛋白表达的相关性分析 Pearson相关性分析结果,P=0.094>0.05, ERβ蛋白与p57kip2蛋白表达之间尚不能认为有相关关系。
3 讨论
基于孕激素对子宫内膜的调控作用,孕激素的激素疗法已经广泛应用于治疗子宫内膜增生和高分化子宫内膜癌。尤其对于有生育要求的早期子宫内膜癌患者,孕激素治疗成为子宫内膜癌的主要内分泌治疗方法[11]。Wang等[12]研究发现,对于早期子宫内膜癌患者,行宫腔镜电切术联合口服醋酸甲地孕酮治疗,在患者完全缓解后可自然受孕并生育健康婴儿。Mitsuhashi等[13]研究发现,子宫内膜癌患者经醋酸甲羟孕酮联合二甲双胍治疗后,其复发率降低。本研究结果显示,P在低、中浓度时,对JEC细胞增殖有一定促进作用,部分细胞表面微绒毛出现不同程度肿胀、融合等形态改变;高浓度时,则对JEC细胞的增殖有抑制作用,细胞表面微绒毛稍有增多,部分细胞胞质内分泌泡明显增多。提示P对JEC细胞具有双重调控作用,其浓度较低时有一定促进细胞生长的作用,使细胞分化向较差的方向发展;其浓度较高时则可抑制细胞的生长,使细胞分化向较好的方向发展。
ER、PR是女性内分泌调控过程中最重要的两种激素受体,在人体许多组织中有表达。孕激素与PR结合后,可抑制ER的合成,破坏ER的稳定性,加快ER及雌激素在人体内的降解,使体内ER及雌激素水平下降,ER功能减弱,以对抗雌激素促进细胞增殖的作用[14]。在哺乳动物中,ER 主要有ERα、ERβ两种亚型,二者结构相似,功能上存在差异。目前研究认为,ERα可与雌二醇结合后促进细胞增殖,ERβ则可抑制细胞的增殖,且能抑制ERα的功能,但也有研究发现,在没有ERα表达的情况下,ERβ可促进乳腺癌细胞增殖转移[15]。且有研究发现,ERα表达下降和ERβ的表达上调可能提示食管鳞状细胞癌患者的不良预后[16]。因此,关于ERα和ERβ在肿瘤中的作用目前还存在一定争议。此外,许多研究表明,ERα和ERβ在子宫内膜癌中的表达也有异常[17-18]。PR主要有PR-A、PR-B两种亚型,二者在同一正常组织中往往均有表达,但从正常组织到恶性变的过程中,会出现PR-A、PR-B的表达失衡。Yu等[19]通过免疫组化法(S-P法)检测不同子宫内膜组织中的表达,发现PR在子宫内膜癌组织中表达最低,在不典型增生组织中表达较高,在正常子宫内膜组织中表达最高。因此推测,PR表达降低与子宫内膜癌的发生、发展有关。Kavlashvili等[20]研究发现,在体外培养的子宫内膜癌细胞中,孕激素可上调PR基因与蛋白的表达。本课题组前期通过对人子宫内膜不同病变组织的研究发现,ER、PR蛋白在EC组织中表达最低,在子宫内膜增生性病变组织中表达最高[21],推测与孕激素的调控有关,也可能与ER、PR亚型在子宫内膜癌中的不同表达有关。本研究显示,随着P作用浓度的增高、作用时间的延长,各组细胞ERβ蛋白表达均有增高趋势;对照组及P各浓度组JEC细胞均无ERα、PR-A、PR-B蛋白表达。提示P可能通过上调JEC细胞中ERβ蛋白的表达,促进细胞的生长;JEC细胞为 ERα、PR-A、PR-B蛋白表达均缺失的细胞株,且P不能诱导其表达。
p57kip2作为CKI中Cip/Kip家族中的一员,可以更广泛的抑制cyclin-CDK复合物的活性,阻滞细胞从G1期向S期过渡,负向调控细胞周期,以达到抑制肿瘤细胞恶性增殖的效果[22]。目前研究发现,p57kip2在乳腺癌、肝癌、肺癌等许多肿瘤中表达降低,且与肿瘤细胞的增殖、转移等有关,被认为是一种重要的肿瘤抑制基因[8-10]。研究发现,孕激素可通过调节多种细胞周期蛋白,使细胞周期停滞在G1/S期,并可上调CKI、p21kip1、p27kip1以及抑癌基因p53的表达,从而发挥抑制子宫内膜癌细胞增殖的作用[23]。Kim等[24]研究发现,p57kip2蛋白在分泌期子宫内膜细胞中表达较高,在子宫内膜癌细胞中表达较低;且孕激素可上调子宫内膜癌细胞中p57kip2mRNA的表达水平。本课题组前期研究发现,p57kip2在EC组织中的表达低于在分泌期子宫内膜组织中的表达[21],推测p57kip2在EC中的表达可能受到孕激素的调控。本研究发现,随着P作用浓度的增高、作用时间的延长,各组细胞p57kip2蛋白的表达均有增高趋势。提示随着P作用浓度的增高、作用时间的延长,可能通过诱导JEC细胞中p57kip2蛋白的表达逐渐增加,发挥负向调控细胞周期进程的作用,从而抑制肿瘤细胞生长。
综上所述, P可上调JEC细胞中ERβ、p57kip2蛋白的表达。P浓度较低时,JEC细胞中ERβ、p57kip2蛋白的表达均有所增加,但可能以ERβ蛋白促细胞生长的作用为主,促进JEC细胞增殖,使细胞向更差的分化方向发展;浓度较高时则可能以p57kip2蛋白阻滞细胞周期进程的作用为主导,抑制JEC细胞增殖,使细胞向较好的分化方向发展。JEC细胞中ERα、PR-A、PR-B蛋白均无表达,且P干扰刺激也不能诱导其表达,因此推测孕激素可能通过ERβ,而不是通过ERα、PR-A、PR-B对JEC细胞发挥调控作用。提示联合检测ERα、ERβ、PR-A、PR-B、p57kip2蛋白在EC中的表达情况,更有利于评估EC的发生发展。
[1] Kajo K,Vallová M,Biró C.Molecular pathology of endometrial carcinoma - a review[J].Cesk Patol,2015,51(2):65-73.
[2] Binder P S,Mutch D G.Update on prognostic markers for endometrial cancer[J].Womens Health (Lond),2014,10(3):277-288.
[3] 李继俊.妇产科内分泌治疗学[M].第3版.北京:人民军医出版社,2014:65-79.
[4] Pautier P,Vergote I,Joly F,et al.A Phase 2,randomized,open-label study of irosustat versus megestrol acetate in advanced endometrial cancer[J].Int J Gynecol Cancer,2017,27(2):258-266.
[5] Baek J S,Lee W H,Kang W D,et al.Fertility-preserving treatment in complex atypical hyperplasia and early endometrial cancer in young women with oral progestin:Is it effective? [J].Obstet Gynecol Sci,2016,59(1):24-31.
[6] Bokhari A A ,Lee L R ,Raboteau D,et al.Progesterone potentiates the growth inhibitory effects of calcitriol in endometrial cancer via suppression of CYP24A1[J].Oncotarget,2016,7(47):77576-77590.
[7] Whittaker S R,Mallinger A,Workman P,et al.Inhibitors of cyclin-dependent kinases as cancer therapeutics[J].Pharmacol Ther,2017,7258(17):30022-30030.
[8] Yang C,Nan H,Ma J,et al.High Skp2/Low p57kip2 expression is associated with poor prognosis in human breast carcinoma[J].Breast Cancer:Basic and Clinical Research,2015,9(Suppl 1):13-21.
[9] Guo H,Li Y,Tian T,et al.The role of cytoplasmic p57 in invasion of hepatocellular carcinoma[J].BMC Gastroenterol,2015,15:104.
[10]Sun C C,Li S J,Li G,et al.Long intergenic noncoding RNA 00511 acts as an oncogene in non-small-cell Lung Cancer by binding to EZH2 and suppressing p57[J]. Mol Ther Nucleic Acids,2016,5(11):e385.
[11]Chen M,Jin Y,Li Y,et al.Oncologic and reproductive outcomes after fertility-sparing management with oral progestin for women with complex endometrial hyperplasia and endometrial cancer[J].Int J Gynaecol Obstet,2016,132(1):34-38.
[12]Wang Q,Guo Q,Gao S,et al.Fertility-conservation combined therapy with hysteroscopic resection and oral progesterone for local earlystage endometrial carcinoma in young women[J].Int J Clin Exp Med,2015,8(8):13804-13810.
[13]Mitsuhashi A,Sato Y,Kiyokawa T,et al.Phase II study of medroxyprogesterone acetate plus metformin as a fertility-sparing treatment for atypicalendometrial hyperplasia and endometrial cancer[J].Ann Oncol,2016,27(2):262-266.
[14]徐丛剑.妇科肿瘤内分泌学[M].北京:人民军医出版社,2008:94-99.
[15]查中青,元敏,吴巧胜,等.雌激素受体β表达对于乳腺癌细胞生长特性及内分泌治疗的影响[J].中国现代医学杂志,2013,23(31):18-22.
[16]Dong J,Jiang S W,Niu Y,et al.Expression of estrogen receptor α and β in esophageal squamous cell carcinoma[J].Oncol Rep,2013,30(6):2771-2776.
[17]Jarzabek K,Koda M,Walentowicz-Sadlecka M,et al.Altered expression of Ers,aromatase,and COX2 connected to estrogen action in type 1 endometrial cancer biology [J].Tumour Biol,2013,34(6):4007-4016.
[18]Wik E,Raeder M B,Krakstad C,et al.Lack of estrogen receptor-alpha is associated with epithelial-mesenchymal transition and PI3K alterations in endometrial carcinoma [J].Clin Cancer Res,2013,19(5):1094-1105.
[19]Yu C G,Jiang X Y,Li B,et al.Expression of ER,PR,C-erbB-2 and Ki-67 in Endometrial Carcinoma and their relationships with the clinicopathological features[J].Asian Pac J Cancer Prev,2015,16(15):6789-6794.
[20]Kavlashvili T,Jia Y,Dai D,et al.Inverse relationship between progesterone receptor and Myc in endometrial cancer[J].Plos One,2016,11(2):148912.
[21]罗祖强,周正平,格桑志玛,等.子宫内膜癌及不同子宫内膜病变组织中p57kip2、ER、PR的表达及意义[J].临床与实验病理学杂志,2013,29(9):982-985.
[22]Pateras I S,Apostolopoulou K,Niforou K,et al.p57kip2:“Kip”ing the cell under control [J].Mol Cancer Res,2009,7(12):1902-1919.
[23]Lee L R,Teng P N,Nguyen H,et al.Progesterone enhances calcitriol antitumor activity by upregulating vitamin D receptor expression and promoting apoptosis in endometrial cancer cells[J].Cancer Prev Res (Phila),2013,6(7):731-743.
[24]Kim S T,Lee S K,Gye M C.Cyclic changes in the expression of p57(kip2) in human endometrium and its regulation by steroidhormones in endometrial stromal cells in vitro[J].Reprod Sci,2012,19(1):92-101.

