空心莲子草多糖不同提取工艺的优化与比较
彭浩,王贤,温晓鸣,秦宏伟,王晓强,宋文路,*
(1.济宁学院生命科学与工程系,山东曲阜273155;2.青岛大学基础医学院,山东青岛 266071)
空心莲子草 (Alternanthera philoxeroides(Mart.)Griseb)是多年生草本植物,属于苋科(Amaranthaceae)莲子草属(Alternanthera)。空心莲子草性味甘寒无毒,具有凉血、清热、解毒的功效。目前已于空心莲子草中分离得到多糖、皂苷、蒽醌、有机酸、萜、甾醇、生物碱、内酰胺、无机盐和氨基酸等多种化学成分[1-6]。
多糖作为构成生命的四大基础物质之一,广泛存在于植物,动物及微生物中。目前植物多糖已发掘出其抗氧化活性、免疫调节活性和抗肿瘤活性等作用[7-9]。植物多糖的传统提取方法为水提法。近年来,随着新兴提取技术的快速发展,超声波辅助法、酶法、微波辅助法[10-12]等在植物多糖的提取中得到了应用。由于植物多糖的复杂性和多样性,单一的提取方法可能达不到最好的效果,故使用多种方法进行协同提取,如超声-微波法,超声-酶法,微波-酶法等[13-15],利用其各自优势使多糖提取率得到提升。
超声波是一种能够产生并传递强大能量的弹性波,能使物质中分子加速运动,有利于植物细胞中的有效成分转移、扩散及提取[16-17];纤维素是植物细胞壁的主要成分,亦是胞内多糖等大分子溶出的主要屏障,利用纤维素酶水解细胞壁,更加有利于胞内成分的溶出[18]。因此,分别采用超声波辅助法(utrasonicassisted extraction,UAE)、酶法(enaymatic extraction,EE)、超声-酶法协同法(ultraaonic-assisted enzymatic extraction,UAE-EE)从空心莲子草植株中提取多糖,利用响应面法优化提取工艺,考察并比较不同提取方法对多糖提取率的影响,为空心莲子草多糖(Alternanthera philoxeroides(Mart.)Griseb polysaccharides,APPs)的开发和利用提供理论依据。
1 材料与方法
1.1 材料与试剂
空心莲子草:5月份采集于山东省济宁市南四湖区域,并经济宁学院生命科学与工程系李彦连副教授鉴定为苋科莲子草属植物空心莲子草(Alternanthera philoxeroides(Mart.)Griseb)的植株。纤维素酶(25 000 U/g):生工生物工程(上海)股份有限公司;葡萄糖:天津市大茂化学试剂厂;无水乙醇、苯酚:天津市富宇精细化工有限公司;浓硫酸:烟台市双双化工有限公司(均为分析纯)。
1.2 仪器与设备
DC-2000低温恒温槽:上海横平仪器厂;T6新世纪紫外可见光分光光度计:北京普析通用仪器有限责任公司;FN2004电子天平:上海民桥精密科学仪器有限公司;KQ-250DE型医用数控超声波清洗器:昆山市超声仪器有限公司;RE-52AA旋转蒸发仪:上海亚荣生化仪器有限公司;TGL16高速冷冻离心机:长沙英泰仪器有限公司;DHG9070电热鼓风干燥箱:上海琅玕试验设备有限公司;RHP-400A型高速多功能粉碎机:浙江永康市荣浩工贸有限公司。
1.3 方法
1.3.1 材料预处理
将新鲜的空心莲子草加入电热鼓风干燥箱中烘干至恒重,用高速粉碎机将其粉碎,过80目筛。空心莲子草粉末于锡箔纸包裹的广口瓶中暗处保存备用。
1.3.2 APPs提取工艺流程
称取一定量空心莲子草干粉,按液料比加入适量的去离子水,分别采用超声波处理或纤维素酶处理2 h并灭酶或纤维素酶处理2 h并灭酶后超声波处理。上述处理后,溶液于4 000 r/min离心30 min,上清液中加3倍体积无水乙醇,4℃醇沉过夜。4 000 r/min离心15 min,沉淀真空干燥,得空心莲子草粗多糖。用苯酚-硫酸光度法测多糖含量[19],计算提取率。
1.3.3 单因素试验
1.3.3.1 超声波辅助法
考察液料比、超声时间、超声功率对APPs提取率的影响,单因素试验设计如下:固定超声时间30 min、超声功率 250 W,不同液料比为 10∶1、15∶1、20∶1、25 ∶1、30 ∶1(mL/g);固定液料比 20 ∶1(mL/g)、超声功率 250 W,不同超声时间为 10、20、30、40、50 min;固定液料比 20 ∶1(mL/g)、超声时间 30 min,不同超声功率为 150、175、200、225、250 W。
1.3.3.2 酶法
考察液料比、酶量、酶解温度对APPs提取率的影响,单因素试验设计如下:固定酶解温度50℃、酶量300 U/g,不同液料比为 10 ∶1、15 ∶1、20 ∶1、25 ∶1、30 ∶1(mL/g);固定液料比 20∶1(mL/g)、酶解温度 50 ℃,不同酶量为 150、300、450、600、750 U/g;固定液料比为20 ∶1(mL/g)、酶量为 300 U/g,不同酶解温度为 40、45、50、55、60 ℃。
1.3.3.3 超声-酶协同法
考察液料比、酶量、超声时间对APPs提取率的影响,单因素试验设计如下:酶量300 U/g、超声时间20 min,不同液料比为 10 ∶1、15 ∶1、20 ∶1、25 ∶1、30 ∶1(mL/g);固定液料比 20 ∶1(mL/g)、超声时间 20 min,不同酶用量为 150、300、450、600、750 U/g;固定液料比20 ∶1(mL/g)、酶量 300 U/g,不同超声时间为 10、15、20、25、30 min。
1.3.4 Box-Behnken试验设计及响应面分析
采用中心组合试验,在单因素试验的基础上,每种提取方法分别选取3个因素为自变量,每个因素选取3个水平,以多糖提取率为响应值,采用Box-Behnken设计优化提取条件。利用Design-Expert8.0软件进行数据分析,建立三元二次回归模型。
2 结果与分析
2.1 响应面试验因素水平的确定
3种提取方法的单因素试验结果见图1~图3。
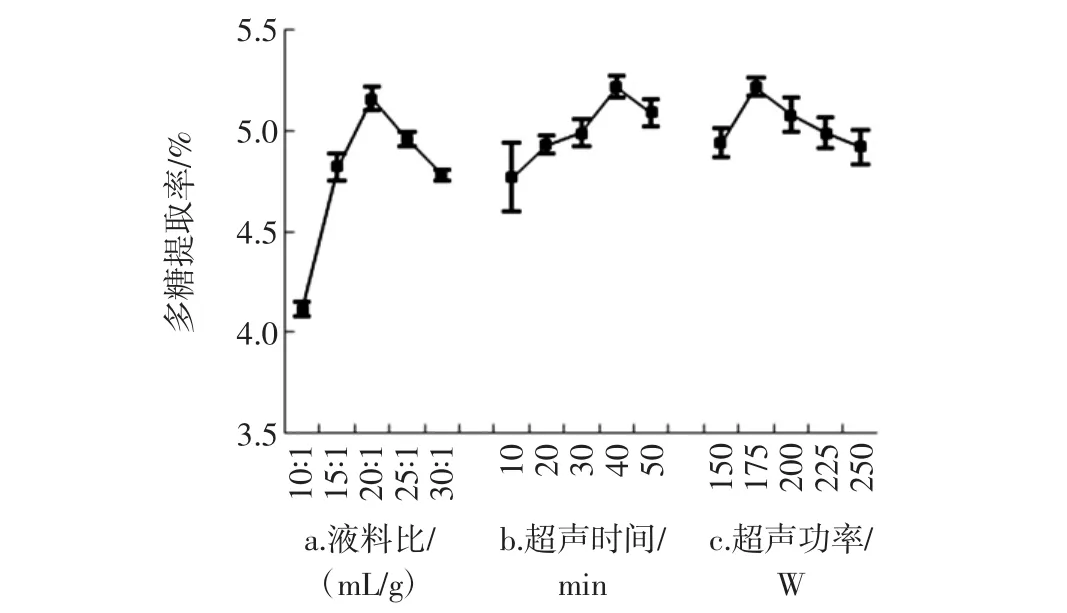
图1 超声波辅助法提取过程中不同提取参数对粗多糖提取率的影响Fig.1 Effect of different extraction parameters on APPs yields with UAE process
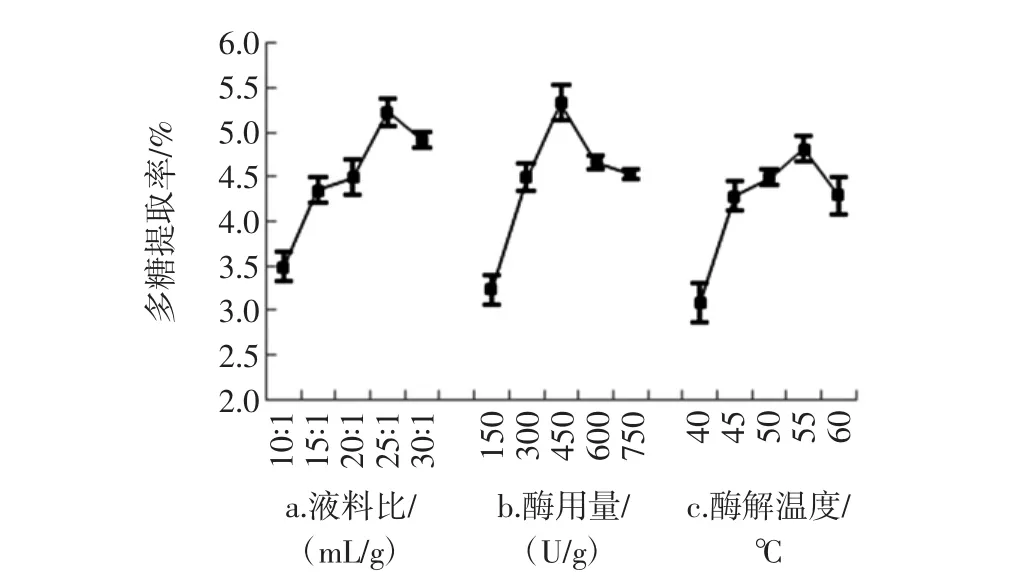
图2 酶法提取过程中不同提取参数对粗多糖提取率的影响Fig.2 Effect of different extraction parameters on APPs yields with EE process
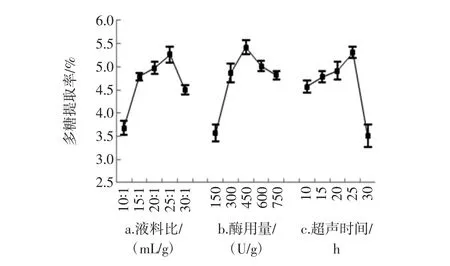
图3 超声-酶协同法提取过程中不同提取参数对粗多糖提取率的影响Fig.3 Effect of different extraction parameters on APPs yields with UAE-EE process
根据图1~图3单因素结果设计各提取方法中心组合试验的因素水平,见表1~表3。

表1 UAE法提取APPs工艺优化中心组合试验因素水平表Table 1 Factors and levels of central composite design(CCD)of UAE method for the APPs yields

表2 EE法提取APPs工艺优化中心组合试验因素水平表Table 2 Factors and levels of central composite design(CCD)of EE method for the APPs yields
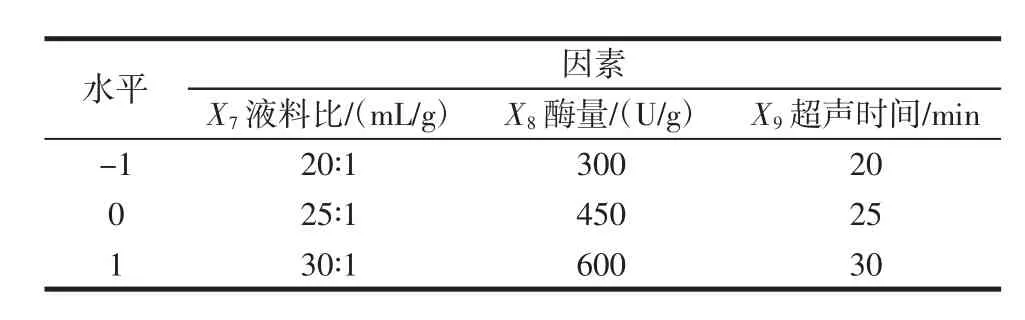
表3 UAE-EE法提取APPs工艺优化中心组合试验因素水平表Table 3 Factors and levels of central composite design(CCD)of UAE-EE method for the APPs yields
2.2 响应面试验设计与结果及方差分析
UAE法提取APPs工艺优化响应面试验设计及结果见表4,其回归模型方差分析结果见表5。

表4 UAE法提取APPs工艺优化响应面试验设计及结果Table 4 BBD matrix with response values of UAE method for the APPs yields

续表4 UAE法提取APPs工艺优化响应面试验设计及结果Continue table 4 BBD matrix with response values of UAE method for the APPs yields

表5 UAE法回归模型方差分析Table 5 Analysis of variance for the fitted quadratic polynomial model of UAE method
利用Design-Expert 8.0软件对表4试验数据进行多元回归拟合,得到回归方程:Y=5.26-0.11X1-0.050X2-0.081X3+0.14X1X2+0.28X1X3-0.070X2X3-对回归模型进行方差分析,从表5可以看出,一次项 X1,二次项和交互项 X1X2、X1X3对多糖提取率影响极显著(P<0.001)。一次项X3对提取率有显著影响(P<0.05)。其他项对提取得率影响不显著(P>0.05)。从表5可以看出,优化建立的回归模型P<0.000 1,说明回归模型达到极显著水平,方程对实际试验有较好的拟合性;相关系数R2为0.985 9,修正相关系数R2Adj为0.967 9也显示模型拟合程度较好,试验误差较小;失拟项不显著(P=0.651 1>0.05),说明非试验因素对结果的影响不大,可以用此模型对UAE法提取空心莲子草多糖进行预测分析。EE法提取APPs工艺优化响应面试验设计及结果见表6,其回归模型方差分析结果见表7。
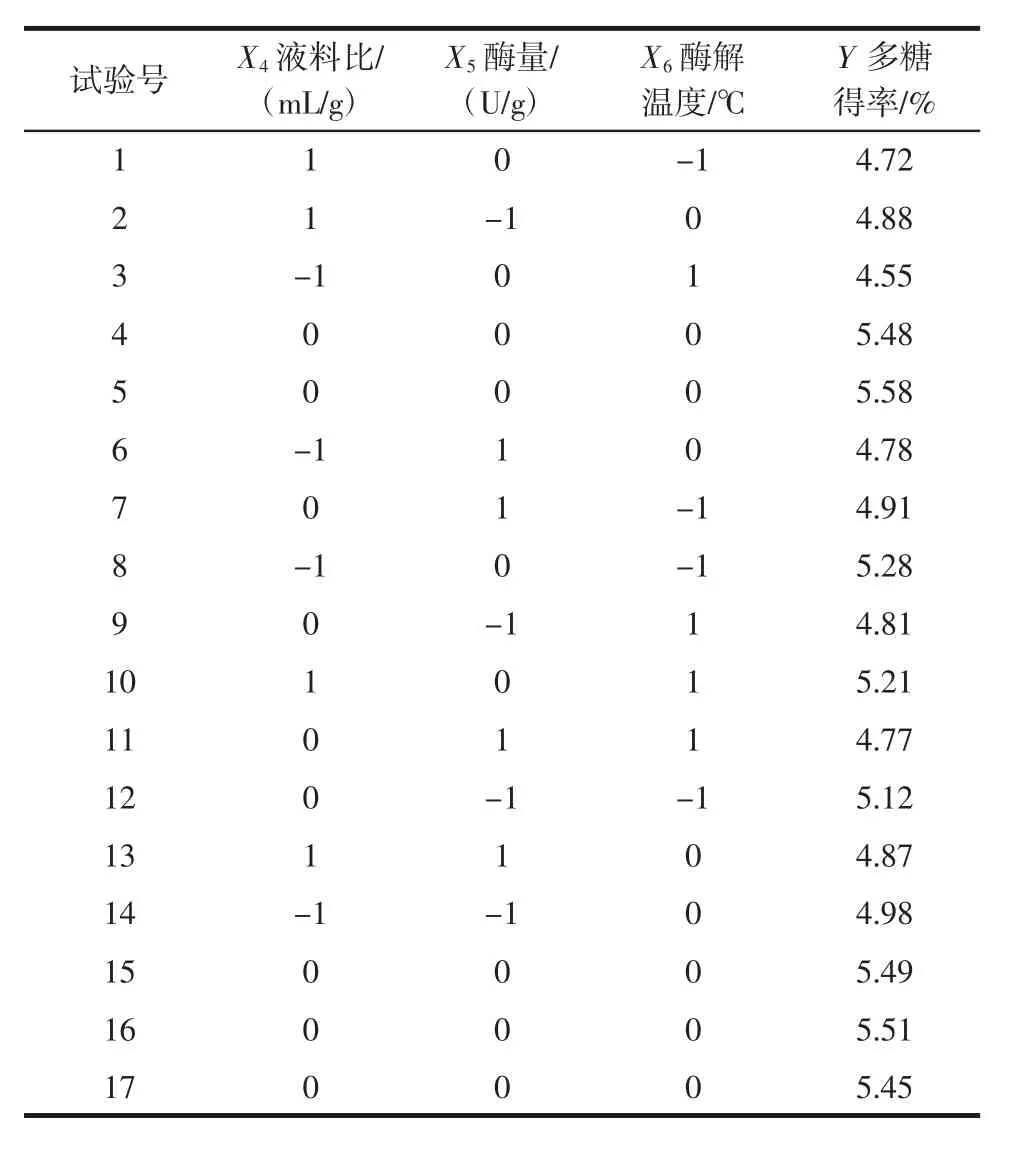
表6 EE法提取APPs工艺优化响应面试验设计及结果Table 6 BBD matrix with response values of EE method for the APPs yields
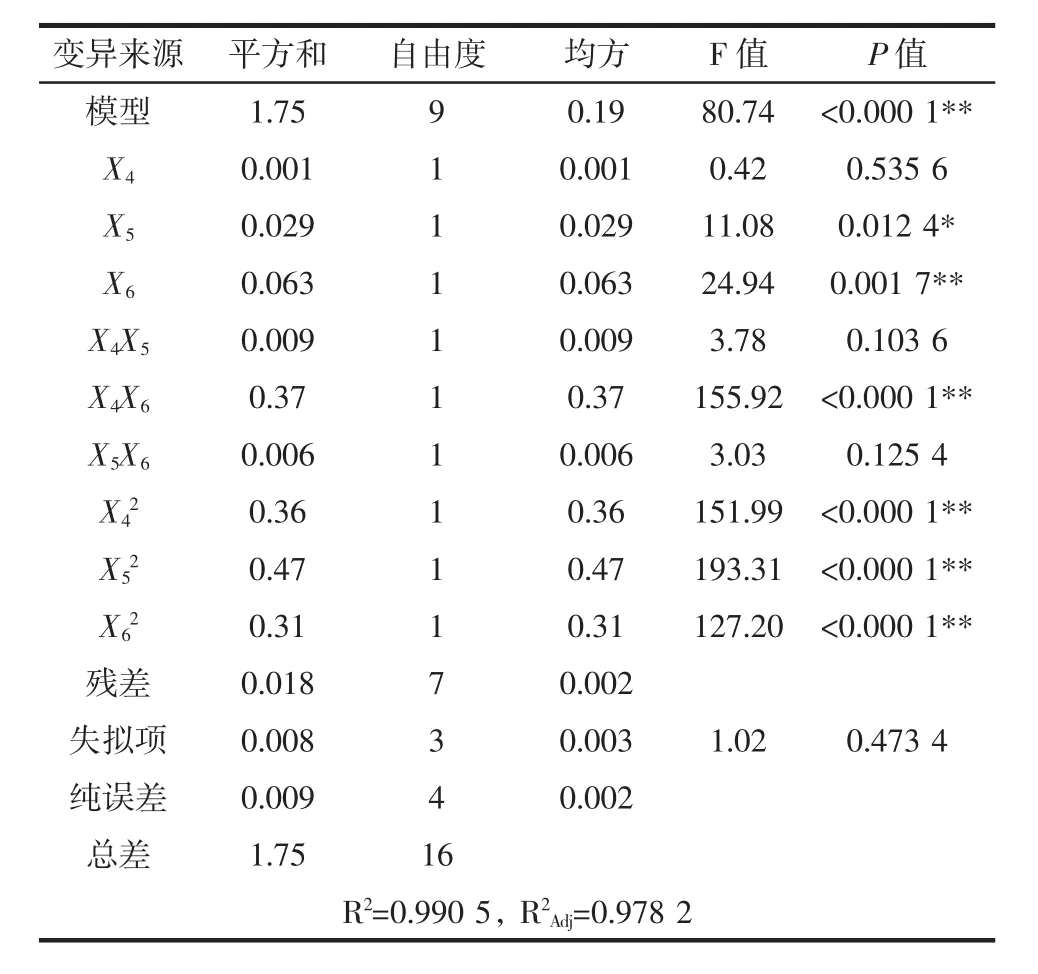
表7 EE法回归模型方差分析Table 7 Analysis of variance for the fitted quadratic polynomial model of EE method
利用Design-Expert 8.0软件对表6试验数据进行多元回归拟合,得到回归方程:Y=5.5+0.011X4-0.06X5-0.089X6+0.047X4X5+0.31X4X6+0.038X5X6-对回归模型进行方差分析,从表7可以看出,一次项 X6,二次项和交互项 X4X6对多糖提取率影响极显著(P<0.01)。一次项X5对提取率有显著影响(P<0.05)。其他项对提取得率影响不显著(P>0.05)。从表7还可以看出,优化建立的回归模型P<0.000 1,说明回归模型达到极显著水平,方程对实际试验有较好的拟合性;相关系数R2为0.990 5,修正相关系数为0.978 2也显示模型拟合程度较好,试验误差较小;失拟项不显著(P=0.473 4>0.05),说明非试验因素对结果的影响不大,可以用此模型对EE法提取空心莲子草多糖进行预测分析。UAE-EE法提取APPs工艺优化响应面试验设计及结果见表8,其回归模型方差分析结果见表9。

表8 UAE-EE法提取APPs工艺优化响应面试验设计及结果Table 8 BBD matrix with response values of UAE-EE method for the APPs yields
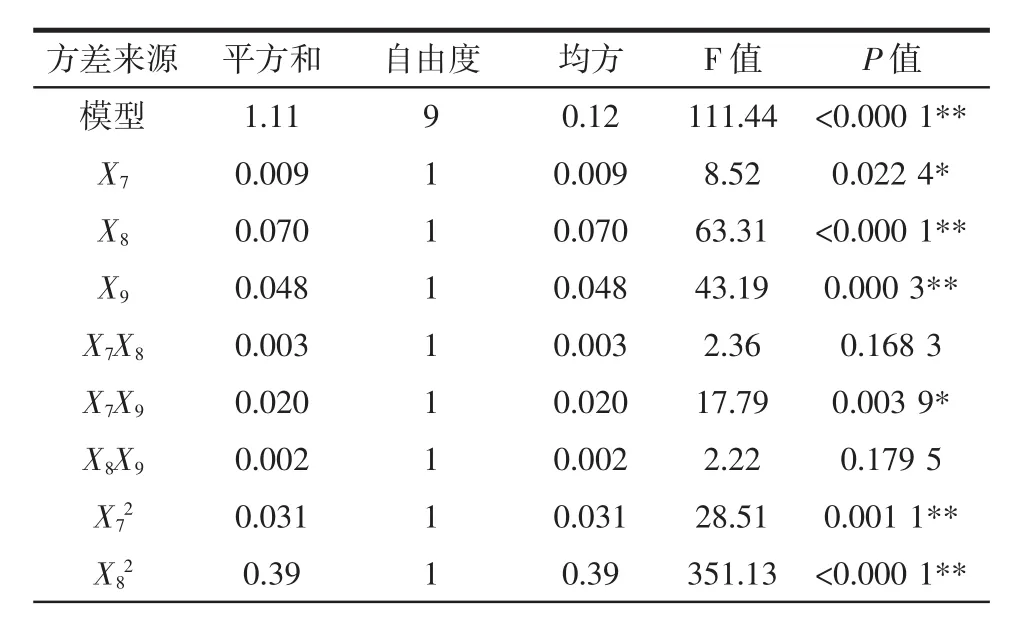
表9 UAE-EE法回归模型方差分析Table 9 Analysis of variance for the fitted quadratic polynomial model of UAE-EE method

续表9 UAE-EE法回归模型方差分析Continue table 9 Analysis of variance for the fitted quadratic polynomial model of UAE-EE method
利用Design-Expert 8.0软件对表8试验数据进行多元回归拟合,得到回归方程:Y=5.64-0.034X7+0.093X8+0.077X9+0.025X7X8-0.070X7X9-0.025X8X9-对回归模型进行方差分析,从表9可以看出,一次项 X8、X9,二次项和交互项X7X9对多糖提取率影响极显著(P<0.01)。一次项X7对提取率有显著影响(P<0.05)。其他项对提取得率影响不显著(P>0.05)。从表9还可以看出,优化建立的回归模型P<0.000 1,说明回归模型达到极显著水平,方程对实际试验有较好的拟合性;相关系数R2为0.993 1,修正相关系数为0.984 2也显示模型拟合程度较好,试验误差较小;失拟项不显著(P=0.302 5>0.05),说明非试验因素对结果的影响不大,可以用此模型对UAE-EE法提取空心莲子草多糖进行预测分析。
2.3 各试验因素的交互作用对APPs提取率的影响
通过响应面三维图可直观地反映各因素的交互作用对响应值的影响,从而确定最佳工艺范围,根据拟合模型绘制APPs提取率三维响应面图,见图4~图6。比较响应面三维图可知,在所选范围内存在极值,即响应面最高点。

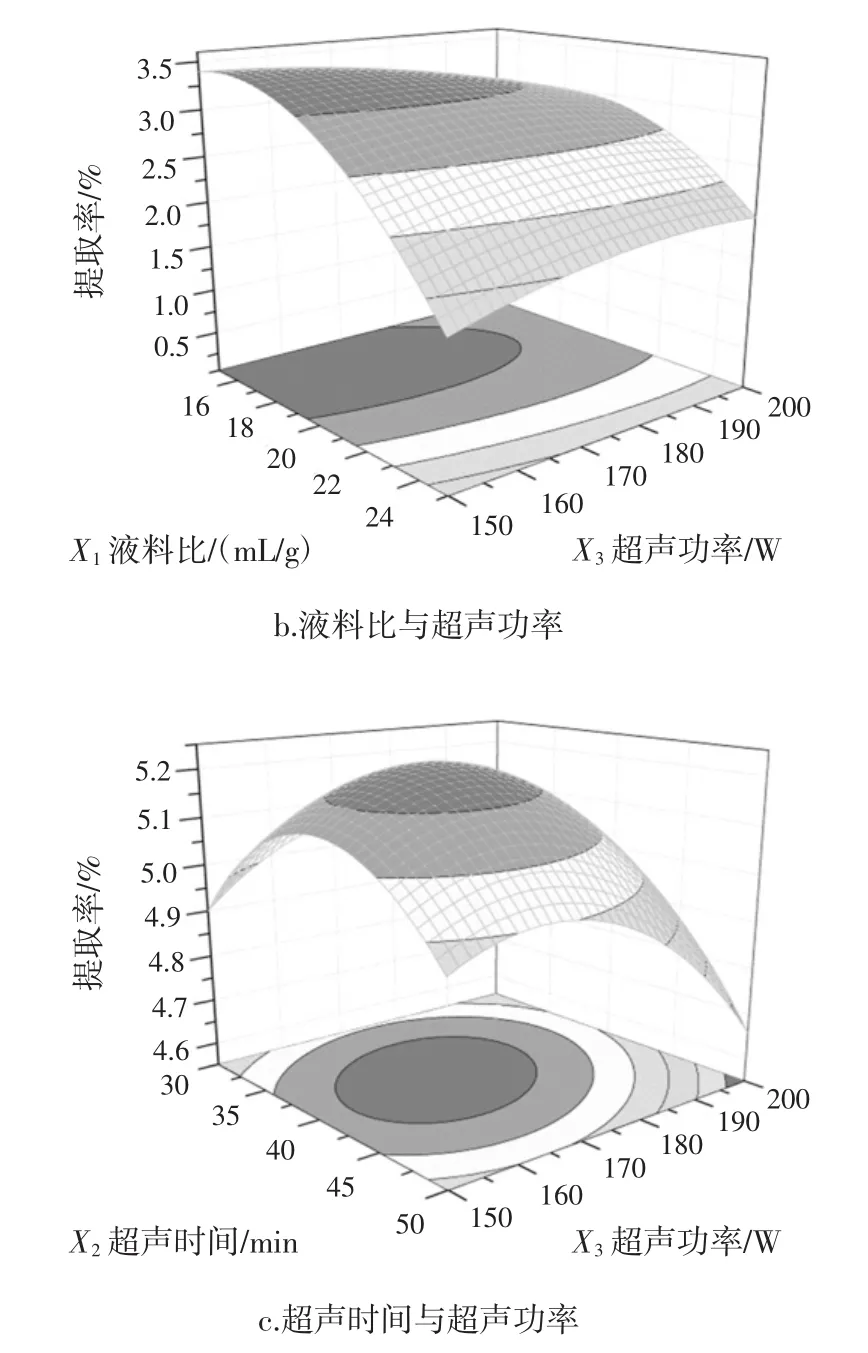
图4 UAE法各因素交互作用对多糖提取率影响的响应面图Fig.4 Response surface plots showing the effects of various factors on the APPs yields of the UAE method
固定超声功率175 W,如图4a所示,提取率随液料比升高和超声时间延长呈先增大后减小的趋势。在液料比 18 ∶1(mL/g)~20 ∶1(mL/g),超声时间 32.5 min~40 min之间时,响应值达到最大。说明在一定的范围内增加液料比和延长超声时间都有利于多糖的提取。水在超声波提取过程中起介质作用。溶剂用量少,原料细胞组织浸润不完全,提取效果差。溶剂量增大,超声波介质增多,降低了多糖物质向外扩散的阻力,多糖提取率不断增大[20]。但溶剂过多会消耗大量超声波辐射能量,因而影响多糖的析出[21]。同时,延长超声时间可使超声波对固体组织的空化、剪切效能累积量增加,组织细胞破碎程度和多糖的溶出量增加,因此提取率明显提高。但处理时间过长,产生较强的机械剪切作用,使组织中大量的细胞进一步破裂,细胞内大量不溶物及黏性物质等混入提取液中,增大了传质阻力,影响了多糖成分的溶出;同时,随着超声提取时间的延长,超声波较强的空化和机械振动使部分多糖大分子链断裂,其小分子糖在醇沉处理过程中损失掉,从而降低了多糖的提取率[22]。固定超声时间40 min,如图4b 所示,在液料比 15 ∶1(mL/g)~19 ∶1(mL/g),超声功率150 W~165 W之间时,响应值达到最大,此后提取率显著降低。对于一个给定的介质和单位体积的提取溶剂,振动与超声功率呈正比。高的超声功率产生更强的振动,导致更强空化和剪切效应,多糖的传质效率提高,提取率增加。然而,过高超声功率可能造成多糖解聚和黏度降低,从而导致提取率降低[23]。固定液料比20∶1(mL/g),如图4c所示,随超声时间和超声功率增大,多糖提取率呈现先增大后减小的趋势。在超声时间37.5 min~42.5 min,超声功率160 W~170 W之间时,响应值达到最大。图4各图中响应曲面的坡度均相对较为陡峭,表明响应值对液料比、超声时间和超声功率改变较为敏感。从等高线可直观看出,UAE法中两两因素之间交互作用较强,影响显著。

图5 EE法各因素交互作用对多糖提取率影响的响应面图Fig.5 Response surface plots showing the effects of various factors on the APPs yields of the EE method
固定酶解温度55℃,如图5a所示,提取率随液料比升高和酶量的增加呈先增大后减小的趋势。在液料比 24 ∶1(mL/g)~26 ∶1(mL/g),酶量 350 U/g~450 U/g之间时,响应值达到最大。说明在一定的范围内增加液料比和酶量有利于细胞壁的分解和溶质的释放。而酶量过多时,没有足够的底物与之反应,因此多糖提取量不再变化。固定酶量450 U/g,如图5b所示,当液料比为 22∶1(mL/g)~25∶1(mL/g),酶解温度达 50℃~54℃之间时,响应值达到最大。随着液料比和酶解温度的进一步升高,多糖提取率逐渐降低。说明在一定的温度范围内较高温度可以有效降低提取剂的黏度和密度,利于提取溶剂向固体组织内部的渗透和多糖由组织内部向周围溶剂的扩散;同时,在一定范围内升高温度会增加酶的催化活性,提高酶解的效率[7]。但温度过高会降低酶的活性,且导致溶剂的挥发和杂质溶出量的增加,从而降低了多糖提取率[7,18,24]。固定液料比25∶1(mL/g),如图5c所示,随酶量和酶解温度的增大,多糖提取率呈现先增大后减小的趋势。酶量400 U/g~500 U/g,酶解温度51℃~54℃之间时,响应值达到最大。图5各图中响应曲面的坡度均相对较为陡峭,表明响应值对液料比、酶量和酶解温度改变较为敏感。从等高线可直观看出,EE法中酶量和酶解温度交互作用较弱,其余两两因素交互作用较强,影响显著。

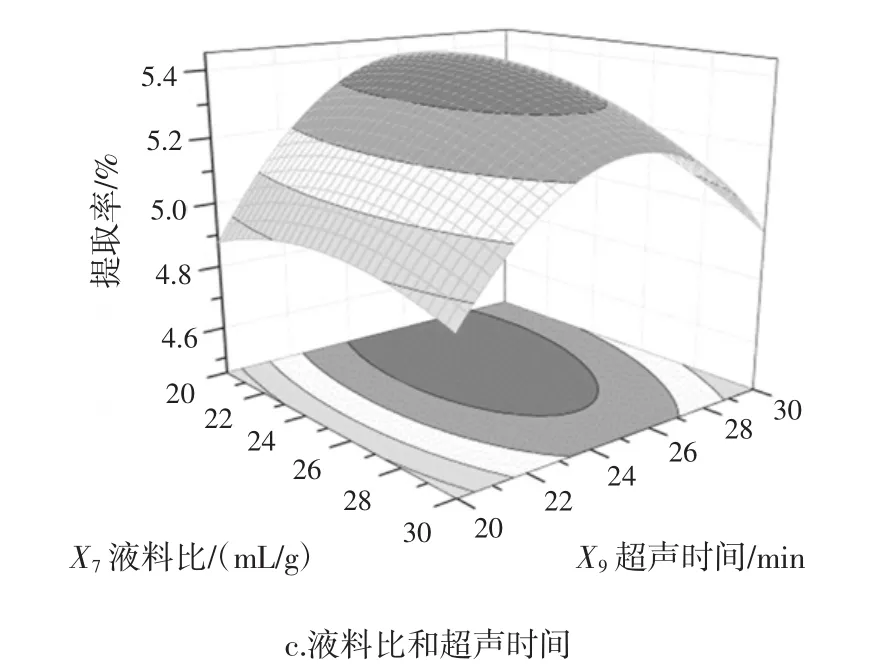
图6 UAE-EE法各因素交互作用对多糖提取率影响的响应面图Fig.6 Response surface plots showing the effects of various factors on the APPs yields of the UAE-EE method
固定超声时间25 min,如图6a所示,提取率随液料比升高和酶量的增加呈先增大后减小的趋势。随液料比 24 ∶1(mL/g)~28 ∶1(mL/g),酶量 450 U/g~525 U/g之间时,响应值达到最大。固定酶量450 U/g,如图6b所示,酶量450 U/g~550 U/g与超声时间24 min~26 min之间时,响应值达到最大。固定液料比25∶1(mL/g),如图 6c 所示,液料比 24 ∶1(mL/g)~26 ∶1(mL/g)和超声时间24 min~26 min之间时,响应值达到最大。图6各图中响应曲面的坡度均相对较为陡峭,表明响应值对液料比、酶量和超声功率改变较为敏感。从等高线可直观看出,UAE-EE法中两两因素之间交互作用较强,影响显著。
2.4 最优工艺参数的确定及验证试验
通过对回归模型求解方程,得到APPs提取工艺的最优组合如下,UAE法:液料比为19.02∶1(mL/g),超声时间为38.72 min,超声功率为165.28 W,多糖提取率为5.29%。修正后的最佳工艺条件为:液料比为19∶1(mL/g),超声时间为 39 min,超声功率为 165 W。EE 法:液料比为 24.44∶1(mL/g),酶量 433.35 U/g,酶解温度为53.83℃,多糖提取率为5.52%。修正后的最佳工艺条件为:液料比为 24∶1(mL/g)、酶量为 433 U/g、酶解温度为54℃。UAE-EE法:液料比为23.83∶1(mL/g),酶量470.85 U/g,超声时间为25.69min,多糖提取率为5.64%。修正后的最佳工艺条件为:液料比24∶1(mL/g),酶量471 U/g,超声时间为26 min。分别进行验证试验,各3次重复,得到多糖提取率平均分别为(5.19±0.16)%、(5.44±0.13)%、(5.82±0.21)%。验证试验值与模型预测值基本一致,表明预测值和真实值之间有很好的拟合性,进一步验证了模型的可靠性。
3 结论
以山东省济宁市南四湖区域5月份所产同一批次的空心莲子草为试验原料,采用超声波辅助法、酶法、超声-酶协同法3种提取方法制备了APPs,使用响应面法分别对其进行优化,并对使用各优化工艺得到的多糖提取率进行了测定和比较。分别确定了3种提取工艺的最佳条件,且最优条件下APPs提取率大小排列依次为超声-酶协同法>酶法>超声波辅助法。因此,超声波和纤维素酶处理均为提取APPs的有效方法,同时超声波作用又能够促进纤维素酶提取过程的进行,超声-酶协同提取作为一个高效的绿色提取技术,能够更加合理而有效的应用于空心莲子草多糖成分的提取,可以广泛应用于从植物原料中提取有效成分。然而,不同提取方法对空心莲子草多糖结构的影响及其与抗氧化活性之间的关系,尚待进一步研究。
参考文献:
[1]LI B,GUO Q L,TIAN Y,et al.New Anti-HBV C-Boivinopyranosyl Flavones from Alternanthera philoxeroides[J].Molecules,2016,21(3):336-340
[2]蔡凌云,王良海,王胜兵,等.空心莲子草多糖的提取和确证性实验[J].凯里学院学报,2011,29(3):78-80
[3]蔡凌云,黎云祥,贺顺美,等.空心莲子草皂苷的微波辅助提取工艺[J].食品科学,2011,32(2):84-87
[4]程超,李伟,汪兴平,等.空心莲子草不同提取物抑菌作用及有效成分分析[J].食品科学,2007,28(9):52-56
[5]李琼娅,范文乾,马卓,等.空心莲子草的化学成分研究[J].天然产物研究与开发,2009,21(1):70-72
[6]李琼娅,范文乾,马卓,等.空心莲子草化学成分和药理活性研究进展[J].时珍国医国药,2007,18(2):334-335
[7]谭莉,陈瑞战,常清泉,等.淫羊藿叶多糖工艺优化及抗氧化活性[J].食品科学,2017,38(2):255-263
[8]CHEN R,Li H,Li S,et al.Extraction optimization,preliminary characterization and immunological activity of polysaccharides from figs[J].International journal of biological macromolecules,2015,72(1):185-194
[9]鞠瑶瑶,曹纯洁,陈美珍,等.响应面试验优化脆江蓠多糖提取工艺及其对肿瘤细胞的抑制作用[J].食品科学,2016,37(8):57-62
[10]JALILI SAFARYAN M,GANJLOO A,BIMAKR M,et al.Optimization of ultrasound-assisted extraction,preliminary characterization and in vitro antioxidant activity of polysaccharides from green pea pods[J].Foods,2016,5(4):78-93
[11]WU S,LU M,WANG S.Amylase-assisted extraction and antioxidant activity of polysaccharides from Gracilaria lemaneiformis[J].3 Biotech,2017,7(1):38-42
[12]ROSTAMI H,GHARIBZAHEDI S M T.Microwave-assisted extraction of jujube polysaccharide:Optimization,purification and functionalcharacterization[J].Carbohydrate polymers,2016,143(5):100-107
[13]Yin X,You Q,Jiang Z,et al.Optimization for ultrasonic-microwave synergistic extraction of polysaccharides from Cornus officinalis and characterization of polysaccharides[J].International journal of biological macromolecules,2016,83(2):226-232
[14]PU JB,XIA BH,HU YJ,et al.Multi-Optimization of Ultrasonic-Assisted Enzymatic Extraction of Atratylodes macrocephala Polysaccharides and Antioxidants Using Response Surface Methodology and Desirability Function Approach[J].Molecules,2015,20(12):22220-22235
[15]CHENG Z,SONG H,YANG Y,et al.Optimization of microwave-assisted enzymatic extraction of polysaccharides from the fruit of Schisandra chinensis Baill[J].International journal of biological macromolecules,2015,76(3):161-168
[16]ZHANG Y,WANG ZY,CHEN XQ.Ultrasound-associated extraction of seed oil of Korean pine[J].Journal of Forestry Research,2005,16(2):140-142
[17]赵玉红,王静,金秀明.超声波辅助酶法提取榛子壳色素工艺条件的研究[J].中国调味品,2010,35(4):110-114
[18]蒋德旗,黄利敏,王艳,等.响应面优化纤维素酶法提取桂花多糖工艺及其抗氧活性研究[J].食品工业科技,2015,36(2):271-275
[19]刘晓涵,陈永刚,林励,等.蒽酮硫酸法与苯酚硫酸法测定枸杞子中多糖含量的比较[J].食品科技,2009,34(9):270-272
[20]张双灵,李文香,赵海燕,等.超声波协同酶法提取香菇多糖的工艺优化[J].食品科技,2016,41(3):192-196
[21]史娟.微波预处理-超声波提取山茱萸多糖及稳定性研究[J].食品研究与开发,2014,35(1):1-5
[22]刘航,国旭丹,马雨洁,等.超声波辅助提取苦荞麦多糖工艺优化及其体外抗氧化研究[J].食品科学,2013,34(14):45-50
[23]贾东升,崔施展,谢晓亮,等.Box-Benhnken响应面法优化超声波辅助提取酸枣多糖工艺研究[J].食品研究与开发,2016,37(14):34-38
[24]谢丽源,王富伟,李洪军,等.超声波复合酶法提取桑黄多糖研究[J].食品科学,2010,31(10):81-85

