响应面法优化槟榔核多酚提取工艺
成焕,王传花,2,李珂,2,郭亦晨,赵志友,王远亮,2,*
(1.湖南农业大学食品科技学院,湖南长沙410128;2.食品科学与生物技术湖南省重点实验室,湖南长沙410128;3.湖南省槟榔加工与食用安全工程技术研究中心,湖南湘潭411201;4.湖南省槟榔产业技术创新战略联盟理事长单位,湖南湘潭411201)
槟榔为棕榈科植物槟榔(Areca catechu L.)的成熟种子。原生长在马来西亚的热带雨林中,目前主要分布在印度和东南亚各国[1]。外形呈扁球形或圆锥形,表面淡黄棕色或淡红棕色,质地坚硬,断面可见大理石样花纹。槟榔含生物碱、鞣质、脂肪油及槟榔红色素、氨基酸等成分,具有杀虫,消积,行气,利水,截疟的功效[2]。槟榔作为世界四大嗜好品之一,大部分以果壳加工制品进行销售[3],果核部分多作为废品处理。近来研究表明[4-5],槟榔果核中含有大量多酚,值得进行理化研究和深加工处理。目前已从槟榔中检测出的酚类物质主要有儿茶素、单宁酸、表没食子儿茶素、表儿茶素等9种物质[6-8],这些化合物具有良好的抗氧化活性[9-10],在治疗炎症[11-12]、心血管疾病[13]、癌症[14]等方面具有药用潜力。
近年来,随着人们对食品安全性的重视,天然产物的开发利用得到了极大发展,植物多酚以其分布的广泛性、生理功能的多样性以及来源丰富性等特点[15],成为了当前研究的热点。将这些生物活性多酚与槟榔中的有害成分分离,既可促进对槟榔的安全使用又有益环境。该试验以槟榔鲜果为原料,采用响应曲面设计方法,以提取剂浓度、提取温度、提取时间、料液比为试验因素,以提取液中的多酚含量为评价指标,分别进行二次多项回归方程拟合及其优化分析,有效的提高多酚得率,为后续研究提供理论依据。
1 材料与方法
1.1 材料与试剂
槟榔鲜果:2017年1月购于海南省定安县,果核干燥、粉碎备用。
无水乙醇:郑州派尼化学试剂厂;甲醇:国药集团化学试剂有限公司;丙酮:衡阳市凯信化工试剂股份有限公司;无水碳酸钠:上海虹光化工厂;Folin酚试剂:合肥博美生物;没食子酸一水物(纯度≥98.5%):上海瑞永生物科技有限公司。
1.2 仪器与设备
ANJIEFD-1A-50冷冻干燥机:北京博医康实验仪器有限公司;WGL-125B电热鼓风干燥箱:天津市泰斯特仪器有限公司;TD5A台式多管架离心机:长沙英泰仪器有限责任公司;WFJ7200型可见分光光度计:尤尼柯(上海)仪器有限公司;RE-52系列旋转蒸发仪:上海亚荣生化仪器厂;CP411电子天平:奥豪斯仪器(上海)有限公司。
1.3 方法
1.3.1 没食子酸工作曲线的绘制
以没食子酸为标准品,参考GB/T 8313-2008《茶叶中茶多酚和儿茶素类含量的检测方法》[16],根据FC-酚法制作标准曲线。称取(0.110±0.001)g没食子酸(相对分子质量188.14),制成100 mL标准溶液。分别移取1.0 mL~7.0 mL到100 mL容量瓶并定容,再各移取1.0 mL与5.0 mL 10%的Folin酚试剂和4.0 mL 7.5%碳酸钠溶液于室温暗反应1 h,在765 nm波长条件下测吸光值。以没食子酸标准溶液质量浓度(μg/mL)为横坐标,溶液吸光度为纵坐标,得到标准曲线为:Y=0.011 X+0.017 7(R2=0.999)。
1.3.2 槟榔干物质测定
取槟榔鲜果,分别采用热风干燥和冷冻干燥后充分粉碎,收集果核粉末,用恒重法[17]进行测定。
干物质质量按下式计算:
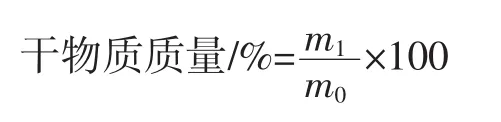
式中:m0为试样原始质量,g;m1为干燥后试样质量,g。
1.3.3 槟榔核多酚的提取及其含量测定[16]
准确称取果核粉末0.2 g,加入10 mL提取剂,采用水浴加热法进行提取,冷却后于3 500 r/min离心10 min,收集上清液,加提取剂定容至10 mL为母液,取母液1.0 mL用水定容至100 mL为测试液。取测试液1.0 mL,采用和标准曲线相同的方法测定样品中总多酚的含量,以没食子酸计。
多酚得率按下式计算:
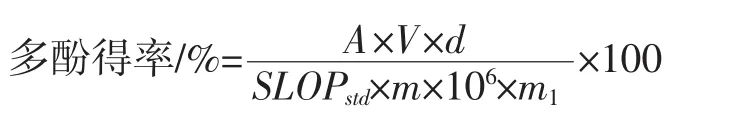
式中:A为样品测试液吸光值;V为样品提取液体积,mL;d为稀释因子(通常为1 mL稀释成100 mL,稀释因子为100);SLOPstd为没食子酸标准曲线的斜率;m为样品干物质质量,%;m1为样品质量,g。
多酚含量按下式计算:

式中:C为溶液中多酚质量浓度,mg/mL;d为稀释因子(通常为1 mL稀释成100 mL,稀释因子为100);V为样品提取液体积,mL;m为样品质量,g。
1.3.4 单因素试验[18-19]
按1.3.3中操作方法对槟榔核中的多酚进行提取和测定,固定其他条件不变,分别考察干燥方式(热风干燥60℃处理24 h、冷冻干燥-53℃处理24 h);提取剂(水、70%乙醇、70%甲醇、70%丙酮);提取剂体积分数(30%~70%);提取温度(40℃~80℃);提取时间(10 min~90 min);料液比 1 ∶20(g/mL)~1 ∶60(g/mL);提取次数(1次~5次)对多酚提取率的影响,以提取液中的多酚含量为考察指标。
1.3.5 响应面试验设计[20]
根据单因素试验的结果进行显著性分析,选取对多酚提取率影响较大的4个因素进行试验设计,利用Design-Expert 8.0软件进行数据拟合,以多酚含量为响应值,确定槟榔核多酚最适宜提取条件,并进行验证,响应面设计因素水平及编码见表1。
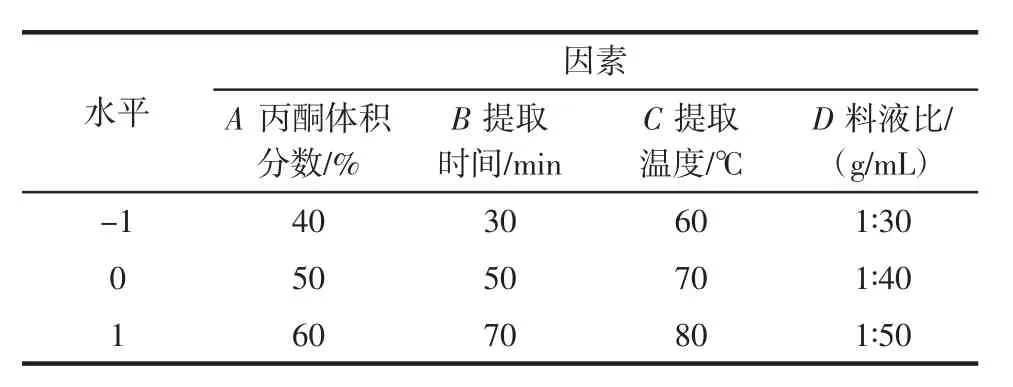
表1 响应面设计因素水平及编码Table 1 Factors and their coded levels used in experimental design for response surface methodology
1.4 统计分析
每个单因素试验平行处理3次,采用SPSS 21.0软件处理数据、显著性分析、制作图表,结果用x±s表示;响应面结果用Design-Expert 8.0软件进行参数优化及方差分析。
2 结果与分析
2.1 槟榔核干物质质量
按1.3.2方法操作,测得烘干和冻干的槟榔核干物质质量分别为92.96%和89.89%。
2.2 单因素试验结果
2.2.1 不同干燥方式与提取剂对槟榔核多酚得率的影响
不同干燥方式与提取剂对槟榔核多酚得率的影响见图1。
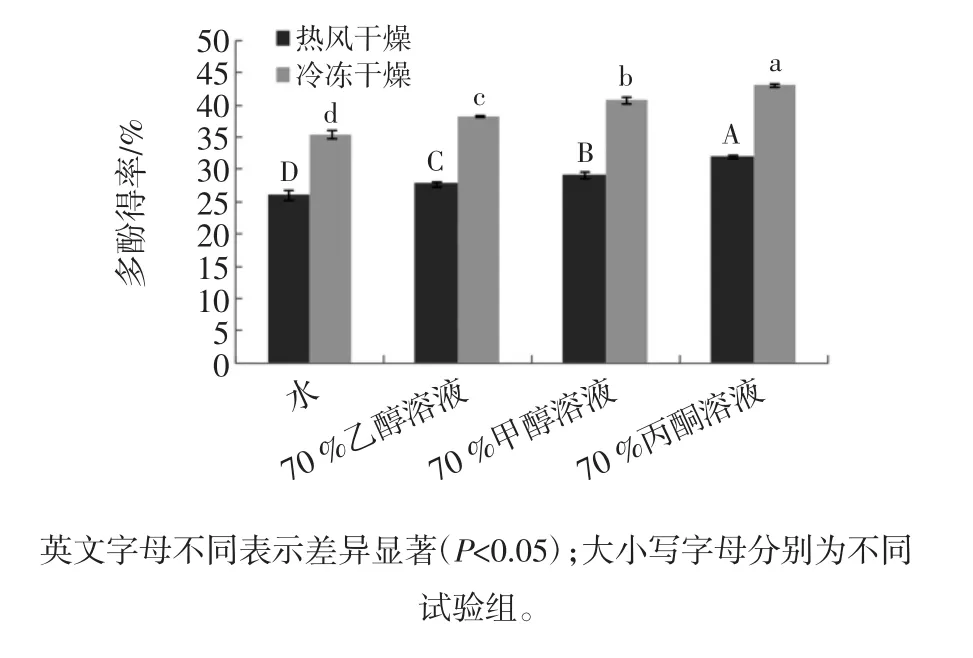
图1 不同干燥方式与提取剂对多酚得率的影响Fig.1 Effect of different drying methods and extractants on the extraction efficiency of polyphenols
有图1可以看出,长时间的热风干燥会使多酚大量损失。C Ratti在试验中指出,热风干燥会引起材料皱缩,成分损坏,而冷冻干燥的过程中样品的结构不会被破坏,可有效保留产品的生物和化学结构及其活性的完整性[21-22]。在试验的4种提取剂中,冷冻干燥的提取效果均优于相同条件下的热风干燥,热风干燥处理的样品多酚提取率约是冻干处理的73%左右。
多酚物质极性较强,易溶于水和有机溶剂。本试验采用使用最多的4种溶剂进行考察,根据相似相溶原理,发现丙酮的提取效果最好。Chavan Y等[23]对比了乙酸乙酯等8种提取剂,也证明丙酮对槟榔核多酚的提取更为有效。Paula Kuma[24]则在西芹多酚的提取试验中发现丙酮水溶液仅对多酚总量的提取最好,对于单一成分来说并不一定是最合适的。这可能是由于丙酮与槟榔核多酚中的大多数成分极性更为相似,极性相似的溶剂可以使提取物充分溶于溶剂中从而被提取出来。同时以丙酮作为提取剂,对提取物的抗自由基能力可起到一定积极作用[25]。
2.2.2 丙酮体积分数对槟榔核多酚得率的影响
丙酮体积分数对槟榔核多酚得率的影响见图2。
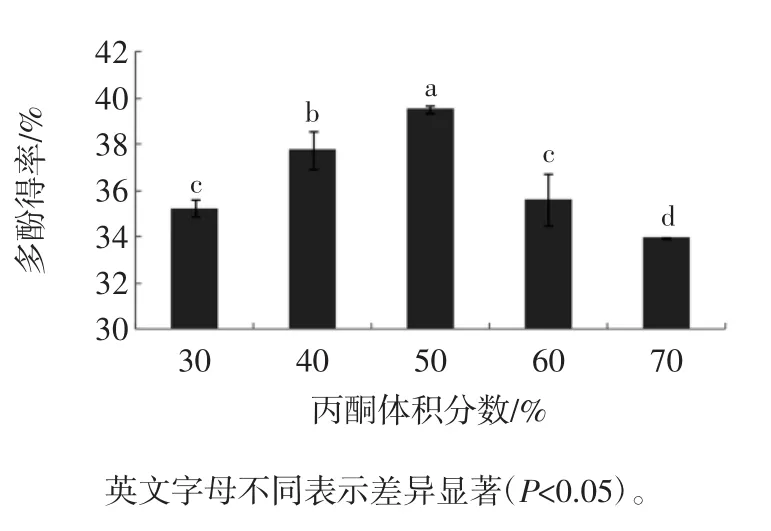
图2 丙酮体积分数对多酚得率的影响Fig.2 Effect of acetone concentration on the extraction efficiency of polyphenols
从图2可以看出,多酚提取率随丙酮体积分数的增大先缓慢增加后快速减小,在50%时达到最大值,为39.53%。多酚在植物体内常与蛋白质等以氢键的形式形成稳定的复合物,丙酮体积分数过低,溶剂对氢键的破坏能力不强,从而使提取率降低;丙酮体积分数过高,溶剂极性低,导致提取率下降,并且会增加色素等脂溶性物质的溶出[26-27],给后续的分离纯化工作造成不便。因此,选择50%的丙酮作为较佳提取剂浓度。
2.2.3 提取时间对槟榔核多酚得率的影响
提取时间对槟榔核多酚得率的影响见图3。
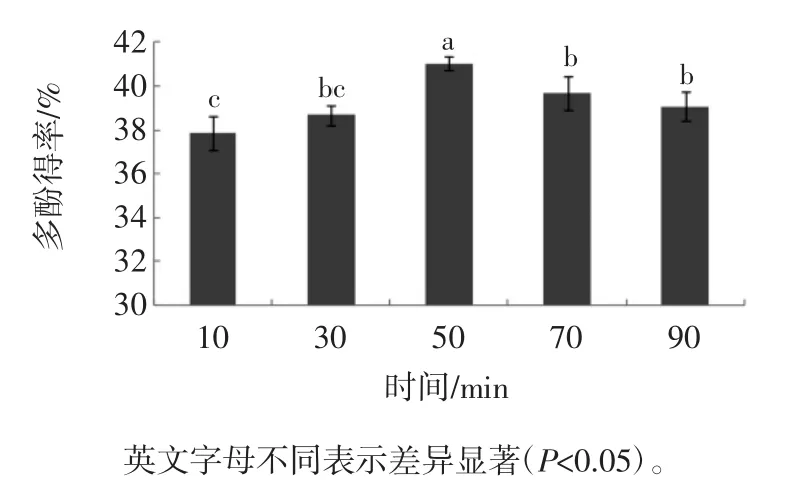
图3 提取时间对多酚得率的影响Fig.3 Effect of time on the extraction efficiency of polyphenols
从图3可以看出,在90 min内,多酚提取率随提取时间的延长先增加后减小,提取时间为50 min时多酚含量最大为41.04%。当提取时间继续延长,提取液中的多酚含量缓慢下降,可能是因为长时间的高温条件使多酚的分解速率大于了溶出速率。徐玮等[28]通过正交试验证明加热时间控制在60 min以内,加热温度100℃~140℃,茶多酚的损失率可控制在15%以内。
2.2.4 提取温度对槟榔核多酚得率的影响
提取温度对槟榔核多酚得率的影响见图4。
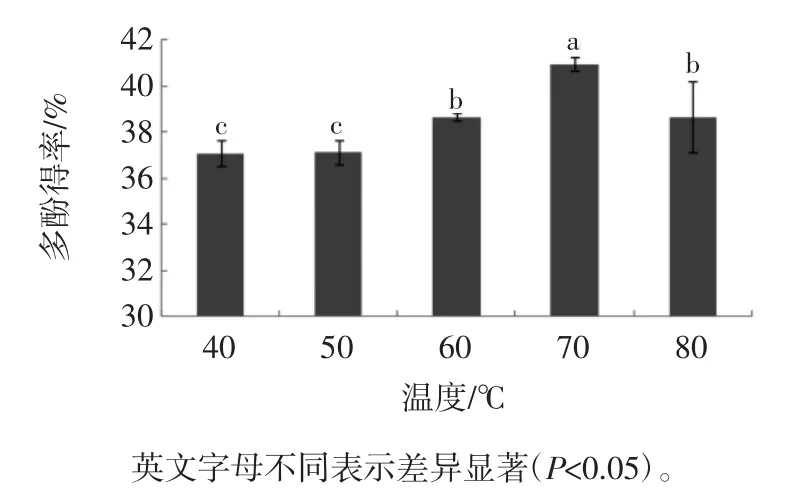
图4 提取温度对多酚得率的影响Fig.4 Effect of temperature on the extraction efficiency of polyphenols
从图4可以看出,在40℃~80℃范围内,多酚含量随着温度的升高而迅速升高,在70℃达到最大值,含量为40.96%。温度进一步升高,高温促使多酚类物质的氧化变性,因此,多酚含量有着明显的下降,80℃多酚提取率同70℃多酚提取率有着显著性差异(P<0.05),因此,70℃是最佳提取温度。Sólyom K 等[29]以葡萄渣和过滤液为例测试了不同温度和加热时间下的多酚分解状况,相同条件下提取物的不同形态也会影响多酚的分解程度。
2.2.5 料液比对槟榔核多酚得率的影响
料液比对槟榔核多酚得率的影响见图5。
由图5可以看出,随着液料比的增大,提取液中的多酚含量逐渐升高,在1∶40(g/mL)时达到最大,再提高料液比时多酚得率反而下降,液料比改变,提取液中的多酚含量的差异显著(P<0.05)。提高溶剂比例不但会增大不必要的溶剂成本,还会给后续浓缩提纯带来不便,因此选择料液比为1∶40(g/mL)。
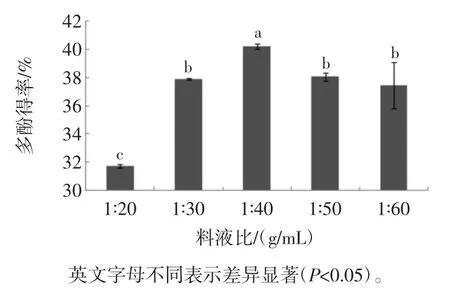
图5 料液比对多酚得率的影响Fig.5 Effect of solid/liquid ratio on the extraction efficiency of polyphenols
2.2.6 提取次数对槟榔核多酚得率的影响
提取次数对槟榔核多酚得率的影响见图6。
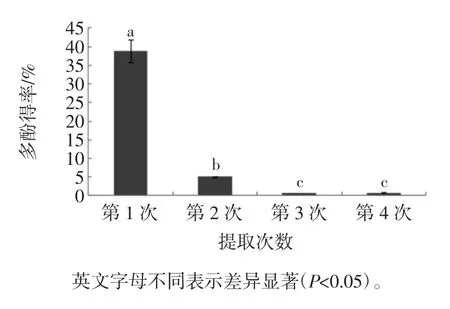
图6 提取次数对多酚得率的影响Fig.6 Effect of number of extractions on the extraction efficiency of polyphenols
多次提取可以增加提取液中的多酚含量,但会对后续的分离纯化造成一定难度。由图6可知,1次就能将槟榔核中的大部分多酚提出,重复一次还能获得少量多酚。第3次、4次提取液中多酚含量少,且差异不显著(P<0.05)。本试验中选择提取一次,实际生产中可根据实际条件选择1次~2次提取。
2.3 响应面试验结果
2.3.1 Box-Behnken设计试验结果与分析
响应面设计与结果见表2,表中1~24号为析因点,25号~29号为零点,重复5次,用以估计试验误差。以提取液中的多酚含量为响应值。
2.3.2 方差分析
回归模型方差分析见表3。
运用Design-Expert软件,对槟榔果核多酚提取率显著影响因素进行响应面分析,得到槟榔果核多酚提取率(Y)的多元二次回归模型:
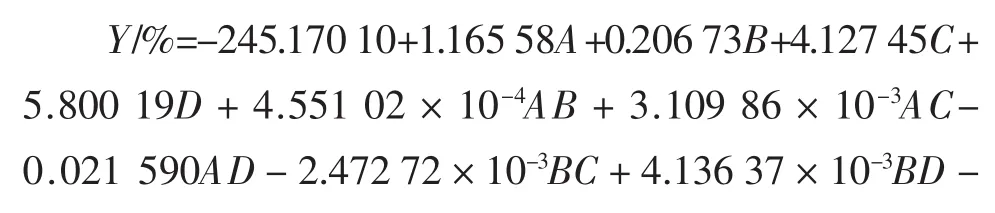
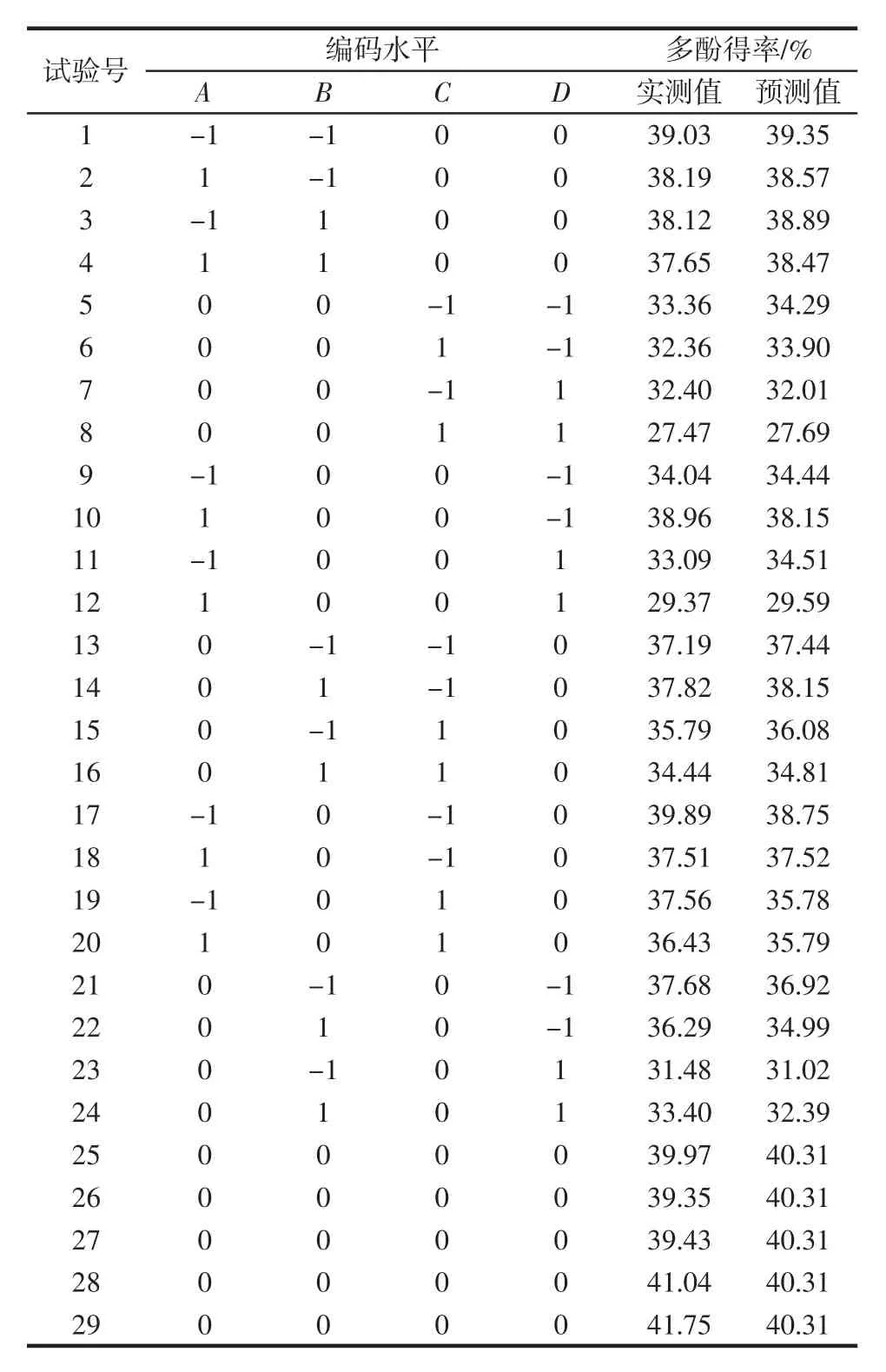
表2 Box-Behnken试验设计及结果Table 2 Box-Behnken experimental design matrix and results

表3 回归模型方差分析Table 3 ANOVA for response surface quadratic model
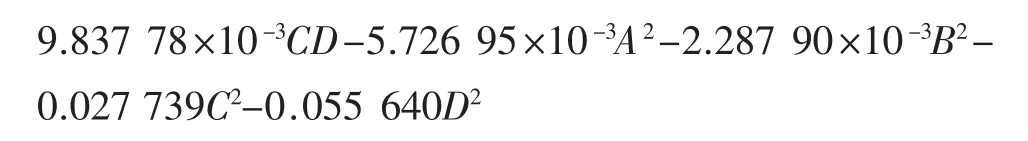
由表3可知,该回归方程模型的P<0.000 1,模型极显著,而失拟项不显著P=0.369 3>0.05,试验误差小;模型相关系数R2=0.939 1,校正决定系数R2adj=0.878 2,表明该方程具有较好的模拟性,可用于优化试验设计与结果分析,以确定丙酮提取槟榔核多酚的最优工艺条件。各因素对响应值影响大小顺序为:料液比>提取温度>丙酮体积分数>提取时间。
一次项C、D均达到了极显著的水平(P<0.01),而A、B不显著(P>0.05),说明提取温度和料液比对响应值影响较大,故要得良好的响应值,需要严格控制提取温度和料液比。除AD之间的交互作用极显著外,其余因素之间的交互因素并不显著,其P值远大于0.05,表明交互作用对响应值的影响较小。方差分析结果还显示,C、D的二次项对响应目标值均有极显著影响。
2.3.3 响应面分析
各因素交互作用对槟榔核多酚得率的影响见图7。
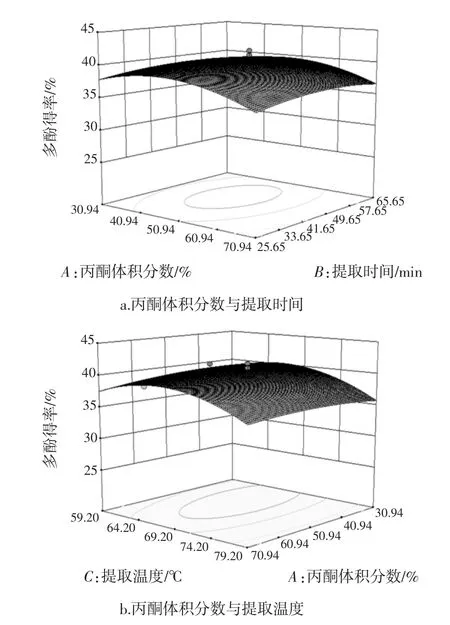
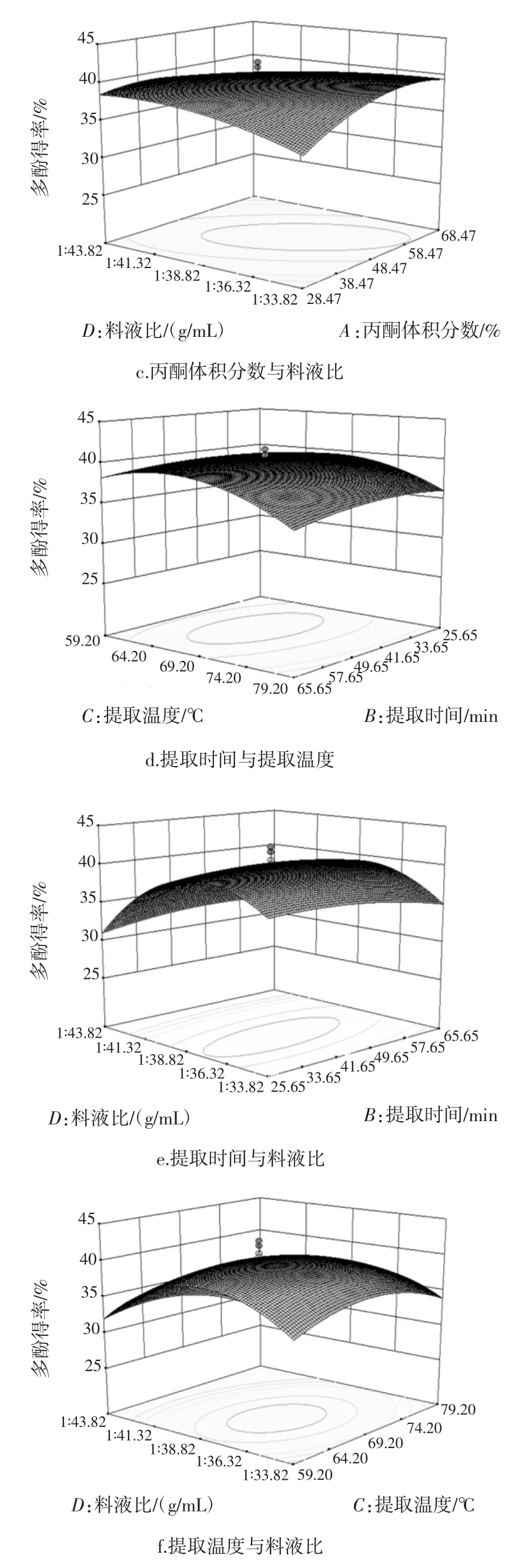
图7 各因素交互作用对槟榔核多酚得率的影响Fig.7 Interactive effects of various factors on the extraction efficiency of polyphenols
由图7可知,开始时提取液中的多酚含量随丙酮体积分数、料液比、提取时间和提取温度水平的增大而增大,达到各因素中心值以后,得率随各因素增大而逐渐减小。对比各图可知,料液比和提取温度对响应值的影响大,表现为图7f的曲面较陡,由此可见,控制好料液比和提取温度对取得良好的提取效果至关重要。而丙酮浓度和提取时间响应面相对较为平缓,说明该因素对得率影响较小。由图7c可知,丙酮体积分数与料液比的交互因素较强外,其余各因素间的交互作用不强,表现为等高线为椭圆形,其余各图的等高线椭圆形状不明显,这与回归方程的方差分析结果一致,说明响应面优化设计可以较好地反映出丙酮体积分数、料液比、提取时间和提取温度4个因素对槟榔核多酚提取情况的影响。
通过Design-Expert 8.0软件分析计算可得到最佳提取工艺条件:丙酮体积分数50.49%、浸提温度68.35℃、提取时间 47.69 min、料液比 1∶38.06(g/mL),在此条件下,回归模型预测的多酚含量的理论值可达40.61%。
2.4 工艺条件的优化和验证
由Design-Expert 8.0软件得出的多酚的最佳提取条件为:丙酮体积分数50.49%、浸提温度68.35℃、提取时间 47.69 min、料液比 1 ∶38.06(g/mL)。此条件下模型预测的最大得率为40.61%。考虑到实际操作的局限性,将理论值修正为丙酮体积分数50%、浸提温度 68℃、提取时间 48 min、料液比 1∶38(g/mL)。此条件下做验证试验,提取液的多酚得率为40.43%(即367.39mg/g,由多酚含量计算公式可得出),与理论值40.61%接近,说明该模型能较好地预测实际得率。韩林[5]用乙醇对槟榔核进行多酚提取,在最佳工艺参数下提取物的总酚含量为160.95mg/g。其优化条件是以槟榔壳作为试验对象得到的,由于壳与核本身存在组织形态、成分含量的差别,故该条件并不一定是槟榔核的最适工艺,导致提取效率低于本试验。Chavan Y等[23]采用旋转振荡法用丙酮提取产于印度的槟榔的果核多酚,在最佳工艺参数下得率为407.47mg/g,要高于本试验提取效率。除了品种和产地原因外,也可能是由于振荡加强了提取剂与槟榔粉末的接触,更大程度的渗透进槟榔的细胞组织,促进了多酚的扩散效率。可见旋转振荡和超声处理对于多酚提取是一种有效的辅助手段,在后续试验中可以尝试、验证。
3 结论与讨论
本研究优化了丙酮提取槟榔核多酚的工艺参数,其中各因素对得率的影响大小顺序为:料液比>提取温度>丙酮体积分数>提取时间。按实际情况优化后的最佳工艺条件为丙酮体积分数50%、浸提温度68℃、提取时间 48 min、料液比 1 ∶38(g/mL),在此条件下,槟榔核多酚得率达到最大值40.43%,与理论预测值基本一致。本提取过程中未采用任何辅助方法,在与其他研究结果比较中发现超声辅助的空化作用[30]和微波辅助的高能效果[31]都能在一定程度上提高效率。试验中可根据试验条件添加辅助方式。本试验作为基础研究可为槟榔核多酚的深入研究提供数据支持。
参考文献:
[1]李晓娜,曾小红,谢龙莲,等.槟榔科学研究近况分析[J].热带农业科学,2017,37(3):79-82
[2]国家药典委员会.中华人民共和国药典:一部[M].北京:中国医药科技出版社,2010
[3]吕俊辰,弓宝,孙佩文.槟榔药用和食用安全性研究概况[J].中草药,2017,48(2):384-390
[4]韩林.槟榔中抗氧化成分的提取及分离研究[D].海口:海南大学,2010
[5]Wang C K,Lee W H,Peng C H.Contents of phenolics and alkaloids in Areca catechu Linn.during maturation[J].Journal of Agricultural&Food Chemistry,1997,45(4):1185-1188
[6]王明月,罗金辉,李建国.HPLC法测定槟榔中的多酚类物质[J].天然产物研究与开发,2011,23(1):101-104
[7]普义鑫.槟榔核多酚提取、纯化及组分分析[D].株洲:中南林业科技大学,2012
[8]牟肖男,杨文强,王文婧,等.槟榔的化学成分[J].暨南大学学报(自然科学与医学版),2014,35(1):56-60
[9]Zhang W M,Huang W Y,Chen W X,et al.Optimization of extraction conditions of areca seed polyphenols and evaluation of their antioxidant activities[J].Molecules,2014,19(10):16416-16427
[10]Safriani N,Erfiza N M,Arpi N.Antioxidant Activities of Cyperus rotundus L.Rhizome and Areca catechu L.Seed[J].2016,6(3):285-288
[11]Baby A A,Raphael K R.Potential antimicrobial,anthelmintic and antioxidant properties of Areca catechu L.root[J].International Journal of Pharmacy&Pharmaceutical Sciences,2014,6(6):486-489
[12]Bhandare A M,Kshirsagar A D,Vyawahare N S,et al.Potential analgesic,anti-inflammatory and antioxidant activities of hydroalcoholic extract of Areca catechu L.nut[J].Food&Chemical Toxicology An International Journal Published for the British Industrial Biological Research Association,2010,48(12):3412-3417
[13]Quinones M,Miguel M,Aleixandre A,et al.Beneficial effects of polyphenols on cardiovascular disease[J].Pharmacological Research,2013,68(1):125-131
[14]Mileo A M,Miccadei S.Polyphenols as Modulator of Oxidative Stress in Cancer Disease:New Therapeutic Strategies[J].Oxidative Medicine and Cellular Longevity,2016,2016(7):1-17
[15]Manach C,Scalbert A,Morand C,et al.Polyphenols:food sources and bioavailability[J].The American Journal of Clinical Nutrition,2004,79(5):727-747
[16]中华人民共和国国家监督检验检疫局.GB/T 8313-2008茶叶中茶多酚和儿茶素类含量的检测方法[S].北京:中国标准出版社,2008:3-5
[17]中华人民共和国国家技术监督局.GB/T 8303-2013,茶磨碎试样的制备及其干物质含量测定[S].北京:中国标准出版社,2013:1
[18]C Am M,Hls Il Y.Pressurised water extraction of polyphenols from pomegranate peels[J].Food Chemistry,2010,123(3):878-885
[19]冯进,曾晓雄,李春阳.响应面法优化蓝莓叶多酚提取工艺[J].食品科学,2013,34(4):59-64
[20]李佳桥,余修亮,曾林晖,等.响应面试验优化超声波辅助提取莲房原花青素工艺[J].食品科学,2016,37(12):40-45
[21]Ratti C.Hot air and freeze-drying of high-value foods:a review[J].Journal of Food Engineering,2001,49(4):311-319
[22]Zubair M,Nybom H,Lindholm C,et al.Major polyphenols in aerial organs of greater plantain(Plantago major,L.),and effects of drying temperature on polyphenol contents in the leaves[J].Scientia Horticulturae,2011,128(4):523-529
[23]Chavan Y,Singhal R S.Separation of polyphenols and arecoline from areca nut(Areca catechu L.)by solvent extraction,its antioxidant activity,and identification of polyphenols[J].Journal of the Science of Food and Agriculture,2013,93(10):2580-2589
[25]Tanih N F,Ndip R N.Evaluation of the Acetone and Aqueous Extracts of Mature Stem Bark of Sclerocarya birrea for Antioxidant and Antimicrobial Properties[J].Evidence-based complementary and alternative medicine:eCAM,2012,2012:1-7
[26]夏季,郑炯,陈光静,等.响应面法优化超声辅助提取野木瓜多酚工艺[J].食品工业科技,2014,35(21):253-258
[27]Luengthanaphol S,Mongkholkhajornsilp D,Douglas S,et al.Extraction of antioxidants from sweet Thai tamarind seed coat-preliminary experiments[J].Journal of Food Engineering,2004,63(3):247-252
[28]徐玮,王利华,聂宁.不同温度和时间处理对茶多酚损失率的影响[J].中国农学通报,2009,25(2):6-8
[29]Sólyom K,Solá R,Cocero M J,et al.Thermal degradation of grape marc polyphenols[J].Food Chemistry,2014,159(159):361-366
[30]江慎华,刘梦莹,杜余辉,等.诃子总多酚恒温超声辅助提取与过程动力学研究[J].农业机械学报,2015(2):213-221

