偏头痛病理生理机制与5-HT7受体相关性研究进展*
徐晓白 刘 璐 赵洛鹏 曲正阳 朱玉璞 张雅杰 李瑷同 王麟鹏△
(1首都医科大学附属北京中医医院针灸科,北京100010;2北京中医药大学,北京100029 )
偏头痛是一种常见的神经性功能障碍。流行病学调查报告指出目前中国成人的偏头痛患病率达9.3%[1],西方国家的患病率大约在12%[2]。偏头痛病理生理学改变认为主要是疼痛阈值降低[3]。病理生理机制主要涉及下行痛觉调节通路失调[4]、三叉神经及自主神经系统活性改变[5]、丘脑敏化[6]等。目前,阵发性偏头痛镇痛的特异性药物—5-HT1B/1D受体激动剂,不仅疗效有限(缓解率仅40%)[7],而且长期使用会导致药物滥用性头痛,加重心血管负担;慢性偏头痛预防性特异性药物托吡酯具有抗痛觉敏化,减少发作频率的作用,然而也出现了感觉异常、记忆障碍、消化不良等副作用。因此,希望能够从镇痛和抗痛觉敏化两个方面寻找治疗偏头痛的新作用靶点,从而达到提高缓解率、减少不良反应等要求。
偏头痛临床随机对照试验说明,曲坦类、选择性五羟色胺再摄取抑制剂(SSRI)等药物治疗偏头痛具有较好的临床疗效,因此我们推断出5-HT神经通路在偏头痛病理生理机制—下行疼痛易化、抑制通路失调中起重要作用[8]。临床前实验也证明,针刺可以减少偏头痛大鼠自发及诱发痛行为,并升高5-HT在下行痛觉调节通路的表达[9]。除此之外,大量实验表明5-HT7受体参与痛觉调节机制[10],且在外周[11]和中枢[12]发挥着截然不同的作用。本团队的临床前研究也发现,针刺不仅可以改善偏头痛大鼠的疼痛行为,且在中枢和外周两个层面改变了5-HT7受体的数量和分布。本综述首次从偏头痛病理生理机制、痛觉调节环路与5-HT能神经通路、5-HT7受体与疼痛、5-HT7受体与偏头痛等方面,分析5-HT7受体可能在偏头痛反复发作痛觉敏化形成中的作用机制,为明确以5-HT7受体通路为新的作用靶点的偏头痛防治机制奠定理论基础。
1.偏头痛的病理生理机制
对于偏头痛的病理生理机制,目前存在三叉神经血管痛觉通路学说、皮层抑制扩散学说、脑干功能异常学说等学术假说,其中三叉神经血管痛觉通路的激活学说在偏头痛病理机制中占主导地位,也是研究偏头痛发生和反复发作的主流学说。
(1)偏头痛三叉神经血管痛觉通路学说
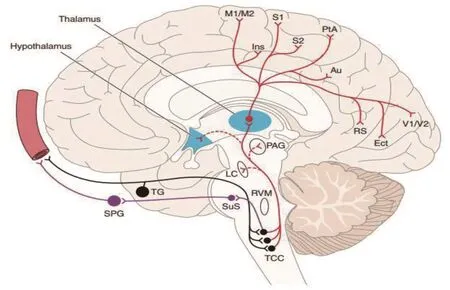
图1 偏头痛三叉神经血管通路—上行投射系统[13]Au: auditory 听觉皮层; Ect: ectorhinal, 嗅外皮层;Ins: insula, 岛叶; LC: the locus coeruleus, 蓝斑;M1/M2: primary and secondary motor cortices, 初级及次级运动皮质; PAG: periaqueductal grey, 中央导水管周围灰质; PtA: parietal association cortex, 顶叶联合皮层; RS: retrosplenial, 后压部皮质; RVM,rostral ventromedial medulla, 延髓头端腹内侧区;S1/S2: somatosensory cortices, 躯体感觉皮质; SPG:sphenopalantine ganglion, 蝶腭神经节; SuS: superior salivatory nucleus, 上泌涎核; TCC: trigeminocervical complex, 三叉颈复合体; TG: trigeminal ganglion, 三叉神经节; Thalamus, 丘脑; Hypothalamus,下丘脑; V1/V2: visual cortices, 视觉皮质.(引自Goadsby PJ, Holland PR, et al. Physiol Rev,2017)
该学说认为三叉神经节支配的软脑膜、蛛网膜和硬脑膜的血管上分布着丰富的伤害性神经纤维丛,这些神经纤维丛是偏头痛临床表现中疼痛的起源[7](见图1[13])。当这些区域受到机械、化学或电刺激时会表现出类似于偏头痛的疼痛,还有其他的包括恶心和畏光等与偏头痛相关的症状。颅内血管和脑膜主要受三叉神经眼支的无髓鞘(C)和细髓鞘(Aδ)伤害性神经纤维支配,这些伤害性神经纤维末梢释放神经肽—降钙素基因相关肽(Calcitonin Gene-Related Peptide, CGRP),P物质,神经激酶A,和垂体腺苷酸环化酶激活肽(Cyclase-activating Peptide, PACAP)引起硬脑膜和软脑膜血管舒张,从而引起偏头痛[14]。
伤害性信息传导首先从位于三叉神经节的初级神经元通过三叉神经束,神经末梢位于三叉神经脊束核尾核(Spinal Trigeminal Nucleus Caudalis, TNC/SP5C)和上颈部脊束核(Upper Cervical Spinal Cord,C1-C2)两个部位,合称三叉颈髓复合体(trigeminocervical complex, TCC),传至次级神经元。伤害性信息经位于TCC区域的次级神经元上行与其他延髓脑桥核包括延髓腹内侧喙端、臂旁核、蓝斑、中脑核、中央导水管周围灰质腹外侧(Ventrolat Periaqueductal Gray, vlPAG)和楔状核相连[15]。
(2)偏头痛下行痛觉调控通路

图2 偏头痛上行、下行痛觉传导调节通路[16]Amygdala, 杏仁核; CeA: the central nucleus of the amygdala, 杏仁中央核; LA: lateral amygdala, 杏仁外侧核; BLA: basolateral amygdala, 杏仁基底外侧核; DRt: dorsal reticular nucleus, 背侧网状核.(引自Ossipov MH, Dussor GO, Porreca F. Journal of Clinical Investigation, 2010)
一些内源性的机制也可以下行调节三叉神经血管伤害性通路,进一步决定信息的性质及程度(见图2[16])。下行痛觉调节通路形成是疼痛易化、抑制的基础,该通路是指下丘脑、杏仁核和前扣带回喙端(Rrostral Anterior Cingulate Cortex, rACC)等区域的信息下行至中脑的中央导水管周围灰质区域,并从该区域汇总信息下行直接或经臂旁核、蓝斑间接至包括中缝大核和巨细胞网状结构核的RVM区。从该区域汇总信息投射到三叉神经脊束核尾核,增强或减弱伤害性通路,改变对外界信息的感受。
PAG-RVM之间神经示踪研究揭示了PAGRVM-TNC均通过背外侧束下行投射[17],且RVM可能是伤害性下行抑制通路脊上位点的最后的共同中继站,接受来自PAG的神经传入。在轻度麻醉的大鼠中,RVM区神经元的活性是否因伤害性刺激而改变(比如对伤害性热的甩尾反应)等研究明确了一类RVM神经元在伤害性反应时激活增强[称为“On(开)细胞”],另一类神经元在伤害性反应时激活减少[称为”Off(关) 细胞”][18],而其他细胞的兴奋与伤害性刺激无关[称为Neutral(中性)细胞][19]。Off细胞和On细胞投射到脊髓背角,下行伤害性传入信号产生调节性影响,除这两者之外,5-HT能神经元也下行投射到TNC区域进行疼痛调节[20]。总之,下行痛觉调节通路的激活,投射到脊髓或者延髓的背角,逆转或者加强原有信息的性质及强度。
2.脊束核-球-脊束核环路与5-HT能神经通路
偏头痛涉及的疼痛上行传导和下行调节机制构成一条脊束核-球-脊束核(spino-bulb-spinal)环路,其信息整合最后中继站为RVM区(见图3[21])。直接电刺激RVM会引起脊髓水平的5-HT释放和伴随的抗疼痛机制[22]。RVM区域的5-HT神经元有疼痛调制作用[23]。由RVM投射到脊束核的5-HT作用不仅与受体亚型有关,也与动物的生理病理状态有关[21],在健康动物中,脊髓的5-HT起疼痛抑制的作用,但是在病理状态,5-HT有时起促痛的作用。中枢敏化的产生可能是由于5-HT下行抑制系统活性减低或缺损,而下行5-HT疼痛调节通路的恢复可以纠正由脊束核损伤引起的神经元的过度兴奋。
迄今为止,5-HT的研究主要集中于疼痛控制的两个中枢水平—脊束核的背角和中脑,这两者在解剖和功能上通过脊髓-脑-脊髓环路相互关联。本团队在偏头痛预防性针刺风池穴单穴的前期研究中发现,偏头痛大鼠脑区内5-HT含量低于对照组,针刺风池穴可减少自发性痛行为,降低 PAG、RMg、 Sp5C 区域 c-Fos 的表达[24],增加 RVM、TNC 区域 5-HT 的含量[9]。不仅如此,最近研究显示,含5-HT细胞主要分布在疼痛调控整合区最后中继站—RVM区内的中缝大核(RMg)中,而且5-HT7受体在此区分布广泛。因此假设,RVM区神经元5-HT合成的选择性抑制,引起了TNC-RVM-TNC的疼痛调控小环路功能失调,同时可认为5-HT7受体信号转导通路与下行疼痛调节通路可能相关[25]。
3.疼痛与5-HT7受体
5-HT7受体是5-HT受体家族最新确认的成员,目前已经被克隆出了很多种类:人类[26],大鼠[27]、小鼠[28]、猪[29]、豚鼠[30]和非洲爪蟾[31]等。在人类中,5-HT7受体基因位于10号染色体(10q21-q24)[26]。它包括三个内含子,其中的两个通过改变拼接方式,成为不同的受体亚型[27],这些亚型在细胞内羧基端的长度是不同的,但是各亚型的药理作用是类似的。
5-HT7受体是G蛋白偶联受体,通过Gαs和Gα12蛋白与下游信号分子偶联[32,33]。在大多数情况下,5-HT7受体和Gαs蛋白偶联,5-HT7受体激活,引起AC活性增加,cAMP的产生[34],进而激活蛋白激酶A (PKA),诱导不同靶蛋白的磷酸化,导致神经保护细胞外信号调节激酶(ERK)[35]和Akt(蛋白激酶B)[36]途径的Ras依赖性和Rap1非依赖性等多个下游信号级联的激活(见图4)。
5-HT7受体在体内通常与其他亚型的5-HT受体及其本身构成异源或者同源二聚体,从而激活不同的信号通路。其中,与5-HT1A受体形成异源二聚体最常见[37]。

图3 脊束核-球-脊束核(spino–bulbo–spinal)环路激活后,启动脑干兴奋性5-HT通路。Parabrachial, 臂旁核。RVM成为下行反馈影响脊束核的主要的中继站[21](引自Suzuki R, Rygh LJ, Dickenson AH. Trends in Pharmacological Sciences, 2004)
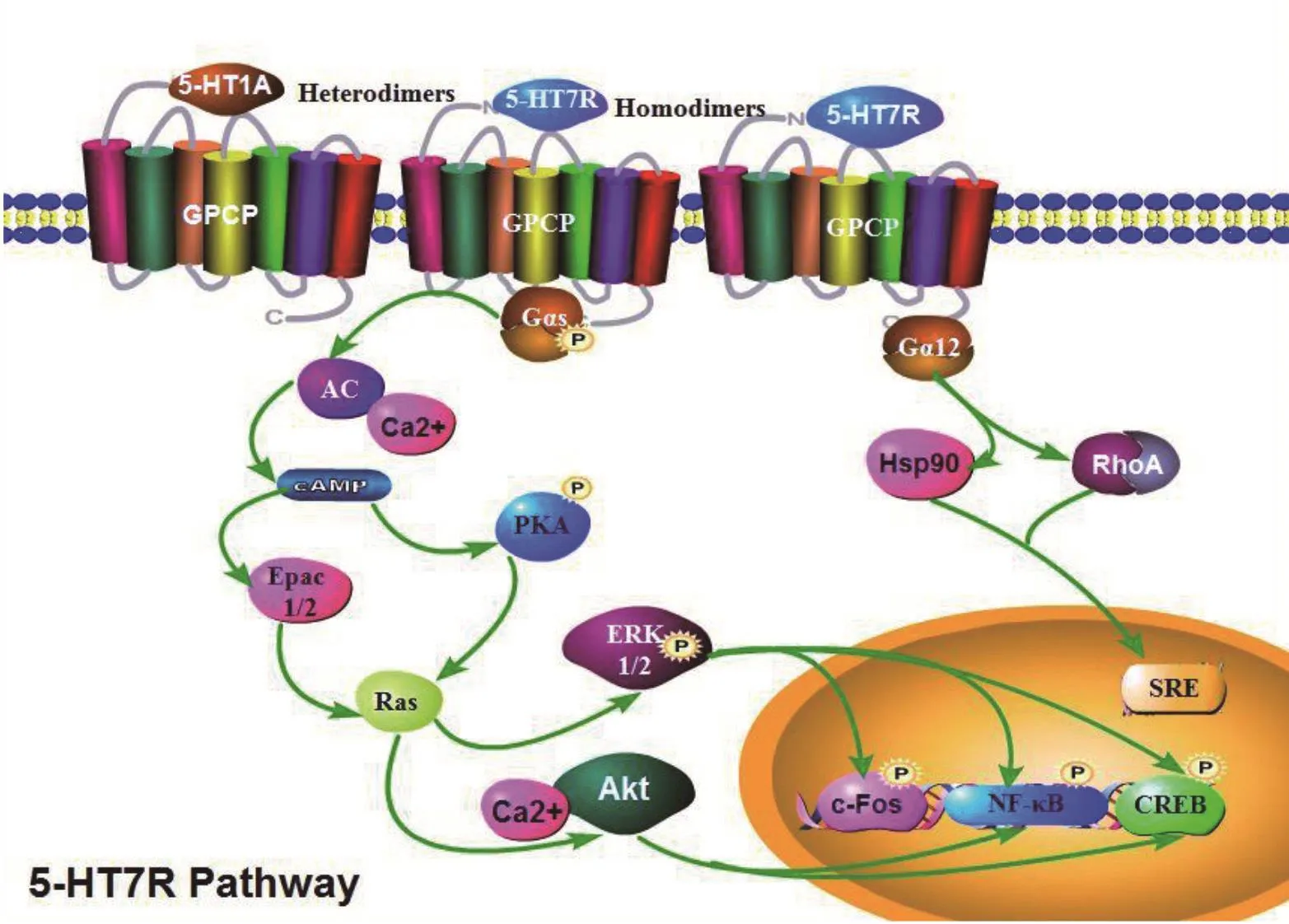
图4 5-HT7受体细胞信号通路模型GPCP:G Protein Coupled Receptor, G蛋白偶联受体;Gαs, Gα刺激蛋白; Gα12, Gα12蛋白; AC:adenylate cyclase,腺苷酸环化酶, cAMP: cyclic adenosine monophosphate, 环磷酸腺苷; PKA: Protein Kinase A, 蛋白激酶A; Epac1/2:cAMP激活的鸟苷酸转换因子; ERK: extracellular signal-regulated kinases, 细胞外信号调节激酶; Hsp90: heat shot shock protein 90, 热休克蛋白90; CREB: cAMP response element-binding protein cAMP, 反应因子结合蛋白; SRE: serum response element, 血清反应因子; Akt: protein kinase B, 蛋白激酶B;RhoA:小鸟苷酸激酶Rho家族成员。(此图为作者原创,引用请注明出处)
PIerce等检测到5-HT7受体mRNA在大鼠和人类的背根神经节中存在[10]。解剖学研究发现,5-HT7受体表达在沿痛觉传导通路的关键突触上。通过精确的电子显微镜发现5-HT7受体位于脊髓背角的无髓鞘和细髓鞘肽能神经纤维突触前膜,肽能细胞胞体和星形细胞突触后膜[38]。在脊髓上水平,5-HT7受体分布在一些皮层,丘脑,中脑,脑桥和延髓等一些核团[39],这些分布特点可能与痛觉调控功能兼容。
在脊髓及外周,5-HT7受体激活主要起促痛作用[38]。这些研究中局部注射选择性的5-HT7受体拮抗剂时,会出现较原有基础炎症痛的促痛作用[11]。5-HT7受体激动剂的研究也表现了5-HT7R通路的局部促痛作用。如在大鼠关节内注射混合的5-HT1A/5-HT7受体的激动剂(8-OH-DPAT),通过激活位于初级痛觉传入纤维周围端的5-HT7受体,增加了c-Fos在脊束核背角的表达[38]。研究还发现,脑池内注射辣椒素之后,静脉注射选择性的5-HT7受体激动剂LP-211,使大鼠三叉神经尾核的表层c-Fos蛋白表达显著增加[40]。除此之外,在向已经注射过5-HT7受体激动剂E-57431的小鼠足底注射辣椒素时,会出现明显的促痛效应[41]。
与之相反,有一些实验却认为系统性注射5-HT7受体拮抗剂(SB-269970 和SB-258719)会增加辣椒素引起的小鼠敏化或者神经损伤相关的机械性感觉敏化[41]。首先,鞘内注射SB-269970药理性拮抗脊髓的5-HT7受体,会消除静脉注射吗啡,曲马多或者大麻素产生的镇痛效应,并通过行为学测试甩尾实验等获取数据支持[25]。与5-HT7受体在脊束核激活产生的镇痛效应一致,鞘内注射5-HT7受体激动剂E-57431和E-55888,发现可以抑制继发于辣椒素注射和神经损伤大鼠和小鼠中的机械性感觉敏化[12],国内学者也有一致的发现[42]。除此之外,AS19可以减轻链脲佐菌素诱导的实验性糖尿病小鼠的热痛觉超敏现象,说明5-HT7受体激动剂可能治疗糖尿病周围神经病变疼痛是有效的[43]。
事实上,5-HT7受体激活呈兴奋性,应表现为促痛性效应,而不应直接抑制初级传入神经或者伤害性的背根神经元发挥整体的抑痛效应[38]。目前,两个可能的机制被提出以解释这些发现[44]:一是5-HT7受体触发快速的脱敏现象;二是通过激动剂或5-HT7受体,介导抑制性神经元的兴奋。首先,5-HT7受体下调已经在一些研究中被描述(比如氟西汀治疗21天之后的下丘脑[45])。5-HT7受体长时程激活之后,即使没有受体下调也会出现脱敏现象[46]。其次,5-HT7受体激活可能产生了一个5-HT再摄取的间接抑制作用,因此增加了细胞外的5-HT受体水平,并且长时间激活,镇痛效应会消失[47]。尽管5-HT7受体脱敏在治疗中常常出现,然而反复系统性的注射选择性5-HT7R激动剂到神经损伤的小鼠和大鼠中,证明了这些配体的镇痛效果并没有耐受性[12,41]。与第二个假设一致,通过特异性抗体双标免疫细胞化学方法发现,在脊束核背角内,5-HT7受体通过中间神经元被表达[12,41],特别是通过GABA能神经元[12]。如预期所言,不同状态下AS19的促痛和镇痛效应都能被特异性拮抗剂SB-269970拮抗。
4.偏头痛与5-HT7受体
5-HT7受体与偏头痛相关研究较少,研究范围以属于外周神经系统的硬脑膜及其血管上分布的伤害性感受器为主。由于颅内血管扩张是偏头痛病理机制之一,有研究发现5-HT7受体在外周激活可以诱导血管扩张,5-HT7受体拮抗剂可抑制5-CT(5-HT1A和5-HT7受体共同激动剂)引起的大脑中动脉的扩张[47],所以认为5-HT7受体激动剂可以诱发类似于偏头痛疼痛的产生,而5-HT7受体拮抗剂有抑制作用。研究还发现,5-HT7受体拮抗剂(SB-269970)能拮抗电刺激硬脑膜和三叉神经造成的偏头痛模型大鼠诱发的神经源性的硬脑膜血管扩张,5-HT7受体激动剂会使其扩张增加[48]。除此之外,预注射5-HT7受体拮抗剂(SB-269970)能降低电刺激三叉神经节偏头痛模型大鼠产生的CGRP水平,同时AS19可以逆转SB-269970的作用,这些均提示了5-HT7受体拮抗剂在偏头痛发作之前有预防作用[49]。然而,这些实验只是5-HT7受体在周围神经及血管层面和正常健康大鼠中激活产生的作用,实验中并未涉及中枢神经系统尤其是脊上水平和已经发生偏头痛产生痛觉敏化的大鼠。因此,目前确认5-HT7受体与偏头痛的关系还为时尚早。
偏头痛是一种神经性功能障碍,以下行痛觉调控通路失调为主。由于RVM是下行痛觉调节通路最后的中继站,决定感觉的类型和强度,所以RVM区域未能发挥正常的痛觉调制作用是本疾病病理机制的核心。总之,5-HT7受体在调节疼痛方面的作用比较复杂。在敏化的神经病理痛状态下,5-HT7受体在脊束核以上水平激活获得表现出抗疼痛效应,而正常状态下,激活周围结构的5-HT7受体会产生促痛作用。不仅如此,在系统性注射5-HT7受体激动剂后,通过中枢5-HT7受体介导的抗疼痛效应似乎占优势。参考5-HT7受体在神经病理性疼痛及炎症性疼痛所致痛觉敏化中的表现,我们可以推断在病理情况下,5-HT7受体在下行疼痛调节通路在最后中继站RVM呈抗痛觉敏化效应(见图5[44])。一般认为,当发生痛觉敏化时,外周伤害感受器信号激活5-HT能下行系统和抑制性GABA能中间神经元。在慢性神经性病理痛期间,GABA能中间神经元过度活化[50],因此对脊髓内突触下游的5-HT能神经元产生强烈的抑制作用,从而使5-HT能神经元分泌的5-HT减少,产生痛觉敏化。然而5-HT7受体激动剂可以直接激活胞体-树突的5-HT7受体触发异二聚体5-HT7与5-HT1A受体二联体的内化[37],使其在5-HT能神经元内,引发GABAA受体的磷酸化依赖性脱敏,从而拮抗GABA中间神经元对下行5-HT能通路的抑制作用,从而使RVM区5-HT表达分泌增加,下行至TNC区起疼痛抑制作用。虽然需要补充实验来评估其在偏头痛痛觉敏化状况下是否发生,但这种机制可以解释慢性压迫性坐骨神经损伤大鼠中激活5-HT7受体从而恢复5-HT介导的慢性疼痛的下行抑制作用的过程[12]。
5.总结
偏头痛是一个复杂的神经功能障碍,单纯靠现有的药物无法满足病人的需要,寻找新的作用机制和治疗靶点,尽早摆脱偏头痛难题迫在眉睫。通过对近50年来5-HT7R方面的文献进行搜索分析,其在病理痛状态下的整体及中枢部位主要起抑痛的作用。不仅如此,目前认为,5-HT7受体在疼痛方面作用机制比较复杂。在正常状态下外周局部组织主要起促痛作用的研究中大多与偏头痛的发病相关,认为外周硬脑膜等部位的5-HT7受体激活会引起偏头痛的发生。然而,在已经形成偏头痛的中枢敏化的状态下,中枢部位的5-HT7R的作用机制仍待进一步的研究和探索。这种趋势和未知也鼓舞着更多科学研究者设计逻辑缜密,方法科学的实验,为5-HT7R与偏头痛的研究贡献出自己的力量。

图5 5-HT7受体RVM-TNC区5-HT7R抑制性疼痛调节通路模型[44] (引自Viguier F, Michot B, et al. European Journal of Pharmacology, 2013)
[1]Liu R, Yu S, He M,et al. Health-care utilization for primary headache disorders in China: a populationbased door-to-door survey. J Headache Pain, 2013,14:47.
[2]Hagen K, Zwart JA, Vatten L,et al. Prevalence of migraine and non-migrainous headache--head-HUNT,a large population-based study. Cephalalgia, 2000,20:900~906.
[3]Dahlem MA, Kurths J, Ferrari MD,et al. Understanding migraine using dynamic network biomarkers.Cephalalgia, 2015, 35:627~630.
[4]Schulte LH, Sprenger C, May A. Physiological brainstem mechanisms of trigeminal nociception: An fMRI study at 3T. Neuroimage, 2016 , 124(Pt A):518~525.
[5]Cernuda-Morollon E, Larrosa D, Ramon C,et al.Interictal increase of CGRP levels in peripheral blood as a biomarker for chronic migraine. Neurology, 2013,81:1191~1196.
[6]Burstein R, Jakubowski M, Garcia-Nicas E,et al.Thalamic sensitization transforms localized pain into widespread allodynia. Ann Neurol, 2010, 68:81~91.
[7]Melo-Carrillo A, Lopez-Avila A. A chronic animal model of migraine, induced by repeated meningeal nociception, characterized by a behavioral and pharmacological approach. Cephalalgia, 2013, 33:1096~1105.
[8]Hamel E. Serotonin and migraine: biology and clinical implications. Cephalalgia, 2007, 27:1293~1300.
[9]Liu L, Pei P, Zhao L,et al. Electroacupuncture Pretreatment at GB20 Exerts Antinociceptive Effects via Peripheral and Central Serotonin Mechanism in Conscious Migraine Rats. Evid-Based Compl Alt Med,2016, 2016:1~10.
[10]Pierce PA, Xie GX, Meuser T,et al. 5-Hydroxytryptamine receptor subtype messenger RNAs in human dorsal root ganglia: a polymerase chain reaction study. Neuroscience, 1997, 81:813~819.
[11]Rocha-Gonzalez HI, Meneses A, Carlton SM,et al.Pronociceptive role of peripheral and spinal 5-HT7 receptors in the formalin test. Pain, 2005, 117:182~192.
[12]Viguier F, Michot B, Kayser V,et al. GABA, but not opioids, mediates the anti-hyperalgesic effects of 5-HT7 receptor activation in rats suffering from neuropathic pain. Neuropharmacology, 2012, 63:1093~1106.
[13]Goadsby PJ, Holland PR, Martins-Oliveira M,et al.Pathophysiology of Migraine: A Disorder of Sensory Processing. Physiol Rev, 2017, 97:553~622.
[14]Uddman R, Goadsby PJ, Jansen I,et al. PACAP, a VIP-like peptide: immunohistochemical localization and effect upon cat pial arteries and cerebral blood flow. J Cereb Blood Flow Metab, 1993, 13:291~297.
[15]Liu Y, Broman J, Zhang M,et al. Brainstem and thalamic projections from a craniovascular sensory nervous centre in the rostral cervical spinal dorsal horn of rats. Cephalalgia, 2009, 29:935~948.
[16]Ossipov MH, Dussor GO, Porreca F. Central modulation of pain. Journal of Clinical Investigation, 2010,120:3779~3787.
[17]Sandkuhler J, Gebhart GF. Relative contributions of the nucleus raphe magnus and adjacent medullary reticular formation to the inhibition by stimulation in the periaqueductal gray of a spinal nociceptive re flex in the pentobarbital-anesthetized rat. Brain Res, 1984,30577~30587.
[18]Potrebic SB, Mason P, Fields HL. The density and distribution of serotonergic appositions onto identi fi ed neurons in the rat rostral ventromedial medulla. J Neurosci, 1995, 15(5 Pt 1):3273~3283.
[19]Fields HL, Malick A, Burstein R. Dorsal horn projection targets of ON and OFF cells in the rostral ventromedial medulla. J Neurophysiol, 1995, 74:1742~1759.
[20]Foo H, Mason P. Brainstem modulation of pain during sleep and waking. Sleep Med Rev, 2003, 7:145~154.
[21]Suzuki R, Rygh LJ, Dickenson AH. Bad news from the brain: descending 5-HT pathways that control spinal pain processing. Trends Pharmacol Sci, 2004, 25:613~617.
[22]Cui M, Feng Y, McAdoo D J,et al. Periaqueductal gray stimulation-induced inhibition of nociceptive dorsal horn neurons in rats is associated with the release of norepinephrine, serotonin, and amino acids. J Pharmacol Exp Ther, 1999, 289:868~876.
[23]Jensen TS, Yaksh TL. Spinal monoamine and opiate systems partly mediate the antinociceptive effects produced by glutamate at brainstem sites. Brain Res,1984, 321:287~297.
[24]Pei P, Liu L, Zhao L,et al. Effect of electroacupuncture pretreatment at GB20 on behaviour and the descending pain modulatory system in a rat model of migraine.Acupunct Med, 2016, 34:127~135.
[25]Dogrul A, Ossipov MH, Porreca F. Differential mediation of descending pain facilitation and inhibition by spinal 5HT-3 and 5HT-7 receptors. Brain Res, 2009,1280:52~59.
[26]Bard JA, Zgombick J, Adham N,et al. Cloning of a novel human serotonin receptor (5-HT7) positively linked to adenylate cyclase. J Biol Chem, 1993,268:23422~23426.
[27]Ruat M, Traiffort E, Leurs R,et al. Molecular cloning,characterization, and localization of a high-affinity serotonin receptor (5-HT7) activating cAMP formation.Proc Natl Acad Sci U S A, 1993, 90:8547~8551.
[28]Plassat JL, Amlaiky N, Hen R. Molecular cloning of a mammalian serotonin receptor that activates adenylate cyclase. Mol Pharmacol, 1993, 44:229~236.
[29]Bhalla P, Saxena PR, Sharma HS. Molecular cloning and tissue distribution of mRNA encoding porcine 5-HT7 receptor and its comparison with the structure of other species. Mol Cell Biochem, 2002, 238:81~88.
[30]Tsou AP, Kosaka A, Bach C,et al. Cloning and expression of a 5-hydroxytryptamine7 receptor positively coupled to adenylyl cyclase. J Neurochem, 1994,63:456~464.
[31]Nelson CS, Cone RD, Robbins LS,et al. Cloning and expression of a 5HT7 receptor from Xenopus laevis.Receptors Channels, 1995, 3:61~70.
[32]Kvachnina E, Dumuis A, Wlodarczyk J,et al. Constitutive Gs-mediated, but not G12-mediated, activity of the 5-hydroxytryptamine 5-HT7(a) receptor is modulated by the palmitoylation of its C-terminal domain. Biochim Biophys Acta, 2009, 1793:1646~1655.
[33]Kvachnina E, Liu G, Dityatev A,et al. 5-HT7 receptor is coupled to G alpha subunits of heterotrimeric G12-protein to regulate gene transcription and neuronal morphology. J Neurosci, 2005, 25:7821~7830.
[34]Shen Y, Monsma FJ, Metcalf M A,et al. Molecular cloning and expression of a 5-hydroxytryptamine7 serotonin receptor subtype. J Biol Chem, 1993,268:18200~18204.
[35]Lin SL, Johnson-Farley NN, Lubinsky DR,et al.Coupling of neuronal 5-HT7 receptors to activation of extracellular-regulated kinase through a protein kinase A-independent pathway that can utilize Epac. J Neurochem, 2003, 87:1076~1085.
[36]Johnson-Farley NN, Kertesy SB, Dubyak GR,et al.Enhanced activation of Akt and extracellular-regulated kinase pathways by simultaneous occupancy of Gqcoupled 5-HT2A receptors and Gs-coupled 5-HT7A receptors in PC12 cells. J Neurochem, 2005, 92:72~82.
[37]Renner U, Zeug A, Woehler A,et al. Heterodimerization of serotonin receptors 5-HT1A and 5-HT7 differentially regulates receptor signalling and traf fi cking. J Cell Sci,2012, 125(Pt 10):2486~2499.
[38]Meuser T, Pietruck C, Gabriel A,et al. 5-HT7 receptors are involved in mediating 5-HT-induced activation of rat primary afferent neurons. Life Sci, 2002, 71:2279~2289.
[39]Martin-Cora FJ, Pazos A. Autoradiographic distribution of 5-HT7 receptors in the human brain using [3H]mesulergine: comparison to other mammalian species.Br J Pharmacol, 2004, 141:92~104.
[40]Martinez-Garcia E, Leopoldo M, Lacivita E,et al.Increase of capsaicin-induced trigeminal Fos-like immunoreactivity by 5-HT(7) receptors. Headache,2011, 51:1511~1519.
[41]Brenchat A, Nadal X, Romero L,et al. Pharmacological activation of 5-HT7 receptors reduces nerve injuryinduced mechanical and thermal hypersensitivity. Pain,2010, 149:483~494.
[42]肖智, 文松. 中脑导水管周围灰质5-HT-7受体在神经病理性疼痛中的镇痛作用研究. 中国疼痛医学杂志 , 2014, 12(11):861~865.
[43]Ulugol A, Oltulu C, Gunduz O,et al. 5-HT7 rece-ptor activation attenuates thermal hyperalgesia in streptozocin-induced diabetic mice. Pharmacol Biochem Behav,2012, 102:344~348.
[44]Viguier F, Michot B, Hamon M,et al. Multiple roles of serotonin in pain control mechanisms-Implications of 5-HT7 and other 5-HT receptor types. European Journal of Pharmacology, 2013, 716:8~16.
[45]Sleight AJ, Carolo C, Petit N,et al. Identification of 5-hydroxytryptamine7 receptor binding sites in rat hypothalamus: sensitivity to chronic antidepressant treatment. Mol Pharmacol, 1995, 47:99~103.
[46]Iceta R, Mesonero JE, Aramayona JJ,et al. Expression of 5-HT1A and 5-HT7 receptors in Caco-2 cells and their role in the regulation of serotonin transporter activity. J Physiol Pharmacol, 2009,60(1):157~164.
[47]Bosker FJ, Folgering JH, Gladkevich AV,et al. Antagonism of 5-HT(1A) receptors uncovers an excitatory effect of SSRIs on 5-HT neuronal activity, an action probably mediated by 5-HT(7) receptors. J Neurochem,2009,108(5):1126~1135.
[48]Wang X, Fang Y, Liang J,et al. 5-HT7 Receptors Are Involved in Neurogenic Dural Vasodilatation in an Experimental Model of Migraine. Journal of Molecular Neuroscience, 2014,54(2):164~170.
[49]Wang X, Fang Y, Liang J,et al. Selective Inhibition of 5-HT7 Receptor Reduces CGRP Release in an Experimental Model for Migraine. Headache: J Head Face Pain, 2010,50(4):579~587.
[50]Saade NE, Al AH, Barchini J,et al. Brainstem injection of lidocaine releases the descending pain-inhibitory mechanisms in a rat model of mononeuropathy. Exp Neurol, 2012,237(1):180~190.

