14例电压门控钾通道复合物相关抗体自身免疫性脑炎临床分析
彭丽丹 刘宇 李京红 王梦涵 卢宏
自身免疫性脑炎是一种与神经元细胞表面抗体和突触蛋白抗体相关的自身免疫性疾病,其靶位是参与突触传递和神经元兴奋的蛋白质和受体。近年来已发现10余种新型细胞外抗体,如富亮氨酸胶质瘤失活蛋白1(leucine-rich glioma-inactivated 1,LGI1)和接触蛋白相关蛋白2(contactin-associated protein-like 2,Caspr2)抗体等[1-2]。LGI1和Caspr2抗体引起的疾病既往被归因于电压门控钾通道(antibodies against voltage-gated potassium channels, VGKCs)抗体,2010年Irani等[1]和Lai等[2]发现致病性抗体并非针对VGKC本身,而是其亚基相关蛋白LGI1和Caspr2。遂将LGI1抗体、Caspr2抗体、VGKC抗体三种统称为VGKC复合物相关抗体,并将其所引起的疾病依据患者体内抗体不同被分为LGI1抗体阳性、Caspr2抗体阳性,VGKC抗体阳性但LGI1、Caspr2抗体均阴性患者三个亚类。目前VGKC复合物相关抗体的自身免疫性脑炎,尤其是Caspr2抗体相关自身免疫性脑炎,国内报道相对较少。本文通过回顾性分析作者医院收治的14例VGKC复合物相关抗体阳性的自身免疫性脑炎患者,包括LGI1抗体脑炎13例、Caspr2抗体脑炎1例,并结合国内外文献总结分析其临床特点,期望有助于加强临床医生对本病的认识。
1 对象和方法
1.1观察对象收集2015-11—2017-09期间郑州大学第一附属医院神经内科确诊的VGKC复合物相关抗体阳性的自身免疫性边缘叶脑炎患者14例,包括LGI1抗体阳性患者13例、Caspr2抗体阳性患者1例的临床资料。所有患者均符合2016年柳叶刀神经病学杂志提出的自身免疫性脑炎诊断标准[3-4]:(1)亚急性起病(3个月内快速进展),提示边缘系统受累的症状,如记忆障碍、癫痫发作或精神症状;(2)T2加权FLAIR像表现为大脑双侧局限于内侧颞叶的异常信号,或脑FDG-PET提示内侧颞叶高代谢;(3)脑脊液细胞数增多(白细胞数>5/mm3)或EEG显示颞叶痫性放电或慢波;(4)排除其他可能病因。如果不具备上述(1)~(3)中的其中一条,但具有抗神经元胞膜、突触蛋白抗体或肿瘤神经抗体阳性,并可排除其他可能的病因者,亦可直接确诊为自身免疫性脑炎。
1.2方法所有患者均随访至随访至2017年10月。回顾性分析14例患者的临床资料,主要包括性别、年龄、临床表现、实验室检查结果、治疗及预后转归等。
于治疗前后采用改良Rankin评分(mRS)对患者进行神经功能评估,治疗后评分≤2分为转归良好。
2 结果
2.1一般资料分析14例患者部分资料见表1。14例患者均为男性,年龄48~69岁,平均(61.3±6.7)岁,起病至确诊时间23~93 d,起病至确诊中位时间39.5 d,四分位数间距11 d。其中有高血压病史5例(L1、L2、L7、L9、L10),糖尿病史2例(L3、L5),头部外伤史2例L8、L12,余既往史无特殊。
2.2临床特点14例患者均为亚急性起病(病程<3个月),其中3例(L1、L2、L13)以劳累、1例(L4)以情绪激动为诱因。有前驱症状者4例,均发生于起病前2~5个月,3例表现为阵发性头晕、心慌、纳差等非特异性症状,1例表现为严重的发作性心动过缓需行心脏起搏器植入术。以边缘系统症状起病10例(以癫痫发作起病6例,认知障碍起病3例,精神行为异常起病1例),以面臂肌张力障碍发作(FBDS)起病2例,以低钠血症,四肢无力、肌肉不自主跳动起病各1例。13例(93%)患者病程中至少出现癫痫发作、认知障碍、精神症状中的1项,其中12例患者出现不同程度的认知功能障碍,主要表现为记忆力、计算力、定向力减退及反应迟钝;8例出现癫痫发作;6例出现精神行为异常(胡言乱语5例,行为异常2例,幻觉1例)。10例有睡眠障碍(失眠、睡眠增多)。8例患者出现自主神经功能障碍,其中6例出现心律失常(窦性心动过速3例,心动过缓2例,房性/室性早搏4例),2例出现严重便秘并发生肠梗阻,2例表现为多汗。入院时mRS 3~5分12例,2分2例。
2.3实验室检查
2.3.1血清学及脑脊液检查:6例患者出现低钠血症。2例合并其他自身抗体异常〔L5抗甲状腺过氧化物酶抗体87.71 IU/mL(正常参考值 0~34 IU/mL),抗甲状腺球蛋白抗体329.40 IU/mL(正常参考值0~115 IU/mL),甲状腺球蛋白0.11 μg/L(正常参考值3.5~77.0 μg/L);L8甲状腺球蛋白0.11 μg/L〕。
除L3患者拒绝外,余13例均行腰椎穿刺术。其中2例颅压轻度升高(190 mmH2O、220 mmH2O),1例白细胞计数轻度升高(8×106/L),7例蛋白轻度升高〔0.49~0.84 g/L,正常值(0.15~0.45)g/L〕,5例淋巴细胞比例轻度增高(72%~80%,正常参考值60%~70%)。6例行脑脊液副肿瘤抗体检查,其中1例抗-PNMA2(Ma/Ta)可疑阳性(±);7例查脑脊液电泳均为阴性。14例患者中13例行脑脊液自身免疫性脑炎抗体检测(间接免疫荧光法)、4例行血清检测,其中例C1为Caspr2抗体阳性(脑脊液),余均为LGI1抗体阳性,3例脑脊液和血清LGI1抗体均阳性,1例仅检测血清,血清LGI1抗体阳性,余9例脑脊液LGI1抗体阳性。3例患者血肿瘤标志物轻度异常,例L4总前列腺特异性抗原2.420 ng/mL;游离前列腺特异抗原0.36 ng/mL;例L11神经元特异性烯醇化酶46.11 ng/nL(正常参考值0~25 ng/nL),例L12非小细胞肺癌抗原3.85 ng/mL(正常参考值0.1~3.3 ng/mL),铁蛋白615.60 ng/mL(正常值30~400 ng/mL)。
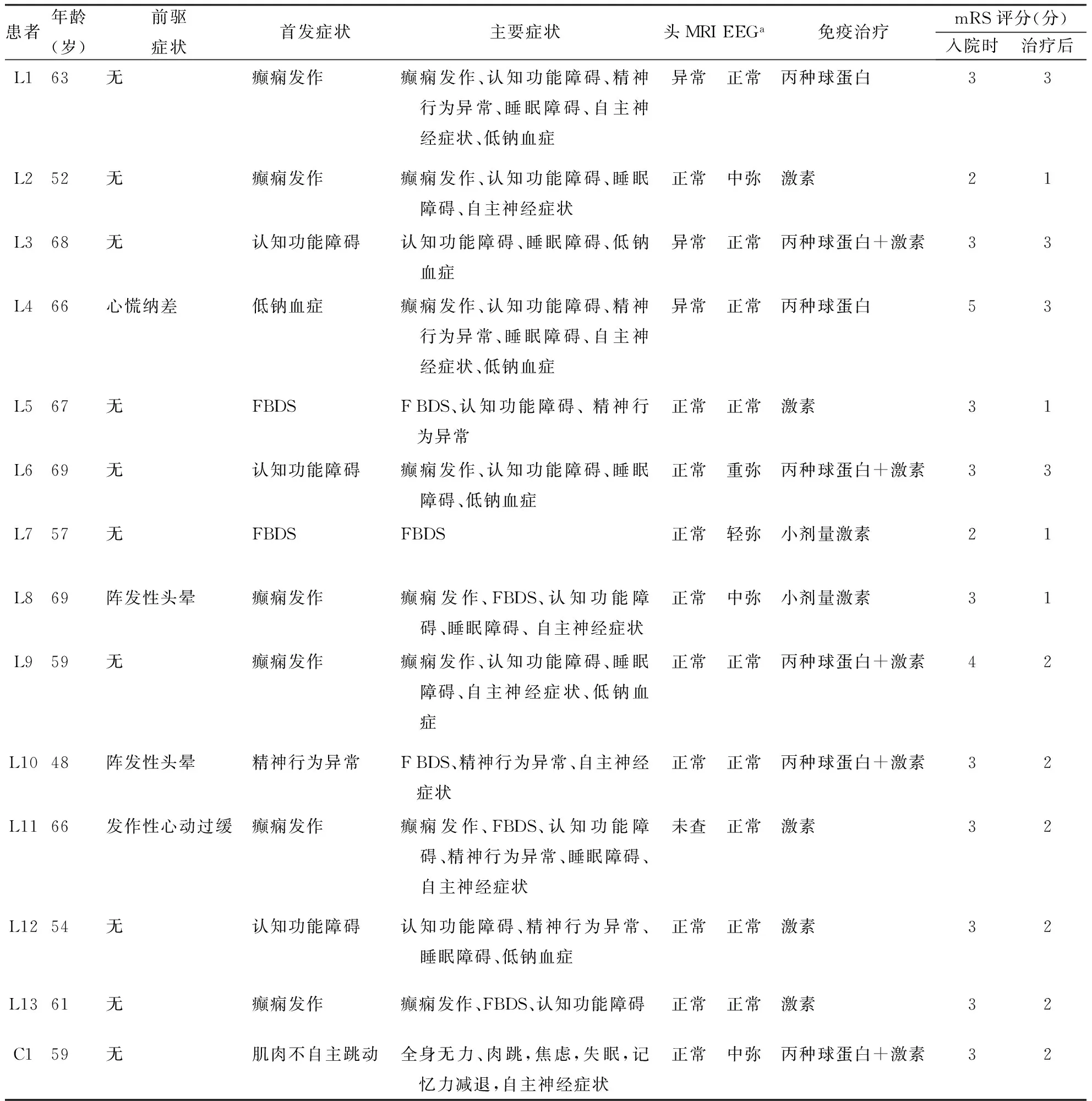
表1 14例VGKC复合物抗体相关自身免疫性脑炎患者部分资料比较
注:患者均为男性;激素:糖皮质激素的简称,后文同;丙种球蛋白剂量及用法:按0.4 g·(kg·d)连续静脉滴注5 d;激素剂量及用法:甲泼尼龙500mg静脉滴注5 d递减至停用;小剂量激素剂量及用法:甲泼尼龙80mg静脉滴注5 d递减至停用;mRS评分≤2分为转归良好;a轻、中、重弥指轻、中、重度弥漫性慢波
2.3.2影像学检查:除例L11因植入心脏起搏器未行头MRI,余均行头MRI检查:其中3例异常,L1表现为右侧颞叶及海马、右侧基底节异常信号(图1),2例(L3、L4)表现为基底节异常信号;5例行增强MRI,L1见可见右侧基底节区片状强化影,余均未见明显强化。所有患者均行胸部CT、腹部CT或彩超、睾丸超声,均未发现肿瘤相关表现。2例行PET-CT,其中1例示右侧尾状核头部及苍白球代谢减低,1例脑实质内未见异常。所有患者均行脑电图(EEG)检查,5例表现为不同程度的弥漫性慢波,L7为轻度,L2、L8、C1为中度,L6为重度。

图 1 例L1患者的头MRI表现:患者头T2 FLAIR像显示右侧海马(A)、右侧基底节区(B)高信号, T1增强像(C)显示右侧基底节区片状强化影
2.4治疗及随访具体见表1。14例患者中,5例使用激素联合丙种球蛋白治疗,7例单用激素、2例单用丙种球蛋白治疗,并对合并癫痫、高级智能障碍的患者进行对症处理,营养支持治疗等。
随访结果:14例患者中,10例患者预后良好,mRS评分1~2分,无症状或轻度智能减退,生活可自理;4例预后不良,mRS评分3分,仍存在不同程度认知障碍,可行走,生活不能自理,其中例L6于首次因记忆力减退、发作性抽搐伴意识丧失2个月于作者医院诊为LGI1脑炎后,予以丙种球蛋白0.4 g/(kg·d)连续静脉滴注5 d,甲泼尼龙500 mg静脉滴注5 d递减至停用,仅遗留轻微反应迟钝、记忆力轻度减退,首次发病6个月后复发,症状基本同前,再次采用上述免疫治疗后患者癫痫未再发作,认知障碍改善不明显,mRS评分3分,预后不良。
3 讨论
3.1病因及发病机制VGKC复合物抗体于1995年被Shillito等首次报道,见于获得性神经性肌强直患者体内[5]。随后研究发现该患者的致病性抗体并非针对VGKC本身,而是针对其相关蛋白LGI1和Caspr2。LGI1是一种神经元分泌蛋白,它和突触前去整合素金属蛋白酶(a disintegrin and metalloproteinase,ADAM)11、ADAM23及突触后ADAM22一同构成跨突触复合物,在神经元兴奋的突触间传递发挥作用[6]。LGI1抗体的致病机制尚不明确。有研究表明在大鼠海马神经元中,LGI1抗体可通过作用于LGI1的表位及亮氨酸重复域,抑制LGI1和ADAM22或ADAM23之间的配体-受体相互作用,导致体内突触间α-氨基-3 羟基-5 甲基-4 异恶唑受体(AMPAR)蛋白聚集减少,而LGI1脑炎患者癫痫发作的主要原因即为抑制性神经元中AMPARs的降低[7-8]。Caspr2是轴突蛋白Ⅳ超家族的一种细胞黏附分子,它和接触蛋白2(ontactin-2)共同构成跨突触复合物,介导KV1.1 和KV1.2 VGKCs在有髓轴突的近节侧区的聚集。Caspr2还广泛表达于中枢神经系统的抑制性神经元,连接突触前膜的接触蛋白2和突触后膜的桥尾蛋白(gephyrin),可能作为突触网络形成中的细胞识别分子发挥重要作用[9]。Caspr2抗体可能通过抑制Caspr2的功能或阻止蛋白间的相互作用产生致病性。
3.2临床特点仅VGKC复合物抗体阳性是否能作为疾病的标志物尚不明确,尽管LGI1和Caspr2抗体分别可引起不同的临床综合征[10]。既往多报道LGI1、Caspr2抗体多见于中老年男性[11-15],也有女性稍多的报道[16]。本组患者均为男性。儿童体内LGI1、Caspr2抗体罕见,因此并不建议对癫痫或脑炎的儿童常规进行抗体筛查[11],这与NMDA受体脑炎主要累及青少年患者不同。Gadoth等[14]认为本病中较大年龄与中枢神经系统累及相关。他们通过观察256例LGI1/Caspr2抗体阳性的患者发现,50岁以上的患者中91%有中枢神经系统表现,而低于50岁患者中,有中枢神经系统表现仅为54%。本研究中14例患者均为中老年男性,其中大于50岁13例,除1例仅表现为FBDS外,余12例(92%)均有中枢神经系统受损表现(癫痫发作、认知功能减退、精神行为异常等),与上述报道基本相符。
LGI1抗体脑炎主要表现为典型边缘叶脑炎(癫痫发作,记忆、行为改变,空间定向力障碍等),常伴FBDS、低钠血症。FBDS是LGI1脑炎的特征表现之一,表现为一侧面部和上肢(或下肢)的不自主收缩,持续约数秒钟,每天可发作100余次,常发生于认知障碍之前[17],抗癫痫药物对其疗效不佳,免疫治疗可能有效。低钠血症是LGI1脑炎的另一重要表现,本组14例患者中6例患者出现低钠血症,对症治疗效果欠佳,经免疫治疗后好转。因此对于无明显诱因出现顽固性低钠血症的患者,应考虑LGI1抗体脑炎可能。
Caspr2抗体疾病主要表现为边缘叶脑炎和Morvan 综合征,约77%患者至少有以下核心症状的三种:大脑症状(认知障碍、癫痫),小脑症状,周围神经兴奋性增高,自主神经功能损害,失眠,神经性疼痛,体重减轻[12]。此类疾病较为罕见,目前全球共报道约150~200例患者[11]。本组资料中有1例作者医院诊断的Caspr2抗体相关自身免疫性脑炎患者,表现为亚急性起病的全身无力、肉跳,记忆力减退,伴窦性心动过速、严重便秘、焦虑、失眠,查脑脊液Caspr2抗体阳性,为上述观点提供了更多的临床资料。
LGI1/Caspr2抗体脑炎的自主神经功能损害症状包括胃排空异常(早饱、恶心、便秘)、多汗、心律失常、血压变化等[12,14]。本组8例患者(57%)出现自主神经功能障碍,提示这在本病中并不少见。本组例L11起病前因晕厥3次至当地医院就诊发现严重心动过缓,行心脏起搏器植入术后好转,2个月后出现癫痫发作、答非所问、意识错乱、近记忆力减退等,作者医院查脑脊液LGI1抗体阳性,诊断为抗LGI1抗体自身免疫性脑炎。Naasan等[18]和Nilsson等[19]分别于2014、2015年先后报道了类似现象,这在其他类型自身免疫性脑炎中较为罕见。Naasan等认为发作性心动过缓是一种继发于颞叶、岛叶病变的痫性发作,可能定位于岛叶、颞叶及大脑皮层中调节心脏自主神经功能的区域,是LGI1抗体脑炎的一个显著的前驱症状等[18]。
3.3实验室检查常规实验室检查多为正常。脑脊液检查可见细胞数和蛋白轻度升高,大多患者脑脊液检查并无特殊表现。头MRI典型表现多为内侧颞叶、海马高信号,既往报道发生率不一,本组仅1例出现上述典型改变。尚有报道显示氟代脱氧葡萄糖-正电子发射型计算机断层显像(F-18-FDG-PET)和动态自旋标记(ASL)磁共振序列可发现伴癫痫发作的LGI1脑炎患者海马和杏仁核高代谢/超灌注[20],其敏感性和特异性仍需后续大样本临床研究来加以明确。另有研究显示约一半患者出现脑电图改变,多表现为痫性放电或局灶性慢波[11],加做蝶骨电极可能提高阳性率。LGI1/Caspr2抗体检查对确诊帮助较大,建议对亚急性起病,表现为边缘叶脑炎症状和(或)肌肉颤搐、不明原因自主神经功能损害症状的中老年男性患者早期进行相关抗体检查。本病较少伴发肿瘤[13,16],LGI1、Caspr2抗体阳性患者肿瘤发生率分别为13%、20%,LGI1、Caspr2抗体双阳性患者则为44%,多为胸腺瘤[14]。本组患者均未发现肿瘤,这与既往报道一致。
3.4治疗和预后早期诊断对治疗和预后较为有利。目前认为一线治疗方案为静脉注射丙种球蛋白、类固醇激素、二者联用或血浆置换,二线方案为环磷酰胺或利妥昔单抗,伴发肿瘤者应积极进行肿瘤相关治疗。LGI1、Caspr2抗体脑炎患者均可出现复发,复发率分别为35%、25%[12,15],复发后再次免疫治疗疗效尚不明确。
综上所述,VGKC相关抗体的自身免疫性脑炎是一种亚急性起病,中老年男性多见,表现为边缘叶脑炎(癫痫发作、认知障碍、精神症状)和(或)肌肉颤搐、不明原因自主神经功能损害的可治性疾病,免疫治疗有效,可复发。该病目前仍较为少见,临床应予关注。
参考文献:
[1]Irani SR, Alexander S, Waters P, et al. Antibodies to Kv1 potassium channel-complex proteins leucine-rich, glioma inactivated 1 protein and contactin-associated protein-2 in limbic encephalitis,Morvan’s syndrome and acquired neuromyotonia[J]. Brain, 2010, 133(9):2734-2748.
[2]Lai M, Huijbers MG, Lancaster E, et al. Investigation of LGI1 as the antigen in limbic encephalitis previously attributed to potassium channels:a case series[J]. Lancet Neurol, 2010, 9(8):776-785.
[3]Graus F, Titulaer MJ, Balu R, et al. A clinical approach to diagnosis of autoimmune encephalitis[J]. Lancet Neurol, 2016, 15(4):391-404.
[4]陈向军,邓波. 自身免疫性脑炎的诊断标准及其临床指导意义[J]. 中国临床神经科学, 2016, 24(3):336-340.
[5]Shillito P, Molenaar PC, Vincent A, et al. Acquired neuromyotonia:evidence for autoantibodies directed against K+channels of peripheral nerves[J]. Ann Neurol, 1995, 38(5):714-722.
[6]Sagane K, Ishihama Y, Sugimoto H. LGI1 and LGI4 bind to ADAM22, ADAM23 and ADAM11[J]. Int J Biol Sci, 2008, 4(6):387-396.
[7]Ohkawa T, Fukata Y, Yamasaki M, et al. Autoantibodies to epilepsy-related LGI1 in limbic encephalitis neutralize LGI1-ADAM22 interaction and reduce synaptic AMPA receptors[J]. J Neurosci, 2013, 33(46):18161-18174.
[8]Fukata Y, Lovero KL, Iwanaga T, et al. Disruption of LGI1-linked synaptic complex causes abnormal synaptic transmission and epilepsy[J]. Proc Natl Acad Sci USA, 2010, 107(8):3799-3804.
[9]Penagarikano O, Abrahams BS, Herman EI, et al. Absence of CNTNAP2 leads to epilepsy, neuronal migration abnormalities, and core autism-related deficits[J]. Cell, 2011, 147(1):235-246.
[10]van Sonderen A, Schreurs MW, Wirtz PW, et al. From VGKC to LGI1 and Caspr2 encephalitis:The evolution of a disease entity over time[J]. Autoimmun Rev, 2016, 15(10):970-974.
[11]van Sonderen A, Petit-Pedrol M, Dalmau J, et al. The value of LGI1, Caspr2 and voltage-gated potassium channel antibodies in encephalitis[J]. Nat Rev Neurol, 2017, 13(5):290-301.
[13]张元杏,杨辉丽,吴颖颖,等. 抗富亮氨酸胶质瘤失活1蛋白抗体相关边缘性脑炎九例临床分析[J]. 中华医学杂志, 2017, 97(17):1295-1298.
[14]Gadoth A, Pittock SJ, Dubey D, et al. Expanded phenotypes and outcomes among 256 LGI1/CASPR2-IgG-positive patients[J]. Ann Neurol, 2017, 82(1):79-92.
[15]van Sonderen A, Thijs RD, Coenders EC, et al. Anti-LGI1 encephalitis clinical syndrome and long-term follow-up[J]. Neurology, 2016, 87(14):1449-1456.
[16]杨宇,张海宁,曹杰,等. LGI1-Ab相关LE临床特点分析(附8例病例报告及文献复习)[J]. 中风与神经疾病杂志, 2015, 32(9):783-787.
[17]Irani SR, Michell AW, Lang B, et al. Faciobrachial dystonic seizures precede Lgi1 antibody limbic encephalitis[J]. Ann Neurol, 2011, 69(5):892-900.
[18]Naasan G, Irani SR, Bettcher BM, et al. Episodic bradycardia as neurocardiac prodrome to voltage-gated potassium channel complex/leucine-rich, glioma inactivated 1 antibody encephalitis[J]. JAMA Neurol, 2014, 71(10):1300-1304.
[19]Nilsson AC, Blaabjerg M. More evidence of a neurocardiac prodrome in anti-LGI1 encephalitis[J]. J Neurol Sci, 2015, 357(1-2):310-311.
[20]Espinosa-Jovel C, Toledano R, Garcia-Morales I, et al. Serial arterial spin labeling MRI in autonomic status epilepticus due to anti-LGI1 encephalitis[J]. Neurology, 2016, 87(4):443-444.

