拉莫三嗪诱发皮肤不良反应与TCRBV基因表达的相关性研究
晁丽娜 许贤瑞 王旭 李琪 刘美丽 张庆
癫痫(epilepsy)是神经系统常见病。应用抗癫痫药物(antiepileptic drugs,AEDs)有效控制痫性发作仍是目前癫痫治疗的首选方法。癫痫患者个体化用药及用药安全性问题受到广泛关注。AEDs种类繁多,其中,拉莫三嗪(lamotrigine,LTG)与卡马西平(carbamazepine,CBZ)、奥卡西平(oxcarbazepine,OXC),苯巴比妥(phenobarbitone,PB)、苯妥英钠(phenytoin,PHT)在化学结构上均具有苯环而被统称为芳香族抗癫痫药物(aromatic antiepileptic drugs,AAEDs)[1]。临床实践提示,AAEDs较其他AEDs更易诱发皮肤不良反应(cutaneous adverse reactions,cADRs)[1]。cADRs已成为临床停用或更换AAEDs的主要原因,给患者和医生造成困扰[2]。目前,AAEDs诱发cADRs的确切发病机制尚未阐明。现有的研究表明AAEDs诱发cADRs可能涉及特定的人类白细胞抗原(human leukocyte antigen,HLA)分子,药物或其代谢产物和特异性T细胞受体(T cell receptor,TCR)的相互作用[3]。TCR是T细胞表面的受体分子,其作用是识别抗原和参与免疫应答。不同的抗原刺激会引起TCR β链可变区(beta chain variable region,BV)基因(TCRBV基因)片段的限制性取用。对其他药物(如青霉素、巴氨西林和对二苯胺)引起过敏反应的研究证实:不同药物引起过敏反应时TCRBV基因表达谱出现差异[4-6]。基于上述情况,本实验拟通过研究LTG激活T细胞介导免疫应答而诱发cADRs的可能致病机制,分析在LTG诱发的cADRs(LTG-cADRs)患者与LTG耐受者外周血单个核细胞(PBMCs)中,TCRBV基因表达的差异,以期明确LTG-cADRs与TCRBV基因表达是否存在相关性。
1 对象和方法
1.1观察对象本研究应用巢式病例对照研究方法。选取2014-12—2016-12宁夏医科大学总医院神经内科门诊确诊为癫痫并口服LTG治疗的患者为研究队列,收集患者的临床资料。癫痫患者服用LTG的起始剂量及增加剂量,均按照《中国药典2010》关于LTG的相关说明内容进行,口服LTG的起始剂量均≤12.5 mg/d。依照Mockenhaupt M(2009)cADRs诊断与分型标准[7]执行。将队列内cADRs已治愈达6周以上的LTG-cADRs患者作为病例组。以年龄相差±3岁、性别和民族相同为原则,按照1︰1配对设计选取该队列内口服LTG时间大于12周而未出现cADRs者作为对照组。
本次共纳入癫痫患者20例,其中病例组10例,对照组10例。(1)病例组:男6例、女4例,年龄17~56岁,平均年龄(34.50±13.71)岁。患者中汉族7例,回族3例,1例有花粉过敏史。10例cARDs均为轻型的斑丘疹(maculopapular eruption,MPE),无严重皮肤不良反应者。10例中1例以6.25 mg/d的剂量口服LTG至第5天时发生cADRs,3例以12.5 mg/d口服LTG时发生cADRs,其余6例均以≥25 mg/d口服LTG时发生cADRs,发生cADRs距开始服用LTG的时间最长为60 d,最短为1 d,中位数为11.5 d,四分位数间距32.5 d。(2)对照组:年龄为19~53岁,平均年龄为(34.20±12.70)岁。
1.2主要试剂与仪器植物凝集素(PHA)及人外周血淋巴细胞分离液(北京Solarbio公司),FBS(浙江天杭生物科技有限公司),PBS(美国HyClone公司),RPMI1640基础培养基(美国gibco公司),Recombinant Human IL-2(美国Pepro Tech公司),LTG标准品(英国Glaxo Smith Kline公司),总RNA提取试剂盒(北京天根公司),First Strand cDNA Synthesis Kit及CO2培养箱(美国Thermo公司),2×TransStart®Tip Green qPCR Mix(北京全式金生物有限公司),人干扰素γ(IFN-γ)、白细胞介素5(IL-5)及肿瘤坏死因子β(TNF-β)ELISA检测试剂盒(北京欣博盛生物科技有限公司),高速低温离心机(德国HERMLE公司),电子天平(瑞士METTLER TOLEDO公司),25号细胞培养瓶(美国Corning公司),倒置显微镜(日本OLYMPUS公司),东胜龙PCR仪(北京东胜创新生物科技有限公司),酶标仪(芬兰雷勃集团),实时荧光定量PCR仪(iCyeler iQ5)(美国BIO-RAD公司)。
1.3方法
1.3.1实验标本收集:收集病例组和对照组新鲜全血,每例抽取2 mL血常规管(含EDTA)4管(共8 mL),置于4℃冰箱保存,于4 h内行PBMCs分离实验。
1.3.2PBMCs的分离:用无菌巴氏滴管从血常规管中取出8 mL新鲜全血,用PBS等体积稀释。另取1支离心管,加入人外周血淋巴细胞分离液4 mL。吸取等体积的稀释血液平铺于分离液液面上方,保持两液面界面清晰。室温下,以1000g离心30 min,吸取出全部白膜层,移入另一空白离心管中,加入10 mL的PBS,吹吸混匀,以250g离心10 min。弃去上清,加入5 mL的PBS,吹打30次重悬细胞后以250g离心10 min(重复此步骤洗涤细胞两次)。弃上清,加入含有15%(体积分数)FBS的RPMI1640培养液1 mL,吹打重悬细胞并计数。
1.3.3PBMCs培养与干预:培养条件为:严格无菌操作,37℃恒温培养,5%(体积分数)CO2,饱和湿度。用台盼蓝染色法进行PBMCs活力检测,若活细胞数达90%或以上,吸取已重悬的PBMCs加入到细胞培养瓶中,再加入含有15%(体积分数)FBS的RPMI1640细胞培养液,调整细胞密度至1×106/mL。然后向细胞中加入已配制好的重组人IL-2溶液、PHA溶液和LTG溶液(终浓度分别为20 ng/mL、5 μg/mL和25 μg/mL)以促进细胞增殖,吹打混匀后放置在培养箱中培养。每天更换细胞培养液1次。细胞培养72 h后,将细胞悬液转至离心管中,以250g离心10 min,取细胞上清液保存至-20℃备用,以供后续ELISA法检测细胞因子;取细胞沉淀后用实时荧光定量逆转录PCR技术(RT-qPCR)的SYBR GreenⅠ荧光染料法检测TCRBV基因的转录与表达。
1.3.4ELISA法检测LTG刺激PBMCs分泌IL-5、TNF-β及IFN-γ的情况:取出于-20 ℃冰箱保存的细胞上清液,常温下均匀充分解冻待测样品,按照ELISA试剂盒说明进行操作,采用双抗体一步夹心ELISA法检测IFN-γ、IL-5及TNF-β的分泌量。测定450 nm波长下每孔吸光度〔D(λ)〕,记取3个复孔的平均值。用CurverExpert1.4软件,以标准品浓度(0、50、100、200、400、800 pg/mL)为x轴,以所测得的D(λ)值为y轴,绘制标准品线性回归曲线,列出曲线方程后计算细胞上清液中细胞因子的浓度值(μg/mL),以此浓度值×5(稀释倍数)计算样本实际浓度。
1.3.5TCRBV基因检测:(1)引物设计:登陆NCBI,在Genebank中查询人TCRBV基因(TCRBV1-TCRBV24)各序列,删除TCRBV基因家族中的假基因,将其余18个基因序列(TCRBV2-TCRBV7、TCRBV9、TCRBV11-TCRBV20和TCRBV24)提供给上海生工公司设计合成引物,引物序列见下表1。
(2)总RNA的提取、cDNA第一链的合成:按照北京天根公司总RNA提取试剂盒的说明提取PBMCs的总RNA,用酶标仪测定RNA的浓度及纯度测定,D(λ)260/D(λ)280比值为1.8~2.0之间说明RNA纯度高。将用于第一链cDNA合成时的总RNA定量为100 ng,依据每例样本所测总RNA的浓度,计算RNA实际加样的体积量,设置反应体系行反转录得到cDNA,反应体系为:总RNA 100 ng,Oligo(dT)18 primer 1 μL,5×Reaction Buffer 4 μL,RiboLock RNase Inhibitor(20 U/μL)1 μL,10 mmol/L dNTP Mix 2 μL,ReverTAid M-MuLV RT(200 U/μL) 1 μL,以无核酸酶纯水(nuclease-free water)补齐至20 μL。混匀并离心,反转录反应条件:42℃ 60 min、70℃ 5 min后终止反应。将cDNA于-80℃冰箱保存备用。
(3) RT-qPCR检测病例组和对照组TCRBV基因的表达:以制备好的cDNA为模板、选择GAPDH作为内参对照,每样本设3个复孔,行RT-PCR扩增,用SYBR GreenⅠ荧光染料法检测TCRBV基因的表达,其反应体系为:cDNA 1 μL,Forward Primer(10 μmol/L) 0.4 μL,Reverse Primer(10 μmol/L) 0.4 μL,Tip Green qPCR SuperMix 10 μL,ddH2O 8.2 μL,总体积20 μL。反应条件为: 94 ℃ 30 s;94 ℃ 5 s;56 ℃ 15 s;72 ℃ 10 s,循环42次后终止反应。反应结束后收集数据,得到病例组与对照组TCRBV基因和GAPDH内参的扩增曲线和熔解曲线,每一种颜色的曲线代表一种基因。用Excel2007整理扩增产物达到设定域值时所经历的循环数(即Ct值),采用2-ΔΔCt相对定量法计算两组TCRBV基因的相对表达量,以2-ΔΔCt值作为相对表达量指标进行比较。两组TCRBV基因的ΔCt值计算如下:ΔCt病例组=Ct病例组-CtGAPDH,ΔCt对照组=Ct对照组-CtGAPDH。ΔCt对照组平均值计算方法为:对照组3个复孔ΔCt之和,再除以3。两组TCRBV基因的ΔΔCt值计算如下:ΔΔCt病例组=ΔCt病例组-ΔCt对照组平均值,ΔΔCt对照组=ΔCt对照组-ΔCt对照组平均值。

表1 TCBBV基因引物序列
1.4统计学处理采用Excel(2007)和17.0版本的SPSS 软件进行分析。计量资料符合正态分布者,以均数±标准差表示;两样本均数比较时,用t检验(方差齐时)或t’检验(方差不齐时)。计量资料不符合正态分布者,数据以中位数和四分位数间距〔M(QR)〕表示,两样本比较采用Mann-WhitneyU检验。以P<0.05为差异有统计学意义。
2 结果
2.1两组PBMCs分泌IFN-γ、IL-5及TNF-β水平比较病例组IFN-γ水平明显高于对照组(P<0.05),IL-5和TNF-β水平略高于对照组,但差异无统计学意义(均P> 0.05),具体结果见表2。
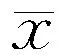
表2 两组IFN-γ、IL-5及TNF-β水平比较(n=10,±s,ng/mL)
注:IFN-γ:干扰素γ;IL-5:白细胞介素5;TNF-β:肿瘤坏死因子β
2.2两组TCRBV基因表达水平比较
2.2.1TCRBV基因的扩增曲线和熔解曲线:病例组与对照组TCRBV基因和GAPDH内参的扩增曲线(图1)和熔解曲线(图2)显示:TCRBV基因扩增曲线的基线平整并到达平台期,且每个基因的熔解曲线峰形较单一,表明所设置的反应条件准确,在TCRBV基因的扩增过程中未出现非特异性扩增产物。
2.2.2两组TCRBV基因表达的差异:在两组中差异表达的TCRBV基因有TCRBV11、TCRBV15、TCRBV17、TCRBV18、TCRBV19(P< 0.05;表3)。依据这5个差异表达的基因在病例组与对照组中的秩和值可见:TCRBV11、TCRBV15、TCRBV17、TCRBV18、TCRBV19在病例组中的表达量高于对照组(表4)。

图 1 TCRBV与GAPDH基因的扩增曲线
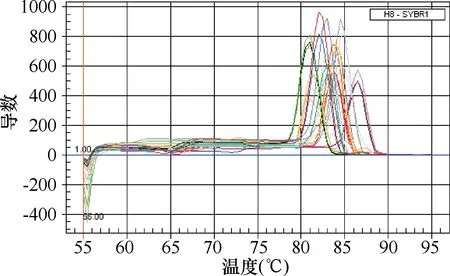
图 2 TCRBV与GAPDH基因的熔解曲线
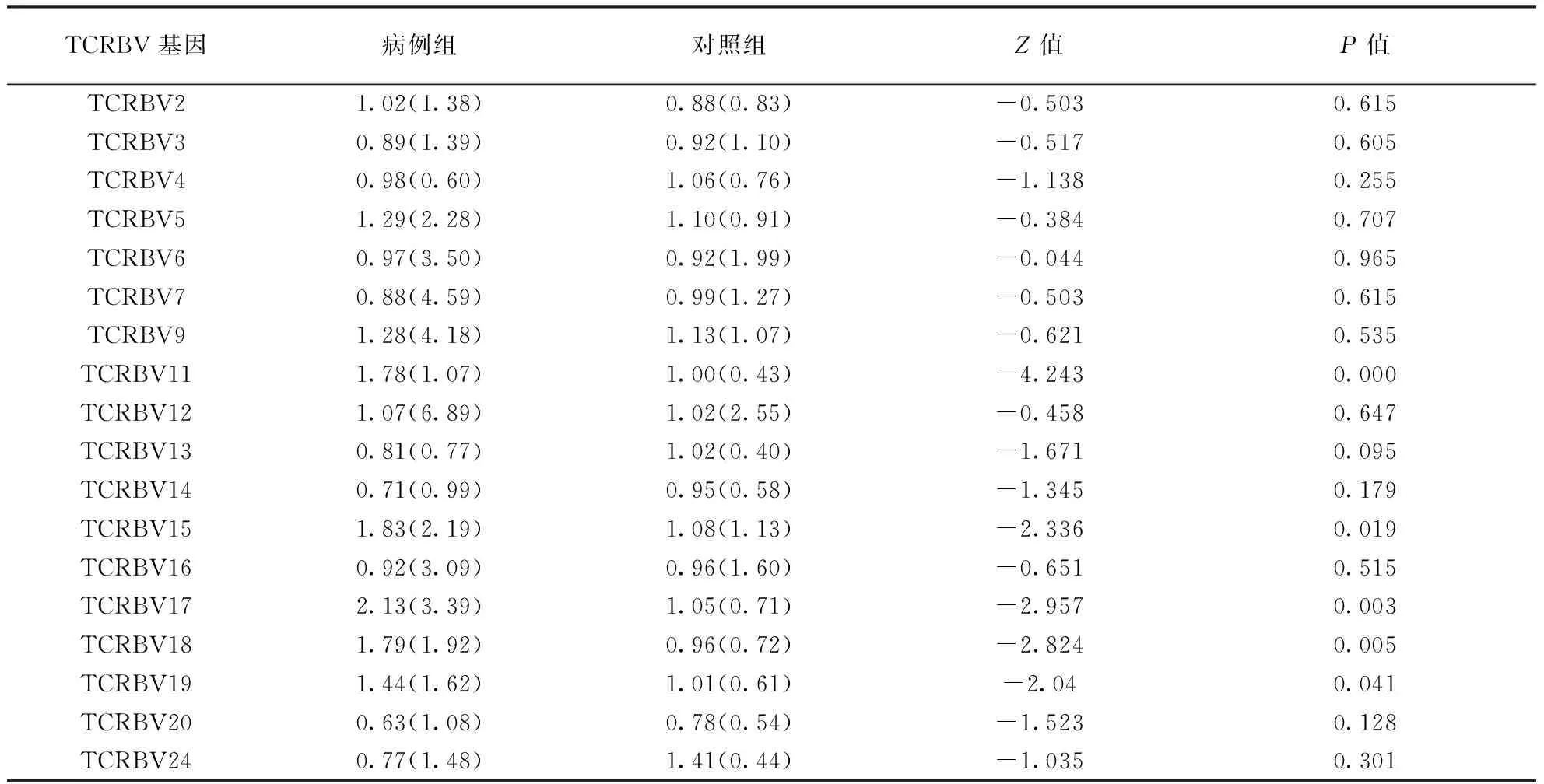
TCRBV基因病例组对照组Z值P值TCRBV21.02(1.38)0.88(0.83)-0.5030.615TCRBV30.89(1.39)0.92(1.10)-0.5170.605TCRBV40.98(0.60)1.06(0.76)-1.1380.255TCRBV51.29(2.28)1.10(0.91)-0.3840.707TCRBV60.97(3.50)0.92(1.99)-0.0440.965TCRBV70.88(4.59)0.99(1.27)-0.5030.615TCRBV91.28(4.18)1.13(1.07)-0.6210.535TCRBV111.78(1.07)1.00(0.43)-4.2430.000TCRBV121.07(6.89)1.02(2.55)-0.4580.647TCRBV130.81(0.77)1.02(0.40)-1.6710.095TCRBV140.71(0.99)0.95(0.58)-1.3450.179TCRBV151.83(2.19)1.08(1.13)-2.3360.019TCRBV160.92(3.09)0.96(1.60)-0.6510.515TCRBV172.13(3.39)1.05(0.71)-2.9570.003TCRBV181.79(1.92)0.96(0.72)-2.8240.005TCRBV191.44(1.62)1.01(0.61)-2.040.041TCRBV200.63(1.08)0.78(0.54)-1.5230.128TCRBV240.77(1.48)1.41(0.44)-1.0350.301
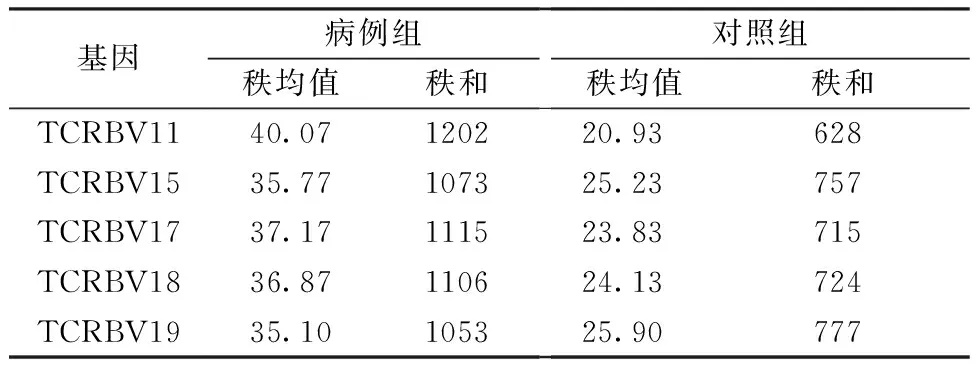
表4 差异表达的TCRBV基因在病例组与对照组中的秩和值比较(n =10)
3 讨论
癫痫是一组由脑神经元过度放电引起的,以反复发作、短暂脑功能失调为特征的临床综合征。当前癫痫治疗共识[8]认为:癫痫确诊后,如无针对病因治疗的指征,除非发作稀疏,均需应用AEDs控制发作。2/3以上新诊断的癫痫患者在经过AEDs正规治疗后发作可得到有效控制。约2/5的癫痫患者经正规治疗可以完全停药。然而所有AEDs在使癫痫患者获益的同时,均可能发生不良反应,给患者带来损害。cADRs是AEDs常见不良反应之一,在接受AEDs治疗的患者中,cADRs的发生率为3%左右。超过90%的AEDs诱发的cADRs发生于用药后3个月内,少数AEDs诱发cADRs发生在使用AEDs数年之后[2]。AEDs诱发cADRs常见的临床表现为轻型的MPE,也可出现药物超敏反应综合征(drug-induced hypersensitivity syndrome,DHS)、Stevens-Johnson综合征(SJS)、中毒性表皮坏死松解症(toxicepidermal necrolysis,TEN)等严重类型而威胁生命[1,9-10]。
本研究收集LTG-cADRs患者与LTG耐受者的新鲜全血,提取PBMCs,以终浓度为25 μg/mL的LTG体外刺激并培养PBMCs,72 h后检测IFN-γ、IL-5和TNF-β的水平,结果发现LTG-cADRs患者细胞培养上清液中IFN-γ的水平明显高于LTG耐受者(P<0.05),这提示LTG可在体外激活LTG-cADRs患者PBMCs分泌的IFN-γ,T细胞介导的免疫反应可能参与了LTG-cADRs的致病机制。该结果和Ko等[11]的研究结果一致,Ko等的研究显示,用CBZ体外刺激培养CBZ诱发SJS(CBZ-SJS)组和CBZ耐受组的PBMCs后,CBZ-SJS组IFN-γ水平高于CBZ耐受组。另外,LTG-cADRs患者细胞培养上清液中IL-5和TNF-β的水平均略高于LTG耐受者,但差异均无统计学意义(P>0.05)。分析出现细胞因子水平差异的原因如下:激活的T细胞分泌产生IFN-γ、IL-5和TNF-β,IFN-γ主要由CD4+T细胞、CD8+T细胞和NK细胞产生,可诱导和增加多种细胞表达HLA分子,增强免疫应答。TNF-β主要由Th1细胞(CD4+T细胞)分泌产生,IL-5主要由介导体液免疫应答的Th2细胞分泌产生。LTG-cADRs患者细胞培养上清液中IFN-γ的水平明显高于LTG耐受者,提示LTG体外刺激并培养LTG-cADRs患者PBMCs,可能是以CD8+T细胞增殖为主,CD8+T细胞增殖分泌出了更多的IFN-γ。另外,在实验过程中,为促进PBMCs的生长而加入了重组人IL-2,IL-2可能增强了IFN-γ基因的转录,使得IFN-γ水平更高。Rozieres等[12]在动物模型中观察到CD8+T细胞在药物超敏反应中的致病作用。Wu等[13]以体外培养的方式观察到CD8+T细胞在药物超敏反应中的致病作用,关于CBZ-cADRs的研究发现,CD8+T细胞不仅具有药物特异性,而且在体外具有细胞毒性作用。
T细胞主要功能是介导细胞免疫,调节机体的免疫应答。TCR是所有T细胞表面关键的受体分子,其作用是识别抗原。健康人外周血中90%~95%的T细胞表达αβTCR,αβTCR由α和β两条肽链组成。TCRβ链胞外区分为恒定区(C区)及可变区(V区),TCRBV基因大部分位于人类7号染色体上,仅有小部分序列位于9号染色体上。对TCRβ链V区的氨基酸序列分析表明,TCR有三个互补决定区即CDR1、CDR2和CDR3,其中以CDR3变异性最大,直接决定了TCR的抗原特异性。CDR3可直接在识别HLA-抗原肽复合体时与其抗原肽发生相互作用,TCRBV基因片段依据CDR3的V基因片段核苷酸的同源性被分成24个基因家族(TCRBV1~TCRBV24),其中TCRBV5包含TCR BV5.1和TCR BV5.2两个亚家族,TCRBV13包含有TCR BV13.1和TCR BV13.2两个亚家族。TCRBV基因由V、D、J基因片段重排而成,由于TCRBV基因的多样性使TCRβ链的CDR3区也呈现多样性,这种多样性以约107种抗原受体结构不同的T细胞存在于人体内,即人体内存在着至少107种能识别各种抗原的淋巴细胞克隆[14]。不同的抗原刺激机体,机体会从众多淋巴细胞克隆中选择出受体结构与之互补的淋巴细胞克隆。对于健康人,其TCRBV基因家族谱型呈现正态分布,而机体在疾病状态下,或遭受某种抗原刺激时,淋巴细胞受体库发生偏移,引起T细胞克隆增生。在不同的抗原刺激下,出现不同的T细胞克隆增生,引起只有少数V-(D)-J基因片段入选扩增克隆的现象(即抗原对TCRBV基因片段的限制性取用),TCRBV基因各家族差异表达,其呈现非正态分布[15]。Sieben等[6]在二苯胺引起的迟发型过敏反应的研究中发现,3组(共6组)HLA限制性克隆细胞表达TCRBV16。Pichler等[4]在体外细胞实验中发现,对青霉素过敏的患者,体内存在药物特异性T细胞克隆,TCR库会出现偏移,TCRBV基因谱型呈寡克隆或多克隆。一项巴氨西林引起变态反应的体外研究发现,克隆性增殖明显的T淋巴细胞表达BV14、TCRBV2、BV3和BV5.1[5]。
以上研究表明,药物可以在体外激活T细胞,引起淋巴细胞受体库的偏移,出现TCRBV基因片段的限制性取用,进而表现出不同的T细胞克隆增生,导致TCRBV基因表达的差异。并且既往研究表明,PBMCs是免疫活性细胞的集合体,其主要包括淋巴细胞和单核细胞等,参与固有免疫反应和适应性免疫反应发生的过程,担负重要的免疫功能,而用密度梯度法提取出的PBMCs,淋巴细胞可达90%以上,活细胞百分率在95%以上,可满足检测TCRBV基因的需要[16]。另外,PCR技术能够检测TCRBV基因各家族表达情况,RT-qPCR是在PCR反应体系中加入荧光基团,利用荧光信号累积实时检测整个PCR进程。RT-qPCR进行定量分析时有两种方法,即绝对定量法和相对定量法。相对定量法无需绘制标准曲线,可利用熔解曲线排除非特异性产物扩增的干扰,更容易操作。本研究中对TCRBV基因表达在LTG-cADRs患者和LTG耐受者中的差异进行检测,因此相对定量法即可满足实验结果的分析。基于以上观点,本研究对10例LTG-cADRs患者和10例LTG耐受者的PBMCs,运用RT-qPCR的SYBR GreenⅠ荧光染料法,进行了18个TCRBV基因(TCRBV2~TCRBV7、TCRBV9、TCRBV11~TCRBV20和TCRBV24)表达差异的检测,以明确LTG-cADRs与TCRBV基因表达是否存在相关性。结果显示,两组中存在差异表达的TCRBV基因共有5个,分别是TCRBV11、TCRBV15、TCRBV17、TCRBV18、TCRBV19。这5个差异表达的基因在两组中的秩和值(其在LTG-cADRs患者中的表达量)较LTG耐受者高。上述结果提示LTG-cADRs可能与TCRBV11、TCRBV15、TCRBV17、TCRBV18、TCRBV19基因的表达相关。然而,本次研究结果与既往的研究结果存在差异。如Naisbitt等[17]报道,在LTG-cADRs患者的PBMCs中,检测到以CD4+T细胞为主的克隆增殖,这些T细胞表面均表达αβ-TCR,TCR BV5.1和TCR BV9基因呈优势表达,故认为在LTG-cADRs发生的过程中,TCR BV5.1起关键作用。Hashizume等[18]在PB-cADRs患者外周血中发现一组显著克隆增生的T细胞亚群,这些T细胞主要表达TCR BV5.1和TCR BV13.1,以Th2反应为主,分泌导致表皮细胞甚至真皮细胞损害的细胞因子、颗粒酶、穿孔素及颗粒溶素,发生cADRs,该作者推测特异性TCR的表达与PB-cADR临床表现的差异相关。存在上述实验结果差异的可能原因如下:(1)cADRs类型和病情严重程度的差异对研究结果造成的影响。如在Naisbitt等的研究中,所纳入的4例LTG-cADRs,其cADRs类型包括MPE、SJS、TEN和多形性红斑合并淋巴结肿大各1例,而本研究中所纳入LTG-cADRs的皮疹类型均为MPE。(2)本研究纳入研究的病例数较少,仅收集到10例LTG-cADRs患者的血标本,尚需更多样本量进行研究。(3)诱发cADRs的药物不同。如Hashizume等的研究对象是以PB诱发cADRs的患者。这提示LTG、PB虽均属于AAEDs,具有相似的苯环结构,但仍可能出现TCRBV基因的表达差异。
综上可见,LTG可在体外激活LTG-cADRs患者的PBMCs分泌IFN-γ,这提示T细胞介导的免疫反应可能参与了LTG-cADRs的致病机制。LTG-cADRs可能与TCRBV11、TCRBV15、TCRBV17、TCRBV18、TCRBV19基因的表达相关。但本研究纳入研究的LTG-cADRs患者较少,后续可扩大样本量深入研究,对LTG-cADRs患者与LTG耐受者的TCRBV基因表达差异进行分析。
参考文献:
[1]Wang XQ,Shi XB,Au R,et al.Influence of chemical structure on skin reactions induced by antiepileptic drugs--the role of the aromatic ring[J].Epilepsy Res,2011,94(3):213-217.
[2] Zaccara G,Franciotta D,Perucca E.Idiosyncratic adverse reactions to antiepileptic drugs[J].Epilepsia,2007,48(7):1223-1244.
[3] Ko TM,Chen YT.T-cell receptor and carbamazepine-induced Stevens-Johnson syndrome and toxic epidermal necrolysis:understanding a hypersensitivity reaction[J].Exp Rev Clin Immunol,2012,8(5):467.
[4] Pichler WJ,Zanni M,Von Greyerz S,et al.High IL-5 Production by Human Drug-Specific T Cell Clones[J].Int Arch Allergy Immunol,1997,113(1-3):177-180.
[5] Cederbrant K,Marcusson-Stahl M,Hultman P. Characterization of primary recall in vitro,lymphocyte responses to bacampicillin in allergic subjects[J].Clin Exp Allergy,2000,30(10):1450-1459.
[6] Sieben S,Kawakubo Y,Al MT,et al.Delayed-type hypersensitivity reaction to paraphenylenediamine is mediated by 2 different pathways of antigen recognition by specific alphabeta human T-cell clones[J].J Allergy Clin Immunol,2002,109(6):1005-1011.
[7] Mockenhaupt M.Severe drug-induced skin reactions: clinical pattern,diagnostics and therapy[J].J Dtsch Dermatol Ges,2009,7(2):142-160.
[8] 王维治.神经病学[M].第2版.北京:人民卫生出版社,2013.1331-1341.
[9] Levi N,Bastuji-Garin S,Mockenhaupt M,et al.Medications as risk factors of Stevens-Johnson syndrome and toxic epidermal necrolysis in children: a pooled analysis[J].Pediatrics,2009,123(2):e297-304.
[10] Kumari R,Timshina DK,Thappa DM.Drug hypersensitivity syndrome[J].Indian J Dermatol Venereol Leprol,2011,77(1):7-15.
[11] Ko TM,Chung WH,Wei CY,et al.Shared and restricted T-cell receptor use is crucial for carbamazepine-induced Stevens-Johnson syndrome[J].J Allergy Clin Immunol,2011,128(6):1266-1276.
[12] Rozieres A,Vocanson M,Rodet K,et al.CD8+T cells mediate skin allergy to amoxicillin in a mouse model[J].Allergy,2010,65(8):996-1003.
[13] Wu Y,Farrell J,Pirmohamed M,et al.Generation and characterization of antigen-specific CD4+,CD8+,and CD4+CD8+T-cell clones from patients with carbamazepine hypersensitivity[J].J Allergy Clin Immunol,2007,119(4):973-981.
[14] Ebert A,Medvedovic J,Tagoh H,et al.Control of antigen receptor diversity through spatial regulation of V(D)J recombination[J].Cold Spring Harb Symp Quant Biol,2013,78(1):11-21.
[15] Attaf M,Huseby E,Sewell AK.αβ T cell receptors as predictors of health and disease[J].Cell Mol Immunol,2015,12(4):391-399.
[16] J.E.科利根,BE比勒,D.H.马古利斯,等著.曹雪涛译.精编免疫学实验指南[M].北京:科学出版社,2009.271-275.
[17] Naisbitt D J,Farrell J,Wong G,et al.Characterization of drug-specific T cells in lamotrigine hypersensitivity[J].J Allergy Clin Immunol,2003,111(6):1393-1403.
[18] Hashizume H,Takigawa M,Tokura Y.Characterization of drug-specific T cells in phenobarbital-induced eruption[J].J Immunol,2002,168(10):5359-5368.

